Органические кислоты, действие на алюминий
По величине высокого отрицательного потенциала алюминий должен легко окисляться как кислородом, так и ионом водорода воды. Но на воздухе вследствие образования чрезвычайно тонкой пленки оксида или гидроксида, плотно пристающей к поверхности металла, он очень стоек даже при сравнительно высокой температуре (100° С). Наоборот, чрезвычайно легко окисляется покрытый ртутью алюминий, так как он образует амальгаму, т. е. раствор алюминия в ртути, атомы же беспрепятственно окисляются кислородом и ионами водорода, так как.слой ртути не дает пленке оксида плотно пристать к поверхности металла. Кислоты типа НН1 легко растворяют алюминий, окисляя его ионом водорода. Концентрированная азотная кислота при обыкновенной температуре пассивирует его, т. е. окисляет только с поверхности, образуя оксидную пленку. Серная кислота с алюминием дает основную соль, точно так же препятствующую его дальнейшему окислению. Разбавленные органические кислоты — уксусная и лимонная, почти не действуя на холоду, окисляют его при нагревании до 100° С. Особо нужно отметить взаимодействие алюминия с раствором щелочи, протекающее очень легко [c.437]
Особо нужно отметить взаимодействие алюминия с раствором щелочи, протекающее очень легко [c.437]
На воздухе алюминий покрывается пленкой окиси алюминия, которая защищает его от дальнейшего окисления и обусловливает сравнительно высокую коррозионную стойкость металла. На него не действуют концентрированная азотная кислота и органические кислоты, однако алюминий разрушается едкими щелочами, соляной и серной кислотами. Алюминий легко поддается прокатке. Сочетание хорошей пластичности и сравнительно высокой коррозионной стойкости делают алюминий весьма перспективным материалом для изготовления разрывных предохранительных мембран, предназначенных для мягких условий эксплуатации, когда отношение разрывного давления мембраны к рабочему давлению в защищаемом сосуде значительно. [c.109]
К электролитам относятся некоторые минеральные и органические кислоты (соляная, серная, уксусная), щелочи (едкий натр, известь) и соли (поваренная соль, хлористый кальций, железный купорос, хлорное железо, нафтенат алюминия и др. ). Действие электролитов различно. Одни из них снижают стабильность эмульсии, другие способствуют разрушению пленки эмульгатора, третьи образуют нерастворимые осадки с солями, входящими в состав эмульсии. Применение некоторых реагентов ограничено вследствие их корродирующего действия на аппаратуру или высокой стоимости. [c.182]
). Действие электролитов различно. Одни из них снижают стабильность эмульсии, другие способствуют разрушению пленки эмульгатора, третьи образуют нерастворимые осадки с солями, входящими в состав эмульсии. Применение некоторых реагентов ограничено вследствие их корродирующего действия на аппаратуру или высокой стоимости. [c.182]
Метод каталитического отвердения последнее проводится под действием щелочей, амидов щелочных металлов, минеральных кислот, солей многовалентных металлов, солей органических кислот таких металлов, как А1, 2п, Т1, РЬ, Со, титановых эфиров, алкоголятов алюминия и т. д. Полимеризация облегчается тем, что все эпоксидные смолы содержат гидроксильные группы, что сводит эти процессы к типу поликонденсаций с образованием поперечных связей эфирного типа. [c.494]
Алюминиевые бронзы обладают хорошими механическими свойствами и повышенной устойчивостью во многих средах. По устойчивости они превосходят оловянные бронзы. Из них изготавливают детали клапанов, насосов, фильтров и сит для работы в кислых агрессивных средах, а также змеевики нагревательных установок, предназначенных для работ в разбавленных и концентрированных растворах солей при высоких температурах. Недостатком алюминиевых бронз является их чувствительность к местной коррозии по границам зерен и коррозии под напряжением вследствие холодной пластической обработки. Алюминиевые бронзы с 7—12% алюминия наиболее устойчивы и могут успешно применяться для изготовления оборудования травильных ванн, например насосов, клапанов, корзин для травления и др. Вальцованный сплав с 80% Си, 10% А1, 4,5% N1 и 1% Мп или Ре корродирует со скоростью менее 0,1 мм/год в 50%-ной серной кислоте при перемешивании и температуре 110°С или в 65%-ной серной кислоте при 85°С и скорости перемещения раствора 3 м/с. Известна также хорошая устойчивость алюминиевых бронз к действию слабых органических кислот и щелочей, за исключением аммиака независимо от концентрации и температуры. [c.122]
Недостатком алюминиевых бронз является их чувствительность к местной коррозии по границам зерен и коррозии под напряжением вследствие холодной пластической обработки. Алюминиевые бронзы с 7—12% алюминия наиболее устойчивы и могут успешно применяться для изготовления оборудования травильных ванн, например насосов, клапанов, корзин для травления и др. Вальцованный сплав с 80% Си, 10% А1, 4,5% N1 и 1% Мп или Ре корродирует со скоростью менее 0,1 мм/год в 50%-ной серной кислоте при перемешивании и температуре 110°С или в 65%-ной серной кислоте при 85°С и скорости перемещения раствора 3 м/с. Известна также хорошая устойчивость алюминиевых бронз к действию слабых органических кислот и щелочей, за исключением аммиака независимо от концентрации и температуры. [c.122]
Органические кислоты, образующиеся при окислении углеводородов, являются более сильными агентами, чем те кислоты, которые попадают в бензин при переработке. Они не действуют па алюминий, слабо действуют на сталь и чугун, но корродируют цветные металлы и в первую очередь свинец и цинк. [c.400]
[c.400]
Политрифторхлорэтилен обладает исключительной химической стойкостью к действию разбавленных и концентрированных минеральных и органических кислот, в том числе дымящей азотной, плавиковой кислотам, окислителям, щелочам, перекисям и органическим растворителям. Разрушается при нагревании в расплавленных щелочных металлах [1177, 1178]. Гладстон [1179], изучая действие различных соединений на политрифторхлорэтилен при повышенных температурах, установил, что в случае нагревания полимера в растворе некоторых органических веществ при температуре выше 200° происходит отщепление хлора в виде НС1. Медь, алюминий, никель, ускоряют отщепление хлора. Из галогенидов металлов наиболее активно хлорное железо в ряду аминов реакционная способность уменьшается при переходе от первичных к вторичным и третичным аминам. Нагревание твердого политрифторхлорэтилена при 300—450° приводит к разложению полимера с образованием менее высокомолекулярных веществ [1180]. [c.306]
Особенно большое значение нержавеющая сталь имеет при изготовлении химической аппаратуры, где чаще всего применяются стали, содержащие 14—20% хрома, 7—12% никеля и не более 0,2% углерода. Особый сплав, отличающийся большой стойкостью действию кислот и щелочей, имеет состав никеля—58%, молибдена—17%, хрома—14%, вольфрама—5%, железа—6%. Получают также стойкие сплавы из цветных металлов. Например, сплав, стойкий к концентрированной азотной кислоте, ряду органических кислот, окислам азота и т. д., имеет состав алюминия—95%, меди—4%, магния—0,5% и марганца—0,5%. Для химического аппаратостроения очень пригодными оказались высококремнистые кислотоупорные чугуны с содержанием 15—18% Е .. Щелочноупорный чугун готовят с малым содерн анием кремния (так как кремний частично растворяется в щелочах). [c.341]
Особый сплав, отличающийся большой стойкостью действию кислот и щелочей, имеет состав никеля—58%, молибдена—17%, хрома—14%, вольфрама—5%, железа—6%. Получают также стойкие сплавы из цветных металлов. Например, сплав, стойкий к концентрированной азотной кислоте, ряду органических кислот, окислам азота и т. д., имеет состав алюминия—95%, меди—4%, магния—0,5% и марганца—0,5%. Для химического аппаратостроения очень пригодными оказались высококремнистые кислотоупорные чугуны с содержанием 15—18% Е .. Щелочноупорный чугун готовят с малым содерн анием кремния (так как кремний частично растворяется в щелочах). [c.341]
В качестве промышленных реакторов наибольшее применение получили барботажные колонны высотой до 10—15 м и диаметром до 2—3 м их в некоторых случаях секционируют горизонтальными ситчатыми или колпачковыми тарелками или соединяют в каскады. Поскольку карбоновые кислоты корродируют обычную сталь, для изготовления аппаратуры применяют алюминий, титан или некоторые легированные стали, стабильные к действию органических кислот. [c.354]
[c.354]
Наибольший урон наносится озерам, в которых вода обладает слабыми буферными свойствами. В присутствии природных щелочных буферов кислые соединения, приносимые дождем (большей частью серная и азотная кислоты, в меньших количествах органические кислоты), нейтрализуются. Однако озера, лежащие на гранитных (кислых) породах, весьма подвержены действию попадающих в них кислот, способных переводить в раствор ионы таких металлов, как алюминий и марганец, что может повлечь подавление роста растений и водорослей, а в некоторых озерах — сокращение или вообще исчезновение популяций рыб. Значительный ущерб наносят кислотные дожди и растительности, причем проявление их влияния может быть самым различным — от дефолиации до разрушения тонкой корневой системы. [c.21]
Экспериментально в лабораторных условиях подтверждена возможность преобразования ОВ в направлении образования УВ нефтяного ряда. Например, при Т — 200 С под действием хлористого алюминия на холестерин, ряд органических кислот, пчелиный воск, каучук удалось получить продукты, похожие по внешнему виду, по физическим и химическим свойствам на нефть. [c.85]
[c.85]
Плотность нафтеновых кислот меньше единицы. Они плохо раство]Н1мы в воде, но хорошо растворяются в углеводородах н многих органических растворителях. Вязкость нафтеновых кислот повышается с увеличением молекулярного веса. По химическим свойствам эти кислоты аналогичны карбоновым кислотам. Оии легко образуют сложные эфиры, хлорангидриды и амиды, легко вступают во взаимодействие со свинцом, цинком, медью н оловом на алюминий, так же как и другие органические кислоты, оии почти не действуют. [c.289]
Выбор материалов для аппаратуры, применяемой в промышленных условиях, имеет исключительное значение. Раньше важнейшими конструкционными материалами в химических производствах являлись сталь и медь. Реакторы и, особенно, перегонные аппараты изготовляли из меди, которая устойчива к действию уксусной кислоты и многих органических кислот. В настоящее время медь во многих случаях заменяется алюминием, особенно алюминием высокой чистоты (свыше 99,5% А1), устойчивым к действию органических кислот, уксусного ангидрида и концентрированной азотной кислоты. [c.244]
[c.244]
Сила действия карбоновых кислот на алюминий и его сплавы, по существу, зависит от концентрации водородных ионов. Большинство органических кислот — слабые кислоты поэтому их агрессивность незначительна. С увеличением молекулярного веса алифатических монокарбоновых кислот степень диссоциации снижается. Разбавленные кислоты вызывают относительно сильную коррозию с повышением концентрации она ослабевает и для кислот, содержащих незначительные количества воды, практически снижается до нуля. В совершенно безводном состоянии при высокой температуре агрессивность снова резко повышается. [c.534]
В качестве катализаторов ионной полимеризации предложено большое число химических элементов и их соединений щелочные и щелочноземельные металлы, медь, железо, платина серная, уксусная, соляная, фтористоводородная, фосфорная кислоты галогениды алюминия, бора, цинка, сурьмы, олова, меди окислы кремния, алюминия, меди, железа, цинка, марганца, молибдена, а также металлорганические соединения, активированный уголь, органические основания и другие вещества. Общая сущность действия катализаторов — понижение энергии активации процесса полимеризации. [c.134]
Общая сущность действия катализаторов — понижение энергии активации процесса полимеризации. [c.134]
Коррозионная стойкость алюминия зависит от чистоты поверхности, содержания примесей, свойств агрессивной среды, ее концентрации, температуры, скорости движения потока. Алюминий устойчив на воздухе и в средах, содержащих h3S, SO2, Nh4 и другие газы, в воде при нагревании, а также в растворах сульфата магния, натрия, аммония. Многие органические кислоты (уксусная, лимонная, винная) не действуют на алюминий, а муравьиная, щавелевая [c.58]
Титан устойчив к действию морской воды, рассолов и хлоридов металлов (кроме насыщенных растворов хлористого цинка и хлористого алюминия) при обычных и повышенных температурах, к действию хромовой, хлорной, азотной (кроме дымящей) и многих органических кислот (за исключением щавелевой и трихлоруксусной). [c.37]
Хранение и транспортирование. Жидкие и расплавленные органические кислоты оказывают корродирующее действие на черные и цветные металлы. Хранить и транспортировать их следует в емкостях из нержавеющей стали или алюминия. Твердые кристаллические кислоты упаковывают в многослойные мешки из [c.39]
Хранить и транспортировать их следует в емкостях из нержавеющей стали или алюминия. Твердые кристаллические кислоты упаковывают в многослойные мешки из [c.39]
Восстановление ангидридов кислот действием амальгамы натрия или амальгамы алюминия в органических растворителях приводит к образованию спиртов лишь с незначительным выходом [c.135]
Нафтеновые кислоты практически не действуют на алюминий, очень слабо действуют на железо, но вызывают очень сильную коррозию цинка и свинца и допускаются в топливе лишь в ничтожных количествах. О количестве органических кислот в бензине судят по количеству щелочи КОН (в миллиграммах), которую необходимо добавить в 100 жл топлива, чтобы нейтрализовать действие органических кислот. Обычно эта величина не превышает 2—3 мг КОН (по ГОСТ 5985—59). [c.143]
В табл. 8 приведены данные о тормозящем действии ряда органических веществ на коррозию железа и цинка в серной кислоте и алюминия в растворе едкого натра. [c.72]
[c.72]
Электролиты. К этой группе химикалий относятся некоторые минеральные и органические кислоты (соляная, серная, уксусная), щелочи (едкий натр, известь) и соли (поваренная соль, хлористый кальций, железнк й купорос, хлорное железо, нафтенат алюминия и др.). Действие этих электролитов весьма различно. Одни из них, соединяясь с водой, нарушают стабильность эмульсии, другие способствуют разрушению плевки эмульгатора, третьи образуют нерастворимые осадки с солями, входящими в состав эмульсии. К реагентам этой группы принадлежит поваренная соль. Через концентрированный подогретый слой соли пропускают нефтяную эмульсию. Едкий натр и известь были одними из первых реагентов, применявшихся для разрушения эмульсионной пефти. [c.200]
В повседневный быт алюминий вошел главным образом в виде всевозможной кухонной посуды. Здесь, помимо легкости и прочности, используются и другие ценные свойства алюминия высокая теплопроводность, способность противостоять действию не только холодной, но и кипящей воды и неядовитость его соединений, которые в небольшом количестве могут образоваться при действии на алюминий слабых органических кислот, содержащихся в пище. [c.145]
[c.145]
Данные основного текста о действии кислот на алюмшшй относятся к обычным условиям. При нагревании стойкость его значительно снижается. Особо следует отметить возможность заметной растворимости алюминия при кипячении его с разбавленными растворами некоторых органических кислот. [c.354]
Коррозия металлов в природных водах и грунтах является в основном процессом, протекающим с кислородной деполяризацией по катодной частичной реакции в соответствии с уравнением (2.17). Выделение водорода из воды по уравнению (2.19) даже в присутствии очень неблагородных металлов типа магния, алюминия и цинка сильно затруднено в принципе оно возможно по уравнению (2.18) из кислот, например из раствора двуокиси углерода или из органических кислот, содержащихся в грунте. Однако агрессивное коррозионное действие кислот обусловливается не столько их участием в катодной частичной реакции, сколько затруднением образования защитного поверхностного слоя из продуктов коррозии. Из-за этого протекание промежуточных частичных реакций по уравнениям (2.17) и (2.21) затормалсвойств образующихся поверхностных слоев весьма существенно для понимания механизма коррозии металлов в природных водах и грунтах [1]. [c.132]
Из-за этого протекание промежуточных частичных реакций по уравнениям (2.17) и (2.21) затормалсвойств образующихся поверхностных слоев весьма существенно для понимания механизма коррозии металлов в природных водах и грунтах [1]. [c.132]
В контакте с другим металлом олово обычно служит анодом по отношению к меди и железу, а к цинку и алюминию — като дом. Однако точное соотношение электродных потенциалов мо жет немного изменяться в зависимости от параметров коррози онной среды. Стойкость олова в щелочах слабая из-за раство рения окисной пленки, но действие кислот происходит медленно особенно при отсутствии достаточного количества кислорода Стойкость олова в органических кислотах особенно высокая [c.121]
В нефтепродуктах присутствуют коррозионно-активные вещества — органические кислоты, меркаптаны, сера и сероводород, перешедшие из нефти и образовавшиеся при переработке. Органические кислоты образуются также при хранении нефтепродуктов в результате процессов окисления. Сульфиды, дисульфиды, полисульфиды, тиофены, а также другие более сложные сераорганические соединения без связей 5—Н пассивны к основным конструкционным материалам, однако они при хранении могут окисляться с образованием сульфоокисей, сульфонов, сульфиновых и сульфоновых кислот, а иногда серной, сернистой кислот и сероводорода, которые чрезвычайно коррозионно-активны. Среди азотистых опасны в коррозионном отношении лишь соединения основного характера, и то только к алюминию и его сплавам. Коррозионное действие гетероорганических соединений значительно усиливается в присутствии воды. [c.105]
Сульфиды, дисульфиды, полисульфиды, тиофены, а также другие более сложные сераорганические соединения без связей 5—Н пассивны к основным конструкционным материалам, однако они при хранении могут окисляться с образованием сульфоокисей, сульфонов, сульфиновых и сульфоновых кислот, а иногда серной, сернистой кислот и сероводорода, которые чрезвычайно коррозионно-активны. Среди азотистых опасны в коррозионном отношении лишь соединения основного характера, и то только к алюминию и его сплавам. Коррозионное действие гетероорганических соединений значительно усиливается в присутствии воды. [c.105]
Медь практически не реагирует с сухими галогенами, но активна с аммиаком, хлористым аммонием, с цианистыми соединениями. Большинство органических кислот не действуют на медь, а минеральные кислоты значительно растворяют ее. При легировании меди алюминием резко гювы- [c.23]
Это искажающее действие катализатора, как полагают, по своей природе является электрическим. Энергичные катализаторы, например серная кислота, хлористый алюминий, хлорное железо, которые легко ионизируются или имеют остаточную валентнссть, рассматриваются как открытые системы , между тем жак реагирующие органические молекулы, даже ненасыщенные, принадлежат азакрытым системам . Ксгда эти две системы приближаются друг к другу, катализатор оказывает свое влияние на менее полярные молекулы реагентов,. приводя их в состояние большей полярности и высшей активнссти. Допущение, что полярная молекула превратит другую молекулу в состояние скорее большей, нежели меньшей, полярности, приемлемо. [c.48]
Энергичные катализаторы, например серная кислота, хлористый алюминий, хлорное железо, которые легко ионизируются или имеют остаточную валентнссть, рассматриваются как открытые системы , между тем жак реагирующие органические молекулы, даже ненасыщенные, принадлежат азакрытым системам . Ксгда эти две системы приближаются друг к другу, катализатор оказывает свое влияние на менее полярные молекулы реагентов,. приводя их в состояние большей полярности и высшей активнссти. Допущение, что полярная молекула превратит другую молекулу в состояние скорее большей, нежели меньшей, полярности, приемлемо. [c.48]
Метод выделения металлов в виде основных солей оказался во многих случаях очень эффективным. Уиллард рекомендует выделять алюминий в виде основной соли янтарной кислоты, железо и торий — в виде основных солей муравьиной кислоты, титан и галлий — в виде основных сульфатов. Анионы органических кислот наиболее пригодны, так как они, проявляя буферное действие, регулируют изменение pH, а кроме того, образованные ими основные соли можно легко прокалить до окислов. В этой связи интересны наблюдения Дюпюи и Дюваля которые показали, что основная алюминиевая соль янтарной кислоты, осажденная из гомогенного раствора, была доаедена до постоянной массы при 611° С, тогда как гидратированную окись алюминия обычно приходится прокаливать при 1100°С. В некоторых случаях для обеспечения оптимальной чистоты рекомендуется получить большую часть осадка при очень низком pH, но для обеспечения полноты осаждения закончить его при более высоком значении pH. Так, при выделении железа в виде основной соли муравьиной кислоты сначала кипятят раствор, содержащий мочевину, пока pH раствора не достигнет 1,8, затем отфильтровывают основную порцию осадка и продолжают кипячение до тех пор, пока pH не повысится до 3. Образующийся дополнительно небольшой осадок можно перенести на тот же фильтр. [c.163]
В этой связи интересны наблюдения Дюпюи и Дюваля которые показали, что основная алюминиевая соль янтарной кислоты, осажденная из гомогенного раствора, была доаедена до постоянной массы при 611° С, тогда как гидратированную окись алюминия обычно приходится прокаливать при 1100°С. В некоторых случаях для обеспечения оптимальной чистоты рекомендуется получить большую часть осадка при очень низком pH, но для обеспечения полноты осаждения закончить его при более высоком значении pH. Так, при выделении железа в виде основной соли муравьиной кислоты сначала кипятят раствор, содержащий мочевину, пока pH раствора не достигнет 1,8, затем отфильтровывают основную порцию осадка и продолжают кипячение до тех пор, пока pH не повысится до 3. Образующийся дополнительно небольшой осадок можно перенести на тот же фильтр. [c.163]
Для повышения скорости и глубины окисления очепь важное значение придается вопросу предварительной очистки изопропилбензола и других углеводородов формулы Ar HRa от примесей, ингибирующих окисление [62, 182, 197, 198]. Обычно технический изопропилбензол перед окислением обрабатывается концентрированной серной кислотой (перманганатом, гипохлоритом), едким натром и кипячением над металлическим натрием, после чего перегоняется. В некоторых патентах [199] предлагается обрабатывать углеводород перед окислением катализаторами алкилирования. Особенно хорошие результаты, в смысле полноты удаления ингибиторов окисления, достигаются обработкой изонронилбензола серной кислотой и проведением автоокисления при 110° в реакторе из стекла Пирекс . Для этих целей можно применять также пористый глинозем [200, 201] или водный раствор уксуснокислой ртути [202, 203]. Автоокислепие изопропилбензола кислородом или газами, содержащими кислород, протекает и в отсутствие катализаторов [204]. Гомологи кумола общей формулы Ar HRg способны подвергаться жидкофазиому окислению под действием ультрафиолетового света или в присутствии перекисей щелочных металлов, формиатов, оксалатов и бензоатов щелочных и щелочноземельных металлов, формальдегида, органических гидроперекисей и соединепий, применяемых в качестве катализаторов алкилирования, нанример фторсульфоновой кислоты, хлористого алюминия, BFg—HF [120, 205—209] при 100-120° [210].
Обычно технический изопропилбензол перед окислением обрабатывается концентрированной серной кислотой (перманганатом, гипохлоритом), едким натром и кипячением над металлическим натрием, после чего перегоняется. В некоторых патентах [199] предлагается обрабатывать углеводород перед окислением катализаторами алкилирования. Особенно хорошие результаты, в смысле полноты удаления ингибиторов окисления, достигаются обработкой изонронилбензола серной кислотой и проведением автоокисления при 110° в реакторе из стекла Пирекс . Для этих целей можно применять также пористый глинозем [200, 201] или водный раствор уксуснокислой ртути [202, 203]. Автоокислепие изопропилбензола кислородом или газами, содержащими кислород, протекает и в отсутствие катализаторов [204]. Гомологи кумола общей формулы Ar HRg способны подвергаться жидкофазиому окислению под действием ультрафиолетового света или в присутствии перекисей щелочных металлов, формиатов, оксалатов и бензоатов щелочных и щелочноземельных металлов, формальдегида, органических гидроперекисей и соединепий, применяемых в качестве катализаторов алкилирования, нанример фторсульфоновой кислоты, хлористого алюминия, BFg—HF [120, 205—209] при 100-120° [210].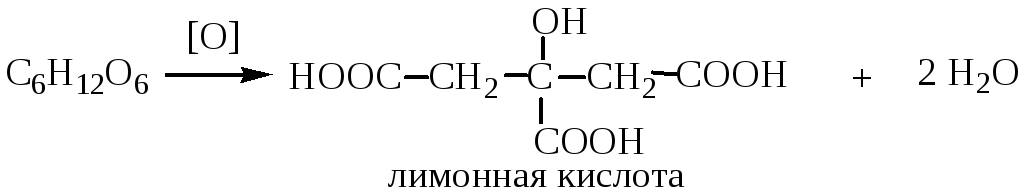 [c.511]
[c.511]
Бутилкаучук. Это название присвоено сополимеру изобутилена с диолефином, как правило с изопреном (1,5—4,5%). Смесь изобутилена и изопрена полимеризуется под действием электрофильного катализатора и, следовательно, проходит по катионному механизму (том I). В промышленности в качестве катализатора применяется раствор хлористого алюминия в хлористом метиле. Рабочая температура равнй —100°. Доказано, что реакция не происходит в отсутствие небольших количеств активаторов , или сокатализаторов , как, например, воды, спиртов ROH или органических кислот RGOOH. Эти вещества образуют с электрофильным катализатором комплекс, обладающий характером сильной протонной кислоты [c.951]
В отдельных случаях ирисутствуюш,ий в системе органический реагент может предотвращ,ать гасящее действие некоторых посторонних ионов. В водном растворе, содержащем соляную или уксусную кислоту, 8-оксихинолин не только увеличивает интенсивность эмиссии определяемых элементов — кальция и стронция, но и снижает гасящее действие алюминия, вызванное образованием трудно-летучего соединения aAlgO. [655—657]. Аналогично действует также ацетилацетон [656]. [c.199]
[655—657]. Аналогично действует также ацетилацетон [656]. [c.199]
Органические кислоты, за исключением, повидимому, хлор-уксусных кислот, являются при низких температурах медленными растворителями для железа и алюминия, но при повышенных температурах (150—200°) в присутствии кислорода и Н2О2 проявляют довольно разрушительное действие на железо, алюминий и даже на медь, латунь и свинец. Им могут достаточно сопротивляться лишь нержавеющие хромоникелевые стали особенно с присадками ниобия и титана. [c.418]
СОСНЫ, лиственницы, березы а = 0,05 при сжатии вдоль волокон ели, пихты, дуба а = 0,04 при изгибе всех пород а = 0,04 при скалывании вдоль волокон для всех пород а = 0,05. С повышением температуры с 20 до + 80° С прочностные свойства дерева ухудшаются на 20″—30%. Наоборот, понижение температуры до минус 60 С увеличивает пределы прочности при скалывании, растяжении и сжатии соответственно на 15, 20 и 45% сравнительно с этими же характеристиками при 20° С. Древесина химически не стойка против действия крепких серной и соляной кислот, азотной кислоты, растворов едких ш,елочей, углекислых солей, солей железа, алюминия, магния, сернистого газа, хлора и многих других сред. Смолы, содержащиеся в древесине, могут загрязнять обрабатываемые вещества. Конструктивное оформление аппаратуры из дерева довольно примитивно. Максимальная температура материалов, обрабатываемых в деревянной аппаратуре, не должна быть выше 100° С. Дерево применяется в пищевой промышленности, а также в промышленности органических полупродуктов и красителей. Дерево служит прекрасным материалом для тары. Дерево устойчиво против органических кислот, хлористых и сернокислых солей, масел, растворов красителей, сахарных растворов, соляных рассолов. Теплоемкость абсолютно сухой древесины не зависит от породы и равна 0,33 ккал/ка °С, теплопроводность ее весьма низка К = 0,03 до 0,1 ккал м Счас, что может явиться в зависимости от применения и достоинством, и недостатком. Коэффициент температурного расширения весьма мал.
Древесина химически не стойка против действия крепких серной и соляной кислот, азотной кислоты, растворов едких ш,елочей, углекислых солей, солей железа, алюминия, магния, сернистого газа, хлора и многих других сред. Смолы, содержащиеся в древесине, могут загрязнять обрабатываемые вещества. Конструктивное оформление аппаратуры из дерева довольно примитивно. Максимальная температура материалов, обрабатываемых в деревянной аппаратуре, не должна быть выше 100° С. Дерево применяется в пищевой промышленности, а также в промышленности органических полупродуктов и красителей. Дерево служит прекрасным материалом для тары. Дерево устойчиво против органических кислот, хлористых и сернокислых солей, масел, растворов красителей, сахарных растворов, соляных рассолов. Теплоемкость абсолютно сухой древесины не зависит от породы и равна 0,33 ккал/ка °С, теплопроводность ее весьма низка К = 0,03 до 0,1 ккал м Счас, что может явиться в зависимости от применения и достоинством, и недостатком. Коэффициент температурного расширения весьма мал. Механические свойства основных пород, используемых в аппаратостроении, приведены в табл. 34. Для улучшения свойств древесины ее покрывают бакелитовым и другими лаками. [c.55]
Механические свойства основных пород, используемых в аппаратостроении, приведены в табл. 34. Для улучшения свойств древесины ее покрывают бакелитовым и другими лаками. [c.55]
При алкилировании бензола галоидными алкилами в присутствии хлористого алюминия в ароматическое кольцо может входить до шести алкильных групп. С другой стороны, при пспользованип клорангидридов органических кислот можно ввести только один ацильный остаток например, при действии на бензол хлористого бензоила в присутствии хлористого алюминия по данным Фриде-чя и Крафтса получается только бензофенон Однако если в бензольном кольце имеются метильные группы, то ароматическое кольцо становится более реакционноспособным и появляется возможность [c.203]
Металлический алюминий был получен в первый раз Вёлером, в 1827 г., при действии калия на хлористый алюминий. Вёлер получил этот металл сперва в виде серого порошка, а потом (1845) и в сплошном виде белого металла, не окисляющегося на воздухе и трудно действующего на кислоты. Вследствие громадного распространения соединений алюминия, желательно было изучить в подробности способы получения этого металла, что и выполнил (1845) Генрих Сент-Клер Девилль, знаменитый своим учением о диссоциации. Его приемы применены были затем в технике и дали уже значительные массы алюминия, но опыт в большом виде показал, что металлический алюминий, обладая большою легкостью и прочностью и малою изменчивостью на воздухе, очень пригоден для некоторых изделий, однако, по своим свойствам оказался не столь пригодным для технических потребностей, как то предполагали первоначально. Действительно, хотя азотная и многие другие кислоты (особенно органические) мало действуют на него, но щелочи, слабый раствор N1-1 , его соли, даже влажная поваренная соль, пот и т. п., растравляют его, и вследствие того предметы, сделанные из алюминия, часто страдают с поверхности, изменяются и не могут заменить, как предполагалось прежде, драгоценных металлов, от которых алюминий отличается большею легкостью.
Вследствие громадного распространения соединений алюминия, желательно было изучить в подробности способы получения этого металла, что и выполнил (1845) Генрих Сент-Клер Девилль, знаменитый своим учением о диссоциации. Его приемы применены были затем в технике и дали уже значительные массы алюминия, но опыт в большом виде показал, что металлический алюминий, обладая большою легкостью и прочностью и малою изменчивостью на воздухе, очень пригоден для некоторых изделий, однако, по своим свойствам оказался не столь пригодным для технических потребностей, как то предполагали первоначально. Действительно, хотя азотная и многие другие кислоты (особенно органические) мало действуют на него, но щелочи, слабый раствор N1-1 , его соли, даже влажная поваренная соль, пот и т. п., растравляют его, и вследствие того предметы, сделанные из алюминия, часто страдают с поверхности, изменяются и не могут заменить, как предполагалось прежде, драгоценных металлов, от которых алюминий отличается большею легкостью. Но сплавы (особенно с медью, напр., алюминиевая бронза), образуемые алюминием, оказались обладающими драгоценными свойствами и пригодными ко многим приложениям. [c.125]
Но сплавы (особенно с медью, напр., алюминиевая бронза), образуемые алюминием, оказались обладающими драгоценными свойствами и пригодными ко многим приложениям. [c.125]
Алюминийорганические соединения оказывают общее раздражающее действие на организм человека. При горении или при взаимодействии алюминийалкилов с влагой воздуха в производственных помещениях образуется сложная смесь продуктов окисления, распада, гидролиза и реакций карбоксилирования с двуокисью углерода [1, с. 201 5]. Основными из них являются аэрозоли алюминия, окиси и гидроокиси алюминия, предельные и непредельные углеводороды, водород, органические кислоты и спирты, окись углерода, альдегиды, а также галогенводороды и алкилгалогениды (в случае разложения алкилалюминийгалогенидов). Отмечается, что значительная часть образующихся яродуктов гидролиза находится в воздухе не в свободном состоянии, а в адсорбционной связи с аэрозолями [1, с. 201]. Из всех образующихся соединений при разложении алюминийалкилов наиболее опасными для человека являются аэрозоли алюминия, его окислов и хлористого водорода. Токсические свойства продуктов разложения низших алюминийалкилов представлены ниже [5] [c.204]
Токсические свойства продуктов разложения низших алюминийалкилов представлены ниже [5] [c.204]
Поливииилбутираль и покрытия из него стойки к действию органических кислот, минеральных масел покрытие обладает высокой твердостью и износостойкостью при истирании, хорошей адгезией к стали, алюминию, меди, цинку, хрому, пластмассам и тканям. К недостаткам покрытий из поливинилбутираля относится их невысокая стойкость в щелочах, минеральных кислотах, растворимость в спиртах. [c.29]
какая формула реакции алюминий+лимонная кислота?
ДАЮ 30 БАЛ ТОЛЬКО РЕШИТЬ ПРВИЛЬНО
Когда уголь полностью сгорает на воздухе, образуется бесцветный газ CO2. Предполагая, что уголь на 100% состоит из у
…
глерода, ответьте на следующие вопросы.
a] Напишите уравнение реакции
б] Сколько молей CO2 производится из 5 молей угля? Определите это количество CO2.
c] Рассчитайте массу угля, необходимую для получения 44,8 л CO2.
г] CO2, h3CO3,
Na2CO3
определить эквивалент.
Просто ответь правильно, а то я пришлю спам!!!
Просто ответь правильно, а то я пришлю спам!!!
ДАЮ 30 БАЛЛ ТОЛЬКО РЕШИТЬ ПРВИЛЬНОКогда уголь полностью сгорает на воздухе, образуется бесцветный газ CO2. Предполагая, что уголь на 100% состоит из у
…
глерода, ответьте на следующие вопросы.a] Напишите уравнение реакцииб] Сколько молей CO2 производится из 5 молей угля? Определите это количество CO2.c] Рассчитайте массу угля, необходимую для получения 44,8 л CO2.г] CO2, h3CO3,Na2CO3определить эквивалент.Просто ответь правильно, а то я пришлю спам!!!
Элемент флеровий был синтезирован в ОИЯИ в г. Дубна по следующей схеме:
abX + 48Ca → 288Fl+410n
Определите X, a и b
Символ элемента X:
Ответ
a:
Число
…
b:
1)Визначити масу купрум (ІІ) оксиду, який утворюється при розкладі 14,7 г купрум (ІІ) гідроксиду.
2)Розрахувати масу солі, яка утвориться при взаємоді
…
ї 13 г цинку з соляною кислотою.
3)Який об‘єм кисню (н.у.) утворюється при розкладі 6 г магній оксиду.
4) Розрахувати який об‘єм водню повинен вступити в реакцію з купрум (ІІ) оксидом, для утворення 32 г міді.
Яка сіль утвориться при взаємодії калій гідроксиду з сульфітною кислотою? Пожалуйста срочнооо!
Розрахуйте масу атомів Кальцію та Оксигену у 150 г негашеного вапна
Пожалуйста помогите с химией хоть чуть-чуть 55 балов
До суміші магнію та міді масою 200 г додали HCl. Виділився водень об’ємом 67,2л. Обчисліть масу міді у суміші
До суміші магнію та міді масою 200 г додали HCl. Виділився водень об’ємом 67,2л. Обчисліть масу міді у суміші
срочно надо подалуста хімя
Коррозия алюминия
Коррозия алюминия – разрушение металла под влиянием окружающей среды.
Для реакции Al3+ +3e → Al стандартный электродный потенциал алюминия составляет -1,66 В.
Температура плавления алюминия — 660 °C.
Плотность алюминия — 2,6989 г/см3 (при нормальных условиях).
Алюминий, хоть и является активным металлом, отличается достаточно хорошими коррозионными свойствами. Это можно объяснить способностью пассивироваться во многих агрессивных средах.
Коррозионная стойкость алюминия зависит от многих факторов: чистоты металла, коррозионной среды, концентрации агрессивных примесей в среде, температуры и т.д. Сильное влияние оказывает рН растворов. Оксид алюминия на поверхности металла образуется только в интервале рН от 3 до 9!
Очень сильно влияет на коррозионную стойкость Al его чистота. Для изготовления химических агрегатов, оборудования используют только металл высокой чистоты (без примесей), например алюминий марки АВ1 и АВ2.
Коррозия алюминия не наблюдается только в тех средах, где на поверхности металла образуется защитная оксидная пленка.
При нагревании алюминий может реагировать с некоторыми неметаллами:
2Al + N2 → 2AlN – взаимодействие алюминия и азота с образованием нитрида алюминия;
4Al + 3С → Al4С3 – реакция взаимодействия алюминия с углеродом с образованием карбида алюминия;
2Al + 3S → Al2S3 – взаимодействие алюминия и серы с образованием сульфида алюминия.
Коррозия алюминия на воздухе (атмосферная коррозия алюминия)
Алюминий при взаимодействии с воздухом переходит в пассивное состояние. При соприкосновении чистого металла с воздухом на поверхности алюминия мгновенно появляется тонкая защитная пленка оксида алюминия. Далее рост пленки замедляется. Формула оксида алюминия – Al2O3 либо Al2O3•H2O.
Реакция взаимодействия алюминия с кислородом:
4Al + 3O2 → 2Al2O3.
Толщина этой оксидной пленки составляет от 5 до 100 нм (в зависимости от условий эксплуатации). Оксид алюминия обладает хорошим сцеплением с поверхностью, удовлетворяет условию сплошности оксидных пленок. При хранении на складе, толщина оксида алюминия на поверхности металла составляет около 0,01 – 0,02 мкм. При взаимодействии с сухим кислородом – 0,02 – 0,04 мкм. При термической обработке алюминия толщина оксидной пленки может достигать 0,1 мкм.
Алюминий достаточно стоек как на чистом сельском воздухе, так и находясь в промышленной атмосфере (содержащей пары серы, сероводород, газообразный аммиак, сухой хлороводород и т.п.). Т.к. на коррозию алюминия в газовых средах не оказывают никакого влияния сернистые соединения – его применяют для изготовления установок переработки сернистой нефти, аппаратов вулканизации каучука.
Коррозия алюминия в воде
Коррозия алюминия почти не наблюдается при взаимодействии с чистой пресной, дистиллированной водой. Повышение температуры до 180 °С особого воздействия не оказывает. Горячий водяной пар на коррозию алюминия влияния также не оказывает. Если в воду, даже при комнатной температуре, добавить немного щелочи – скорость коррозии алюминия в такой среде немного увеличится.
Взаимодействие чистого алюминия (не покрытого оксидной пленкой) с водой можно описать при помощи уравнения реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2↑.
При взаимодействии с морской водой чистый алюминий начинает корродировать, т.к. чувствителен к растворенным солям. Для эксплуатации алюминия в морской воде в его состав вводят небольшое количество магния и кремния. Коррозионная стойкость алюминия и его сплавов, при воздействии морской воды, значительно снижается, если в состав метала будет входить медь.
Коррозия алюминия в кислотах
С повышением чистоты алюминия его стойкость в кислотах увеличивается.
Коррозия алюминия в серной кислоте
Для алюминия и его сплавов очень опасна серная кислота (обладает окислительными свойствами) средних концентраций. Реакция с разбавленной серной кислотой описывается уравнением:
2Al + 3H2SO4(разб) → Al2(SO4)3 + 3H2↑.
Концентрированная холодная серная кислота не оказывает никакого влияния. А при нагревании алюминий корродирует:
2Al + 6H2SO4(конц) → Al2(SO4)3 + 3SO2↑ + 6H2O.
При этом образуется растворимая соль – сульфат алюминия.
Al стоек в олеуме (дымящая серная кислота) при температурах до 200 °С. Благодаря этому его используют для производства хлорсульфоновой кислоты (HSO3Cl) и олеума.
Коррозия алюминия в соляной кислоте
В соляной кислоте алюминий или его сплавы быстро растворяются (особенно при повышении температуры). Уравнение коррозии:
2Al + 6HCl → 2AlCl3 + 3H2↑.
Аналогично действуют растворы бромистоводородной (HBr), плавиковой (HF) кислот.
Коррозия алюминия в азотной кислоте
Концентрированный раствор азотной кислоты отличается высокими окислительными свойствами. Алюминий в азотной кислоте при нормальной температуре исключительно стоек (стойкость выше, чем у нержавеющей стали 12Х18Н9). Его даже используют для производства концентрированной азотной кислоты методом прямого синтеза
При нагревании коррозия алюминия в азотной кислоте проходит по реакции:
Al + 6HNO3(конц) → Al(NO3)3 + 3NO2↑ + 3H2O.
Коррозия алюминия в уксусной кислоте
Алюминий обладает достаточно высокой стойкостью к воздействию уксусной кислоты любых концентраций, но только если температура не превышает 65 °С. Его используют для производства формальдегида и уксусной к-ты. При более высоких температурах алюминий растворяется (исключение составляют концентрации кислоты 98 – 99,8%).
В бромовой, слабых растворах хромовой (до10%), фосфорной (до 1%) кислотах при комнатной температуре алюминий устойчив.
Слабое влияние на алюминий и его сплавы оказывают лимонная, масляная, яблочная, винная, пропионовая кислоты, вино, фруктовые соки.
Щавелевая, муравьиная, хлорорганические кислоты разрушают металл.
На коррозионную стойкость алюминия очень сильно влияет парообразная и капельножидкая ртуть. После недолгого контакта металл и его сплавы интенсивно корродируют, образуя амальгамы.
Коррозия алюминия в щелочах
Щелочи легко растворяют защитную оксидную пленку на поверхности алюминия, он начинает реагировать с водой, в результате чего металл растворяется с выделением водорода (коррозия алюминия с водородной деполяризацией).
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑;
2(NaOH•H2O) + 2Al → 2NaAlO2 + 3H2↑.
Образуются алюминаты.
Также оксидную пленку разрушают соли ртути, меди и ионы хлора.
Как остановить окисление алюминия – АвтоТоп
Вопросы, как и чем очистить алюминий, актуальны для многих. Алюминиевые изделия отличаются легкостью, удобством и красивым блеском, однако в результате эксплуатации быстро темнеют, покрываются налетом или окисью, что портит эстетический вид и мешает полноценному использованию предмета. Дабы вернуть блеск и чистоту алюминию, используйте народные средства и специальную бытовую химию, соблюдайте рекомендации по уходу и эксплуатации.
Общие рекомендации
Алюминий – мягкий металл, который требует бережного отношения во время эксплуатации и чистки. Чтобы почистить изделия от разного рода загрязнений и не повредить материал, следуйте простым рекомендациям:
- Не используйте металлические скребки или щетки, жесткие мочалки или острые предметы. Данные инструменты повреждают поверхность, оставляют царапины и другие неэстетичные следы. После такой обработки посуды частички алюминия могут попадать в пищу, что негативно отразиться на вкусовых качествах блюда и его пользе.
- Не проводите очистку изделий из алюминиевого сплава абразивными средствами (песком, порошком).
- Кухонную утварь следует мыть только после остывания. Горячий металл при взаимодействии с водой деформируется, а вернуть его первоначальный вид самостоятельно практически невозможно.
- Не применяйте для чистки агрессивные вещества – кислоты и щелочи. Они портят эстетический вид, а возникшая химическая реакция может привести к выделению токсинов или тяжелых металлов, опасных для здоровья.
- Чтобы добиться желаемого эффекта, выбирайте метод очистки и чистящее средство с учетом типа и степени загрязнения.
- Не мойте алюминиевую посуду в посудомойке. Перепады температур негативно действуют на металл, повышают риск деформации и коррозии.
- Дабы изделие блестело, проводите полировку поверхности губкой, смоченной в растворе, приготовленном из буры и аммиака в соотношении 3:1.
Не мойте алюминиевую посуду в посудомоечной машине.
Как очистить алюминий от окиси в домашних условиях
Алюминий подвержен окислению. При эксплуатации изделий слой окисла растет, что приводит к появлению темных пятен, которые покрывают всю поверхность или отдельные детали.
Чистить окись и черноту можно дома доступными народными средствами:
- Сода. Растворите средство в небольшом количестве воды для получения кашицы. Нанесите смесь на пятно и обработайте поверхность круговыми движениями.
- «Кока-Кола». Залейте предмет газировкой и через 1,5 часа вымойте его водой.
- Щавель. В емкость, требующую очистки, выложите пучок свежего щавеля и залейте водой. Поставьте посуду на плиту и прокипятите смесь на слабом огне 30 минут. Слейте раствор и прополощите изделие.
- Лимонная кислота. В кастрюле соедините 2 ст. л. лимонной кислоты и 1 л воды. Прокипятите раствор 15-25 минут в зависимости от степени загрязнения, а затем вымойте емкость чистой водой.
- Яблоко. Натрите потемневший окисленный след половинкой фрукта и оставьте на полчаса, чтобы яблочная кислота подействовала. По истечении времени вымойте емкость моющим средством.
Горчичный порошок, уксус и соль
Для удаления черноты с наружных стенок изделия приготовьте смесь из равных частей поваренной соли, уксуса и сухого горчичного порошка. Перемешайте компоненты до однородной консистенции. При помощи губки нанесите смесь на загрязнения и через 15 минут смойте теплой водой.
Поваренная соль
Для очистки алюминия соедините 2 ст. л. соли и 1 ч. л. теплой воды. Смешайте компоненты и нанесите на губку. Вотрите смесь в место загрязнения, оставьте на полчаса, а затем вымойте кастрюлю.
Кислоты
Для очистки алюминиевых изделий используйте продукты, содержащие натуральные кислоты: кефир, лимонный сок, простоквашу, огуречный рассол. Залейте выбранным средством емкость или деталь и оставьте на ночь. Утром прополощите изделие и вытрите насухо.
Избавиться от значительного почернения помогут очищающие средства на основе щавелевой кислоты. Нанесите препарат на поверхность, выждите время, указанное на упаковке, а затем смойте водой.
Винный камень
Оттереть потемнения можно при помощи винного камня. Для проведения чистки в 5 л теплой воды растворите 3 ст. л. средства и в полученном растворе замочите изделие на 2-3 часа. Удалите остатки грязи мягкой губкой, прополощите теплой водой и вытрите насухо.
Методы удаления нагара с алюминия
Нагар – распространенное явление для алюминиевой посуды. Удалить остатки пригоревшей пищи и вернуть изделию естественный блеск и чистоту довольно сложно, учитывая мягкость и капризность металла. Однако справиться с проблемой возможно, используя доступные средства и маленькие хитрости.
Зубной порошок
Дабы убрать нагар со дна кастрюли, обильно засыпьте его зубным порошком и немного сбрызните водой. Оставьте емкость в таком виде на ночь, а утром удалите загрязнения силиконовой лопаткой или мягкой губкой.
Хозяйственное мыло и уксус
Для очистки нагара воспользуйтесь следующим эффективным методом:
- Подготовьте большую эмалированную кастрюлю, в которой свободно разместится емкость, требующая чистки.
- Влейте в посуду 1,5 л воды, добавьте натертое на терке хозяйственное мыло и 150 мл столового уксуса.
- Закройте емкость крышкой и проварите очищаемое изделие 30 минут.
- Вымойте алюминиевую посуду слабым мыльным раствором, а затем тщательно прополощите.
ПВА и мыло
Способ удаления серьезных загрязнений:
- В кастрюле вскипятите 3 л воды.
- Добавьте 1 ст. л. клея ПВА и треть бруска банного мыла, нарезанного тонкими ломтиками.
- Прокипятите раствор под закрытой крышкой 30-40 минут.
- Вымойте кастрюлю моющим средством и хорошо прополощите проточной водой.
Другие методы борьбы с нагаром
Для удаления незначительных загрязнений воспользуйтесь одним из представленных способов:
- Таблетка для посудомоечной машины. Залейте кастрюлю водой, чтобы жидкость покрыла нагар на 2 см. Добавьте 1 таблетку для посудомойки (Finish) и проварите смесь полчаса. Тщательно вымойте кастрюлю из алюминия и хорошо прополощите.
- Хозяйственное мыло. Для удаления свежего нагара залейте посуду кипятком, добавьте ½ бруска хозяйственного мыла, натертого на терке, прокипятите под закрытой крышкой на слабом огне в течение получаса. Остудите емкость и удалите нагар кухонной губкой или силиконовым скребком.
- Бытовая химия. Справиться с нагаром и другими видами загрязнений помогут специальные средства. При выборе препарата убедитесь, что он подходит для алюминия, внимательно ознакомьтесь с инструкцией и примите рекомендованные меры безопасности.
- Поваренная соль. Дабы отмыть сильный нагар, в посуду влейте 1 л воды и добавьте 2 ст. л. соли. Прокипятите смесь 20 минут, а затем вымойте изделие губкой.
Способы очищения накипи с алюминиевой посуды
Посуда из алюминия подвержена образованию накипи. Это обусловлено высоким содержанием в водопроводной воде солей тяжелых металлов, известковых отложений. Чтобы устранить проблему и вернуть чайнику, кастрюле или бидону сияние и чистоту, необходимо правильно чистить и своевременно мыть изделия.
Уксус
Алгоритм очистки алюминиевого чайника:
- В емкость влейте 1/2 бутылки уксуса, 9%.
- Закройте чайник крышкой и закипятите.
- После закипания взболтайте жидкость, чтобы обработать все стенки посуды.
- Слейте раствор, залейте чистую воду и прокипятите чайник дважды.
Дабы избавиться от неприятного уксусного аромата после чистки, поместите в посуду кожуру апельсина/лимона, залейте водой и оставьте на 15 минут. Такая хитрость создаст приятный аромат и свежесть.
Лимонная кислота
Инструкция по очистке алюминия от накипи:
- В теплой воде (1,5 л) растворите 25 г лимонной кислоты.
- Влейте раствор в емкость, закройте крышкой и поставьте на огонь.
- После закипания прокипятите жидкость 5 минут с открытой крышкой.
- Оставьте посуду до полного остывания.
- Промойте изделие проточной водой.
Правила эксплуатации алюминиевой посуды
Сохранить первозданный вид кухонной утвари, уберечь ее от деформации и серьезных загрязнений под силу каждой хозяйке. Для этого соблюдайте основные рекомендации по эксплуатации и уходу за алюминиевыми изделиями:
- Не используйте посуду для засаливания огурцов, капусты и других продуктов. Кислота вступает в реакцию с металлом, что провоцирует выделение отравляющих веществ, опасных для здоровья.
- Алюминиевая утварь не подходит для ежедневной эксплуатации из-за быстрого изнашивания.
- Не храните в алюминиевой посуде остатки еды.
- Избегайте длительного воздействия высоких температур на металл. Во время готовки используйте средний или слабый огонь.
- Для очистки не применяйте порошок, наждачную бумагу, другие абразивные инструменты.
Алюминиевые изделия отличаются легкостью, многофункциональностью, простотой в эксплуатации. При правильном использовании и уходе кухонная утварь, раковина или деталь прослужат долго, выполняя свое основное предназначение.
Видео
Дабы разобраться в нюансах проведения чистки алюминия, посмотрите представленные видеосюжеты:
Молодая мама, жена и фрилансер по совместительству. Будучи юристом по образованию, привыкла собирать и предоставлять максимально полную и достоверную информацию. Постоянно совершенствуется в профессиональной сфере и стремится к личностному росту и развитию.
Нашли ошибку? Выделите текст мышкой и нажмите:
В посудомоечной машине хорошо отмываются не только тарелки и чашки. В нее можно загрузить пластмассовые игрушки, стеклянные плафоны светильников и даже грязные овощи, например картошку, но только без применения моющих средств.
Натяжные потолки из ПВХ-пленки способны выдерживать от 70 до 120 л воды на 1 м 2 своей площади (в зависимости от размеров потолка, степени его натяжения и качества пленки). Так что можно не опасаться протечек от соседей сверху.
Свежий лимон подходит не только для чая: очистите загрязнения с поверхности акриловой ванны, потерев половинкой разрезанного цитруса, или быстро вымойте микроволновку, поставив в нее емкость с водой и дольками лимона на 8-10 минут при максимальной мощности. Размягченную грязь останется просто вытереть губкой.
Если на любимых вещах появились первые признаки вынашивания в виде неопрятных катышков, от них можно избавиться при помощи специальной машинки – шейвера. Он быстро и эффективно сбривает сбившиеся в комки волокна ткани и возвращает вещам достойный вид.
Для борьбы с молью существуют специальные ловушки. В липкий слой, которым они покрыты, добавлены феромоны самок, привлекающие самцов. Прилипая к ловушке, они выбывают из процесса размножения, что ведет к уменьшению популяции моли.
Перед тем как выводить различные пятна с одежды, нужно выяснить, насколько безопасен выбранный растворитель для самой ткани. Его наносят в небольшом количестве на малозаметный участок вещи со стороны изнанки на 5-10 минут. Если материал сохраняет свою структуру и цвет, можно переходить к пятнам.
Привычка «экономно» пользоваться стиральной машиной-автомат может привести к появлению в ней неприятного запаха. Стирки при температурах ниже 60 ℃ и короткие полоскания позволяют грибкам и бактериям с грязной одежды оставаться на внутренних поверхностях и активно размножаться.
Нити из золота и серебра, которыми в старину вышивали одежду, называются канителью. Для их получения металлическую проволоку долго тянули клещами до состояния необходимой тонкости. Отсюда и пошло выражение «тянуть (разводить) канитель» – «заниматься долгой однообразной работой» или «затягивать выполнение дела».
Удалить накипь и нагар с подошвы утюга проще всего поваренной солью. Насыпьте на бумагу толстый слой соли, нагрейте утюг до максимума и несколько раз, слегка придавливая, проведите утюгом по солевой подстилке.
Уважаемые Пикабушники, зная что среди Вас есть множество умных и разносторонних личностей, прошу у вас совета да помощи!
Есть у меня хобби по изготовлению изделию из алюминия, изделия эти подвержены постоянному контакту с водой и различными продуктами горения, и беда в том, что гниют эти изделия и не служат больше полу года и первозданном всем прекрасном виде.
Посоветуйте, как защитить материал от коррозии, анодирование и окраска не спасают.
Дубликаты не найдены
Вашу ж мамашу. ХИМИЮ ВАМ В ШКОЛЕ НАХРЕНА ПРЕПОДАВАЛИ?
Алюминий – ОЧЕНЬ АКТИВНЫЙ металл. Защищает его от воздействий тонкая оксидная пленка. Высокая температура в сочетании еще и с воздействием воды будет разрушать алюминий. Хоть ты что делай.
Свинцовый сурик. Про гальванические пары не слышали? Вот ее вы и получите.
Аффтар, не парь мозги. Для таких целей нужно использовать ДРУГИЕ МЕТАЛЛЫ. Медь и сплавы на ее основе, нержавеющая сталь. Забудь про алюминий.
Не-не, свинцовый сурик (оксид свинца в сочетании с олифой и лаковой основой) – не реагент в данном случае. Алюминий активнее свинца, см. таблоид Менделя. А вот соли калия-натрия-кальция из воды, его рушат на раз, дай только добраться через слой Al2O3
Алюминий активнее свинца – верно. Вот и будет тебе гальваническая микропара – в огромном числе. При этом что у нас будет разрушаться?
[Вспоминаем учебник химии, где рассказывали про оцинкованное железо]
Справочник химика. Взаимодействие алюминия с водой при высоких температурах
http://chem21.info/info/1702139/
Когда-то, пацанами, мы нашли очень эффективный способ добычи водорода из воды – при помощи алюминия. Соль + медный купорос растворяем в воде в бутылке, кидаем алюминиевые вилки, стыренные в столовой – на горловину шарик. Алюминий БУРНО взаимодействует с водой с выделением огромного количества водорода. Шарик наполняется за пару минут. Куда там соляной кислоте с цинком
нужно исключить электрохимическую корозию с медьюнержавейкой
использовать магниевый анод
либо использовать цинковый расходный анод
так в морской воде защищают алюминиеввые лодки
Попробуй не опускать в воду и не подвергать горению, может поможет.
На приеме у доктора:
-У вас однозначно кашель
ещё одно дело распутано, поздравляю коллегу.
отличный повод не заниматься бесполезным хобби.
Кабельные заводы используют лак для предотврашения ржавчины.
СОЖ (смазочно-охлаждающие жидкости) используют при обработке метала (сверление, точение шлифовка, штамповка)
Цвет мет. хорошо коорозирует с шелочами (сода, соли) зашитить его можно кислотами (азотная, фосфорная и т.д.). Самый оптимальный вариант для кальянов это обработка до зеркальной поферхности и покрытие лаком.
П.С. это как надо делать кальян чтобы огонь 9угли) прожигали его? Глининая чашечка для чего? Может конструкцию поменять? (у Альфакеров спец. чаша для льда сверху сделана (он типо воздух охлаждает))
Много раз замечал – алюминей долгое время хорошо стоит на открытом воздухе но толи со временем толи от каких- то воздействий ((допустим кислотный дождь ) моментально покрывается белым налетом (я так понимаю разрушается оксидня пленка ) и насинает идти реакция – образуется не окид алюминия а гидрооксид который в свою очередь поверхность совсем не защищает .
Так вот вопрос что можно сделать с алюминем чтобы остановить этот процес ,желательно химичискими способами
зачистку и покраску не предлогать
я так думаю что можно подобрать метализацию (омеднение, оцинкование, никелирование) экспериментально.
Где-то читал, что хорошо углекислотой всё чистится. Из огнетушителя. Но не проверял
Надо поискать среди авиационных технологий. Кто имел дело с авиатехникой, тот знает, что алюминиевые детали покрывают такой довольно плотной (обычно цветной) плёнкой. Возможно, это просто краска. Я чеще всего видел тёмно-зелёную.
А защита такая – дело актуальное. Ведь это именно та причина, по которой самолёты списывают через определённый срок службы. Конденсат при смене высоты полёта забирается в самые недоступные точки, ремонт которых невозможен, и вся надежда – на заводские антикоррозийные покрытия. Однажды довелось присутствовать при разделке старого АН-24 – круто его проело.
А какую деталь необходимо защитить от коррозии и в какие условия работы ?
в данном случае алюминевый бокс ,алюминевые трубки антен , несколько лет стояли как новые но со временем стал покрывтся белым налетом
пробовал его почитстить но всеравно через небольшой промежуток времени появлялся налет .
Просто интересно – не раз замечал что до кокогото момента оксидная пленка достаточно прочная но в какойто момент что то присходит и защита исзчезает, сам склоняюсь к покраске но пред этим поверхность нужно обработать , механически это трудно вот если бы чем промыть
ВОПРОС
Консультации как остановить корозию алюминевой детали
piligrim130
15 января, 12:56 Много раз замечал – алюминей долгое время хорошо стоит на открытом воздухе но толи со временем толи от каких- то воздействий ((допустим кислотный дождь ) моментально покрывается белым налетом (я так понимаю разрушается оксидня пленка ) и насинает идти реакция – образуется не окид алюминия а гидрооксид который в свою очередь поверхность совсем не защищает .
Так вот вопрос что можно сделать с алюминем чтобы остановить этот процес ,желательно химичискими способами
зачистку и покраску не предлогать
ОТВЕТ :
«ГАЛЬВАНОТЕХНИКА»,(справочник),п/р Гинберга и др.,Москва,»Металлургия»,1987,стр.449
. для хроматной обработки алюминия рекомендуется ряд растворов, я отобрал не самые экзотические:
Раствор 1.
Хромового ангидрида 3 – 4 г. на литр р-ра;
Кремнефтористого натрия 3 – 4 г. на литр р-ра ;
Температура 18 – 25 град.Цельсия;
Время обработки 8 – 20 мин.
Оксидная плёнка бесцветная.
Раствор 2.
Хромового ангидрида 5 – 10 г. на литр р-ра;
Ортофосфорной кислоты 40 – 60 г. на литр р-ра;
Фторида натрия 3 – 5 г. на литр р-ра;
Температура 15 – 30 град. Цельсия .
Оксидная плёнка прочная и может служить хорошим грунтом под лакокрасочное пркрытие.
Желаю успехов! ahonik
понятно, а вот еще вопрос при погружении алюминевой детали в Naoh, точнее адскую смесь типа КРОТА (Состав для очистки канализации ) алюминий наченает покрыватся черным налетом .
После промывки и просушки черное покрытие теряет стойкость и легко стерается – как его можно закрепить
гдето встречал способы чернения алюминия – желательно доступными способами
piligrim130
сегодня, 11:32 понятно, а вот еще вопрос при погружении алюминевой детали в Naoh, точнее адскую смесь типа КРОТА (Состав для очистки канализации ) алюминий наченает покрыватся черным налетом .
После промывки и просушки черное покрытие теряет стойкость и легко стерается – как его можно закрепить
гдето встречал способы чернения алюминия – желательно доступными способами
ОТВЕТ
Чистый алюминий в чистом едком натре никаких черных осадков не даёт.Можно окрашивать алюминий анодированием.
Успехов. ahonik
Форум про радио — сайт, посвященный обсуждению электроники, компьютеров и смежных тем.
95% успеха состоит с правильной воды для опрыскиваня.
Очень похожая ситуация и в сельском хозяйстве, где аграрии используют воду для опрыскивания из речек, скважин, озёр и прочее.
Рабочий раствор составляется только с 5% действующих веществ, а остальные 95% это вода.
Именно от такой воды, от её характеристик зависит, насколько эффективно сработает тот или другой препарат. Значит, смело можна заявить – качество воды очень важно и за ней необходимо следить!
Основные факторы, которые влияют на качество воды:
— уровень жесткости
— показатель рН
— мутность
— температура
Смоделируем ситуацию. Агроном купил новую технику, купил нужные и лучшие семена, хорошо рассчитал технологическую карту, но не учёл качество воды.
Напоминает бочку Либиха, где ограниченым фактором, который не позволит ей наполниться до края является – качество воды. С первыми двумя факторами трудно разобраться без знаний химии, а вот с последними ситуация проще.
Мутность.
Такая вода встречается, когда набирается вода с речек или озёр, и проблема не только в химическом составе, но и в удобстве использования. Органические остатки вступают в реакцию с пестицидами и результат в основном не удовлетворительный, а ещё попадают остатки растений, водоростли, разные виды животных, которые живут в воде (рыбы, лягушкт и т.п.) и самые простые организмы. Использовать осмос или дистилированную воду невероятно дорого. Монтаж собственной скважины, в нужном для вас месте – сэкономит время и расходы на логистику. И главное – вода будет чистой.
Но, появляется новая проблема — температура.
Вода из скважины холодная и в среднем её ткмпература 12 °С. Порошкообразные вещества в такой воде очень плохо растворяются, и как следствие, теряется концентрация рабочего раствора. Есть один вариант, это подогреть воду на протяжении дня, заблаговременно набрать у опреелённые ёмкости.
Вот и дошли к двум самым важным факторам рН и жесткость.
Определить, что важнее невозможно, так как каждый с этих факторов играет свою роль на эффективность препарта, поэтому решать нужно сразу две проблемы. Значение рН характеризирует кислотность (Концентрация ионов водорода) или щёлочность любого раствора в диапазоне от 0 до 14, до 7 рН среда кислая, 7 рН нейтральная, а выше 7 рН щелочная. Большинство пестицидов является кислотами и соответственно для эффективной работы им необходимо нейтральная или кислая среда, но уж никак не щёлочная. Если пестициды попадают в щёлочную среду происходит щелочной гидролиз – деградация пестицида до неактивных (нетоксичных) форм. Жесткость воды – это общий термин, который характеризирует сумму ионов Кальция (Ca2+) и Магния (Mg2+ ) и других металов. Чем больше концентрацияэтих и других металов, тем жестче будет вода. При использовании слишком жесткой воды свыше 300 ррм заключается опасность в том, что свободные и «сильные» ионы Кальция и Магния замещают более слабые ионі действующего вещества (пестицидов).
Несколько маленьких и незаметных отверствий в большой бочке, не позволят наполнить её наполнить её и получить ожидаемый результат. Для начала скважину сдклать, позже воду нужно подогркть, а ещё и рН в ней не подходит, о жесткости вообще хотелось бы забыть, но если начали, нужно разбираться, что и как!
Способов для решения выше перечисленных проблем есть несколько. Один из них начали использовать в Америке вначале 90х годов, где в качестве подкислителя использовали сульфат аммония.
То что он действительно работает, это да, но не с желаемым эффектом. С его использованием обнаружили один из минусов – в первую очередь это растворимость. Сульфат амония не растворяется полностью в холодной воде и как результат – нерастворимый осадок. Ещё один из минусов – это логистика, норма расхода сульфат аммония в среднем 4кг на 100 литров воды, и вот когда нужно обработать, к примеру, 300 га это уже 1200 кг, вряд ли кто-то захочет потратить весь день, чтобы таким способом «улучшать» характеристику воды. И на последок, хотя наверное один из важных минусов – «экономия»! Если подсчитать все логистические услуги, хранение, погрузочные работы и затраты времени на ожидания (пока растворится «подкислитель») — получается не экономия, а лишь перерасход денег.
Есть один продукт, который как помогает избежать этих проблем. Способ эффективный но есть несколько но …
Лимонная кислота, которая действительно окисляет воду и делает это иногда слишком хорошо. А еще она уменьшает жесткость воды, но по сравнению со специальными кондиционерами воды лимонная кислота справляется не очень эффективна. Кажется, что все хорошо, низкая норма расхода (100г на 100л воды), не дорогая (примерно 1кг — 25грн), уменьшает показатели рН и жесткость, меньшие затраты на логистику, какие же могут быть минусы? К сожалению они есть. Лимонную кислоту используют в виде порошка, что с ней происходит без тщательного перемешивания — известно. Уменьшение жесткости происходит за счет взаимодействия с кальцием (Са) при этом образуется соль — Цитрат кальция (Ca3 (C6H5O7) 2), которая очень сильно снижает усвояемость основных питательных элементов. Рабочий раствор в котором есть лимонная кислота, при взаимодействии с листовой поверхностью сильно сушит письмо, что приводит к снижению усвояемости основных минералов.
Цитрат кальция (соль) сама по себе тоже может выпадать в осадок, забивая форсунки и фильтра потому что она нерастворимая. Среди прочего, что лимонная кислота просто оседает, она еще и отрицательно влияет на изделия из металла и резины. Такие металлы, как силумин и алюминий вообще не «дружат» с лимонной кислотой, через некоторое время они превращаются в порошок.
В системах опрыскивателя есть элементы именно из таких металлов и поэтому, использовать лимонную кислоту в качестве подкислителя крайне опасно. С резиной подобная ситуации, со временем она теряет упругость и превращается в пасту. Негативные последствия можно увидеть на примерах стиральных машин, которые часто промывают лимонной кислотой, чтобы избавиться от неприятного запаха или плесени. Одно дело стиральная машина, стоит 500 $, а что же с опрыскивателем, цена которого иногда более 200000 $? И еще один из важных факторов — это рН земли. Для полноценного усвоения растениями наиболее доступных элементов — рН земли должен быть от 7 и выше (зависит от минералов, которые вносятся), а как удерживать этот показатель в норме, если мы постоянно заливаем водный раствор с рН ниже 5, что в свою очередь приводит к подкисление земле Кто-то может подумать — тогда почему бы не добавлять меньшую норму лимонной кислоты? Тогда рН потребуется. Возможно и так, но как тогда быть с жесткостью?
Такая ситуация приводит к использованию «управленческих костылей», и увеличение количества переменных параметров приводит к использованию все большего и большего количества разнообразных костылей, каждый из которых решает одну проблему, то способствует появлению новой, для решения которой нужна своя костыль.
Специалисты компании Агротека создали карту с показателями жесткости и рН воды:
Для решения сразу всех проблем — существуют комплексные адъюванты, в нашем случае кондиционер жесткости воды и регулятор pH — Аквалайт.
В работе с этим продуктом «но» не существуют. Его стала формула помогает подобрать необходимую норму препарата для того, чтобы снизить рН до необходимой отметки и параллельно буферизует избыточную жесткость. Аквалайт является раствором, поэтому проблем с растворимостью в холодной воде не существует. Нормы расхода начинаются с 50 мл на 100 л воды помогает уменьшить затраты на логистику, а 5ти литровая канистра позволяет для удобного использования.
Вариантов, как подготовить воду для максимально эффективного применения много, выбор за вами.
Что же выберете сегодня? Сэкономить деньги и приобрести «народный продукт» или использовать старые технологии и тратить драгоценное время при обработке? Или же выбрать лучший вариант — комплексный адъювант который поможет решить все проблемы с подготовкой воды. Выбор за Вами.
С умным подходом — большой доход обеспечен.
За более подробной информацией о регуляторе рН и кондиционер жесткости воды Аквалайт, обращайтесь к специалистам компании Агротека.
Тел.: +38 (044) 221 8870, моб.: +38 (050) 221 8810
Часто задаваемые вопросы: Дезодоранты — NIVEA
1. В ЧЕМ РАЗНИЦА МЕЖДУ ДЕЗОДОРАНТОМ И АНТИПЕРСПИРАНТОМ?
Дезодоранты убивают бактерии, вызывающие появление у тела неприятного запаха. Дезодоранты содержат дезодорирующие активные вещества, которые препятствуют росту бактерий или даже уменьшают количество бактерий в области подмышек.
Антиперспиранты содержат антиперспирантные активные вещества – обычно это соли алюминия – которые уменьшают потоотделение из потовых желез, образуя в самой верхней части потовых пор временные гелевые пробки. Постепенно эти пробки исчезают в результате механического воздействия и естественного процесса обновления кожи. Антиперспиранты тоже обладают дезодорирующим действием, поскольку они сдерживают рост бактерий за счет более низкого уровня рН и меньшего количества влаги в области подмышек.
2. ПОЧЕМУ АНТИПЕРСПИРАНТЫ ОТ NIVEA СОДЕРЖАТ СОЛИ АЛЮМИНИЯ (НАПРИМЕР, ХЛОРГИДРАТ АЛЮМИНИЯ)?
Многим хотелось бы, чтобы дезодоранты не только подавляли запах, но и способствовали уменьшению потоотделения, что предотвращало бы появление пятен на одежде. Все эффективные антиперспиранты содержат соли алюминия (например, хлоргидрат алюминия). Эти соли образуют временные гелевые пробки в самой верхней части потовых пор, в результате чего выделяется меньше пота. Со временем, благодаря трению и естественному процессу обновления кожи, эти пробки исчезают.
Соли алюминия используются в производстве антиперспирантов уже более ста лет. В целом, применяемые в косметике ингредиенты строго контролируются Европейской директивой о косметике и подвергаются жесткому контролю безопасности и научному анализу на европейском и национальном уровнях.
3. ПОЧЕМУ МЫ ПОТЕЕМ?
Потоотделение происходит вследствие нескольких факторов. Повышенная температура тела из-за физической активности и/или жары может вызвать потоотделение по всему телу. При таком выделении пота происходит терморегуляция организма за счет испарительной теплоотдачи. Пот выделяется так называемыми эккриновыми потовыми железами и состоит в основном из воды и солей.
Потоотделение также может быть вызвано эмоциональным или психологическим стрессом. В таких случаях оно обычно происходит в области подмышек, ступней, ладоней и лба. Такой пот выделяется не только эккриновыми, но и апокриновыми потовыми железами. Апокриновый пот состоит из липидов и белков, которые метаболизируются кожными бактериями, что приводит к появлению у тела специфического запаха. Вызванное стрессом потоотделение является составной частью нашей древней эволюционной реакции на угрожающую ситуацию (реакция «борьба или бегство») и играет важную роль в невербальной коммуникации. Для того чтобы противодействовать потоотделению, вызванному стрессом, мы разработали женские и мужские спреи и ролики «Защита АнтиСтресс» от NIVEA.
4. ВРЕДНО ЛИ СДЕРЖИВАТЬ ПОТООТДЕЛЕНИЕ С ПОМОЩЬЮ АНТИПЕРСПИРАНТОВ?
Использование антиперспирантов не влияет на терморегуляцию организма. Общая площадь подмышек составляет примерно 200 cm2, то есть около 1% всей поверхности тела. Конечно, эта область слишком мала, чтобы она могла нарушить терморегуляцию всего организма. Безопасность антиперспирантов была доказана в ходе многих исследований, поэтому их применение в косметической продукции было одобрено.
5. ПОЧЕМУ МЫ ПАХНЕМ?
Свежий пот представляет собой жидкость без запаха. Неприятный запах появляется, только когда присутствующие в области подмышек кожные бактерии метаболизируют (то есть расщепляют) определенные компоненты пота, такие как липиды и белки. В области подмышек создаются идеальные условия для роста кожных бактерий благодаря наличию здесь влажной среды, более высокому уровню рН и оптимальному снабжению бактерий питательными веществами из потовых и сальных желез.
6. ПОЧЕМУ НУЖНО ВСТРЯХИВАТЬ ДЕЗОДОРАНТ ИЛИ АНТИПЕРСПИРАНТ ОТ NIVEA?
Перед использованием спреи-антиперспиранты (например, *NIVEA DRY Spray*) необходимо хорошо встряхнуть, чтобы антиперспирантный активный порошок (соль алюминия) равномерно распределился по баллончику. Иначе средство может выходить из отверстия в слишком концентрированной форме, что может привести к закупорке клапана или появлению белых следов на коже или одежде.
Спиртосодержащие спреи-дезодоранты от NIVEA (например, продукция из линейки «Свежесть» от NIVEA: *Fresh Pure*, *Fresh Natural*, *Fresh Flower* и *Fresh Comfort*) встряхивать не обязательно.
7. МОЖЕТ ЛИ ИСПОЛЬЗОВАНИЕ ДЕЗОДОРАНТА ПРИВЕСТИ К ПОЯВЛЕНИЮ ЖЕЛТЫХ ПЯТЕН НА ТКАНЯХ?
Желтые пятна появляются вследствие комплексного взаимодействии липидов кожи, кожного сала, моющего средства и антиперспирантного активного вещества. Опыт показывает, что в этом участвуют несколько факторов, а именно: частота применения, используемое количество дезодоранта, частота смены одежды, интенсивность стирки, индивидуальный состав пота, содержание минералов или следовых элементов в водопроводной воде и состав самой ткани. Чтобы на ткани не оставалось желтых следов от дезодоранта, средство должно полностью высохнуть на вашей коже до того, как вы наденете одежду.
Однако следует отметить, что желтые пятна могут также появляться при отсутствии каких-либо антиперспирантных ингредиентов, подобно тому как появляются желтые пятна на белом воротнике, когда липиды кожи вместе с содержащимися в воздухе частицами грязи приводят к образованию стойких пятен, которые уже не так легко удалить. В некоторых случаях появление пятен обусловлено вымыванием фабричных красителей.
Если вы хотите снизить риск появления на одежде желтых пятен, возможно, вас заинтересует продукция из линии «Невидимая защита для черного и белого» от NIVEA.
8. КАК УДАЛИТЬ ЖЕЛТЫЕ ПЯТНА?
Существующие желтые пятна на одежде невозможно удалить или сделать менее заметными путем частых/ повторных стирок; иногда в результате стирки пятна становятся еще более стойкими.
Если на вашей одежде появились пятна, прополощите ее в холодной воде, а потом выстирайте с моющим средством. Во многих случаях нам успешно удавалось удалить пятна путем замачивания одежды в 5%-м растворе лимонной кислоты примерно на 24 часа. Очень важно: Прополощите одежду в чистой воде, а затем выстирайте в стиральной машине в нормальном режиме при 30°C с применением жидкого моющего средства. Тем не менее трудно гарантировать, что данная процедура будет успешной для всех типов пятен и тканей. Будьте осторожны в отношении деликатных и цветных тканей, а также одежды с перламутровыми пуговицами, так как они могут повредиться под действием кислотного раствора. Прежде чем использовать продукт, пожалуйста, протестируйте его на незаметном участке.
Внимание: Имейте в виду, что лимонная кислота представляет определенную опасность при контакте с кожей (раздражитель, сенсибилизатор), при попадании в глаза (раздражитель), при глотании и вдыхании (раздражитель). Ее попадание на кожу может вызывать воспаления и волдыри. Степень повреждения тканей зависит от длительности контакта. По этой причине мы настоятельно рекомендуем при работе с лимонной кислотой использовать защитные перчатки и не вдыхать пыль лимонной кислоты.
9. МОЖЕТ ЛИ ИСПОЛЬЗОВАНИЕ ДЕЗОДОРАНТА ПРИВЕСТИ К ПОЯВЛЕНИЮ БЕЛЫХ СЛЕДОВ НА ТКАНЯХ?
Некоторые дезодоранты, а точнее – антиперспиранты, которые содержат соли алюминия, например, хлоргидрат алюминия (ACH), при определенных условиях и неправильном использовании могут оставлять на одежде белые следы. Перед использованием спреи-антиперспиранты (например, *Nivea Deodorant Dry*) необходимо хорошо встряхнуть, чтобы порошок хлоргидрата алюминия равномерно распределился в баллончике и, соответственно, на коже. Чтобы избежать появления белых следов на одежде, все антиперспирантные средства должны полностью впитаться или высохнуть на коже, прежде чем вы оденетесь. Обычно белые остатки на одежде легко удаляются щеткой. Если вы хотите снизить риск появления на одежде белых пятен, возможно, вас заинтересует продукция из линии «Невидимая защита для черного и белого» от NIVEA.
10. ДЕЙСТВИТЕЛЬНО ЛИ КУПЛЕННЫЙ МНОЮ ПРОДУКТ НЕ СОДЕРЖИТ СПИРТА?
С точки зрения химии, термин «спирт» относится к широкому кругу соединений. Их объединяет то, что в их молекуле содержится определенная группа атомов. Однако на непрофессиональном уровне «спиртом» называют содержащийся в алкогольных напитках этанол (химическое название – этиловый спирт). Если на упаковке указано, что данный продукт «бесспиртовый», это значит, что в нем не содержится этанол, то есть «спирт» или «спирт, денат.», хотя само слово «спирт» может встречаться в наименовании вещества по МНКИ (например, стеариловый спирт).
11. ЧЕРЕЗ КАКОЕ ВРЕМЯ ПОСЛЕ БРИТЬЯ МОЖНО ПОЛЬЗОВАТЬСЯ АНТИПЕРСПИРАНТОМ С СОДЕРЖАНИЕМ АЛЮМИНИЯ?
Во время бритья удаляется небольшая часть наружного слоя кожи, но это не значит, что при этом обязательно повреждаются кожа и кожные барьеры. Тем не менее небольшие повреждения все же могут происходить. В таком случае воздержитесь от использования дезодорантов с содержанием алюминия до тех пор, пока раздражение или повреждение на коже не пройдет полностью. Антиперспирант не следует использовать даже в том случае, если кожа в области подмышек раздражена или повреждена по какой-либо другой причине.
12. МОЖЕТ ЛИ ИСПОЛЬЗОВАНИЕ ДЕЗОДОРАНТА ПРИВЕСТИ К ПОЯВЛЕНИЮ ЦВЕТНЫХ СЛЕДОВ НА ТКАНЯХ (НАПРИМЕР, ЗЕЛЕНЫХ, КОРИЧНЕВЫХ, КРАСНЫХ, СИНИХ)?
Появление на тканях цветных или желтых пятен происходит аналогичным образом. Конкретный цвет пятен может зависеть от следовых металлов, содержащихся в водопроводной воде (например, меди, марганца, железа). В некоторых случаях цветные отпечатки также могут возникать в результате воздействия флуоресцентных отбеливателей (оптических отбеливателей).
Кроме того, цветные пятна могут появиться на светлой одежде, если вы наденете поверх или под нее какое-то цветное изделие и оно полиняет. Такое часто происходит, если окрашенный материал не обладает потоотталкивающими свойствами.
Удаление потемнения серебра
Серебро темнеет на воздухе и образуют черный налет сульфида серебра, который имеет формулу Ag2S. Серебро тускнеет после реакции с сероводородом (h3S) химическое уравнение которой выглядит следующим образом:
2 Ag(т) + H2S(г) → Ag2S(т) + H2(г)
Есть предположение, что, на сегодняшний день, потускнения серебра происходит быстрее из-за возросшего количества сероводорода который выделяется в атмосферу при сгорании ископаемого топлива и тому подобное. Сульфид серебра который и дает потускнение может быть довольно легко удален с помощью полиролей, содержащих абразивные вещества, чтобы стереть с серебра его сульфид, но недостатком этого процесса является то что удаляется и небольшое количеств серебра. Однако, химия предоставляет метод, который обходит эту проблему.
Как удалить потемнения серебра
В этом простом методе используется алюминиевая фольга, кипяток, питьевая сода (натрия гидрокарбонат) и поваренная соль (натрия хлорид). В миску с фольгой, добавить чайную ложку соды и немного соли, затем просто добавьте кипяток. Потускневшую серебряную вещь помещают в воду, убедившись, что нет контакта между ней и алюминиевой фольгой. Потемнения серебра тускнеют и быстро исчезают.
Химия реакции при удалении потемнения серебра
Алюминий имеет более сильное сродство к сере, чем серебро, поэтому в этой реакции алюминий просто вытесняет серебро из его сульфидного соединения, высвобождая чистое металлическое серебро и образуя сульфидное соединение алюминия:
3 Ag2S(т) + 2 Al(т) → 6 Ag(т) + Al2S3(т)
Реакция сама по себе является собственно электрохимической реакцией – по сути, крошечный электрический ток протекает между серебряной вещью и алюминиевой фольгой когда они находятся в контакте, и количество серебра в сульфиде серебра снижается (прирост электронов) в виде металлического серебра, а алюминий окисляется (теряет электроны) замещая Аl3+ на ионы:
3 Ag+ + 3 e– → 3 Ag
Al → Al3+ + 3e
Объединив эти две половины уравнений получаем полное уравнение окислительно-восстановительной реакции:
Al + 3 Ag+ → Al3+ + 3 Ag
Необходимость соды и соли при удалении потемнения серебра
Это реакция замечательная, но не объясняет необходимость соды или соли во время реакции, а ведь оба вещества являются важными компонентами в этой реакции. Натрия бикарбонат необходим, чтобы удалить тонкий слой гидроксида алюминия, который образуется на алюминиевой фольге; без этого, реакция будет не в состоянии начать образование ионов алюминия, и как таковая не начнется. Реакция между содой и алюминивой фольгой также производит водород, который не играет никакой роли в удалении потускнения серебра и просто улетучивается в виде газа. Соль, между тем, выступает в качестве “солевого моста” – это помогает в передаче электронов по мере протекания реакции, предотвращая дисбаланс и позволяет окислительно-восстановительной реакции продолжаться до конца.
Можно также заметить слабый запах яиц при проведении этой процедуры – это связано с дальнейшей реакции, которая может возникнуть. Сульфид алюминия дальше вступает в реакцию с водой следующим образом:
Al2S3(s) + 6 H2O(l) → 2 Al(OH)3(aq) + 3 H2S(g)
Сероводород, Н2S – тот же газ, что образуется при гниении яиц – отсюда и узнаваемый неприятный запах.
Статья написана по материалам сайта Compound Interest.
(PDF) Лимонная кислота в качестве ингибитора коррозии алюминиевых сплавов в водных щелочных средах
Результаты
На рис. 1 показаны анодные поляризационные кривые для AA1050 с различной концентрацией лимонной кислоты
. Порог концентрации ингибитора, необходимый для эффективного формирования пассивного состояния
, составляет ~ 20 мМ, сдвигая Ecorr на +1 В. Тем не менее, пассивное состояние
нестабильно выше +1 В по сравнению с Ag | Ag2O. 200 мМ обеспечивает пассивную стабильность состояния
в диапазоне глубокой поляризации.Эффективность и стабильность ингибитора
пассивного слоя зависит от легирующих компонентов, т.е. лимонная кислота менее
эффективна на алюминиевом сплаве, содержащем богатые магнием интерметаллические фазы (AA5754) при анодной поляризации
(рис. 2).
Эффективность ингибитора (Eff) может быть рассчитана по скорости коррозии (CR), где
CR0 — скорость коррозии незащищенного металла.
Алюминий потенциально может быть использован в качестве анодного материала в аккумуляторах и топливе
элементов, вырабатывающих энергию для электрических и гибридных транспортных средств [2], работающих
при поляризации до +16 В [3]. применение
ограничено из-за его интенсивной коррозии в щелочных средах.Динамическая
спектроскопия электрохимического импеданса (DEIS) позволяет в режиме реального времени контролировать
нестационарных процессов, предлагая понимание механизма коррозии и кинетики
.
На рис. 3a, b представлены 3D-спектры DEIS в зависимости от поляризационного потенциала для AA1050 с
и без 200 мМ лимонной кислоты. В отсутствие ингибитора можно увидеть отрицательную петлю
[4], характерную для адсорбционных форм Al +, Al3 + и
OH- [5]. Добавление ингибитора ограничивает спектры единственной постоянной времени.
Сопротивление переносу заряда (RCT) увеличивается с увеличением анодной поляризации
, что означает увеличение коррозионной стойкости (рис. 4).
Кроме того, эффективность ингибитора, рассчитанная на основе RCT, составляет ~ 95%.
СЭМ-изображения (рис. 3c, d) показывают влияние лимонной кислоты на рельеф поверхности
, практически устраняя тонкий слой адсорбированных продуктов коррозии
, что подтверждается результатами импеданса.
Лимонная кислота в качестве ингибитора коррозии алюминиевых сплавов
в водно-щелочных средах
Джоанна Высоцка, Стефан Краковяк, Яцек Рил, Казимеж Даровицкий
Кафедра электрохимии, коррозии и материаловедения,
Химический факультет Гданьского технологического университета
Narutowicza 11/12, 80-233 Gdansk, POLAND
Introduction
Основным ограничением использования алюминия в щелочной среде является его ускоренная коррозия.Лимонная кислота — один из самых эффективных ингибиторов коррозии
алюминия в щелочных средах. Кроме того, он совершенно нетоксичен и может быть получен из
природных возобновляемых источников. В результате химической реакции между лимонной кислотой и ионами Al3 + образуется тетраэдрическое комплексное соединение
. Хелатный комплекс термодинамически стабилен, а ограниченный катион металла гораздо менее реакционноспособен, чем свободный катион Al3 + [1].
Ссылки
[1] B.Мюллер, Коррос. Sci., 46 (2004) 159-167.
[2] X. Zhang, S.H. Ян, Х. Никл, J. Power Sources, 128 (2004) 331-342.
[3] К. Накахара, Дж. Ирияма, С. Иваса, М. Сугура, М. Сато, Э.Дж. Cairns, J. Power Sources, 163 (2007) 1100-
1113.
[4] J. Wysocka, S. Krakowiak, J. Ryl, K. Darowicki, J. Electroanal. Chem., DOI: 10.1016 / j.jelechem.2016.08.028
[5] K.C. Эмрегул, А.А. Аксот, Коррос. Наук, 42 (2000) 2051-2067.
Выводы
Лимонная кислота является анодным ингибитором алюминия в щелочном растворе.При pH = 11
эффективный порог
, необходимый для формирования пассивного слоя, составляет 20 мМ. Эффективность ингибитора
на 99,9% выше концентрации 20 мМ. Добавление лимонной кислоты
улучшает коррозионную стойкость даже при очень высоких анодных потенциалах.
Лимонная кислота может быть получена путем ферментации отходов, например,
мелассы, отрубей, цитрусовых, и, таким образом, ее использование экономически оправдано. Рис.4: Мгновенное значение сопротивления переноса заряда
RCT
, полученное из измерения DEIS
с R (C (R (CR)) в отсутствие ингибитора
и R (CR) с добавлением
200 мМ лимонная кислота.
Рис. 1: Кривые циклической поляризации
для AA1050 в карбонатном буфере
при pH = 11
с различным добавлением лимонной кислоты
. Скорость сканирования 1 мВ / с.
Рис. 2: Кривые циклической поляризации
для AA1050 и
AA5754 в карбонатном буфере
при pH = 11 (20 мМ лимонная кислота
). Скорость сканирования 1 мВ / с.
Рис. 3: a, b) 3D-спектры DEIS в зависимости от поляризационного потенциала в карбонатном буфере при
pH = 11 и с добавлением 200 мМ лимонной кислоты соответственно.
Скорость сканирования 2 мВ / с. Пакет DEIS из 21 синусоиды в диапазоне от 11,5 кГц до 7 Гц;
c, d) СЭМ-микрофотографии топографии поверхности после эксперимента DEIS.
Увеличение x500.
a) b)
c) d)
0
0
* 100 (%) CRCRCR
Eff
Лимонная кислота и алюминиевые отливки
Образование, Алоха и большинство
весело вы можете получить в отделке
№1 в мире по отделочным материалам с 1989 года
Вход в систему не требуется: звоните прямо сейчас
тема 41251
2006 г.
Я читал предыдущие сообщения о методе использования лимонной кислоты для удаления ржавчины с металлических деталей.
Я попробовал, и он отлично сработал.
Как будет работать очистка алюминиевых деталей? Безопасно ли окунать литые алюминиевые детали в раствор лимонной кислоты?
Какая тёмно-серая пленка осталась на металлических частях? Стоит ли снимать это перед покраской?
Альваро Симан
Реставрация — Майами, Флорида
2006
Hi Alvaro,
Я использую белый дистиллированный уксус и винный камень в небольшом количестве воды, чтобы очистить Al. Попробуйте 1 чайную ложку уксуса, 1/4 чайной ложки винного камня и 1/2 пинты воды для очистки.Лимонная кислота может подойти, но это будет зависеть от концентрации лимонной кислоты, которую вы используете для окунания, слишком сильная, и у вас могут возникнуть проблемы. Серая пленка на Al — это пленка естественного оксида, которая образуется при реакции с воздухом. Пленка действительно защищает металл. Я бы сказал, что нужно красить сразу после очистки оксидной пленки, чтобы обеспечить хорошую адгезию. Удачи!
Марк Бейкер,
, инженер-технолог — Мэлоун, Нью-Йорк,
, 2006 г.
Да, лимонная кислота подходит для обработки алюминия.
Рэй Кремер
Stellar Solutions, Inc.
МакГенри, Иллинойс
2006
Раствор — 50 г на 1 л воды. Я измерил pH, и он составляет от 2 до 2,5.
Лимонная кислота разбавляется горячей водой.
Альваро Э. Симан
Реставрация — Майами, Флорида
2006
Лимонная кислота может использоваться для очистки алюминия (5%) — pH необходимо довести до 7-8 (с небольшим количеством аммиака). Можно также использовать чистый раствор, но он может травить алюминий и удалять анодированные или хромированные / фосфатированные покрытия. Надеюсь, это поможет и удачи!
Горан Будия
— Загреб, Хорватия
14 декабря 2008 г.
Можно ли использовать раствор лимонной кислоты в качестве безопасного альтернативного раствора для раскисления алюминия перед его анодированием?
Гэвин Уилкинсон,
— Лидни, Великобритания,
, 15 декабря 2008 г.
Привет, Гэвин.Я никогда не слышал об этом. Слово «раскислитель» широко используется в этом контексте, но неправильно; процесс, о котором вы говорите, на самом деле устраняет коммутацию. Я не думаю, что лимонная кислота растворяет медь или кремний, а это главное, что должен делать раствор десмута. Тот факт, что я не слышал об этом, не обязательно означает, что это невозможно, но я сомневаюсь. Удачи.
С уважением,
Тед Муни, P.E.
Стремление к жизни Алоха
Finish.com — Пайн-Бич, Нью-Джерси
Первый из двух одновременных ответов — 16 декабря 2008 г.
Лимонная кислота растворяет медь, но медленнее, чем другие вещества, которые вы могли бы назвать.
Рэй Кремер
Stellar Solutions, Inc.
МакГенри, Иллинойс
Секунда из двух одновременных ответов — 16 декабря 2008 г.
1. То, что сказал Тед выше, и
2. Не допускайте попадания грязной липкой крупномолекулярной органической кислоты в поры отливки.
3. Используйте 100% азотную кислоту плюс бифторид аммония 2 # / гал.
Роберт Х. Проберт
Роберт Х. Проберт Техническая служба
Гарнер, Северная Каролина
отделка.com стало возможным благодаря …
этот текст заменяется на bannerText
Заявление об ограничении ответственности: на этих страницах невозможно полностью диагностировать проблему отделки или опасности операции. Вся представленная информация предназначена для общего ознакомления и не отражает профессионального мнения или политики работодателя автора. Интернет в основном анонимный и непроверенный; некоторые имена могут быть вымышленными, а некоторые рекомендации могут быть вредными.
Если вы ищете продукт или услугу, относящуюся к отделке металлов, пожалуйста, проверьте эти каталоги:
О нас / Контакты — Политика конфиденциальности — © 1995-2021 finish.com, Пайн-Бич, Нью-Джерси, США
Керамика — Исследования
Дэниел М. Даббс
Загрязнение алюминием почвы и грунтовых вод и возможные связи
к широкому спектру человеческих недугов привело к повышенному интересу к видообразованию
алюминия в природных водах, [1] почве, [2] и сыворотке крови. [3] В результате интерес
сосредоточен на физиологическом диапазоне pH 6-9, [4,5] и информации о растворимости
алюминия в растворах с высоким pH (pH ≥ 10), условиях сильного гидролиза, составляет
ограничивается в основном преобладающими алюминийсодержащими частицами, наблюдаемыми в
термодинамически устойчивые растворы.[6] Несмотря на очевидное отсутствие фона
информации, вид алюминия в условиях высокого pH важен для
восстановление водных растворов опасных отходов, особенно
найденные в резервуарах с радиоактивными отходами. [7]
Оксигидроксиды алюминия растворимые и нерастворимые алюминийсодержащие частицы
комплекс с лимонной кислотой в условиях высокого гидролизишидроксид-иона до
соотношение алюминия превышает 2,46 моль / моль.[8] Органическое вещество может защищать
существующие поверхности частиц от растворения или для поддержания растворимости катионов.
Мы титровали растворы хлорида алюминия NaOH (водн.), Добавляя лимонную кислоту.
кислота в количестве от нуля до немного меньшего, чем цитрат / Al = 1 моль / моль.
Механизмы комплексообразования молекул и коллоидной стабилизации. Взаимодействия
между комплексообразователем и целевым атомом чешуйки от микромасштаба (поверхностей)
к атомному.Стабильность, продолжение существования частицы или молекулы,
может быть придан термодинамически или кинетически.
Изменения размера частиц суспензии измеряли с помощью
квазиупругое рассеяние света. Растворы хлорида алюминия без лимонной кислоты
при добавлении кислоты образовывались крупные частицы, которые быстро сжимались до достаточного
гидроксид добавляли, и частицы оставались в суспензии. Большой
алюминийсодержащие поликатионы детектировали методом ЯМР раствора 27 Al под
условия сильного гидролиза, и они могли дать зародыш для частиц
формирование.
Добавление лимонной кислоты изменило динамику обоих растворов и
подвески. В растворах очень сильного гидролиза (OH / Al = 3,29) частицы не
не образуется, когда мольное / мольное отношение цитрата к алюминию равно 0,8. Под
те же условия гидролиза, но при соотношении цитрат / Al менее 0,8, частицы
образовались, но зарождение и рост были заметно замедлены. В условиях высокого
гидролиз (OH / Al = 2,46), частицы образуются в присутствии лимонной кислоты, когда
основание добавляли, но скорость образования замедлялась.Поликатионов не было
обнаружен в растворах, содержащих лимонную кислоту, что позволяет предположить, что важные семена
или строительные блоки в формировании и росте частиц были устранены
взаимодействия лимонной кислоты с алюминиевыми центрами.
При добавлении NaOH (водн.) К растворам AlCl 3 частицы
нестабильны для OH / Al менее 2,6. Частицы быстро образуются и достигают больших размеров, а затем сжимаются (или дезагрегируются).
и исчезнуть.При OH / Al выше 2,6 частицы сжимаются до стабильного размера, и полученная суспензия
остается стабильным при комнатной температуре.
Рост частиц остается быстрым, но
последующее уменьшение замедляется в присутствии лимонной кислоты в условиях сильного гидролиза.
При более высоком содержании OH / Al рост частиц можно остановить, используя достаточное количество
лимонная кислота (~ 0,8 лимонной кислоты на алюминий в молях).
Список литературы
1.ДО Н.Э. Фауст, В. Лабиоза, К. Дай, Дж. Макфолл, Б.А. Браун, А.А.
Рибейро, Д. Рихтер Геохим. Космохим. Акта 1995 59
2651-61.
2. D.L. Jones Plant and Soil 1998 205 2544; Дж. Ф. Ма,
P.R. Ryan, E. Delhaize Trends Plant Sci. 2001 6 273-8.
3. А. Лакатос, Ф. Эваникс, Г. Домби, Р. Бертани, Т. Кисс евро. J. Inorg.
Chem. 2001 12 3079-86.
4. Л.-О. hman Chem. Геол. 1998 151 4150.
5. R.B. Martin В соотв. Chem. Res. 1994 27 204-210; Л.-О.
hman, R.B. Martin Clin. Chem. 1994 40 598-601.
6. А. Лакатос, И. Бняй, П. Декок, Т. Кисс евро. J. Inorg. Chem.
2001 2 461-9.
7. Резервуары Приоритетная область , Годовой отчет 1997 (Национальный технический
Информационная служба Министерства торговли США, Спрингфилд, Вирджиния, 1998 г.).
8. Д.М. Даббс, У. Рамачандран, С. Лу, Дж. Лю, И.А. Аксай исследования в г.
прогресс (2004).
За дополнительной информацией обращайтесь к Дэниелу Даббсу. Увидеть
Веб-страница Лаборатории керамических материалов для получения дополнительной информации
о нашей группе и ее исследованиях.
© 2004 Принстонский университет, Лаборатория керамических материалов.Все права защищены.
Синтез и характеристика соединений цитрата алюминия и оценка их влияния на образование гидрогелей на основе полиакриламида
Чемберлен Д. (2007) Анионное опосредование разрушения бумаги, катализируемой алюминием. Polym Degrad Stabil 92: 1417–1420
CAS
Статья
Google Scholar
Xu LQ, Neoh K, Kang E (2018) Природные полифенолы как универсальные платформы для материаловедения и функционализации поверхностей.Prog Polym Sci 87: 165–196
CAS
Статья
Google Scholar
Zhu G, Cui X, Zhang Y, Chen S, Dong M, Liu H, Shao Q, Ding T, Shide W, Guo Z (2019) Поли (винилбутираль) / оксид графена / поли (метилгидросилоксан) ) нанокомпозитное покрытие для улучшенной антикоррозионной защиты алюминиевых сплавов. Полимер 172: 415–422
CAS
Статья
Google Scholar
Li F, Koopal L, Tan W (2018) Влияние цитрата на виды и уровни примесей Al в ферригидрите.Коллоидный прибой A 539: 140–147
CAS
Статья
Google Scholar
Rajalakshmi K, Siknam Y, Selvaraj M, Lee Y, Lee K (2018) Безметалловый реагент для биовизуализации внутриклеточного цитрата в клетках рака простаты с использованием производного арилбороната. Приводы Sens B Chem 259: 90–96
CAS
Статья
Google Scholar
Ранджбар М., Салавати-Ниасари М., Хоссейнпур-Машкани С.М. (2012) Микроволновый синтез и характеристика наночастиц алюмината цинка шпинельного типа.J Inorg Organomet Polym Mater 22: 1093–1100
CAS
Статья
Google Scholar
Song P, Chen G, Wel Z, Chang Y, Zhang W, Liang J (2012) Быстрая кристаллизация поли (l-молочной кислоты), вызванная наноразмерным комплексом цитрата цинка в качестве зародышеобразователя. Полимер 53: 4300–4309
CAS
Статья
Google Scholar
Мирзаджани Ф., Рафати Х., Атяби Ф. (2010) Изготовление биоразлагаемых наночастиц поли (d, l-лактид-гликолид), содержащих цитрат тамоксифена.Iran Polym J 19: 437–446
CAS
Google Scholar
Amir M, Baykal A, Güner S, Sertkol M, Sözeri H, Toprak M (2012) Синтез и характеристика Co x Zn 1 − x AlFeO 4 Наночастицы. J Inorg Organomet Polm Mater 25: 747–754
Статья
Google Scholar
Фен Л, Биан Х, Ли Г, Чен З, Цуй У, Чен Х (2013) Определение сверхнизкой температуры стеклования с помощью дифференциальной сканирующей калориметрии.Polym Test 32: 1368–1372
CAS
Статья
Google Scholar
Фенг И.Л., Гуриан П.Л., Хили, М.Д., Баррон А.Р. (1990) Цитрат алюминия: выделение и структурная характеристика стабильного трехъядерного комплекса. Inorg Chem 29: 408–411
CAS
Статья
Google Scholar
Wang J, Liu S, Mu Y, Yang L, Yang J, Feng S, Shi M, Yang W, Fu W, Yang H (2018) Рост n- и p, зависящий от комплексообразующего агента цитрата натрия. тонкие пленки CdTe для применения в фотоэлектрических устройствах на основе CdTe / CdS.J Alloy Compd 748: 515–521
CAS
Статья
Google Scholar
Раджу У., Варкар С.Г., Кума А. (2017) Зеленый синтез мультиметалл-цитратных комплексов и их характеристика. J Mol Struct 1133: 90–94
CAS
Статья
Google Scholar
Staal PW (1984) Способ приготовления жидкого цитрата алюминия US4447364
Ставланда А., Карлсен Х. (1996) Новое понимание гелей цитрата алюминия / полиакриламида для контроля жидкости. SPE. https://doi.org/10.2118/35381-MS
Артикул
Google Scholar
Мацапетакис М., Раптопулу С.П., Терзис А., Лакатос А., Кисс Т., Салифоглу А. (1999) Синтез, pH-зависимая структурная характеристика и поведение раствора водных комплексов цитрата алюминия и галлия. Inorg Chem 38: 618–619
CAS
Статья
Google Scholar
Silva AF, Aguiar MSS, Carvalho OS, Santana LNS, Leal WG (2013) Потеря нейронов в гиппокампе, снижение иммунореактивности GFAP и когнитивные нарушения после экспериментальной интоксикации крыс цитратом алюминия. Brain Res J 1491: 23–33
CAS
Статья
Google Scholar
Ren X, Hu X, Xue D, Li Y, Shao Z, Dong H, Cheng W, Zhao Y, Xin L, Lu W (2019) Новые композитные гели силиката натрия / полимера для предотвращения самопроизвольных сжигание угля.J Hazar Mater 371: 643–654
CAS
Статья
Google Scholar
Карими С., Каземи С., Каземи Н. (2016) Измерение синерезиса гелевого полимера HPAM-Cr (III) в различных условиях: экспериментальное исследование. J Nat Gas Sci Eng 34: 1027–1033
CAS
Статья
Google Scholar
Bai Y, Xiong C, Wei F, Li J, Shu Y, Liu D (2015) Исследование гелеобразования гидрофобно связывающей гелевой системы полимер / полиэтиленимин для водоотталкивающей обработки.Energy Fuel 29: 447–458
CAS
Статья
Google Scholar
Qiu L, Shen Y, Wang C, Yang X (2018) Анализ гуаровой камеди с помощью сканирующей электронной микроскопии в процессах растворения, гелеобразования и разрушения геля. Polym Test 68: 95–99
CAS
Статья
Google Scholar
Ren X, Hu X, Cheng W, Bian S, Zhao Y, Wu M, Xue D, Li Y, Lu W, Wang P (2020) Исследование использования ресурсов и противопожарных характеристик нового геля. изготовлен из шлама угольных шахт (MS).Топливо 267: 117261. https://doi.org/10.1016/j.fuel.2020.117261
CAS
Статья
Google Scholar
Smith JE (1997) Состав для изменения проницаемости для использования при добыче нефти. US 5654261 A
Moradi-Araghi A (2000) Обзор термостойких гелей для отвода жидкости при добыче нефти. J Petrol Sci Eng 26: 1–10
CAS
Статья
Google Scholar
Smith JE, Liu H, Guo ZD (2000) Лабораторные исследования технологии глубокого коллоидного дисперсионного геля для нефтяного месторождения Дацин. SPE. https://doi.org/10.2118/62610-MS
Артикул
Google Scholar
Аксой Г., Гомаа А.М., Наср-Эль-Дин Х.А., Ван Х, Болес Дж.Л., Кавизель К.Е. (2011) Оценка нового жидкого разжижителя для загущенных in situ кислот на полимерной основе. SPE. https://doi.org/10.2118/143447-MS
Артикул
Google Scholar
Jia H, Chen H (2018) Использование метода DSC для исследования кинетики неизотермического гелеобразования мультисшитого гелевого герметика из ацетата хрома (Cr 3+ ) -полиэтиленимин (PEI) -полимер. J Petrol Sci Eng 165: 105–113
CAS
Статья
Google Scholar
Bjϕrsvik M, Høiland H, Skauge A (2008) Образование коллоидных дисперсионных гелей из водных растворов полиакриламида. Colloid Surf A 317: 504–511
Артикул
Google Scholar
Bodor A, Bányai L, Zélánk L, Tóth I (2002) Медленная динамика алюминиево-цитратных комплексов изучена с помощью спектроскопии 1 H и 1 3 C-ЯМР. Coord Chem Rev 28: 163–173
Статья
Google Scholar
Hacht B (2008) Изучение видообразования комплексов алюминий (III) –ацетат в физиологических условиях. Chem Spec Bioavailab 20: 2047–6523
Статья
Google Scholar
Groen H, Ronerts KJ (2001) Зарождение, рост и псевдополиморфное поведение лимонной кислоты, наблюдаемое in situ с помощью инфракрасной спектроскопии с преобразованием Фурье с ослабленным полным отражением. J Phys Chem B 105: 10723–10730
CAS
Статья
Google Scholar
Clausen M, Ohman L, Persson P (2005) Спектроскопические исследования водных цитратных комплексов галлия (III) и алюминия (III). J Inorg Biochem 99: 716–726
CAS
Статья
Google Scholar
Peukert A, Seubert A (2009) Характеристика разновидностей цитрата алюминия (III) с помощью ионной хроматографии с детектированием атомно-эмиссионной спектрометрии с индуктивно связанной плазмой. J Chromatogr A 45: 1216
Google Scholar
Росс-Марфи С.Б. (1994) Реологические характеристики полимерных гелей и сеток. Polym Gels Netw 2: 229–237
Статья
Google Scholar
Wang S, Tang H, Guo J, Wang K (2016) Влияние pH на реологические свойства сшитого боратом гидрогеля гидроксипропилгуаровой камеди и гидроксипропилгуаровой камеди. Carbohyd Polym 147: 455–463
CAS
Статья
Google Scholar
Tessarolli FGC, Queirós YGC, Mansur CRE (2014) Оценка pH-чувствительных гидрогелей для контроля анизотропии проницаемости нефтяных пластов. J Appl Polym Sci. https://doi.org/10.1002/app.40665
Артикул
Google Scholar
Oliveira PF, Costa JÁ, Oliveira LFS, Mota LS, Oliveira LA, Mansur CRE (2019) Гидролиз и термическая стабильность частично гидролизованного полиакриламида в средах с высокой соленостью. J Appl Polym. https://doi.org/10.1002/app.47793
Артикул
Google Scholar
Цитрат алюминия | Косметика Информация
Что это?
Лимонная кислота — слабая кислота, которая широко встречается как в растениях, так и в животных.Это натуральный ингредиент, который часто встречается в цитрусовых, например, лимонный сок, который содержит около 5-8 процентов лимонной кислоты. Лимонная кислота используется в основном в качестве натурального ароматизатора и консерванта в продуктах питания и напитках, особенно в безалкогольных напитках. Лимонная кислота также является центральным соединением в круговороте лимонной кислоты. Цикл лимонной кислоты — это путь во многих организмах, включая человека, который производит почти две трети всей энергии, используемой клетками.
Почему его используют в косметике и средствах личной гигиены?
Продукты, содержащие лимонную кислоту и некоторые ее соли и сложные эфиры, могут быть безопасно составлены для специального применения на детской коже или использования в области глаз или на слизистых оболочках.Кроме того, они могут использоваться в косметических спреях, включая спреи для волос, дезодоранты, средства для ухода за телом и другие пропелленты и спреи для помпы. Лимонная кислота также входит в группу ингредиентов, известных как альфа-гидроксикислоты, которые используются в качестве активных ингредиентов в химических пилингах кожи. Цитрат натрия можно использовать во всех типах косметических продуктов, включая детские товары, макияж, губную помаду, средства для ванн, мыло и моющие средства, краски и краски для волос, а также средства по уходу за волосами и кожей. Трибутилцитрат и триэтилцитрат можно использовать в средствах для ванн, других очищающих продуктах, а также в кремах и лосьонах.
Лимонная кислота и ее соли диаммония, калия и натрия используются для сохранения косметики и средств личной гигиены за счет хелатирования (комплексообразования) металлов. Лимонная кислота и ее соли также добавляются в косметические средства, чтобы помочь отрегулировать кислотно-щелочной баланс. Другие функции цитратных ингредиентов включают: буферный агент, косметическое вяжущее средство, косметический биоцид, фиксатор для волос, средство для ухода за полостью рта, пластификатор, средство для ухода за кожей — смягчающее, средство для ухода за кожей — разное, средство для ухода за кожей — окклюзионное и растворитель.
Ингредиенты лимонной кислоты, наиболее часто используемые в косметике, — это лимонная кислота, цитрат натрия, трибутилцитрат и триэтилцитрат. Согласно Программе добровольной регистрации косметических средств (VCRP) Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) 2016 года, лимонная кислота использовалась почти во всех категориях косметических продуктов, о которых сообщалось более 10 000 случаев использования. Следующими наиболее часто используемыми ингредиентами на основе лимонной кислоты были натрий, трибутил и триэтилцитрат.
Ингибирование осаждения оксигидроксида алюминия лимонной кислотой (Журнальная статья)
Даббс, Даниэль М., Рамачандран, Уша, Лу, Санг, Лю, Цзюнь, Ван, Ли Кью и Аксай, Ильхан А. Ингибирование осаждения оксигидроксида алюминия лимонной кислотой . США: Н. П., 2005.
Интернет. DOI: 10.1021 / la050822f.
Даббс, Даниэль М., Рамачандран, Уша, Лу, Санг, Лю, Цзюнь, Ван, Ли К. и Аксай, Ильхан А. Ингибирование осаждения оксигидроксида алюминия лимонной кислотой . Соединенные Штаты. https://doi.org/10.1021/la050822f
Даббс, Даниэль М., Рамачандран, Уша, Лу, Санг, Лю, Цзюнь, Ван, Ли Кью и Аксай, Ильхан А.Вт.
«Ингибирование осаждения оксигидроксида алюминия лимонной кислотой». Соединенные Штаты. https://doi.org/10.1021/la050822f.
@article {osti_876999,
title = {Ингибирование осаждения оксигидроксида алюминия лимонной кислотой},
author = {Даббс, Даниэль М. и Рамачандран, Уша и Лу, Санг и Лю, Цзюнь и Ван, Ли К. и Аксай, Ильхан А},
abstractNote = {Было показано, что лимонная кислота действует как агент, повышающий растворимость оксигидроксидов алюминия в водных растворах с высоким (> 2.47 моль / моль) отношения гидроксида к алюминию. Напротив, лимонная кислота также коллоидно стабилизирует частицы в водных суспензиях алюминийсодержащих частиц. Растворы хлорида алюминия с добавлением лимонной кислоты и без нее титровали NaO (водн.). Наличие и размер частиц определяли с помощью квазиупругого рассеяния света. В растворах, которые не содержали лимонной кислоты, частицы образовывались мгновенно при добавлении NaOH (водн.), Но наблюдалось их быстрое уменьшение в размере, исчезновение при соотношении OH / Al ниже 2.5 моль / моль. Когда отношение OH / Al было увеличено до более 2,5 за счет добавления большего количества NaOH (водн.), Образовывались суспензии коллоидно стабильных частиц. Крупные поликатионы, содержащие 13 атомов алюминия, были обнаружены методом ЯМР в растворе 27Al в растворах без лимонной кислоты с отношениями OH / Al несколько ниже 2,5. Для сравнения, добавление лимонной кислоты к растворам хлорида алюминия ингибировало образование больших алюминийсодержащих поликатионов. Отсутствие поликатионов предотвращает или замедляет последующее образование частиц, указывая на то, что поликатионы, когда они присутствуют, действуют как затравки для образования новых частиц.Частицы не образовывались в растворах с соотношением лимонная кислота / алюминий 0,8 до тех пор, пока не было добавлено достаточное количество NaOH (водн.), Чтобы поднять отношение OH / Al до 3,29. Для сравнения, более низкие количества лимонной кислоты не препятствовали образованию частиц, но замедляли скорость роста.},
doi = {10.1021 / la050822f},
url = {https://www.osti.gov/biblio/876999},
journal = {Langmuir, 21 (25): 11690-11695},
issn = {0743-7463},
число = 25,
объем = 21,
place = {United States},
год = {2005},
месяц = {12}
}
ЦИТРАТ АЛЮМИНИЯ | 31142-56-0
|
ЦИТРАТ АЛЮМИНИЯ Свойства
- Растворимость в воде
- медленно растворяется в холодной h3O, растворим в горячей h3O, аммиаке [MER06]
- Оценки продуктов питания EWG
- 1
- FDA UNII
- IJ623779BA
БЕЗОПАСНОСТЬ
- Заявление о рисках и безопасности
ЦИТРАТ АЛЮМИНИЯ Химические свойства, применение, производство
Описание
Цитрат алюминия — это химическое соединение, образующееся в результате реакции между солью алюминия и лимонной кислотой.
Синтез
Цитрат алюминия можно производить с использованием хлорида алюминия и лимонной кислоты в качестве исходных материалов. PH смеси можно регулировать гидроксидом аммония или гидроксидом натрия с получением цитрата алюминия ,1,2
Приложение
Растворы цитрата алюминия можно использовать для сшивания полимеров, таких как карбоксиметилцеллюлоза (КМЦ) или частично гидролизованный полиакриламид. Это сшивание цитратом алюминия применяется в процессах увеличения нефтеотдачи.Гелеобразование полимеров in situ приводит к блокированию высокопроницаемых зон, что дает возможность извлекать масла, которые в противном случае не могли бы быть извлечены обычными методами. 3 Сшитые цитратом алюминия полимерные материалы используются в подземных пластах для снижения проницаемости пластов для воды.1 Цитрат алюминия использовался в качестве прекурсора для синтеза нитрида алюминия. 4 Цитрат алюминия используется в косметических продуктах с эффектом против пота. 5
Токсикологические исследования
Алюминий признан нейротоксичным. Поглощение алюминия в форме цитрата алюминия в 50 раз больше, чем в форме гидроксида алюминия. 6
Номер ссылки
- Джули Е. Смит, Получение цитрата алюминия и методы, Патент US5559263A
- Филип В. Стаал, Способ получения жидкого цитрата алюминия, Патент US 4447364A
- Лоуренс М.Фодор, Р. Линн Кобб, Раствор цитрата алюминия, Патент US4601340A
- Л. Венг, Д. Хуанг, X. Цзян, Синтез нитрида алюминия из предшественника цитрата алюминия, Материалы Letters, 1993, т. 18, стр. 159–162
- www.bfr.bund.de
- https://de.wikipedia.org/wiki/Aluminiumcitrat#cite_note-DOI10.1007/BF00817919-10
Химические свойства
белый порошок (а) или чешуйки; изучение комплексообразования в [LOP84] [MER06]
Продукты и сырье для получения цитрата алюминия
Сырье
Продукты для приготовления
Глобальные (36) Поставщики
КИТАЙ 27 Германия 2 Великобритания 1 США 6 В мире 36
Посмотреть последнюю цену от производителей ЦИТРАТА АЛЮМИНИЯ
31142-56-0 (ЦИТРАТ АЛЮМИНИЯ) Поиск по теме:
- 2-гидрокси-1,2,3-пропантрикарбоксилат алюминия
- Лимонная кислота, алюминиевая соль
- ЦИТРАТ АЛЮМИНИЯ
- Цитрат алюминия
- Einecs 250-484-4
- Цитрат алюминия, 96%
- 1,2,3-пропантрикарбоновая кислота, 2-гидрокси- алюминиевая соль (1 🙂
- 1,2,3-Пропантрикарбоновая кислота, 2-гидрокси-, алюминиевая соль
- 2,3-пропантрикарбоновая кислота, 2-гидроксиалюминоземная соль
- Цитрат алюминия
- цитрат алюминия
- алюминий, 2-гидроксипропан-1,2,3-трикарбоксилат
- 31142-56-0
- C6H8O7xAl
- C6H5AlO7
- Металлоорганическая соль
.