Удельная теплота плавления
Для того, чтобы расплавить какое-либо вещество в твердом состоянии, необходимо его нагреть. И при нагревании любого тела отмечается одна любопытная особенность
Особенность такая: температура тела растет вплоть до температуры плавления, а потом останавливается до того момента, пока все тело целиком не перейдет в жидкое состояние. После расплавления температура вновь начинает расти, если, конечно, продолжать нагревание. То есть, существует промежуток времени, во время которого мы нагреваем тело, а оно не нагревается. Куда же девается энергия тепла, которую мы расходуем? Чтобы ответить на этот вопрос, надо заглянуть внутрь тела.
В твердом теле молекулы расположены в определенном порядке в виде кристаллов. Они практически не двигаются, лишь слегка колеблясь на месте. Для того, чтобы вещество перешло в жидкое состояние, молекулам необходимо придать дополнительную энергию, чтобы они смогли вырваться от притяжения соседних молекул в кристалликах. Нагревая тело, мы придаем молекулам эту необходимую энергию. И вот пока все молекулы не получат достаточно энергии и не разрушатся все кристаллики, температура тела не повышается. Опыты показывают, что для разных веществ одной массы требуется разное количество теплоты для полного его расплавления.
Нагревая тело, мы придаем молекулам эту необходимую энергию. И вот пока все молекулы не получат достаточно энергии и не разрушатся все кристаллики, температура тела не повышается. Опыты показывают, что для разных веществ одной массы требуется разное количество теплоты для полного его расплавления.
То есть существует определенная величина, от которой зависит, сколько тепла необходимо поглотить веществу для расплавления. И величина эта различна для разных веществ. Эта величина в физике называется удельная теплота плавления вещества. Опять же, вследствие опытов установлены значения удельной теплота плавления для различных веществ и собраны в специальные таблицы, из которых можно почерпнуть эти сведения. Обозначают удельную теплоту плавления греческой буквой λ (лямбда), а единицей измерения является 1 Дж/кг.
Формула удельной теплоты плавления
Удельная теплота плавления находится по формуле:
λ=Q/m,
где Q – это количество теплоты, необходимое для того, чтобы расплавить тело массой m.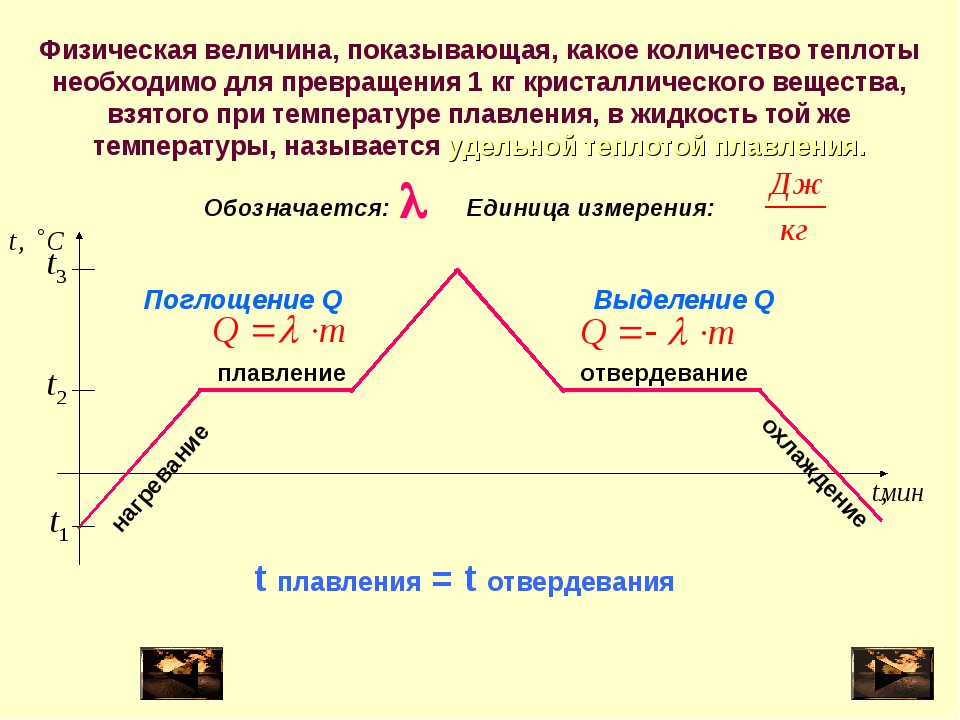
Опять-таки из опытов известно, что при отвердевании вещества выделяют такое же количество тепла, которое требовалось затратить на их расплавление. Молекулы, теряя энергию, образуют кристаллы, будучи не в силах сопротивляться притяжению других молекул. И опять-таки, температура тела не будет понижаться вплоть до того момента, пока не отвердеет все тело, и пока не выделится вся энергия, которая была затрачена на его плавление. То есть удельная теплота плавления показывает, как сколько надо затратить энергии, чтобы расплавить тело массой m, так и сколько энергии выделится при отвердевании данного тела.
Для примера, удельная теплота плавления воды в твердом состоянии, то есть, удельная теплота плавления льда равна 3,4*105 Дж/кг. Эти данные позволяют рассчитать, сколько потребуется энергии, чтобы расплавить лед любой массы. Зная также удельную теплоемкость льда и воды, можно рассчитать, сколько точно потребуется энергии для конкретного процесса, например, расплавить лед массой 2 кг и температурой — 30˚С и довести получившуюся воду до кипения. Такие сведения для различных веществ очень нужны в промышленности для расчета реальных затрат энергии при производстве каких-либо товаров.
Такие сведения для различных веществ очень нужны в промышленности для расчета реальных затрат энергии при производстве каких-либо товаров.
Нужна помощь в учебе?
Предыдущая тема: График плавления: разбираем график на примере льда
Следующая тема:   Испарение и кипение: как происходит процесс, особенности
Богданов К.Ю. — учебник по физике для 10 класса
§ 29. КОЛИЧЕСТВО ТЕПЛОТЫ. УДЕЛЬНАЯ
ТЕПЛОЁМКОСТЬ, ТЕПЛОТА ПЛАВЛЕНИЯ И ПАРООБРАЗОВАНИЯ.
Количество теплоты – это энергия, получаемая телом,
которая приводит к росту его внутренней энергии и температуры. Наоборот, тела,
потерявшие какое-то количество теплоты, уменьшают свою внутреннюю энергию и
охлаждаются.
Внутреннюю энергию тела
можно изменить либо совершив работу над ним, либо изменив его температуру.
Процесс, при котором внутренняя энергия данного тела изменяется, но при этом
окружающие его тела не совершают над ним никакой работы, называют теплообменом
или теплопередачей. Так, теплообмен происходит между соприкасающимися
Так, теплообмен происходит между соприкасающимися
неодинаково нагретыми телами, в месте контакта которых молекулы более нагретого
тела передают часть своей кинетической энергии молекулам менее нагретого тела.
В результате теплообмена, часть внутренней энергии более нагретого тела
переходит к менее нагретому, и, в конце концов, их
температуры становятся равными.
Изменение внутренней
энергию, произошедшее при теплообмена, называют количеством
теплоты. Очевидно, что количество теплоты, Q, необходимое для изменения температуры
тела на Dt, должно быть пропорционально его
массе, m, что можно записать в виде:
Q = cmDt, (29.1)
где с – удельная
теплоёмкость вещества, из которого состоит тело. Удельная теплоёмкость
численно равна количеству теплоты, которое необходимо передать 1 кг вещества,
чтобы поднять его температуру на 1 оС. Единицей измерения
Единицей измерения
удельной теплоёмкости в СИ является Дж/(кг.град).
Удельная теплоёмкость
зависит от свойств вещества. Отметим, что удельная теплоёмкость воды, 4,2 кДж/(кг.град), гораздо выше
величин для других веществ. Так, удельная теплоёмкость воздуха – 1,0 кДж/(кг.град),
дерева – 2,5 кДж/(кг.град), железа – 0,5
кДж/(кг.град), а песка – 0,8 кДж/(кг.град).
Удельная теплоёмкость
зависит не только от типа вещества, но и от того, в каких условиях оно
находится. Например, если нагревать тело и давать ему возможность расширяться,
то часть количества теплоты, потратится на работу против сил, препятствующих
этому расширению. Поэтому удельная теплоёмкость в таких условиях будет больше,
чем в случае, когда нагрев тела не будет сопровождаться его расширением.
При плавлении,
кристаллизации, конденсации и парообразовании молекулы или атомы вещества
изменяют положение относительно друг друга, что сопровождается изменением
потенциальной энергии их взаимодействия, а значит, и внутренней энергии тела.
При этом кинетическая энергия молекул вещества остаётся постоянной, и поэтому
температура при переходе из одного агрегатного состояния в другое тоже остаётся
неизменной (см. рис.29). Таким образом, при переходе тела из одного агрегатного
состояния в другое оно либо требует определённое количество теплоты (плавление,
парообразование), либо отдаёт его в окружающую среду (при конденсации и
кристаллизации).
Количество теплоты Q, необходимое для того, чтобы
расплавить твёрдое кристаллическое тело, должно быть пропорционально массе m тела:
Q = lm , (29.2)
где l — удельная теплота плавления,
численно равная количеству теплоты, необходимому для превращения 1 кг твёрдого
кристаллического вещества при температуре плавления в жидкость той же
температуры. Отметим, что при отвердевании (кристаллизации) выделяется такое же
количество теплоты, какое поглощается при плавлении.
Количество теплоты r, необходимое
для превращения 1 кг жидкости при температуре кипения в пар той же температуры,
называют удельной теплотой парообразования. Поэтому количество теплоты Q, необходимое для испарения жидкости
массы m при температуре её кипения равно:
Q = rm
. (29.3)
При
конденсации (образовании жидкости из пара) выделяется такое же количество теплоты,
какое поглощается при парообразовании.
Удельная теплота
плавления льда, 334 кДж/кг больше, чем у многих других веществ (у свинца – 23
кДж/кг, золота – 66 кДж/кг). Удельная теплота парообразования воды 2260
кДж/кг тоже в 3-10 раз выше, чем у
других жидкостей (спирт, эфир, ртуть, керосин). Вода, обладая такими
уникальными свойствами и окружая нас со всех сторон (моря, океаны и пары в
атмосфере), стабилизирует климат на планете, сглаживая резкие изменения температуры.
Вопросы для
повторения:
·
Что такое количество теплоты, и как оно связано с процессом
теплообмена между телами?
·
Дайте определение удельной теплоёмкости, теплоте плавления и
парообразования вещества?
·
Как изменяется внутренняя энергия при плавлении,
кристаллизации, парообразовании и конденсации?
·
Какова роль воды в стабилизации температуры на Земле?
Рис. 29.
Зависимость температуры льда, а потом воды и пара от количества теплоты, подводимого
к телу.
Формула количества теплоты в физике
Содержание:
Определение и формула количества теплоты
Внутреннюю энергию термодинамической системы можно изменить двумя способами:
- совершая над системой работу,
- при помощи теплового взаимодействия.
Передача тепла телу не связана с совершением над телом макроскопической работы. В данном случае изменение внутренней энергии вызвано тем,
В данном случае изменение внутренней энергии вызвано тем,
что отдельные молекулы тела с большей температурой совершают работу над некоторыми молекулами тела, которое имеет меньшую температуру. В этом
случае тепловое взаимодействие реализуется за счет теплопроводности. Передача энергии также возможна при помощи излучения. Система
микроскопических процессов (относящихся не ко всему телу, а к отдельным молекулам) называется теплопередачей. Количество энергии,
которое передается от одного тела к другому в результате теплопередачи, определяется количеством теплоты, которое предано от одного тела другому.
Определение
Теплотой называют энергию, которая получается (или отдается) телом в процессе теплообмена с окружающими телами (средой).
Обозначается теплота, обычно буквой Q.
Это одна из основных величин в термодинамике. Теплота включена в математические выражения первого и второго начал термодинамики.
Говорят, что теплота – это энергия в форме молекулярного движения.
Теплота может сообщаться системе (телу), а может забираться от нее. Считают, что если тепло сообщается системе, то оно положительно.
Формула расчета теплоты при изменении температуры
Элементарное количество теплоты обозначим как $\delta Q$. Обратим внимание,
что элемент тепла, которое получает (отдает) система при малом изменении ее состояния не является полным дифференциалом.
Причина этого состоит в том, что теплота является функцией процесса изменения состояния системы.
Элементарное количество тепла, которое сообщается системе, и температура при этом меняется от Tдо T+dT, равно:
$$\delta Q=C d T(1)$$
где C – теплоемкость тела. Если рассматриваемое тело однородно, то формулу (1) для количества теплоты можно представить как:
$$\delta Q=c m d T=\nu c_{\mu} d T(2)$$
где $c=\frac{C}{m}$ – удельная теплоемкость тела, m – масса тела,
$c_{\mu}=c \cdot \mu$ — молярная теплоемкость,
$\mu$ – молярная масса вещества,
$\nu=\frac{m}{\mu}$ – число молей вещества.
Если тело однородно, а теплоемкость считают независимой от температуры, то количество теплоты
($\Delta Q$), которое получает тело при увеличении его температуры на величину
$\Delta t = t_2 — t_1$ можно вычислить как:
$$\Delta Q=c m \Delta t(3)$$
где t2, t1 температуры тела до нагрева и после. Обратите внимание, что температуры при нахождении разности
($\Delta t$) в расчетах можно подставлять как в градусах Цельсия, так и в кельвинах.
Формула количества теплоты при фазовых переходах
Переход от одной фазы вещества в другую сопровождается поглощением или выделением некоторого количества теплоты,
которая носит название теплоты фазового перехода.
Так, для перевода элемента вещества из состояния твердого тела в жидкость ему следует сообщить количество теплоты
($\delta Q$) равное:
$$\delta Q=\lambda d m$$
где $\lambda$ – удельная теплота плавления, dm – элемент массы тела.
При этом следует учесть, что тело должно иметь температуру, равную температуре плавления рассматриваемого вещества.
При кристаллизации происходит выделение тепла равного (4).
Количество теплоты (теплота испарения), которое необходимо для перевода жидкости в пар можно найти как:
$$\delta Q=r d m$$
где r – удельная теплота испарения. При конденсации пара теплота выделяется. Теплота испарения равна теплоте конденсации одинаковых масс вещества.
Единицы измерения количества теплоты
Основной единицей измерения количества теплоты в системе СИ является: [Q]=Дж
Внесистемная единица теплоты, которая часто встречается в технических расчетах. [Q]=кал (калория). 1 кал=4,1868 Дж.
Примеры решения задач
Пример
Задание. Какие объемы воды следует смешать, чтобы получить 200 л воды при температуре t=40С, если температура
одной массы воды t1=10С, второй массы воды t2=60С?
Решение. Запишем уравнение теплового баланса в виде:
$$Q=Q_{1}+Q_{2}(1.1)$$
где Q=cmt – количество теплоты приготовленной после смешивания воды; Q1=cm1t1 —
количество теплоты части воды температурой t1 и массой m1;
Q2=cm2t2— количество теплоты части воды температурой t2 и массой m2.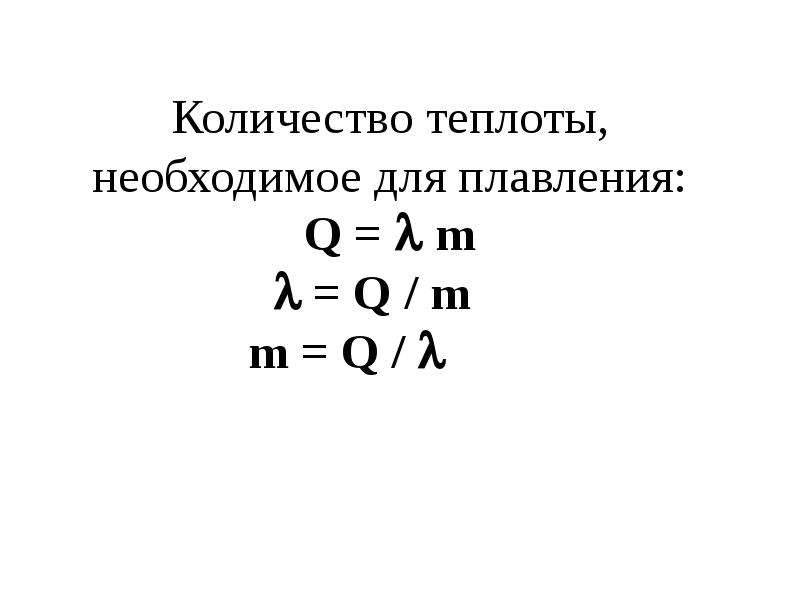
Из уравнения (1.1) следует:
$$
\begin{array}{l}
\mathrm{cmt}=\mathrm{cm}_{1} t_{1}+\mathrm{~cm}_{2} t_{2} \rightarrow \mathrm{mt}=\mathrm{m}_{1} t_{1}+\mathrm{~m}_{2} t_{2} \rightarrow \\
\rightarrow \rho \mathrm{Vt}=\rho V_{1} t_{1}+\rho \mathrm{V}_{2} t_{2} \rightarrow \mathrm{Vt}=V_{1} t_{1}+V_{2} t_{2}(1.2)
\end{array}
$$
При объединении холодной (V1) и горячей (V2) частей воды в единый объем (V) можно принять то, что:
$$$
V=V_{1}+V_{2}(1.3)
$$$
Так, мы получаем систему уравнений:
$$
\left\{\begin{array}{c}
V t=V_{1} t_{1}+V_{2} t_{2} \\
V=V_{1}+V_{2}
\end{array}\right.
$$
Решив ее получим:
$$
\begin{array}{l}
V_{1}=\frac{\left(t_{2}-t\right)}{t_{2}-t_{1}} V \\
V_{2}=\frac{\left(t-t_{1}\right)}{t_{2}-t_{1}} V
\end{array}
$$
Проведем вычисления (это можно сделать, не переходя в систему СИ):
$$
\begin{array}{l}
V_{1}=\frac{(60-40)}{60-10} 200=80 \text { (л) } \\
V_{2}=\frac{(40-10)}{60-10} 200=120 \text { (л) }
\end{array}
$$
Ответ. {*}\right)
{*}\right)
\end{array}
$$
Ответ. $\Delta Q$=1700 Дж
Читать дальше: Формула напряженности магнитного поля.
Количество теплоты, необходимое для плавления тела и выделяющееся при его кристаллизации
В процессе плавления температура вещества не изменяется Вся получаемая им энергия при этом тратится на разрушение кристаллической решетки и увеличение потенциальной энергии молекул тела.
Изучая на опыте плавление различных веществ одной и той же массы, можно заметить, что для превращения их в жидкость требуется разное количество теплоты. Например, для того чтобы расплавить 1 кг льда, нужно затратить 332 кДж энергии, а для того чтобы расплавить 1 кг свинца — 25 кДж.
Физическая величина, показывающая, какое количество теплоты необходимо для превращения 1 кг кристаллического вещества, взятого при температуре плавления, в жидкость той же температуры, называется удельной теплотой плавления.
Удельную теплоту плавления измеряют в джоулях на килограмм (Дж/кг) и обозначают греческой буквой λ (ламбда):
λ — удельная теплота плавления.
При кристаллизации вещества потенциальная энергия молекул уменьшается и в окружающую среду выделяется точно такое же (по модулю) количество теплоты, что и поглощается при его плавлении. Поэтому, например, при замерзании воды массой 1 кг выделяются те же 332 кДж энергии, которые нужны для превращения такой же массы льда в воду.
Удельную теплоту плавления различных веществ можно найти в таблице 10.
Из этой таблицы, например, видно, что удельная теплота плавления меди λ = 2,1 * 105 Дж/кг. Это число показывает, что для плавления 1 кг меди требуется затратить 2,1 * 105 Дж энергии; точно такое же (по модулю) количество теплоты будет выделено 1 кг жидкой меди при ее кристаллизации.
Для плавления 2 кг меди потребуется в 2 раза больше энергии, для плавления 3 кг меди — в 3 раза больше и т. д.
Чтобы найти количество теплоты, необходимое для плавления кристаллического тела произвольной массы, надо удельную теплоту плавления этого тела умножить на его массу:
Q = λm. (39.1)
(39.1)
Количество теплоты, выделяемое телом, считается отрицательным. Поэтому при расчете количества теплоты, выделяющегося при кристаллизации вещества массой m, следует пользоваться той же формулой, но со знаком «минус»:
Q = –λm. (39.2)
Следует помнить, что формулы (39.1) и (39.2) можно применять только к таким телам, которые уже имеют температуру, равную температуре плавления. Если же она отличается от нее, то предварительно следует рассчитать то количество теплоты, которое необходимо для нагревания тела или которое выделяется телом при его охлаждении.
1. Что называется удельной теплотой плавления тела? 2. Удельная теплота плавления золота равна 67 кДж/кг. Что показывает это число? 3. По какой формуле вычисляют количество теплоты, необходимое для плавления тела? 4. По какой формуле вычисляют количество теплоты, выделяющееся при кристаллизации вещества?
Физика 8 класс. Плавление кристаллических тел. Удельная теплота плавления :: Класс!ная физика
Физика 8 класс. ПЛАВЛЕНИЕ КРИСТАЛЛИЧЕСКИХ ТЕЛ
ПЛАВЛЕНИЕ КРИСТАЛЛИЧЕСКИХ ТЕЛ
Плавление — переход вещества из твердого состояния в жидкое.
При нагревании увеличивается температура вещества, и возрастает скорость теплового движения частиц , при этом увеличивается внутренняя энергия тела.
Когда температура твердого тело достигает температуры плавления , кристаллическая решетка твердого вещества начинает разрушаться.
Таким образом, основная часть энергия нагревателя, пдводимая к твердому телу, идет на уменьшение связей между частицами вещества, т. е. на разрушение кристаллической решетки.
При этом возрастает энергия взаимодействия между частицами.
Расплавленное вещество обладает большим запасом внутренней энергии, чем в твердом состоянии.
Оставшаяся часть теплоты плавления расходуется на совершение работы по изменению объема тела при его плавлении.
При плавлении объем большинства кристаллических тел увеличивается (на 3-6%),
а при отвердевании уменьшается.
Но, существуют вещества, у которых при плавлении объем уменьшается, а при отвердевании — увеличивается.
К ним относятся, например, вода и чугун, кремний и некоторые другие. . Именно поэтому лёд плавает на поверхности воды, а твердый чугун — в собственном расплаве.
Твердые тела, называемые аморфными ( янтарь, смола, стекло) не имеют определенной температуры плавления.
Количество теплоты, необходимой для плавления вещества, равно произведению
удельной теплоты плавления на массу данного вещества.
Удельная теплота плавления показывает, какое кол теплоты необходимо для полного превращения 1 кг вещества из твердого состояния в жидкое, взятого при темп плавления.
Единицей удельной теплоты плавления в СИ служит 1Дж/кг.
В процессе плавления температура кристалла остается постоянной. Эта температура называется температурой плавления. У каждого вещества своя температура плавления.
Температура плавления для данного вещества зависит от атмосферного давления.
У кристаллических тел при температуре плавления можно наблюдать вещество одновременно
в твердом и жидком состояниях.
ДА или НЕТ ?
Если два одинаковых сосуда из полиэтилена заполнить водой при 0 градусов C,
и один сосуд поместить в воду при 0 градусов C, а другой—в измельченный лёд при 0 градусов C,
то замерзнет ли вода в каком—нибудь из этих сосудов?
КНИЖНАЯ ПОЛКА
Эти замечательные стеклянные «слёзки»!
Мороз, а лёд-то плавится!
ИНТЕРЕСНО О ПЛАВЛЕНИИ
Ледяные зёрна и звезды.
Устали? — Отдыхаем!
Удельная теплота кристаллизации формула. Плавление и кристаллизация
Энергия, которую получает или теряет тело при теплопередаче, называется количеством теплоты.
Количество теплоты зависит от массы тела, от разности температур тела и от рода вещества.
[Q]=Дж или калориях
1 кал
– это количество теплоты, которое необходимо для нагревания 1 г воды на 1 о С.
Удельная теплоемкость
– физическая величина, равная количеству теплоты, которое необходимо передать телу массой 1 кг для того, чтобы его температура изменилась на 1 о С.
[C] = Дж/кг о С
Удельная теплоемкость воды 4200 Дж/кг о С. Это значит, что для нагревания воды массой 1 кг на 1 о С необходимо затратить 4200 Дж теплоты.
Удельная теплоемкость вещества, находящегося в различных агрегатных состояниях, различна. Так, теплоемкость льда 2100 Дж/кг о С. Удельная теплоемкость воды самая большая. В связи с этим вода в морях и океанах, нагреваясь летом, поглощает большое количество теплоты. Зимой вода остывает и отдает большое количество теплоты. Поэтому в районах, расположенных вблизи водоемов, летом не бывает очень жарко, а зимой очень холодно. Из-за высокой теплоемкости воду широко применяют в технике и быту. Например, в отопительных системах домов, при охлаждении деталей во время их обработки на станках, медицине (грелках) и т. д.
д.
С возрастанием температуры твердых тел и жидкостей возрастает кинетическая энергия их частиц: они начинают колебаться с большей скоростью. При некоторой температуре, вполне определенной для данного вещества, силы притяжения между частицами уже не в состоянии удержать их в узлах кристаллической решетки (дальний порядок превращается в ближний), и кристалл начинает плавиться, т.е. вещество начинает переходить в жидкое состояние.
Плавление
–
процесс перехода вещества из твердого состояния в жидкое.
Отвердевание (кристаллизация)
–
процесс перехода вещества из жидкого состояния в твердое.
В процессе плавления температура кристалла остается постоянной. Эта температура называется температурой плавления
. У каждого вещества есть своя температура плавления. Находят по таблице.
Постоянство температуры при плавлении имеет большое практическое значение, поскольку позволяет градуировать термометры, изготавливать плавкие предохранители и индикаторы, которые расплавляются при строго заданной температуре.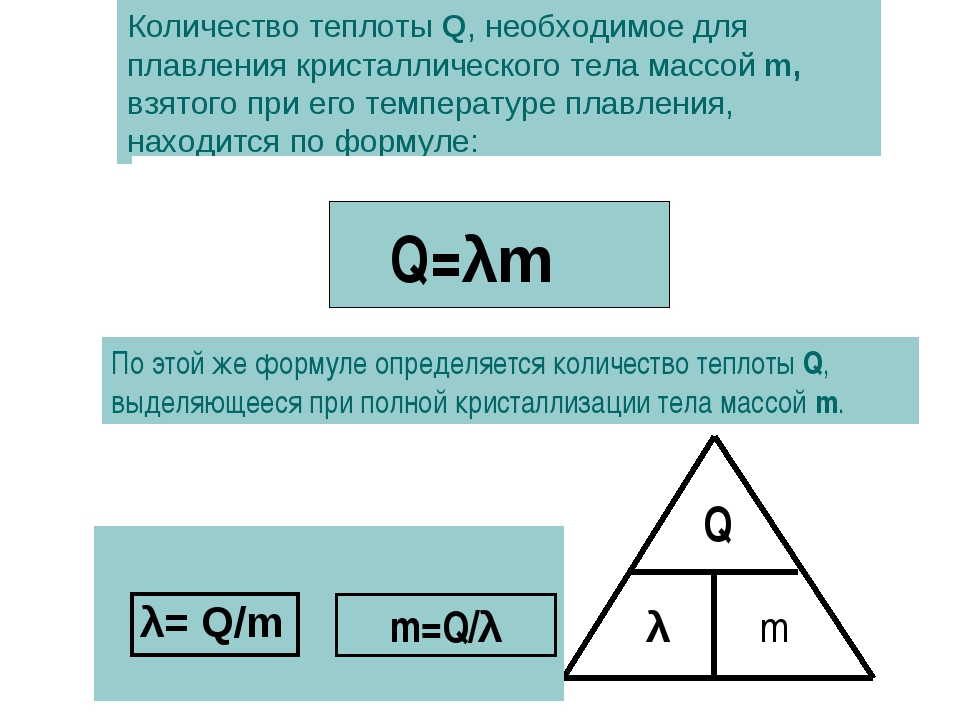 Знание температуры плавления различных веществ важно и с чисто бытовой точки зрения: в противном случае кто поручится за то, что эта кастрюля или сковородка не расплавится на огне газовой горелки?
Знание температуры плавления различных веществ важно и с чисто бытовой точки зрения: в противном случае кто поручится за то, что эта кастрюля или сковородка не расплавится на огне газовой горелки?
Температура плавления и равная ей температура отвердевания — характерный признак вещества. Ртуть плавится и затвердевает при температуре -39 о С, поэтому в районах Крайнего Севера ртутные термометры не используют. Вместо ртутных термометров в этих широтах используют спиртовые (-114 о С). Самым тугоплавким металлом является вольфрам (3420 о С).
Количество теплоты, необходимое для плавления вещества, определяют по формуле:
Где m – масса вещества, — удельная теплота плавления.
Дж/кг
Удельная теплота плавления –
такое количество теплоты, которое необходимо для расплавления 1 кг вещества, взятого при температуре плавления. У каждого вещества своя. Её находят по таблице.
Температура плавления вещества зависит от давления. Для веществ, у которых объем при плавлении возрастает, повышение давления повышает температуру плавления и наоборот.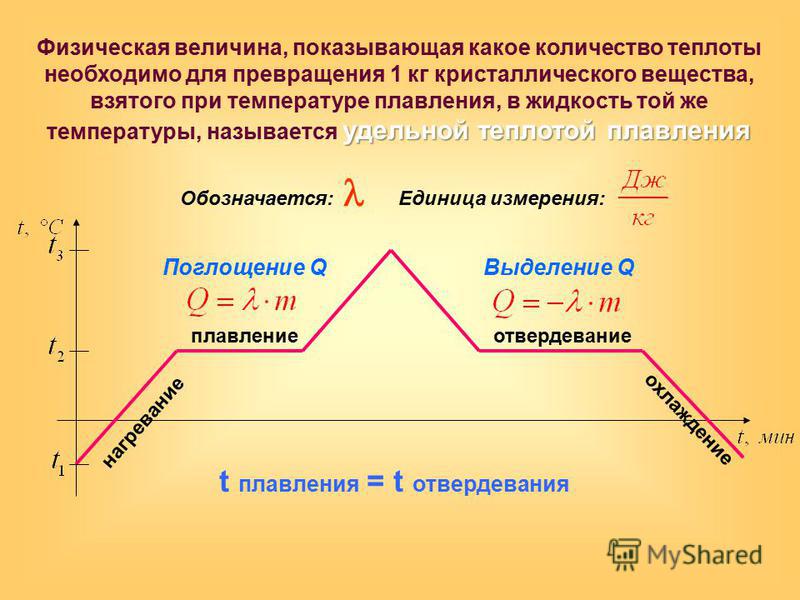 У воды объем при плавлении уменьшается, и при повышении давления лед плавится при более низкой температуре.
У воды объем при плавлении уменьшается, и при повышении давления лед плавится при более низкой температуре.
Билет № 14
Каждому известно, что вода может находиться в природе в трех агрегатных состояниях — твердом, жидком и газообразном. При плавлении происходит превращение твердого льда в жидкость, а при дальнейшем нагревании жидкость испаряется, образуя водяной пар. Каковы же условия плавления, кристаллизации, испарения и конденсации воды? При какой температуре тает лед или образуется пар? Об этом мы поговорим в данной статье.
Нельзя сказать, что водяной пар и лед редко встречаются в повседневной жизни. Однако наиболее распространенным является именно жидкое состояние — обычная вода. Специалисты выяснили, что на нашей планете находится более 1 млрд кубических километров воды. Однако не более 3 млн км 3 воды принадлежат пресным водоемам. Достаточно большое количество пресной воды «покоится» в ледниках (около 30 млн кубических километров). Однако растопить лед таких огромных глыб далеко не просто. Остальная же вода соленая, принадлежащая морям Мирового океана.
Остальная же вода соленая, принадлежащая морям Мирового океана.
Вода окружает современного человека повсюду, во время большинства ежедневных процедур. Многие считают, что запасы воды неиссякаемы, и человечество сможет всегда использовать ресурсы гидросферы Земли. Однако это далеко не так. Водные ресурсы нашей планеты постепенно истощаются, и уже через несколько сотен лет пресной воды на Земле может не остаться вовсе. Поэтому абсолютно каждому человеку нужно бережно относиться к пресной воде и экономить ее. Ведь даже в наше время существуют государства, в которых запасы воды катастрофически малы.
Свойства воды
Прежде чем говорить о температуре таяния льда, стоит рассмотреть основные свойства этой уникальной жидкости.
Итак, воде присущи следующие свойства:
- Отсутствие цвета.
- Отсутствие запаха.
- Отсутствие вкуса (однако качественная питьевая вода имеет приятный вкус).
- Прозрачность.
- Текучесть.
- Способность растворять различные вещества (например, соли, щелочи и т.
 д.).
д.). - Вода не имеет собственной постоянной формы и способна принимать форму сосуда, в который попадает.
- Способность очищаться посредством фильтрования.
- При нагревании вода расширяется, а при охлаждении сжимается.
- Вода может испаряться, превращаясь в пар, и замерзать, образуя кристаллический лед.
В этом списке представлены основные свойства воды. Теперь разберемся, каковы особенности твердого агрегатного состояния этого вещества, и при какой температуре тает лед.
Лед — это твердое кристаллическое вещество, которое имеет достаточно неустойчивую структуру. Он, как и вода, прозрачен, не имеет цвета и запаха. Также лед обладает такими свойствами, как хрупкость и скользкость; он холодный на ощупь.
Снег также представляет собой замерзшую воду, однако обладает рыхлой структурой и имеет белый цвет. Именно снег каждый год выпадает в большинстве стран мира.
Как снег, так и лед — крайне неустойчивые вещества. Чтобы растопить лед, не нужно прикладывать особых усилий. Когда же он начинает таять?
Когда же он начинает таять?
В природе твердый лед существует только при температуре 0 °C и ниже. Если же температура окружающей среды поднимается и становится больше 0 °C, лед начинает таять.
При температуре таяния льда, при 0 °C, происходит и другой процесс — замерзание, или кристаллизация, жидкой воды.
Данный процесс можно наблюдать всем жителям умеренно континентального климата. Зимой, когда температура на улице опускается ниже 0 °C, достаточно часто выпадает снег, который не тает. А жидкая вода, находившаяся на улицах, замерзает, превращаясь в твердый снег или лед. Весной же можно увидеть обратный процесс. Температура окружающей среды поднимается, поэтому лед и снег тают, образуя многочисленные лужи и грязь, которую можно считать единственным минусом весеннего потепления.
Таким образом, можно сделать вывод, что, при какой температуре начинает таять лед, при такой же температуре начинается и процесс замерзания воды.
Количество теплоты
В такой науке, как физика, часто используется понятие количества теплоты. Данная величина показывает количество энергии, необходимой для нагревания, плавления, кристаллизации, кипения, испарения или конденсации различных веществ. Причем каждый из перечисленных процессов имеет свои особенности. Поговорим о том, какое количество теплоты для нагревания льда требуется в обычных условиях.
Данная величина показывает количество энергии, необходимой для нагревания, плавления, кристаллизации, кипения, испарения или конденсации различных веществ. Причем каждый из перечисленных процессов имеет свои особенности. Поговорим о том, какое количество теплоты для нагревания льда требуется в обычных условиях.
Чтобы нагреть лед, нужно сначала его растопить. Для этого необходимо количество теплоты, нужное для плавления твердого вещества. Теплота равняется произведению массы льда на удельную теплоту его плавления (330-345 тысяч Джоулей/кг) и выражается в Джоулях. Допустим, что нам дано 2 кг твердого льда. Таким образом, чтобы его растопить, нам понадобится: 2 кг * 340 кДж/кг = 680 кДж.
После этого нам необходимо нагреть образовавшуюся воду. Количество теплоты для данного процесса рассчитать будет немного сложнее. Для этого нужно знать начальную и конечную температуру нагреваемой воды.
Итак, допустим, что нам требуется нагреть получившуюся в результате плавления льда воду на 50 °C. То есть разница начальной и конечной температуры = 50 °C (начальная температура воды — 0 °C). Тогда следует умножить разность температур на массу воды и на ее удельную теплоемкость, которая равняется 4 200 Дж*кг/°C. То есть количество теплоты, необходимое для нагревания воды, = 2 кг * 50 °C * 4 200 Дж*кг/°C = 420 кДж.
То есть разница начальной и конечной температуры = 50 °C (начальная температура воды — 0 °C). Тогда следует умножить разность температур на массу воды и на ее удельную теплоемкость, которая равняется 4 200 Дж*кг/°C. То есть количество теплоты, необходимое для нагревания воды, = 2 кг * 50 °C * 4 200 Дж*кг/°C = 420 кДж.
Тогда получаем, что для плавления льда и последующего нагревания получившейся воды нам потребуется: 680 000 Дж + 420 000 Дж = 1 100 000 Джоулей, или 1,1 Мегаджоуль.
Зная, при какой температуре тает лед, можно решить множество непростых задач по физике или химии.
В заключение
Итак, в данной статье мы узнали некоторые факты о воде и о двух ее агрегатных состояниях — твердом и жидком. Водяной пар, однако, представляет собой не менее интересный объект для изучения. Например, в нашей атмосфере содержится приблизительно 25*10 16 кубических метров водяного пара. К тому же, в отличие от замерзания, испарение воды происходит при любой температуре и ускоряется при ее нагревании или при наличии ветра.
Мы узнали, при какой температуре тает лед и замерзает жидкая вода. Такие факты всегда пригодятся нам в повседневной жизни, так как вода окружает нас повсюду. Важно всегда помнить о том, что вода, в особенности пресная, является иссякаемым ресурсом Земли и нуждается в бережном к ней отношении.
Под плавлением в физике подразумевают процесс превращения тела из твердого состояния в жидкое, под действием температуры. Классическим повсеместным примером плавления из жизни является таяние льдов, их превращение в воду, или превращение твердого куска олова в жидкий припой под действием паяльника. Передача тому или иному телу определенного количества тепла может изменить его агрегатное состояние, это удивительное свойство твердых тел превращаться в жидкие под действием температуры имеет большое значение для науки и техники. Ученым (а также техникам, инженерам) важно знать при каких температурах плавятся те или иные (а порой и не только металлы), и для этого в физику вошло такое понятие как «удельная теплота плавления». О том, что означает удельная теплота плавления, какая ее формула расчета, читайте далее.
О том, что означает удельная теплота плавления, какая ее формула расчета, читайте далее.
Почему твердое тело становится жидким?
Но давайте для начала разберем, как происходит сам процесс плавления на атомно-молекулярном уровне. Как мы знаем, в любом твердом теле все атомы и молекулы находятся четко и упорядочено в узлах , благодаря этому твердое тело и является твердым.
Но что происходит, если мы начинает это самое гипотетическое твердо тело сильно нагревать – под действием температуры атомы и молекулы резко увеличивают свою кинетическую энергию и по достижении определенных критических значений, они начинают покидать кристаллическую решетку, вырываться из нее. А само твердое тело начинает буквально распадаться, превращаясь в некое жидкое вещество – так происходит плавление.
При этом процесс плавления происходит не резким скачком, а постепенно. Также стоит заметить, что плавление относится к эндотермическим процессам, то есть процессам, при которых происходит поглощение теплоты.
Процесс обратный к плавлению называют кристаллизацией – это когда тело из жидкого состояния наоборот превращается в твердое. Если вы оставите воду в морозилке, она через какое-то время превратится в лед – это самый типичный пример кристаллизации из реальной жизни.
Определение удельной теплоты плавления
Удельной теплотой плавления называют физическую величину равную количеству тепла (в джоулях), которое необходимо передать твердому телу массой 1 кг, чтобы полностью перевести его в жидкое состояние. Удельную теплоту плавления обозначают греческой буквой «лямбда» – λ.
Формула удельной теплоты плавление выглядит так:
Где m – масса плавящегося вещества, а Q – количество тепла, переданное веществу при плавлении.
Зная значение удельной теплоты плавления, мы можем определить, какое количество тепла необходимо передать для тела с той или иной массой, для его полного расплавления:
Для разных веществ удельная теплота плавления была определена экспериментально.
Единица удельной теплоты плавления
Многих интересует вопрос, в каких единицах измеряется удельная теплота плавления. Так вот, удельная теплота плавления измеряется в Джоулях на килограмм – Дж/кг.
Таблица удельной теплоты плавления
Значение удельной теплоты для разных веществ: золота, серебра, цинка, олова и многих других металлов можно найти в специальных таблицах и справочниках. Обычно эти значения приводятся в виде таблицы.
Вашему вниманию таблица удельной теплоты плавления разных веществ
Интересный факт: самым тугоплавким металлом на сегодняшний день является карбид тантала – ТаС. Для его плавления необходима температура 3990 С. Покрытия из ТаС применяют для защиты металлических форм, в которых отливают детали из алюминия
- Енохович А. С. Краткий справочник по физике. — М.: «Высшая школа», 1976. — С. 114. — 288 с.
- Atkins, Peter & Jones, Loretta (2008), Chemical Principles: The Quest for Insight (4th ed.), W. H. Freeman and Company, с.
 236, ISBN 0-7167-7355-4
236, ISBN 0-7167-7355-4 - Hoffer J. K., Gardner W. R., Waterfield C. G., Phillips N. E. Thermodynamic properties of 4He. II. The bcc phase and the P-T and VT phase diagrams below 2 K (англ.) // Journal of Low Temperature Physics (англ.)русск. : journal. — 1976. — April (vol. 23, no. 1). — P. 63-102. — DOI:10.1007/BF00117245. — Bibcode: 1976JLTP…23…63H.
Удельная теплота плавления, видео
Переход вещества из твердого кристаллического состояния в жидкое называется плавлением
. Чтобы расплавить твердое кристаллическое тело, его нужно нагреть до определенной температуры, т. е. подвести тепло.
Температура, при которой вещество плавится, называется
температурой плавления вещества.
Обратный процесс — переход из жидкого состояния в твердое — происходит при понижении температуры, т. е. тепло отводится. Переход вещества из жидкого состояния в твердое называется
отвердеванием,
или
кристал
лизацией.
Температура, при которой вещество кристаллизуется, называется
температурой кристалли
зации.
Опыт показывает, что любое вещество кристаллизуется и плавится при одной и той же температуре.
На рисунке представлен график зависимости температуры кристаллического тела (льда) от времени нагревания (от точки А
до точки D)
и времени охлаждения (от точки D
до точки K
).
На нем по горизонтальной оси отложено время, а по вертикальной — температура.
Из графика видно, что наблюдение за процессом началось с момента, когда температура льда была -40 °С, или, как принято говорить, температура в начальный момент времени t
нач
= -40 °С (точка А
на графике). При дальнейшем нагревании температура льда растет (на графике это участок АВ
). Увеличение температуры происходит до 0 °С — температуры плавления льда. При 0°С лед начинает плавиться, а его температура перестает расти. В течение всего времени плавления (т.е. пока весь лед не расплавится) температура льда не меняется, хотя горелка продолжает го-реть и тепло, следовательно, подводится.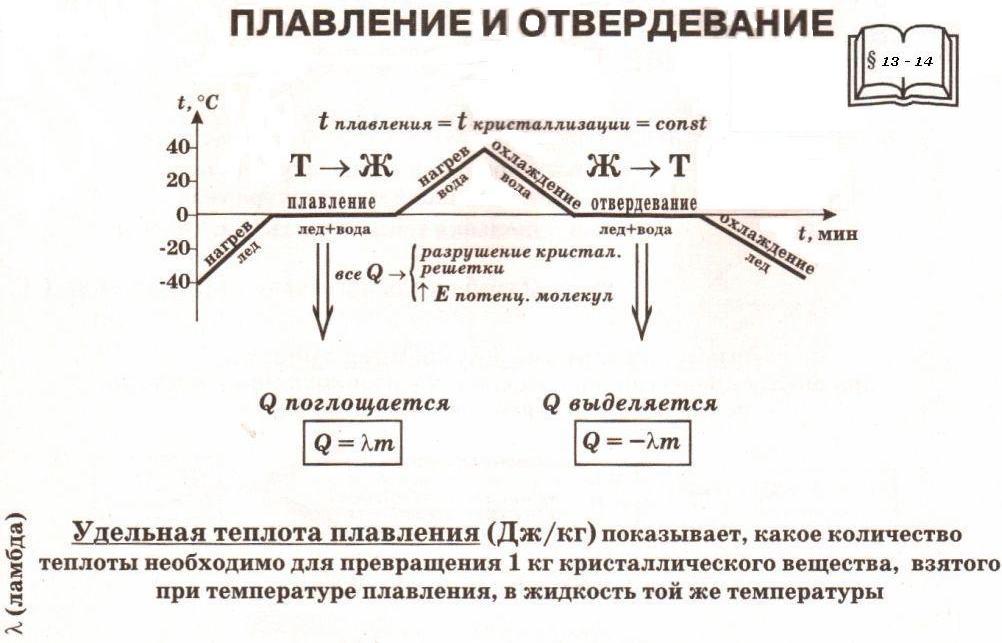 Процессу плавления соответствует горизонтальный учас-ток графика ВС.
Процессу плавления соответствует горизонтальный учас-ток графика ВС.
Только после того как весь лед расплавится и превратится в воду , температура снова начинает подниматься (участок CD
). После того, как температура воды достигнет +40 °С, горелку гасят и воду начинают охлаждать, т. е. тепло отводят (для этого можно сосуд с водой по-местить в другой, больший сосуд со льдом). Температура воды начинает снижаться (участок DE
). При достижении температуры 0 °С температура воды перестает снижаться, несмотря на то, что тепло по-прежнему отводится. Это идет процесс кристаллизации воды — образования льда (гори-зонтальный участок EF
).
Пока вся вода не превратится в лед, температура не изменится. Лишь после этого начинает уменьшаться температура льда (участок FK
).
Вид рассмотренного графика объясняется следующим образом. На участке АВ
благодаря подводимому теплу средняя кинетическая энергия молекул льда увеличивается, и температура его повышается.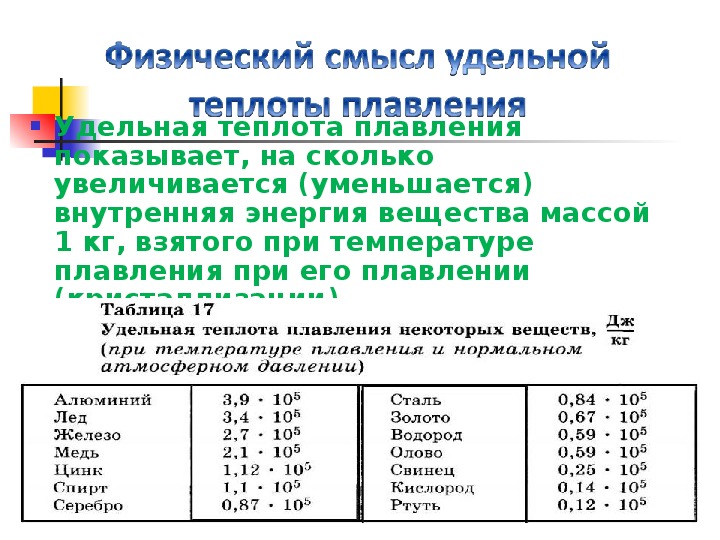 На участке ВС
На участке ВС
вся энергия, получаемая содержимым колбы, тратится на разрушение кристаллической решетки льда: упорядоченное пространственное расположение его молекул сменяется неупорядоченным, меняется расстояние между молекулами, т.е. происходит перестройка молекул таким образом, что вещество становится жидким. Средняя кинетическая энергия моле-кул при этом не меняется, поэтому неизменной остается и температура. Дальнейшее увеличение температуры расплавленного льда-воды (на участке CD
) означает увеличение кинетической энер-гии молекул воды вследствие подводимого горелкой тепла.
При охлаждении воды (участок DE
) часть энергии у нее отбирается, молекулы воды движутся с меньшими скоростями, их средняя кинетическая энергия падает — температура уменьшается, вода охлаждается. При 0°С (горизонтальный участок EF
) молекулы начинают выстраиваться в определенном порядке, образуя кристаллическую решетку. Пока этот процесс не завершится, температура вещества не изменится, несмотря на отводимое тепло, а это означает, что при отвер-девании жидкость (вода) выделяет энергию. Это как раз та энергия, которую поглотил лед, пре-вращаясь в жидкость (участок ВС
Это как раз та энергия, которую поглотил лед, пре-вращаясь в жидкость (участок ВС
). Внутренняя энергия у жидкости больше, чем у твердого тела. При плавлении (и кристаллизации) внутренняя энергия тела меняется скачком.
Металлы, плавящиеся при температуре выше 1650 ºС, называют тугоплавкими
(титан, хром , молибден и др.). Самая высокая температура плавления среди них у вольфрама — около 3400 °С . Тугоплавкие металлы и их соединения используют в качестве жаропрочных материалов в самолетостроении, ракетостроении и космической технике, атомной энергетике.
Подчеркнем еще раз, что при плавлении вещество поглощает энергию. При кристаллизации оно, наоборот, отдает ее в окружающую среду. Получая определенное количество теплоты, выделяющееся при кристаллизации, среда нагревается. Это хорошо известно многим птицам. Неда-ром их можно заметить зимой в морозную погоду сидящими на льду, который покрывает реки и озера. Из-за выделения энергии при образовании льда воздух над ним оказывается на несколько градусов теплее, чем в лесу на деревьях, и птицы этим пользуются.
Плавление аморфных веществ.
Наличие определенной точки плавления
— это важный признак кристаллических веществ. Именно по этому признаку их можно легко отличить от аморфных тел, которые также относят к твердым телам. К ним, в частности, относятся стекла, очень вязкие смолы, пластмассы.
Аморфные вещества
(в отличие от кристаллических) не имеют определенной температуры плавления — они не плавятся, а размягчаются. При нагревании кусок стекла, например, снача-ла становится из твердого мягким, его легко можно гнуть или растягивать; при более высокой температуре кусок начинает менять свою форму под действием собственной тяжести. По мере нагревания густая вязкая масса принимает форму того сосуда, в котором лежит. Эта масса сначала густая, как мед, затем — как сметана и, наконец, становится почти такой же маловязкой жидкостью, как вода. Однако указать определенную температуру перехода твердого тела в жидкое здесь невозможно, поскольку ее нет.
Причины этого лежат в коренном отличии строения аморфных тел от строения кристаллических. Атомы в аморфных телах расположены беспорядочно. Аморфные тела по своему строению напоминают жидкости. Уже в твердом стекле атомы расположены беспорядочно. Значит, повы-шение температуры стекла лишь увеличивает размах колебаний его молекул, дает им постепенно все большую и большую свободу перемещения. Поэтому стекло размягчается постепенно и не обнаруживает резкого перехода «твердое—жидкое», характерного для перехода от расположения молекул в строгом порядке к беспорядочному.
Атомы в аморфных телах расположены беспорядочно. Аморфные тела по своему строению напоминают жидкости. Уже в твердом стекле атомы расположены беспорядочно. Значит, повы-шение температуры стекла лишь увеличивает размах колебаний его молекул, дает им постепенно все большую и большую свободу перемещения. Поэтому стекло размягчается постепенно и не обнаруживает резкого перехода «твердое—жидкое», характерного для перехода от расположения молекул в строгом порядке к беспорядочному.
Теплота плавления.
Теплота плавления
— это количество теплоты, которое необходимо сообщить веществу при постоянном давлении и постоянной температуре, равной температуре плавления, чтобы полностью перевести его из твердого кристаллического состояния в жидкое. Теплота плавления равна тому количеству теплоты , которое выделяется при кристалли-зации вещества из жидкого состояния. При плавлении вся подводимая к веществу теплота идет на увеличение потенциальной энер-гии его молекул. Кинетическая энергия не меняется, поскольку плавление идет при постоянной температуре.
Изучая на опыте плавление различных веществ одной и той же массы, можно заметить, что для превращения их в жидкость требуется разное количество теплоты. Например, для того чтобы расплавить один килограмм льда, нужно затратить 332 Дж энергии, а для того чтобы расплавить 1 кг свинца — 25 кДж .
Количество теплоты, выделяемое телом, считается отрицательным. Поэтому при расчете количества теплоты, выделяющегося при кристаллизации вещества массой m
, следует пользоваться той же формулой, но со знаком «минус»:
Теплота сгорания.
Теплота сгорания
(или теплотворная способность
, калорийность
) — это количество теплоты, выделяющейся при полном сгорании топлива.
Для нагревания тел часто используют энергию, выделяющуюся при сгорании топлива. Обыч-ное топливо (уголь, нефть, бензин) содержит углерод . При горении атомы углерода соединяются с атомами кислорода , содержащегося в воздухе, в результате чего образуются молекулы углекислого газа . Кинетическая энергия этих молекул оказывается большей, чем у исходных частиц. Увеличение кинетической энергии молекул в процессе горения называют выделением энергии. Энергия, выделяющаяся при полном сгорании топлива, и есть теплота сгорания этого топлива.
Кинетическая энергия этих молекул оказывается большей, чем у исходных частиц. Увеличение кинетической энергии молекул в процессе горения называют выделением энергии. Энергия, выделяющаяся при полном сгорании топлива, и есть теплота сгорания этого топлива.
Теплота сгорания топлива зависит от вида топлива и его массы. Чем больше масса топлива, тем больше количество теплоты, выделяющейся при его полном сгорании.
Физическая величина , показывающая, какое количество теплоты выделяется при полном сгорании топлива массой 1 кг, называется удельной теплотой сгорания топлива.
Удельную теплоту сгорания обозначают буквой
q
и измеряют в джоулях на килограмм (Дж/кг).
Количество теплоты Q
, выделяющееся при сгорании m
кг топлива, определяют по формуле:
Чтобы найти количество теплоты, выделяющееся при полном сгорании топлива произвольной массы, нужно удельную теплоту сгорания этого топлива умножить на его массу.
В предыдущем параграфе мы рассматривали график плавления и отвердевания льда. Из графика видно, что, пока лёд плавится, температура его не меняется (см. рис. 18). И лишь после того, как весь лёд расплавится, температура образовавшейся жидкости начинает повышаться. Но ведь и во время процесса плавления лёд получает энергию от сгорающего в нагревателе топлива. А из закона сохранения энергии следует, что она не может исчезнуть. На что же расходуется энергия топлива во время плавления?
Из графика видно, что, пока лёд плавится, температура его не меняется (см. рис. 18). И лишь после того, как весь лёд расплавится, температура образовавшейся жидкости начинает повышаться. Но ведь и во время процесса плавления лёд получает энергию от сгорающего в нагревателе топлива. А из закона сохранения энергии следует, что она не может исчезнуть. На что же расходуется энергия топлива во время плавления?
Мы знаем, что в кристаллах молекулы (или атомы) расположены в строгом порядке. Однако и в кристаллах они находятся в тепловом движении (колеблются). При нагревании тела средняя скорость движения молекул возрастает. Следовательно, возрастает и их средняя кинетическая энергия и температура. На графике это участок АВ (см. рис. 18). Вследствие этого размах колебаний молекул (или атомов) увеличивается. Когда тело нагреется до температуры плавления, то нарушится порядок в расположении частиц в кристаллах. Кристаллы теряют свою форму. Вещество плавится, переходя из твёрдого состояния в жидкое.
Следовательно, вся энергия, которую получает кристаллическое тело после того, как оно уже нагрето до температуры плавления, расходуется на разрушение кристалла. В связи с этим температура тела перестаёт повышаться. На графике (см. рис. 18) это участок ВС.
Опыты показывают, что для превращения различных кристаллических веществ одной и той же массы в жидкость при температуре плавления требуется разное количество теплоты.
Физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления полностью перевести его в жидкое состояние, называется удельной теплотой плавления.
Удельную теплоту плавления обозначают λ (греч. буква «лямбда»). Её единица — 1 Дж / кг.
Определяют удельную теплоту плавления на опыте. Так, было установлено, что удельная теплота плавления льда равна 3,4 10 5 — . Это означает, что для превращения куска льда массой 1 кг, взятого при 0 °С, в воду такой же температуры требуется затратить 3,4 10 5 Дж энергии. А чтобы расплавить брусок из свинца массой 1 кг, взятого при его температуре плавления, потребуется затратить 2,5 10 4 Дж энергии.
А чтобы расплавить брусок из свинца массой 1 кг, взятого при его температуре плавления, потребуется затратить 2,5 10 4 Дж энергии.
Следовательно, при температуре плавления внутренняя энергия вещества в жидком состоянии больше внутренней энергии такой же массы вещества в твёрдом состоянии.
Чтобы вычислить количество теплоты Q, необходимое для плавления кристаллического тела массой т, взятого при его температуре плавления и нормальном атмосферном давлении, нужно удельную теплоту плавления λ умножить на массу тела m:
Из этой формулы можно определить, что
λ = Q / m, m = Q / λ
Опыты показывают, что при отвердевании кристаллического вещества выделяется точно такое же количество теплоты, которое поглощается при его плавлении. Так, при отвердевании воды массой 1 кг при температуре 0 °С выделяется количество теплоты, равное 3,4 10 5 Дж. Точно такое же количество теплоты требуется и для плавления льда массой 1 кг при температуре 0 °С.
При отвердевании вещества всё происходит в обратном порядке. Скорость, а значит, и средняя кинетическая энергия молекул в охлаждённом расплавленном веществе уменьшаются. Силы притяжения теперь могут удерживать медленно движущиеся молекулы друг около друга. Вследствие этого расположение частиц становится упорядоченным — образуется кристалл. Выделяющаяся при кристаллизации энергия расходуется на поддержание постоянной температуры. На графике это участок EF (см. рис. 18).
Скорость, а значит, и средняя кинетическая энергия молекул в охлаждённом расплавленном веществе уменьшаются. Силы притяжения теперь могут удерживать медленно движущиеся молекулы друг около друга. Вследствие этого расположение частиц становится упорядоченным — образуется кристалл. Выделяющаяся при кристаллизации энергия расходуется на поддержание постоянной температуры. На графике это участок EF (см. рис. 18).
Кристаллизация облегчается, если в жидкости с самого начала присутствуют какие-либо посторонние частицы, например пылинки. Они становятся центрами кристаллизации. В обычных условиях в жидкости имеется множество центров кристаллизации, около которых и происходит образование кристалликов.
Таблица 4.
Удельная теплота плавления некоторых веществ (при нормальном атмосферном давлении)
При кристаллизации происходит выделение энергии и передача её окружающим телам.
Количество теплоты, выделяющееся при кристаллизации тела массой т, определяется также по формуле
Внутренняя энергия тела при этом уменьшается.
Пример
. Для приготовления чая турист положил в котелок лёд массой 2 кг, имеющий температуру 0 °С. Какое количество теплоты необходимо для превращения этого льда в кипяток при температуре 100 °С? Энергию, израсходованную на нагревание котелка, не учитывать.
Какое количество теплоты понадобилось бы, если вместо льда турист взял из проруби воду той же массы при той же температуре?
Запишем условие задачи и решим её.
Вопросы
- Как объяснить процесс плавления тела на основе учения о строении вещества?
- На что расходуется энергия топлива при плавлении кристаллического тела, нагретого до температуры плавления?
- Что называется удельной теплотой плавления?
- Как объяснить процесс отвердевания на основе учения о строении вещества?
- Как вычисляют количество теплоты, необходимое для плавления кристаллического тела, взятого при температуре плавления?
- Как вычислить количество теплоты, выделяющееся при кристаллизации тела, имеющего температуру плавления?
Упражнение 12
Задание
- Поставьте на плиту две одинаковые жестяные банки.
 В одну налейте воду массой 0,5 кг, в другую положите несколько кубиков льда той же массы. Заметьте, сколько времени потребуется, чтобы вода в обеих банках закипела. Напишите краткий отчёт о вашем опыте и объясните его результаты.
В одну налейте воду массой 0,5 кг, в другую положите несколько кубиков льда той же массы. Заметьте, сколько времени потребуется, чтобы вода в обеих банках закипела. Напишите краткий отчёт о вашем опыте и объясните его результаты. - Прочитайте параграф «Аморфные тела. Плавление аморфных тел». Подготовьте по нему доклад.
Урок на тему «Удельная теплота плавления»
Удельная теплота плавления.
Класс: 8
Цели урока
Образовательная
Раскрытие сущности процесса плавления и отвердевания. Ознакомление с количественной характеристикой вещества, участвующего в плавлении – удельной теплотой плавления.
Развивающая
Развитие мыслительной деятельности, развитие речи, обогащение словарного запаса новыми терминами, развитие навыков применения формулы для расчета удельной теплоты плавления при решении задач.
Воспитательная
Воспитание культуры речи, коммуникабельной личности, умения грамотно формулировать мысль. Формирование естественно — научного мировоззрения.
Формирование естественно — научного мировоззрения.
Ожидаемые результаты
К концу урока учащиеся понимают и могут объяснить физический смысл величины удельная теплота плавления, умеют рассчитывать количество теплоты, необходимое для плавления тела, могут применить закон сохранения и превращения энергии для объяснения внутренних процессов при плавлении твердого тела.
Форма, методы
Активная, работа в группе, репродуктивный, объяснительно-иллюстративный, диалогический.
УМК
Перышкин А. В. Физика 8 кл. (2013 год)
Обсуждают в группе, выбирают термины, составляют вопросы и задают их соперникам. Отвечают на вопросы, систематизируют и обобщают информацию, дополняют и корректируют ответы друг друга.
Изучение нового материала
Объясняет новый материал, проводит диалог с учащимися, задает им вопросы. Этапы объяснения: 1. При нагревании твердого тела увеличивается кинетическая энергия частиц и размах их колебаний. Вывод: при плавлении разрушается кристаллическая решетка. 2. Энергия, подводимая при плавлении к телу, затрачивается на разрушение кристаллической решетки. 3. Понятие об удельной теплоте плавления. Единица измерения удельной теплоты плавления. 4. Разбор таблицы 4. Физический смысл удельной теплоты плавления на примерах по таблице. 4. Вывод формулы для расчета удельной теплоты плавления. 5. Внутренняя энергия жидкого тела больше чем у твердого тела. 6. Количество теплоты, выделяемое телом при отвердевании. 7. При отвердевании кинетическая энергия молекул уменьшается, и силы притяжения между молекулами образуют кристалл. 8. Кристаллизация облегчается при наличии пылинок центов кристаллизации. Задает вопросы учащимся связанные с объяснением материала.
Вывод: при плавлении разрушается кристаллическая решетка. 2. Энергия, подводимая при плавлении к телу, затрачивается на разрушение кристаллической решетки. 3. Понятие об удельной теплоте плавления. Единица измерения удельной теплоты плавления. 4. Разбор таблицы 4. Физический смысл удельной теплоты плавления на примерах по таблице. 4. Вывод формулы для расчета удельной теплоты плавления. 5. Внутренняя энергия жидкого тела больше чем у твердого тела. 6. Количество теплоты, выделяемое телом при отвердевании. 7. При отвердевании кинетическая энергия молекул уменьшается, и силы притяжения между молекулами образуют кристалл. 8. Кристаллизация облегчается при наличии пылинок центов кристаллизации. Задает вопросы учащимся связанные с объяснением материала.
Слушают новую информацию. Записывают в тетрадь определения удельной теплоты плавления, формулу определяющую удельную теплоту плавления, и следствия из нее, составляют таблицу «Удельная теплота плавления – физическая величина». Приводят примеры на расчет количества теплоты, необходимого для плавления. Отвечают на вопросы учителя в ходе изучения нового материала.
Отвечают на вопросы учителя в ходе изучения нового материала.
Закреплен. материала
1. Решение творческих задач
А) В долинах Альп основным источником воды для сельскохозяйственных нужд являются ледники на вершинах гор. Больше тают ледники – больше воды, а значит и лучше урожай. Но случается, что весеннее тепло поздно приходит в альпийские долины. Поздно начинают таять и ледники. А без своевременной подачи воды напрасными могут стать и все усилия земледельцев. Еще в 18 веке альпийские крестьяне нашли способ, как заставить горные ледники таять в нужное время. В итоге посевные работы часто начинались здесь на 2-3 недели раньше обычных сроков. Как удавалось вызвать искусственное таяние ледников?
Б) Древние греки ночью измеряли время по свечам – свеча определенного размера горела определенное время. Были и специальные большие свечи, которые с помощью небольшого усовершенствования сами громко напоминали о том, что отмерянный отрезок времени миновал. Каким образом свечи оповещали хозяев об этом?
Каким образом свечи оповещали хозяев об этом?
2. Решение задач по карточкам (слайды 11 – 14)
Читают и анализируют условие творческих задач в группе. Отвечают на вопросы, дополняют ответы друг друга. Записывают решения задач на доске и в тетради.
Рефлексия и подведение итогов
Задает вопросы учащимся:1) Все ли было понятно на уроке? Что вызвало трудности? 2) Что больше всего запомнилось? 3) Что нового вы сегодня узнали? 4) Где полученные знания пригодятся нам в жизни? Подводит итоги урока, выставляет отметки в журнал.
Отвечают на вопросы. Анализируют собственные достижения и затруднения. Оценивают результаты своей деятельности на уроке.
д/з
Задает домашнее задание (§15, выуч определения, консп.).
Записывают домашнее задание. Получают консультации.
Теплота плавления — Химия LibreTexts
Твердые тела можно нагреть до такой степени, что молекулы, удерживающие свои связи вместе, разорвутся и образуют жидкость. Самый распространенный пример — превращение твердого льда в жидкую воду. Этот процесс более известен как плавление или теплоты плавления , и в результате молекулы внутри вещества становятся менее организованными. Когда вещество переходит из твердого состояния в жидкое, изменение энтальпии (\ (ΔH \)) является положительным. Однако, если вещество переходит из жидкого состояния в твердое, изменение энтальпии (ΔH) отрицательное.Этот процесс широко известен как замораживание , и в результате молекулы внутри вещества становятся более упорядоченными.
Введение
Определить теплоту плавления довольно просто. Когда твердое тело плавится или замерзает, температура остается постоянной до полного завершения фазового перехода. Визуализировать этот процесс можно, изучив график нагрева / охлаждения. Нарисовав эту диаграмму перед проведением анализа теплоты плавления, можно легко наметить необходимые шаги для завершения анализа.Уравнение для определения энтальпии плавления (\ (ΔH \)) приведено ниже.
\ [\ Delta {H} = n \, \ Delta {H_ {fus}} \]
с
- \ (n \) = количество молей
- \ (\ Delta {H_ {fus}} \) молярная теплота вещества
Пример \ (\ PageIndex {1} \)
Рассчитайте тепло, когда 36,0 граммов воды при 113 ° C охлаждают до 0 ° C.
Дано
- Теплота плавления = 6,0 кДж / моль
- Теплота испарения = 40.7 кДж / моль
- C sp (s) = 2,10 Дж / г · K
- C sp (л) = 4,18 Дж / г · K
- C sp (г) = 1,97 Дж / г · K
Ответ
\ [q = — 110,6 \, кДж \]
Сублимация
В некоторых случаях твердое тело будет обходить жидкое состояние и переходить в газообразное состояние. Это прямое превращение твердого вещества в газ называется сублимацией. Противоположная реакция, когда газ непосредственно превращается в твердое тело, называется осаждением.Следовательно, эти два процесса можно резюмировать в следующем уравнении:
\ [\ Delta {H_ {sub}} = \ Delta {H_ {fus}} + \ Delta {H_ {vap}} \]
с
- \ (ΔH_ {sub} — изменение тепла при сублимации
- \ (ΔH_ {fus} \) — изменение тепла при плавлении.
- \ (ΔH_ {vap} \) — изменение тепла при испарении.
Приложения
Теплота процесса плавления проявляется в бесчисленных приложениях и проявляется в создании многих обычных предметов домашнего обихода.Как упоминалось в первом абзаце, наиболее распространенное применение теплоты плавления — это плавление льда в воде. Подавляющее большинство примеров, когда тепло плавления является обычным явлением, можно увидеть в обрабатывающей промышленности. Следующие ниже примеры использовались сотни лет и до сих пор совершенствуются. Процессы изготовления монет, выдувания стекла, ковки металлических предметов и преобразования выдувного пластика в бытовые изделия требуют тепла плавления, чтобы стать конечным продуктом.Сдача в кошельке, стеклянная ваза на каминной полке и пластиковая бутылка из-под газировки из торгового автомата — все это прошло через производственный процесс плавления.
При изготовлении монет твердый цинк и медь (металлы в американских пенни) помещают в литейную печь и нагревают теплом процесса плавления до тех пор, пока они не достигнут жидкой фазы. Попав в жидкую фазу, расплавленный цинк и медь выливают в форму и отливают в длинные бруски. В процессе литья расплавленный металл переходит из жидкой фазы в твердую, превращаясь в твердый стержень.Длинные слитки сплющиваются тяжелой техникой и штампуются на тысячи монет. Без тепла процесса слияния денежная система не существовала бы в Соединенных Штатах.
Список литературы
- Хейдон, Джули. Изготовление монет и купюр . Смарт Apple Media, 2006.
- Хилл, Джон Уильям. Общая химия: комплексный подход . Прентис Холл, 1933-2002 гг.
- Петруччи, Ральф Х. и др. Общая химия: принципы и современные приложения .9 изд. Река Аппер Сэдл, Нью-Джерси 2007.
- Хагенбо, Барбара. Монетный двор считает изменения в изменении; Рост цен на металлы может привести к появлению новой монеты . стр. В.1. Маклин, Вирджиния: USA Today, 9 августа 2007 г.
- Хошманеш, Х. Численное моделирование и экспериментальный анализ промышленной стекловаренной печи . Vol. 28 Выпуск 5/6, с450-459. Апрель 2008.
Авторы и авторство
Теплота плавления и теплота испарения: определения и уравнения — Видео и стенограмма урока
Теплота плавления и уравнение
Сегодня суббота, и вы с нетерпением ждете веселого и захватывающего вечера с друзьями.Какие дикие и сумасшедшие события вы запланировали? Может, пицца? Фильм? Некоторое корневое пиво плавает? Нет, нет и нет.
Что ж, что это за «веселый и захватывающий» вечер? Вы и ваши друзья собираетесь устроить химическую вечеринку. Итак, возьмите пробирки, очки и лабораторный халат и приготовьтесь к дикой и сумасшедшей ночи, наполненной химией.
Вечер начнется с того, что вы соберете несколько кубиков льда и положите их на кухонный стол. Конечно, наблюдение за таянием льда не кажется особенно захватывающим, но на самом деле с молекулами внутри этого кубика льда происходит много всего.
Прежде чем мы поговорим о молекулах, давайте пробежимся по словарю.
- Плавление или плавление — это когда твердое вещество превращается в жидкость.
- Замерзание или затвердевание — это когда жидкость превращается в твердое тело.
Я уверен, что вы слышали слова «плавление» и «замерзание» раньше, но синтез и затвердевание могут быть для вас в новинку.
Хорошо, вернемся к кубику льда. Тепловая энергия стола заставляет молекулы в кубике льда двигаться быстрее.Они также отдаляются все дальше и дальше друг от друга.
Чтобы преобразовать твердое тело в жидкость, требуется определенное количество энергии. Это называется теплотой плавления . Помните, что синтез означает плавление, поэтому вы можете увидеть, откуда оно получило свое название. В любом случае, теплота плавления — это количество энергии, необходимое для превращения вещества из твердого в жидкое при его температуре плавления.
Стоит отметить, что для того, чтобы что-то растаять, требуется энергия, но энергия выделяется, когда что-то замерзает.Также стоит отметить, что существует теплота затвердевания, которая представляет собой энергию, выделяемую, когда жидкость превращается в твердое тело в точке замерзания. Помните, что затвердевание означает превращение жидкости в твердое тело, поэтому вы можете увидеть, как теплота затвердевания получила свое название. Но пока что в центре внимания вашей химической вечеринки — жар плавления и тающий кубик льда, так что вернемся к этому!
Теплота плавления может быть измерена в джоулях на грамм, или Дж / г, , или калориях на грамм, или кал / г, .Для простоты в этом уроке мы просто будем использовать cal / g.
И джоули, и калории являются единицей измерения энергии. Возможно, вы знакомы с калориями (с большой буквы), которые также известны как килокалории или калории, которые вы видите на этикетке продукта. Просто чтобы вы могли понять, что такое калория, в одной пищевой калории (или килокалории) содержится 1000 калорий.
Итак, ваш кубик льда растаял, и теперь у вас на кухонном столе лужа воды. Возможно, вы думаете, что ваша химическая вечеринка подходит к концу, но не волнуйтесь! Скоро все станет еще интереснее.Есть формула, которая включает в себя тепло плавления, которое вы можете использовать!
А вот оно:
теплота плавления = тепловая энергия / масса
Где:
- теплота плавления H индекс f
- масса м
- , а тепловая энергия — q
Так как это вечеринка по химии, я думаю, нам стоит попробовать эту формулу! Давайте попробуем выяснить, сколько тепловой энергии потребовалось, чтобы превратить кубик льда в лужу с жидкостью при температуре его плавления! Другими словами, мы воспользуемся формулой, чтобы найти q .
- Нам нужно определить массу кубика льда в граммах. Не волнуйтесь, если у вас нет весов. Я помогу тебе. Масса вашего кубика льда составляет 4,0 грамма, поэтому м = 4,0 грамма.
- Вычислить теплоту плавления воды. Таблицы доступны в Интернете и в некоторых учебниках химии. Каждое вещество имеет свою теплоту плавления, а теплота плавления воды составляет 79,7 кал / г.
- Подставьте их в уравнение и решите: q .
Умножьте на 4,0 г с обеих сторон, чтобы получить q отдельно.
Ваш ответ — 318,8 калорий. Итак, для превращения 4,0 г кубика льда в жидкость требуется 318,8 калорий, что составляет менее 1 пищевой калории! Помните, что в 1 калории с большой буквой C содержится 1000 калорий с небольшой буквой «C», с которыми мы знакомы по этикеткам продуктов питания.
единиц теплоты плавления — Calculator.org
Что такое теплота плавления?
Также известная как стандартная энтальпия плавления или удельная теплота плавления, теплота плавления — это изменение тепловой энергии (ΔH), необходимой веществу для изменения своего состояния с твердого на жидкое или наоборот.Все это происходит при температуре плавления вещества. Энергия, необходимая для получения теплоты плавления, — это энергия в дополнение к энергии, необходимой для доведения вещества до точки его плавления или замерзания. Другими словами, если бы мы нагревали твердый кусок льда с помощью термометра внутри до точки плавления, мы бы не наблюдали никаких изменений температуры по мере таяния ледяного блока. Однако после того, как блок полностью расплавится, и мы продолжаем добавлять тепло к воде, мы продолжаем видеть повышение температуры на нашем термометре.
Единицей измерения теплоты плавления в системе СИ является килоджоуль на моль. Каждый моль льда в точке плавления льда требует дополнительного количества килоджоулей тепла, чтобы изменить его состояние на жидкость или наоборот.
Причина, по которой твердые тела требуют этого дополнительного изменения энергии между состояниями, заключается в том, что существует значительная разница в общем порядке между твердым и жидким состояниями. В воде лед имеет кристаллическую структуру, которую невозможно получить при наличии большого количества энергии.Подумайте об этом так. Если бы мы охладили жидкую воду до 0 градусов Цельсия (точка плавления воды), это было бы похоже на замедление отдельных молекул воды настолько, чтобы они могли начать формировать кристаллы льда. Однако, если мы не будем замедлять молекулы воды и дальше (как при понижении температуры), молекулы воды все равно будут двигаться слишком быстро, чтобы кристаллы льда оставались на месте. То же самое и в обратном направлении. Нам нужно добавить дополнительное тепло, чтобы перейти от достаточно упорядоченного состояния твердого тела к более неупорядоченному жидкому состоянию.
Многие вещества имеют разные значения теплоты плавления. Вода из-за своей полярности имеет одну из самых высоких температур плавления — 333,55 Дж / грамм. Метан имеет одно из более низких значений 58,41, потому что это не диполь. Другими словами, химические связи в метане симметричны, то есть нет областей, которые имели бы отрицательный или положительный заряд. Поскольку метан не прилипает к себе (прямо говоря), ему требуется меньше энергии, чтобы сменить фазу.
Мы также можем использовать теплоту плавления, чтобы предсказать, насколько растворимы определенные твердые вещества в жидкостях. Предполагая, что мы работаем с идеальным раствором, растворимость мольной доли (x2) при насыщении будет равна:
Растворимость x2 = ln (x2) = (-ΔH fusion / R). ((1 / T) — (1 / T fus ))
где T — температура раствора, T fus — температура плавления, ΔH fusion — теплота плавления вещества, а R — газовая постоянная.Вышеприведенное уравнение не дает точного предсказания этих значений и обычно имеет отклонение около 11% от реальных значений.
Добавьте эту страницу в закладки в своем браузере, используя Ctrl и d или используя одну из следующих служб: (открывается в новом окне)
Теплота плавления — Теплота испарения — Концепция
Итак, мы собираемся поговорить о тепле плавления и теплоте испарения. Противоположность теплоты плавления — теплота затвердевания, а противоположность теплоты испарения — теплота конденсации.Но что все это значит? Ну, это количество энергии, необходимое для изменения или изменения фазы 1 моля вещества, так что это изменит фазу, как, например, если мы говорим о сплавлении чего-то, и мы переходим от твердого тела к жидкость. Здесь мы меняем фазу с твердой на жидкую и количество энергии, необходимое для изменения фазы 1 моля вещества. И противоположность этому — затвердевание, которое переходит от жидкости к твердому, на самом деле они потребляют одинаковое количество энергии, так что один является эндотермическим, а другой экзотермическим, но такое же количество энергии.Таким образом, теплота плавления — это эндотермический процесс, для которого требуется тепло, поэтому дельта h положительна. Тепловое затвердевание — это экзотермический переход от жидкости к твердому телу с выделением тепла, поэтому дельта h имеет отрицательную величину, но у них те же числа.
То же самое и с тепловым испарением: количество энергии, необходимое для превращения 1 моля вещества из жидкости в газ, является теплотой испарения, а наоборот — конденсация, переходящая из газа в жидкость. Таким образом, мы обозначаем, что с дельтой h vap и дельта конденсации, дельта h vap является эндотермической, будучи положительной дельта h, а конденсация дельта h на самом деле отрицательна, что означает экзотермичность, но опять же числа идентичны друг другу.Итак, если говорить о воде, вода будет нашим основным веществом, потому что это обычное вещество. Фактически, требуется 40,7 килоджоулей, чтобы превратить 1 моль воды из жидкости в газ, или выделяется 40,7 килограммов, чтобы превратить 1 моль воды из газа в жидкость. А дельта-предохранитель воды на самом деле намного, намного, намного меньше. Чтобы превратить его из твердого в жидкое, требуется гораздо меньше энергии, чтобы преодолеть любые молекулярные силы, которые изменяют его из твердого состояния в жидкое, или при переходе от него к твердому телу выделяется гораздо меньше энергии.Таким образом, требуется много энергии, чтобы перейти в газ, и не так много энергии, чтобы перейти в жидкость.
Давайте посмотрим на диаграмму фазового перехода и посмотрим, как это отразится на диаграмме фазового перехода. Итак, мы знаем, что наклон твердого вещества, жидкости и газа зависит от удельной теплоемкости, и мы знаем, что твердый и газовый фазы имеют более крутой наклон, потому что их удельная теплоемкость ниже. Но давайте посмотрим на линии, когда говорим об изменении фаз, переходящих от твердого к жидкому, наша линия на самом деле довольно мала, и не требуется много энергии, чтобы пройти это фазовое изменение.Но обратите внимание, что для фазового перехода жидкости в газ требуется много энергии: 40,7 против 6,01. Мы просто имеем дело с межмолекулярными силами и с тем, как они распадаются и забирают гораздо больше энергии, превращаясь в газ и немного более хаотично. Итак, давайте о том, как мы можем использовать эту диаграмму, когда говорим о том, сколько энергии требуется для прохождения различных фаз. Итак, давайте посмотрим на эту проблему, сколько энергии потребуется, чтобы нагреть 10 граммов льда с минус 15 градусов Цельсия до плюс 15 градусов Цельсия.
Я собираюсь использовать синий, потому что мы уже использовали зеленый. Итак, в основном мы знаем, что это именно здесь 0 градусов Цельсия, потому что когда вода затвердевает или тает [IB], это 100 градусов Цельсия, просто чтобы немного лучше обозначить наш график. Итак, мы переходим от чего-то вроде воды, которая здесь внизу, к воде, которая находится примерно здесь. Таким образом, мы не только меняем фазы, мы фактически поднимаем вещество, меняя фазу, а затем еще немного нагревая вещество.Итак, у нас происходит 3 процесса. Итак, когда мы нагреваем вещество, идущее вверх по склону, нам приходится иметь дело с удельной теплотой q, равной mc delta t. Итак, мы имеем дело с 10 граммами воды, поэтому я собираюсь отметить это здесь q — количество энергии, необходимое для нагрева 10 граммов воды, в данном случае наша удельная теплоемкость лед, потому что мы идем от отрицательных 15, составляет 2,03 джоуля на грамм градусов Цельсия. И наше изменение температуры — это не полное отрицательное 15 на положительное 15, которое здесь будет, потому что для перехода отсюда требуется что-то другое, и это также имеет другую удельную теплоемкость, поэтому мы должны провести совершенно другие вычисления.На самом деле он меняется с отрицательных 15 на 0, так что на самом деле он меняется на 15 градусов.
Хорошо, я умножаю все это вместе и получаю 304,5 джоуля, хорошо, просто чтобы повысить температуру этого льда. Теперь я прохожу фазовый переход, так что это q1, я прохожу через фазовый переход, и что q равно, мы знаем, что наша дельта h выражается в килоджоулях на моль. Поэтому я должен изменить эти 10 граммов на моли, потому что я должен убедиться, что мои единицы правильно выровнены. Итак, 10 граммов воды, мы знаем, что молярная масса воды составляет 18 граммов, мы смотрим на нашу периодическую таблицу, это 1 мол.Итак, у нас есть 0,556 моль воды, хорошо, поэтому я собираюсь умножить это число на нашу теплоту плавления, и наша теплота плавления равна 6,01, поэтому мы знаем, что для плавления 1 моля требуется 6,01 моль, но у меня только 0,556 моль, поэтому я хочу Чтобы выяснить, сколько нужно для этого, чтобы расплавить килоджоуль на моль, я умножаю этих ребят вместе, и я получаю 3,34 килоджоуля.
Я хочу изменить это на джоули, потому что в конце я собираюсь сложить все эти вещи вместе, чтобы получить общее количество энергии. Итак, я собираюсь изменить это на джоули, что составит 3340 джоулей.Хорошо, а затем последний, от которого я хочу перейти, я хочу нагреть эту воду, теперь это вода. Я выполнил фазовый переход, теперь мы переходим от 0 градусов Цельсия до 15, поэтому я собираюсь сделать q еще раз. q равно mc delta t масса равна 10, c в этом случае составляет 4,184 джоуля на грамм градусов Цельсия, а изменение температуры мы идем от 0 до 15, так что снова 15 градусов по Цельсию, умножьте этих ребят вместе, я получу 622,6 джоулей . Итак, это мои шаги, это мои индивидуальные количества энергии для каждого шага, но мне нужно общее количество энергии.Итак, я собираюсь сложить всех этих парней до 3,05 + 3,340 + 622,6, и в итоге я получу 4272,1 джоулей, и именно столько энергии требуется, чтобы перейти от отрицательных 15 к положительным 15. Итак, просто чтобы убедиться, что вы понимаете, это количество энергии, необходимое для перехода из твердого состояния в жидкое, это количество энергии, необходимое для перехода из жидкого состояния в газообразное, и если вы меняете температуру, изменяете эту фазу и снова повышаете температуру, они на самом деле разные вычисления, которые вам придется сложить, это на самом деле довольно важная концепция c, и это не то же самое.Вы не можете перейти от отрицательных 15 прямо к положительным 15 за один мах, вам придется разбить его. Так что эта диаграмма фазового перехода действительно очень полезна в подобных проблемах.
Формула скрытой теплоты плавления
Мы часто слышим с детства, что кусок льда тает, давая охлажденную воду; мы также говорим о превращении воды в пар, который используется для вращения турбин и выработки электроэнергии.
Однако мы сталкиваемся с этим явлением, когда изучаем науку.В этой статье обсуждается формула скрытой теплоты плавления.
Итак, скрытая теплота плавления — это количество внутренней или скрытой теплоты, которую получает твердое тело (плавление) для перехода в жидкое состояние или из жидкого состояния в газообразное (кипение).
(Изображение будет добавлено в ближайшее время)
Скрытая теплота плавления Значение
Скрытая теплота означает энергию, необходимую для изменения состояния объекта. Слияние означает сочетание. В целом, скрытая теплота плавления означает добавленную энергию или тепло, из-за которых объект переходит в другое состояние.
Здесь речь идет о преобразовании твердого вещества в жидкость, которая плавится, а жидкость в газообразное состояние, что называется процессом кипения.
Тепло и температура
В главе, посвященной термодинамике, мы представляем параметр тепла английской печатной буквой «Q». Мы часто путаем слово «тепло» с «температурой»; однако эти два термина имеют огромные различия.
Тепло — это эффект объекта, создающего вибрацию частиц внутри объекта. Мы также рассматриваем тепло как увеличение энтропии частиц или их кинетической энергии под действием повышения температуры.
Температура может быть как высокой, так и низкой, в то время как тепло постоянно растет.
Теперь, когда тепло скрыто, например, у вас есть внутреннее тепло, и когда вы спите, ваше тело достигает состояния свободной энергии Гиббса, потому что в это время ваше тело теряет тепло и его температура падает.
Формула скрытой теплоты плавления
Итак, формула скрытой теплоты плавления определяется следующим образом:
△ Q = mL, что является необходимым уравнением для скрытой теплоты плавления
Здесь
△ Q = изменение в тепловой энергии в джоулях
m = масса в кг
L = удельная скрытая теплота плавления
Итак, знаете ли вы, какова удельная скрытая теплота плавления?
Удельная скрытая теплота плавления
Мы определяем удельную скрытую теплоту как энергию, необходимую для преобразования или изменения состояния 1 кг вещества.
Однако удельная скрытая теплота плавления — это энергия, необходимая для плавления килограмма вещества.
Есть еще один термин, называемый удельной скрытой теплотой парообразования. Мы определяем удельную скрытую теплоту парообразования как энергию, необходимую для кипячения или испарения килограмма вещества.
Однако формула для удельной скрытой теплоты плавления составляет
Удельная скрытая теплота плавления Формула
Формула для удельной скрытой теплоты плавления определяется по формуле:
Q = мл, что является требуемой удельной скрытой теплотой плавления. уравнение.
Уравнение удельной скрытой теплоты плавления
Мы определяем уравнение удельной скрытой теплоты плавления следующим образом:
Если «m» кг твердого вещества переходит в жидкое состояние при постоянной температуре, которая является его точкой плавления, теплота, поглощаемая веществом, или скрытая теплота плавления определяется по формуле:
Q = m L
Где
L = удельная скрытая теплота плавления вещества, которая измеряется в Джоулях на килограмм или Дж / кг.
Заключение
Материя переходит из одного состояния в другое из-за скрытого тепла, которое является скрытым. Если добавить энергию для увеличения на 1 кг, это будет удельная скрытая теплота плавления. Оба измеряются в Дж / кг.
Что происходит, когда происходит фазовый переход (, например, жидкость в твердое тело, твердое тело в жидкость, жидкость в газ)? Например, очевидно, что для плавления кубика льда требуется тепло, но если вы измеряете температуру, вы увидите, что она остается на уровне 0 ºC на протяжении всего процесса. Ученые справляются с этим, определяя новую константу, называемую теплотой плавления : теплота плавления = q / m Теплота плавления измеряется в Дж / г. Разные вещества имеют разную температуру плавления. Например, теплота плавления воды при 0 ºC составляет 333 Дж / г. Сколько тепла нужно, чтобы растопить 50,0 г кубиков льда при 0 ºC? Шаг 1: Определите систему и окружение. Напишите свой ответ в поле ниже, затем нажмите кнопку проверки. | |||
Теперь сравните свой ответ с приведенным ниже. Пожалуйста, введите свой ответ в поле слева. | |||
Поскольку лед меняется больше всего, это лучший выбор для системы. | |||
Шаг 2: Определите и назначьте знаки для всех видов энергии и работы, которые входят в систему или покидают ее.Напишите свой ответ в поле ниже, затем нажмите кнопку проверки. | |||
Теперь сравните свой ответ с приведенным ниже. Пожалуйста, введите свой ответ в поле слева. | |||
Энергия поступает в систему в виде тепла. Имеет положительный знак. Никакая другая энергия или работа не входит в систему или покидает ее. | |||
Шаг 3: Предскажите, какие единицы должны быть в вашем ответе.В вопросе требуется количество тепла, поэтому ответ должен быть количеством энергии в джоулях. Шаг 4. Предскажите примерный размер своего ответа. Теплота плавления воды составляет 333 Дж / г при 0 ºC. Следовательно, ответ должен быть примерно 300 x 50 = 15000 Дж. Какова масса нагреваемого вещества? Введите массу в поле ниже и нажмите кнопку проверки. | |||
Теперь сравните свой ответ с приведенным ниже. Пожалуйста, введите свой ответ в поле слева. | |||
Масса указана как 50,0 г. | |||
Сколько тепла нужно, чтобы растопить кубики льда? Подставьте значения массы и теплоты плавления в приведенное выше уравнение. Введите свой ответ в поле ниже и нажмите кнопку «Обзор ответов», когда закончите. | |||
Верный! Для плавления кубиков льда требуется 16 700 Дж тепла. Не забудьте указать единицы измерения в своем ответе. Ваш ответ численно правильный, но в нем неправильное количество значащих цифр. Попробуй еще раз. Для плавления кубиков льда требуется 16 700 Дж тепла. Это неверно. Пожалуйста, попробуйте еще раз. | |||
Учебное пособие по физике
На предыдущей странице мы узнали, что тепло делает с объектом, когда оно накапливается или выделяется.Прирост или потеря тепла приводят к изменениям температуры, изменению состояния или выполнения работы. Тепло — это передача энергии. Когда объект приобретается или теряется, внутри этого объекта будут происходить соответствующие изменения энергии. Изменение температуры связано с изменением средней кинетической энергии частиц внутри объекта. Изменение состояния связано с изменением внутренней потенциальной энергии, которой обладает объект. А когда работа сделана, происходит полная передача энергии объекту, над которым она выполняется.В этой части Урока 2 мы исследуем вопрос Как измерить количество тепла, полученного или выделенного объектом?
Удельная теплоемкость
Предположим, что несколько объектов, состоящих из разных материалов, нагреваются одинаково. Будут ли предметы нагреваться одинаково? Ответ: скорее всего, нет. Разные материалы будут нагреваться с разной скоростью, потому что каждый материал имеет свою удельную теплоемкость.Удельная теплоемкость относится к количеству тепла, необходимому для изменения температуры единицы массы (скажем, грамма или килограмма) на 1 ° C. В учебниках часто указывается удельная теплоемкость различных материалов. Стандартные метрические единицы — Джоуль / килограмм / Кельвин (Дж / кг / К). Чаще используются единицы измерения — Дж / г / ° C. Используйте виджет ниже, чтобы просмотреть удельную теплоемкость различных материалов. Просто введите название вещества (алюминий, железо, медь, вода, метанол, дерево и т. Д.).) и нажмите кнопку «Отправить»; результаты будут отображены в отдельном окне.
Удельная теплоемкость твердого алюминия (0,904 Дж / г / ° C) отличается от удельной теплоемкости твердого железа (0,449 Дж / г / ° C). Это означает, что для повышения температуры данной массы алюминия на 1 ° C потребуется больше тепла, чем для повышения температуры той же массы железа на 1 ° C.Фактически, для повышения температуры образца алюминия на заданное количество потребуется примерно вдвое больше тепла по сравнению с тем же изменением температуры того же количества железа. Это связано с тем, что удельная теплоемкость алюминия почти вдвое больше, чем у железа.
Теплоемкость указана из расчета на грамм или на килограмм . Иногда значение указывается на основе на моль , и в этом случае оно называется молярной теплоемкостью. Тот факт, что они указаны из расчета на количество , указывает на то, что количество тепла, необходимое для повышения температуры вещества, зависит от того, сколько вещества в нем есть.Эту истину, несомненно, знает всякий, кто варил на плите кастрюлю с водой. Вода закипает при температуре 100 ° C на уровне моря и при слегка пониженной температуре на возвышенностях. Чтобы довести кастрюлю с водой до кипения, ее сначала нужно поднять до 100 ° C. Это изменение температуры достигается за счет поглощения тепла горелкой печи. Быстро замечаешь, что для того, чтобы довести до кипения полную кастрюлю с водой, требуется значительно больше времени, чем для того, чтобы довести до кипения наполовину полную. Это связано с тем, что полная кастрюля с водой должна поглощать больше тепла, чтобы вызвать такое же изменение температуры.Фактически, требуется вдвое больше тепла, чтобы вызвать такое же изменение температуры в двойной массе воды.
Удельная теплоемкость также указана на основе на K или на ° C . Тот факт, что удельная теплоемкость указана из расчета на градус , указывает на то, что количество тепла, необходимое для повышения данной массы вещества до определенной температуры, зависит от изменения температуры, необходимого для достижения этой конечной температуры.Другими словами, важна не конечная температура, а общее изменение температуры. Для изменения температуры воды с 20 ° C до 100 ° C (изменение на 80 ° C) требуется больше тепла, чем для повышения температуры того же количества воды с 60 ° C до 100 ° C (изменение на 40 ° C). ° С). Фактически, для изменения температуры данной массы воды на 80 ° C требуется вдвое больше тепла по сравнению с изменением на 40 ° C. Человек, который хочет быстрее довести воду до кипения на плите, должен начать с теплой водопроводной воды вместо холодной.
Это обсуждение удельной теплоемкости заслуживает одного заключительного комментария. Термин «удельная теплоемкость» в некоторой степени неправильный , неправильное обозначение . Этот термин подразумевает, что вещества могут обладать способностью удерживать вещь , называемую теплотой. Как уже говорилось ранее, тепло — это не то, что содержится в объекте. Тепло — это то, что передается к объекту или от него. Объекты содержат энергию в самых разных формах. Когда эта энергия передается другим объектам с разной температурой, мы называем переданную энергию тепла или тепловой энергии .Хотя это вряд ли приживется, более подходящим термином будет удельная энергоемкость.
Связь количества тепла с изменением температуры
Удельная теплоемкость позволяет математически связать количество тепловой энергии, полученной (или потерянной) образцом любого вещества, с массой образца и ее результирующим изменением температуры. Связь между этими четырьмя величинами часто выражается следующим уравнением.
Q = m • C • ΔT
где Q — количество тепла, переданного объекту или от него, m — масса объекта, C — удельная теплоемкость материала, из которого состоит объект, а ΔT — результирующее изменение температуры объекта. Как и во всех других ситуациях в науке, значение дельта (∆) для любой величины вычисляется путем вычитания начального значения количества из окончательного значения количества. В этом случае ΔT равно T конечный — T начальный .При использовании приведенного выше уравнения значение Q может быть положительным или отрицательным. Как всегда, положительный и отрицательный результат расчета имеет физическое значение. Положительное значение Q указывает на то, что объект получил тепловую энергию от окружающей среды; это соответствовало бы повышению температуры и положительному значению ΔT. Отрицательное значение Q указывает на то, что объект выделяет тепловую энергию в окружающую среду; это соответствовало бы снижению температуры и отрицательному значению ΔT.
Знание любых трех из этих четырех величин позволяет человеку вычислить четвертое количество. Обычная задача на многих уроках физики включает решение проблем, связанных с отношениями между этими четырьмя величинами. В качестве примеров рассмотрим две проблемы ниже. Решение каждой проблемы разработано для вас. Дополнительную практику можно найти в разделе «Проверьте свое понимание» внизу страницы.
Пример проблемы 1 |
Как и любая проблема в физике, решение начинается с определения известных величин и соотнесения их с символами, используемыми в соответствующем уравнении. В этой задаче мы знаем следующее:
м = 450 г
С = 4,18 Дж / г / ° C
Т начальная = 15 ° С
T окончательная = 85 ° C
Мы хотим определить значение Q — количество тепла.Для этого мы использовали бы уравнение Q = m • C • ΔT. Буквы m и C известны; ΔT можно определить по начальной и конечной температуре.
T = T окончательный — T начальный = 85 ° C — 15 ° C = 70 ° C
Зная три из четырех величин соответствующего уравнения, мы можем подставить их и решить для Q.
Q = m • C • ΔT = (450 г) • (4,18 Дж / г / ° C) • (70 ° C)
Q = 131670 Дж
Q = 1.3×10 5 J = 130 кДж (округлено до двух значащих цифр)
Пример задачи 2 |
По сравнению с предыдущей проблемой это гораздо более сложная проблема. По сути, эта проблема похожа на две проблемы в одной. В основе стратегии решения проблем лежит признание того, что количество тепла, теряемого водой (Q вода ), равно количеству тепла, полученного металлом (Q металл ). Поскольку значения m, C и ΔT воды известны, можно рассчитать Q water .Это значение воды Q равно значению металла Q . Как только значение металла Q известно, его можно использовать со значением m и ΔT металла для расчета металла Q . Использование этой стратегии приводит к следующему решению:
Часть 1: Определение потерь тепла водой
Дано:
м = 50,0 г
С = 4,18 Дж / г / ° C
Т начальная = 88,6 ° С
Т финал = 87.1 ° С
ΔT = -1,5 ° C (T конечная — T начальная )
Решить для Q воды :
Q вода = m • C • ΔT = (50,0 г) • (4,18 Дж / г / ° C) • (-1,5 ° C)
Q вода = -313,5 Дж (без заземления)
(Знак — означает, что вода теряет тепло)
Часть 2: Определите стоимость металла C
Дано:
Q металл = 313.5 Дж (используйте знак +, так как металл нагревается)
m = 12,9 г
Т начальная = 26,5 ° С
T окончательная = 87,1 ° C
ΔT = (T конечный — T начальный )
Решить для C металл :
Переставьте Q из металла = m из металла • C из металла • ΔT из металла , чтобы получить C из металла = Q из металла / (м из металла • ΔT из металла )
C металл = Q металл / (м металл • ΔT металл ) = (313.5 Дж) / [(12,9 г) • (60,6 ° C)]
C металл = 0,40103 Дж / г / ° C
C металл = 0,40 Дж / г / ° C (округлено до двух значащих цифр)
Тепло и изменения состояния
Приведенное выше обсуждение и соответствующее уравнение (Q = m • C • ∆T) связывает тепло, полученное или потерянное объектом, с результирующими изменениями температуры этого объекта. Как мы узнали, иногда тепло накапливается или теряется, но температура не меняется.Это тот случай, когда вещество претерпевает изменение состояния. Итак, теперь мы должны исследовать математику, связанную с изменениями состояния и количества тепла.
Чтобы начать обсуждение, давайте рассмотрим различные изменения состояния, которые можно наблюдать для образца вещества. В таблице ниже перечислено несколько изменений состояния и указано имя, обычно связанное с каждым процессом.
Процесс | Изменение состояния |
Плавка | От твердого до жидкого |
Замораживание | От жидкости к твердому веществу |
Испарение | От жидкости к газу |
Конденсация | Газ — жидкость |
Сублимация | Твердое тело в газ |
Депонирование | Газ — твердое вещество |
В случае плавления, кипения и сублимации к образцу вещества должна быть добавлена энергия, чтобы вызвать изменение состояния.Такие изменения состояния называют эндотермическими. Замораживание, конденсация и осаждение экзотермичны; энергия высвобождается образцом материи, когда происходят эти изменения состояния. Таким образом, можно заметить, что образец льда (твердая вода) тает, когда его помещают на горелку или рядом с ней. Тепло передается от горелки к образцу льда; энергия приобретается льдом, вызывая изменение состояния. Но сколько энергии потребуется, чтобы вызвать такое изменение состояния? Есть ли математическая формула, которая могла бы помочь в определении ответа на этот вопрос? Безусловно, есть.
Количество энергии, необходимое для изменения состояния образца материи, зависит от трех вещей. Это зависит от того, что такое субстанция, от того, сколько субстанции претерпевает изменение состояния, и от того, какое изменение состояния происходит. Например, для плавления льда (твердая вода) требуется другое количество энергии, чем для плавления железа. И для таяния льда (твердая вода) требуется другое количество энергии, чем для испарения того же количества жидкой воды. И, наконец, для плавления 10 требуется другое количество энергии.0 граммов льда по сравнению с таянием 100,0 граммов льда. Вещество, процесс и количество вещества — это три переменные, которые влияют на количество энергии, необходимое для того, чтобы вызвать конкретное изменение состояния. Используйте виджет ниже, чтобы исследовать влияние вещества и процесса на изменение энергии. (Обратите внимание, что теплота плавления — это изменение энергии, связанное с изменением состояния твердое-жидкое.)
Значения удельной теплоты плавления и удельной теплоты испарения указаны из расчета на количество .Например, удельная теплота плавления воды составляет 333 Дж / грамм. Чтобы растопить 1,0 грамм льда, требуется 333 Дж энергии. Чтобы растопить 10 граммов льда, требуется в 10 раз больше энергии — 3330 Дж. Такое рассуждение приводит к следующим формулам, связывающим количество тепла с массой вещества и теплотой плавления и испарения.
Для плавления и замораживания: Q = m • ΔH сварка
Для испарения и конденсации: Q = m • ΔH испарение
, где Q представляет количество энергии, полученной или высвобожденной во время процесса, m представляет собой массу образца, ΔH плавления представляет собой удельную теплоту плавления (в пересчете на грамм) и ΔH испарения представляет собой удельную теплоемкость плавления. испарение (из расчета на грамм).Подобно обсуждению Q = m • C • ΔT, значения Q могут быть как положительными, так и отрицательными. Значения Q положительны для процесса плавления и испарения; это согласуется с тем фактом, что образец вещества должен набирать энергию, чтобы плавиться или испаряться. Значения Q отрицательны для процесса замораживания и конденсации; это согласуется с тем фактом, что образец вещества должен терять энергию, чтобы замерзнуть или конденсироваться.
В качестве иллюстрации того, как можно использовать эти уравнения, рассмотрим следующие два примера задач.
Пример задачи 3 |
Уравнение, связывающее массу (48,2 грамма), теплоту плавления (333 Дж / г) и количество энергии (Q): Q = m • ΔH fusion .Подстановка известных значений в уравнение приводит к ответу.
Q = м • ΔH плавление = (48,2 г) • (333 Дж / г)
Q = 16050,6 Дж
Q = 1,61 x 10 4 Дж = 16,1 кДж (округлено до трех значащих цифр)
Пример Задачи 3 включает в себя довольно простое вычисление типа «подключай и исправляй». Теперь мы попробуем Пример задачи 4, который потребует более глубокого анализа.
Пример задачи 4 |
В этой задаче лед тает, а жидкая вода остывает. Энергия передается от жидкости к твердому телу. Чтобы растопить твердый лед, на каждый грамм льда необходимо передать 333 Дж энергии. Эта передача энергии от жидкой воды ко льду охлаждает жидкость.Но жидкость может охладиться только до 0 ° C — точки замерзания воды. При этой температуре жидкость начнет затвердевать (замерзнуть), а лед полностью не растает.
Мы знаем следующее о льду и жидкой воде:
Информация о льду:
м = 50,0 г
ΔH плавление = 333 Дж / г
Информация о жидкой воде:
С = 4.18 Дж / г / ° C
Т начальная = 26,5 ° С
T окончательная = 0,0 ° C
ΔT = -26,5 ° C (T конечная — T начальная )
Энергия, полученная льдом, равна энергии, потерянной из воды.
Q лед = -Q жидкая вода
Знак — указывает, что один объект получает энергию, а другой объект теряет энергию. Мы можем вычислить левую часть приведенного выше уравнения следующим образом:
Q лед = m • ΔH плавление = (50.0 г) • (333 Дж / г)
Q лед = 16650 Дж
Теперь мы можем установить правую часть уравнения равной m • C • ΔT и начать подставлять известные значения C и ΔT, чтобы найти массу жидкой воды. Решение:
16650 Дж = -Q жидкая вода
16650 Дж = -м жидкая вода • C жидкая вода • ΔT жидкая вода
16650 Дж = -м жидкая вода • (4.18 Дж / г / ° C) • (-26,5 ° C)
16650 Дж = -м жидкая вода • (-110,77 Дж / ° C)
м жидкая вода = — (16650 Дж) / (- 110,77 Дж / ° C)
м жидкая вода = 150,311 г
м жидкая вода = 1,50×10 2 г (округлено до трех значащих цифр)
Еще раз о кривых нагрева и охлаждения
На предыдущей странице Урока 2 обсуждалась кривая нагрева воды.Кривая нагрева показывала, как температура воды увеличивалась с течением времени по мере нагрева образца воды в твердом состоянии (т. Е. Льда). Мы узнали, что добавление тепла к образцу воды может вызвать либо изменение температуры, либо изменение состояния. При температуре плавления воды добавление тепла вызывает преобразование воды из твердого состояния в жидкое состояние. А при температуре кипения воды добавление тепла вызывает преобразование воды из жидкого состояния в газообразное.Эти изменения состояния произошли без каких-либо изменений температуры. Однако добавление тепла к образцу воды, не имеющей температуры фазового перехода, приведет к изменению температуры.
Теперь мы можем подойти к теме кривых нагрева на более количественной основе. На диаграмме ниже представлена кривая нагрева воды. На нанесенных линиях есть пять помеченных участков.
Три диагональных участка представляют собой изменения температуры образца воды в твердом состоянии (участок 1), жидком состоянии (участок 3) и газообразном состоянии (участок 5).Две горизонтальные секции представляют изменения в состоянии воды. На участке 2 проба воды тает; твердое вещество превращается в жидкость. В секции 4 образец воды подвергается кипению; жидкость превращается в газ. Количество тепла, передаваемого воде в секциях 1, 3 и 5, связано с массой образца и изменением температуры по формуле Q = m • C • ΔT. А количество тепла, переданного воде в секциях 2 и 4, связано с массой образца и теплотой плавления и испарения по формулам Q = m • ΔH fusion (раздел 2) и Q = m • ΔH испарение (раздел 4).Итак, теперь мы попытаемся вычислить количество тепла, необходимое для перевода 50,0 граммов воды из твердого состояния при -20,0 ° C в газообразное состояние при 120,0 ° C. Для расчета потребуется пять шагов — по одному шагу для каждого раздела приведенного выше графика. Хотя удельная теплоемкость вещества зависит от температуры, в наших расчетах мы будем использовать следующие значения удельной теплоемкости:
Твердая вода: C = 2,00 Дж / г / ° C
Жидкая вода: C = 4,18 Дж / г / ° C
Газообразная вода: C = 2.01 Дж / г / ° C
Наконец, мы будем использовать ранее сообщенные значения ΔH fusion (333 Дж / г) и ΔH испарения (2,23 кДж / г).
Раздел 1 : Изменение температуры твердой воды (льда) с -20,0 ° C до 0,0 ° C.
Используйте Q 1 = m • C • ΔT
, где m = 50,0 г, C = 2,00 Дж / г / ° C, T начальная = -200 ° C и T конечная = 0,0 ° C
Q 1 = m • C • ΔT = (50.0 г) • (2,00 Дж / г / ° C) • (0,0 ° C — -20,0 ° C)
Q 1 = 2,00 x10 3 Дж = 2,00 кДж
Раздел 2 : Таяние льда при 0,0 ° C.
Используйте Q 2 = m • ΔH сварка
, где m = 50,0 г и ΔH плавление = 333 Дж / г
Q 2 = м • ΔH плавление = (50,0 г) • (333 Дж / г)
Q 2 = 1,665 x10 4 Дж = 16.65 кДж
Q 2 = 16,7 кДж (округлено до 3 значащих цифр)
Раздел 3 : Изменение температуры жидкой воды с 0,0 ° C на 100,0 ° C.
Используйте Q 3 = m • C • ΔT
, где m = 50,0 г, C = 4,18 Дж / г / ° C, T начальная = 0,0 ° C и T конечная = 100,0 ° C
Q 3 = m • C • ΔT = (50,0 г) • (4,18 Дж / г / ° C) • (100,0 ° C — 0,0 ° C)
Q 3 = 2.09 x10 4 Дж = 20,9 кДж
Раздел 4 : Кипячение воды при 100,0 ° C.
Использовать Q 4 = m • ΔH испарение
, где m = 50,0 г и ΔH испарение = 2,23 кДж / г
Q 4 = m • ΔH испарение = (50,0 г) • (2,23 кДж / г)
Q 4 = 111,5 кДж
Q 4 = 112 кДж (округлено до 3 значащих цифр)
Раздел 5 : Изменение температуры жидкой воды со 100.От 0 ° C до 120,0 ° C.
Используйте Q 5 = m • C • ΔT
, где m = 50,0 г, C = 2,01 Дж / г / ° C, T начальная = 100,0 ° C и T конечная = 120,0 ° C
Q 5 = m • C • ΔT = (50,0 г) • (2,01 Дж / г / ° C) • (120,0 ° C — 100,0 ° C)
Q 5 = 2,01 x10 3 J = 2,01 кДж
Общее количество тепла, необходимое для превращения твердой воды (льда) при -20 ° C в газообразную воду при 120 ° C, является суммой значений Q для каждого участка графика.То есть
Q итого = Q 1 + Q 2 + Q 3 + Q 4 + Q 5
Суммирование этих пяти значений Q и округление до нужного количества значащих цифр приводит к значению 154 кДж в качестве ответа на исходный вопрос.
В приведенном выше примере есть несколько особенностей решения, над которыми стоит задуматься:
- Первое: длинная задача была разделена на части, каждая из которых представляет собой одну из пяти частей графика.Поскольку было вычислено пять значений Q, они были обозначены как Q 1 , Q 2 и т. Д. Этот уровень организации требуется в многоступенчатой задаче, такой как эта.
- Секунда: внимание было уделено знаку +/- на ΔT. Изменение температуры (или любой величины) всегда рассчитывается как конечное значение величины за вычетом начального значения этой величины.
- Третий: На протяжении всей проблемы внимание уделялось подразделениям.Единицы Q будут либо в Джоулях, либо в килоджоулях, в зависимости от того, какие количества умножаются. Отсутствие внимания к устройствам — частая причина сбоев в подобных проблемах.
- Четвертый: На протяжении всей задачи внимание уделялось значащим цифрам. Хотя это никогда не должно становиться основным акцентом какой-либо проблемы в физике, это, безусловно, деталь, на которую стоит обратить внимание.
Здесь, на этой странице, мы узнали, как рассчитать количество тепла, задействованного в любом процессе нагрева / охлаждения и в любом процессе изменения состояния.Это понимание будет иметь решающее значение, когда мы перейдем к следующей странице Урока 2, посвященной калориметрии. Калориметрия — это наука, связанная с определением изменений энергии системы путем измерения теплообмена с окружающей средой.
Проверьте свое понимание
1. Вода имеет необычно высокую удельную теплоемкость. Какое из следующих утверждений логически следует из этого факта?
а.По сравнению с другими веществами горячая вода вызывает сильные ожоги, потому что она хорошо проводит тепло.
б. По сравнению с другими веществами вода при нагревании быстро нагревается до высоких температур.
c. По сравнению с другими веществами, образец воды требует значительного количества тепла, чтобы немного изменить ее температуру.
2. Объясните, почему в больших водоемах, таких как озеро Мичиган, в начале июля может быть довольно прохладно, несмотря на то, что температура наружного воздуха около или выше 90 ° F (32 ° C).
3. В таблице ниже описан термический процесс для различных объектов (выделен красным жирным шрифтом). Для каждого описания укажите, набирается или теряется тепло объектом, является ли процесс эндотермическим или экзотермическим, и является ли Q для указанного объекта положительным или отрицательным значением.
| Процесс | Получено или потеряно тепло? | Эндо- или экзотермический? | Q: + или -? | |
а. | Кубик льда помещают в стакан с лимонадом комнатной температуры, чтобы охладить напиток. | |||
г. | Холодный стакан лимонада стоит на столе для пикника под жарким полуденным солнцем и нагревается до 32 ° F. | |||
г. | Конфорки на электроплите выключаются и постепенно остывают до комнатной температуры. | |||
г. | Учитель вынимает из термоса большой кусок сухого льда и опускает его в воду. Сухой лед возгоняется, образуя газообразный диоксид углерода. | |||
e. | Водяной пар в увлажненном воздухе ударяется о окно и превращается в каплю росы (каплю жидкой воды). |
4. Образец металлического цинка массой 11,98 грамма помещают в баню с горячей водой и нагревают до 78,4 ° C. Затем его удаляют и помещают в чашку из пенополистирола, содержащую 50,0 мл воды комнатной температуры (T = 27,0 ° C; плотность = 1,00 г / мл). Вода прогревается до температуры 28.1 ° С. Определите удельную теплоемкость цинка.
5. Джейк достает из туалета банку с газировкой и выливает ее в чашку со льдом. Определите количество тепла, теряемого содой комнатной температуры при плавлении 61,9 г льда (ΔH fusion = 333 Дж / г).
 д.).
д.). 236, ISBN 0-7167-7355-4
236, ISBN 0-7167-7355-4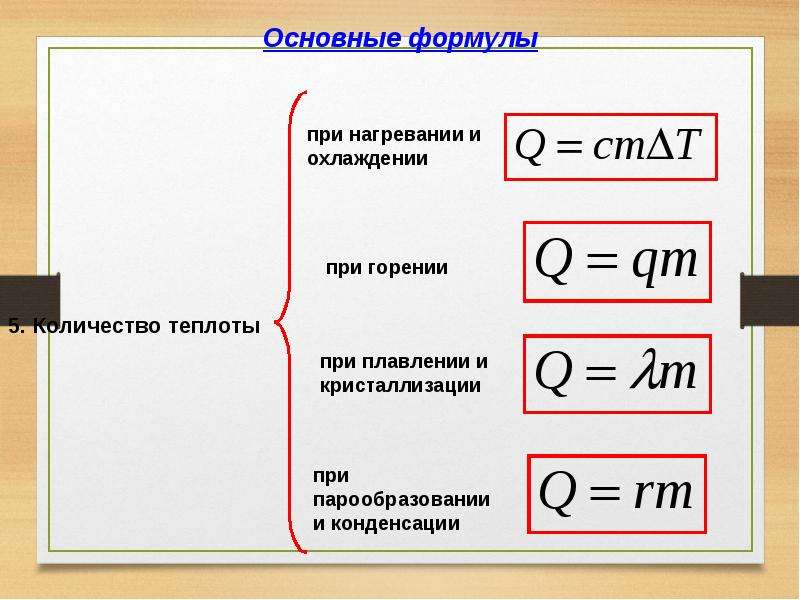 В одну налейте воду массой 0,5 кг, в другую положите несколько кубиков льда той же массы. Заметьте, сколько времени потребуется, чтобы вода в обеих банках закипела. Напишите краткий отчёт о вашем опыте и объясните его результаты.
В одну налейте воду массой 0,5 кг, в другую положите несколько кубиков льда той же массы. Заметьте, сколько времени потребуется, чтобы вода в обеих банках закипела. Напишите краткий отчёт о вашем опыте и объясните его результаты.