Гальваническая коррозия — CMP Products Limited
Тип продуктаКабельные скобы (12)Кабельные вводы (106)
Правила монтажа оборудованияAS/NZS, для горнодобывающей отрасли (Группа I) (15)Зоны AS/NZS (48)Разделы класса CEC (20)Зоны класса CEC (26)CEC, не классифицировано (3)GOST Zones (36)IEC, для горнодобывающей отрасли (Группа I) (14)IEC, не классифицировано (45)Зоны IEC (49)Разделы класса NEC (19)Зоны класса NEC (19)NEC, не классифицировано (3)Зоны Norsok (11)Параллельная конструкция (8)Один кабель (8)Трехлистная компоновка кабелей (7)
Тип защиты1Ex d IIC Gb X (27)1Ex e IIC Gb X (36)2Ex nR IIC Gc X (27)Класс I, Разд. 1 (8)Класс I, Разд. 1, Группы A, B, C, D (8)Класс I, Разд. 2 (18)Класс I, Разд. 2, Группы A, B, C, D (17)Класс I, Группы A, B, C, D (6)Класс I, Группы B, C, D (2)Класс I, Зона 1 (19)Класс I, Зона 1, AEx d IIC Gb (10)Класс I, Зона 1, AEx e IIC Gb (19)Класс I, Зона 2 (19)Класс I, Зона 2, AEx d IIC Gb (10)Класс I, Зона 2, AEx e IIC Gb (12)Класс I, Зона 2, AEx nR IIC Gc (8)Класс I, Зона 20 (10)Класс I, Зона 20, AEx ta IIIC Da (10)Класс I, Зона 21 (10)Класс I, Зона 21, AEx tb IIIC Db (10)Класс I, Зона 22 (10)Класс I, Зона 22, AEx tc IIIC Dc (10)Класс II, Разд. 1 (10)Класс I, Разд. 1, Группы E, F, G (10)Класс II, Разд. 2 (18)Класс II, Разд. 2, Группы E, F, G (18)Класс III, Разд. 1 (15)Класс III, Разд. 2 (13)Ex d I Mb (20)Ex d IIC Gb (36)Ex db I Mb (1)Ex db IIC Gb (1)Ex e I Mb (20)Ex e IIC Gb (46)Ex eb I Mb (1)Ex eb IIC Gb (3)Ex nR IIC Gc (34)Ex nRc IIC Gc (1)Ex ta IIIC Da (43)Ex ta IIIC Da X (35)Ex tb IIIC Db (43)Ex tb IIIC Db X (35)Ex tc IIIC Dc (43)Ex tc IIIC Dc X (35)Ex tD A21 IP66 (2)Промышленного назначения (45)Стандартные среды (6)Одноболтовой (10)Двухболтовой (10)Влажные среды (6)
Тип кабеляАлюминиевая ленточная броня (ASA) (25)Алюминиевая ленточная броня (например, ATA) (24)Алюминиевая проволочная броня (AWA) (34)Оснащенные броней и оболочкой (24)Судовой кабель с броней в виде оплетки (24)Гофрированная металлическая броня, приваренная непрерывным швом (MC-HL) — алюминий (4)Гофрофольгированная броня, приваренная непрерывным швом (MC-HL) — сталь (4)Гофрированная и взаимосвязанная металлическая броня (MC) — алюминий (4)Гофрированная и взаимосвязанная металлическая броня (MC) — сталь (4)Сверхтвердый шнур (2)Небронированный кабель плоской формы (2)Гибкий шнур (5)Освинцованный кабель с алюминиевой проволочной броней (LC/AWA) (9)Освинцованный кабель с гибкой проволочной броней (LC/PWA) (8)Освинцованный кабель с однослойной проволочной броней (LC/SWA) (9)Освинцованный кабель со стальной ленточной броней (LC/STA) (8)Освинцованный кабель с ленточной броней (LC/ASA) (8)Освинцованный кабель с броней в виде проволочной оплетки (8)Освинцованный небронированный кабель (2)M10 (12)M12 (8)Морской судовой кабель с броней в виде оплетки (24)Морской судовой кабель (11)Небронированный морской судовой кабель (19)Гибкая проволочная броня (PWA) (27)Оплетка и алюминиевая проволочная броня (AWA) (4)Оплетка и однослойная проволочная броня (SWA) (4)Гибкая проволочная (EMC) оплетка (например, CY/SY) (42)Однослойная проволочная броня (SWA) (38)Стальная ленточная броня (STA) (24)TECK (4)TECK 90 (4)TECK 90-HL (4)Кабель, укладывающийся в короб (9)Без брони (27)Броня в виде проволочной оплетки (42)
Конфигурация уплотненияДвойное наружное уплотнение (3)Внутреннее и наружное уплотнения (28)Внутреннее защитное уплотнение и кабельный ввод (2)Внутреннее защитное уплотнение и наружное уплотнение (18)Внутреннее защитное уплотнение и наружное уплотнение/переходная муфта FRAS (1)Без уплотнения (4)Наружное уплотнение (46)Наружное уплотнение/кабельный ввод (3)Наружное уплотнение/переходная муфта FRAS (1)Очень высокая (12)
СертификатыABS (67)Алюминий (3)Алюминий/нержавеющая сталь (1)ATEX (61)BS 6121 (45)BV (40)c-CSA-us (19)CCO-PESO (44)CSA (11)DNV-GL (41)Алюминий, покрытый эпоксидным составом (2)ГОСТ К (74)ГОСТ Р (44)IEC 62444 (45)IECEX (61)INMETRO (30)KCC (27)Lloyds (70)LSF (2)Одобренный LUL (Лондонский метрополитен) полимер (2)NEPSI (34)Нейлон (2)RETIE (35)Нержавеющая сталь (6)TR-CU-EAC (38)UL (9)
Защита от влагиОсевая нагрузка (12)Горизонтальная нагрузка (12)Нет (68)Силы при коротком замыкании (8)Да (41)
Гальваническая коррозия алюминия – aluminium-guide.
 com
com
Следует подчеркнуть, что стойкость алюминия и алюминиевых сплавов к нормальным условиях окружающей среды является очень высокой. Главным источником защиты от коррозии является прочная, самовосстанавливающаяся оксидная пленка, которая всегда присутствует на алюминии в условиях окружающей воздушной атмосферы (рисунок 1).
Рисунок 1 – Естественная защита алюминия от коррозии – поверхностная оксидная пленка [4]
Основные типы коррозии алюминия
Для коррозии алюминия характерны следующие основные типы [4]:
- Общая коррозия
- Щелевая коррозия
- Фреттиниг-коррозия
- Коррозия под напряжением
- Гальваническая коррозия
- Точечная (питтинговая) коррозия
- Межзеренная коррозия
- Подповерхностная коррозия
Рисунок 2 – Общая коррозия алюминия: растворение естественной оксидной пленки
растворами сильных щелочей и некоторых кислот [4]
Рисунок 3 – Щелевая коррозия алюминия [4]
Рисунок 4 – Фреттинг-коррозия алюминия: взаимное трение двух алюминиевых компонентов
в условиях шероховатого контакта [4]
Рисунок 5 – Коррозия алюминиевых сплавов под напряжением: при некоторых условиях
в сплавах Al-Cu, Al-Mg, Al-Zn-Mg [4]
Рисунок 6 – Гальваническая коррозия алюминиевого сплава
происходит в условиях его мокрого или влажного контакта
с другим, более “благородным” металлом, таким как медь [4]
Рисунок 7 – Питтинговая (точечная) коррозия алюминия
под воздействием хлоридных ионов [4]
Рисунок 8 – Межзеренная коррозия и подповерхностная коррозия [4]
В зависимости от условий окружающей среды, нагружения и функционального назначения детали любой из видов коррозии может явиться причиной преждевременного разрушения. Кроме того, неправильное применение алюминиевых деталей и изделий может усугублять коррозионные процессы.
Гальваническая коррозия алюминия
Наиболее частые ошибки проектирования алюминиевых конструкций связаны с гальванической коррозией.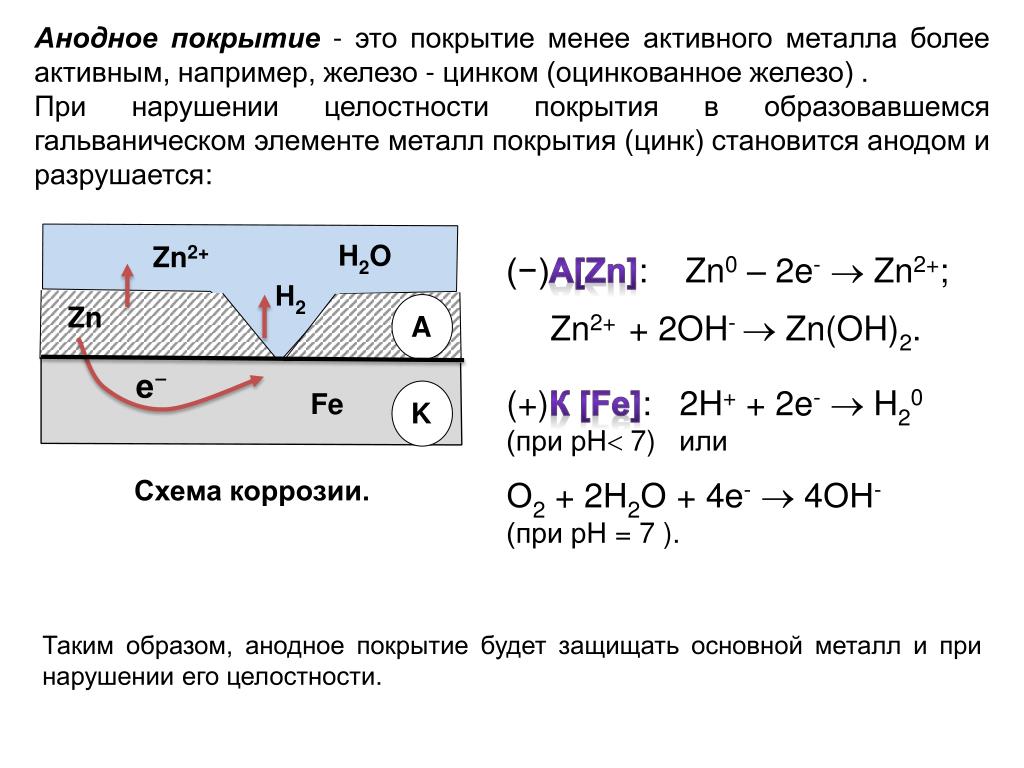 Гальваническая или электрохимическая коррозия происходит, когда два разнородных металла образуют электрическую цепь, замыкаемую жидким или пленочным электролитом или коррозионной средой. В этих условиях разность потенциалов между разнородными металлами создает электрический ток, проходящий через электролит, который (ток) и приводит к коррозии в первую очередь анода или менее благородного металла из этой пары.
Гальваническая или электрохимическая коррозия происходит, когда два разнородных металла образуют электрическую цепь, замыкаемую жидким или пленочным электролитом или коррозионной средой. В этих условиях разность потенциалов между разнородными металлами создает электрический ток, проходящий через электролит, который (ток) и приводит к коррозии в первую очередь анода или менее благородного металла из этой пары.
Сущность гальванической коррозии
Когда два различных металла находятся в прямом контакте с электропроводящей жидкостью, то опыт показывает, что один из них может корродировать, то есть подвергаться коррозии. Это называют гальванической коррозией.
Другой металл не будет корродировать, наоборот, он будет защищен от этого вида коррозии.
Этот вид коррозии отличается от тех видов коррозии, которые могли бы возникнуть, если бы оба эти металлы были помещены раздельно в ту же самую жидкость. Гальваническая коррозия может случиться с любым металлом, как только два различных металла будут находиться в контакте в электропроводящей жидкости.
Внешний вид гальванической коррозии
Внешний вид гальванической коррозии является очень характерным. Эта коррозия не раскидывается по всей поверхности изделия, как это бывает с точечной – питтинговой – коррозий. Гальваническая коррозия плотно локализована в зоне контакта алюминия с другим металлом. Коррозионное воздействие на алюминий имеет равномерный характер, он развивается в глубь в виде кратеров, которые имеют более или менее округлую форму [3[.
Все алюминиевые сплавы подвергаются идентичной гальванической коррозии [3].
Принцип батареи
Гальваническая коррозия работает как батарея, которая состоит из двух электродов:
- катода, где происходит реакция восстановления
- анода, где происходит реакция окисления.
Эти два электрода погружены в проводящую жидкость, которая называется электролитом. Электролит – это обычно разбавленный кислотный раствор, например, серной кислоты, или соляной раствор, например, сульфат меди. Эти два электрода соединены снаружи электрической цепью, которая обеспечивает циркуляцию электронов. Внутри жидкости передача электрического тока происходит путем перемещения ионов. Жидкость, таким образом, обеспечивает ионное электрическое соединение (рисунок 9).
Эти два электрода соединены снаружи электрической цепью, которая обеспечивает циркуляцию электронов. Внутри жидкости передача электрического тока происходит путем перемещения ионов. Жидкость, таким образом, обеспечивает ионное электрическое соединение (рисунок 9).
Рисунок 9 – Принцип гальванической ячейки [3]
Рисунок 1 показывает ячейку, в которой электролитом является раствор серной кислоты. Серная кислота полностью диссоциирована в воде (поскольку является сильной кислотой) путем образования ионов Н+, которые определяют кислотность среды. Происходит следующая электрохимическая реакция [3]:
- цинковый анод окисляется:
Zn → Zn2+ + 2e−
на медном катоде восстанавливаются протоны Н+:
2Н+ + 2e− → Н2
Полная реакция имеет вид:
Zn + H2O → Zn(OH)2 + H2
Эта ячейка производит электричество за счет потребления цинка, который выделяется в виде гидроксида цинка Zn(OH)2.
Для работы ячейки необходимо одновременное выполнение трех условий:
- два различных металла, которые образуют два электрода;
- присутствие электролита;
- непрерывность всей электрической цепочки.
Если хотя бы одно из этих условий не выполняется, например, если нарушается электрический контакт, то ячейка не будет производить электричество, и окисления на аноде не будет происходить (также как и восстановления на катоде).
Условия для гальванической коррозии
Гальваническая коррозия основана на том же самом принципе и для того, чтобы она происходила необходимо одновременное выполнение следующих трех условий [3]:
- различные типы металлов;
- присутствие электролита;
- электрический контакт между двумя металлами.
Различные типы металлов
Для любых металлов, которые относятся к различным их типам, гальваническая коррозия является возможной. Металл с электроотрицательным потенциалом (или более электроотрицательный металл, если они оба электроотрицательные) действует как анод.
Металл с электроотрицательным потенциалом (или более электроотрицательный металл, если они оба электроотрицательные) действует как анод.
Тенденцию различных металлов образовывать гальванические пары и направленность электрохимического действия в различных коррозионных средах (морской воде, тропическом климате, промышленной атмосфере и т.д.) показывают в так называемых гальванических рядах. Чем далее удалены друг от друга металлы в этих рядах, тем более серьезной может быть электрохимическая коррозия. В разных коррозионных средах эти последовательности металлов могут быть разными (рисунок 10).
Присутствие электролита
Область контакта должна быть смочена водным раствором, чтобы обеспечивать ионную электропроводимость. В противном случае отсутствует возможность для гальванической коррозии.
Электрический контакт между металлами
Электрический контакт между металлами может происходить или путем прямого контакта между двумя металлами, или через крепежное соединение, например, болт.
Рисунок 10 [1]
Как видно из графиков рисунка 10 алюминий и его сплавы становятся анодами в гальванических ячейках с большинством металлов, и алюминий корродирует, как говорят, жертвенно и защищает от коррозии другой металл гальванической пары.
Только магний и цинк, включая и оцинкованную сталь, являются более анодными и поэтому, сами подвергаясь коррозии, защищают от нее алюминий.
Алюминий и кадмий вообще имеют почти одинаковые электродные потенциалы и поэтому ни алюминий, ни кадмий не подвергаются гальванической коррозии. К сожалению, кадмий признан весьма токсичным и все реже применяется, а во многих странах просто запрещен, как антикоррозионная защита.
Гальванические пары
Относительное расположение двух металлов или сплавов в гальваническом ряду указывает только возможность гальванической коррозии, если различие их гальванических потенциалов является достаточно большим. Больше этот ряд ничего не говорит, и особенно ничего – о скорости или интенсивности гальванической коррозии. Она может быть нулевой или несущественной или даже незаметной. Ее интенсивность зависит от типов металлов, которые входят в контакт – гальванической пары.
Она может быть нулевой или несущественной или даже незаметной. Ее интенсивность зависит от типов металлов, которые входят в контакт – гальванической пары.
Пара: алюминий – нелегированная сталь
В строительных конструкциях алюминиевые детали, которые открыты для воздействия климатических и погодных воздействий, могут соединяться винтами из обычной стали. Опыт показывает, что алюминий в контакте со стальными винтами подвергается только очень поверхностной коррозии. Возникающая ржавчина, которая не оказывает никакого влияния на алюминий, полностью пропитывает слой оксида алюминия и образует на поверхности пятна. Фактически, для алюминиевой конструкции в контакте с незащищенной сталью важнее будет ее влияние на внешний вид и декоративные качества, а не способность сопротивляться коррозии.
Это явление имеет следующее объяснение:
- на поверхностях контакта образуются пленки с продуктами коррозии – ржавчины на стали и оксида алюминия на алюминии, которые и замедляют электрохимические реакции.
Пара: алюминий – оцинкованная сталь
Судя по гальваническому ряду, цинк является более электроотрицательным, чем алюминий. Крепеж из оцинкованной стали может, поэтому, применяться для соединения и сборки конструкций из алюминиевых сплавов. Надо помнить, что когда цинковое покрытие станет слишком изношенным, чтобы защищать сталь и алюминий, наступает предыдущий сценарий контакта между алюминием и голой сталью [3] .
Пара: алюминий – нержавеющая сталь
Хотя и существует большая разность потенциалов между нержавеющей сталью и алюминиевыми сплавами – около 650 мВ, очень редко можно увидеть гальваническую коррозию на алюминии в контакте с нержавеющей сталью. Поэтому алюминиевые конструкции очень часто собираются с применением болтов и винтов из нержавеющей стали [3].
Пара: алюминий – медь
Контакт между алюминиевыми сплавами и медью, а также медными сплавами (бронза, латунь) приводит к совершенно незначительной гальванической коррозии алюминия под воздействием атмосферных условий.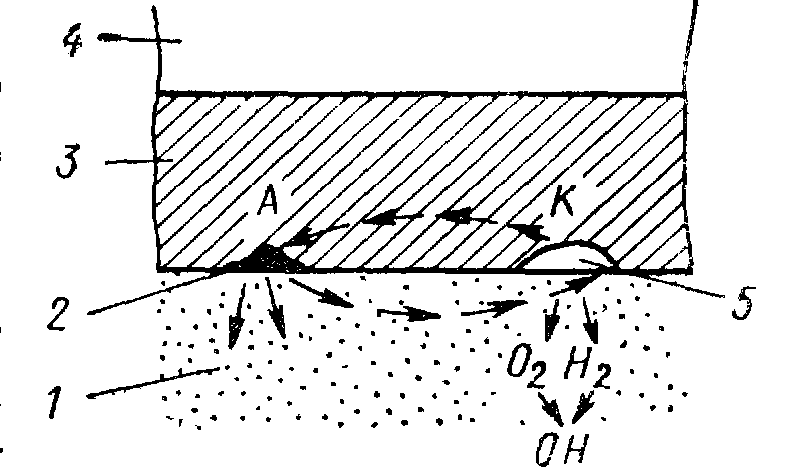 Тем не менее, рекомендуется обеспечивать электрическую изоляцию между этими двумя металлами, чтобы локализовать коррозию алюминия.
Тем не менее, рекомендуется обеспечивать электрическую изоляцию между этими двумя металлами, чтобы локализовать коррозию алюминия.
Необходимо отметить, что продуктом коррозии меди является, так называемая, патина. Эта патина – голубовато-зеленый налет на меди, который состоит в основном из карбоната меди. Эта патина химически воздействует на алюминий и может восстанавливаться с образованием малых частиц меди. Эти медные частицы, в свою очередь, могут вызывать локальную питтинговую коррозию алюминия [3].
Ближе к контакту – больше коррозия
Ускоренная гальваническая коррозия обычно наиболее интенсивна вблизи мест соединения двух металлов; с удалением от мест соединения ее интенсивность уменьшается. Существенное влияние на скорость коррозии оказывает величина отношения площади поверхности катода, контактирующей с электролитом, к площади незащищенной поверхности анода. Желательно иметь малое отношение площади катода к площади анода.
Как избежать гальванической коррозии
- Выбирать в пару алюминию или его сплаву металл, который как можно более ближе к нему в гальваническом ряду для рассматриваемой коррозионной среды (см. рисунок 10).
- Применять «катодный» крепеж. Избегать комбинаций с неблагоприятным (большим) отношением площадей катода к аноду (рисунок 3).
- Обеспечивать полную электрическую изоляцию двух соединяемых металлов. Это может быть выполнено с помощью изолирующих прокладок, втулок, шайб и т.п. (рисунок 12).
- Если применяется окраска, всегда нужно красить катод. Если покрасить только анод, любая царапина на нем даст неблагоприятное отношение поверхностей катода к аноду и приведет к коррозии царапины.
- Увеличивать толщину анода или устанавливать в соединение заменяемые массивные прокладки из анодного металла.
- По возможности размещать гальванический контакт вне коррозионной среды.
- Избегать резьбовых соединений из металлов, образующих гальваническую пару. Заменять их паяными или сварными соединениями.

- Если возможно, применять ингибиторы коррозии, например, в системах с циркуляцией жидкости, которая может играть роль электролита для гальванической коррозии.
- В случаях, когда металлы должны оставаться в электрическом контакте через наружную электрическую цепь, нужно разнести их как можно дальше друг от друга для увеличения сопротивления жидкой цепи (электролита).
- При необходимости и там, где это возможно, применять катодную защиту с цинковым или магниевым жертвенными анодами.
- В наиболее агрессивных средах только цинк, кадмий и магний могут быть в контакте с алюминием без возникновения гальванической коррозии. Заметим, что применение кадмиевых покрытий в значительной степени ограничено из-за их экологической небезопасности.
Рисунок 11 [1]
Рисунок 12 [1]
Источники:
- TALAT 5104.
- Corrosion of Aluminum and Aluminum Alloys. Edited by J.R. Davis. – ASM International, 1999.
- Corrosion of Aluminium / Christian Vargel – ELSEVIER, 2004
- TALAT 1252
Гальваническая
Гальваническая коррозия представляет собой электрохимическую реакцию между двумя и более различными (или разнородными) металлами. Различными, потому что для того, чтобы началась реакция, один должен быть более химически активным (или менее стабильным), чем другой или другие. Когда мы говорим про гальваническую коррозию, то имеем в виду электрообмен. Все металлы обладают электрическим потенциалом, поскольку у всех атомов есть электроны, движение которых и есть электричество.
Гальваническая коррозия более активного металла начинается в тот момент, когда две или более детали из разнородных металлов, имеющие взаимный контакт (благодаря обычному соприкосновению, или же посредством проводника) помещаются в электролит (любую жидкость, проводящую электричество). Электролитом может быть, что угодно, за исключением химически чистой воды. Не только соленая морская, но и обычная вода из под крана благодаря наличию минеральных веществ является превосходным электролитом, и с ростом температуры электропроводность её только растет (по этой причине корпуса судов, эксплуатирующиеся в жарком климате, заметно больше подвержены коррозии, чем на Севере).
Не только соленая морская, но и обычная вода из под крана благодаря наличию минеральных веществ является превосходным электролитом, и с ростом температуры электропроводность её только растет (по этой причине корпуса судов, эксплуатирующиеся в жарком климате, заметно больше подвержены коррозии, чем на Севере).
Процесс гальванической коррозии можно наглядно продемонстрировать на примере взаимного контакта изделий из Алюминия и Нержавеющей стали. Алюминий – более химически активный металл является в данном случае анодом, а менее активная нержавеющая сталь – катодом. При взаимодействии между нержавеющей сталью и алюминием возникает большая разница потенциалов в соответствии с рядом напряжений в металлах. При этом, благодаря действующему на электрический элемент электролиту (жидкость), возникает электрический ток, и анод, в данном случае Алюминий, корродирует. Подобное явление возникает также в винтовых соединениях, в которых между металлами образуется разность потенциалов, а влажность играет роль электролита.
Химический ряд напряжений в металлах
| Углерод Платина Золото Серебро Нержавеющая сталь Никель Медь Латунь Олово Свинец Углеродистая сталь Кадмий Алюминий Цинк (оцинкованная сталь) Магний |
Меньшая активность
Большая активность
|
Чем дальше находятся в ряду напряжений металлы по отношению друг к другу, тем больше разность потенциалов и выше опасность коррозии. При наличии электролита на большинстве однородных металлических поверхностях все равно образуются крошечные аноды и катоды – в тех местах, где состав сплава неоднороден или имеются вкрапления и примеси – например, частицы металла с форм или штампов.
Другим важным фктором, оказывающим влияние на скорость протекания гальванической коррозии, помимо разности потенциалов металлов, является пропорциональное соотношение размеров анода и катода. Если к очень большому аноду подключить маленький катод, процесс коррозии анода пойдет медленно. А если поступить наоборот, то анод очень быстро разрушится. Объясняется это тем, что анодные и катодные реакции должны быть эквивалентны. Рост или снижение катодной реакции, обусловленной размером катода, вызывает ответные рост или снижение анодной реакции
Если к очень большому аноду подключить маленький катод, процесс коррозии анода пойдет медленно. А если поступить наоборот, то анод очень быстро разрушится. Объясняется это тем, что анодные и катодные реакции должны быть эквивалентны. Рост или снижение катодной реакции, обусловленной размером катода, вызывает ответные рост или снижение анодной реакции
Гальваническая коррозия возникает в том случае, если имеет место один из следующих факторов:
- Относительная влажность воздуха превышает 60%;
- Загрязненный воздух: большое количество металлических частиц;
- Металлы в винтовых соединениях, у которых большая разница потенциалов;
- Неправильное соотношение площадей поверхностей анода и катода.
Рекомендации по противодействию гальванической коррозии:
1. Исключите возможность образования гальванического элемента
- защищайте конструкции от действия влажности (удалите электролит)
- изолируйте металлы друг от друга, например, с помощью покрытия
- изолируйте металлы от электролита.
2. Избегайте соединения металлов, у которых большая разница потенциалов.
3. Материал из которого произведен крепеж должен быть более активным (анод), чем материал конструкции (катод).
- площадь поверхности конструкции(катода) больше площади поверхности крепежа(анода).
Гальваническая коррозия
МЕТАЛЛЫ В МОРСКОЙ СРЕДЕ
Крепеж
Когда речь заходит про крепеж, в дело вступают дополнительные факторы. Он должен, естественно, обладать прочностью и желательно при этом иметь разумную стоимость, поскольку количество его даже для самой миниатюрной лодки исчисляется сотнями. Но, пожалуй, самым важным для него является то, что, будучи установлен, он не должен ни корродировать сам, ни вызывать коррозию того, что он крепит — по крайней мере в течение достаточно длительного времени. В данном контексте имеются два вида коррозии, о которых следует помнить: гальваническая и химическая.
В данном контексте имеются два вида коррозии, о которых следует помнить: гальваническая и химическая.
Гальваническая коррозия
Первый ее вид — гальваническая коррозия, которая возникает в тех случаях, когда два разных металла находятся в контакте друг с другом в присутствии электролита. Морская вода является (увы!) отличным электролитом и проникает на лодке повсюду. Гальваническая шкала ниже демонстрирует электрические потенциалы металлов, обычно применяемых в малом судостроении. Постараемся не слишком не углубляться в химические дебри, а заострим ваше внимание на трех основных моментах, чтобы понять ее практический смысл:
- Когда два металла находятся в контакте, находящийся левее будет корродировать.
- Разность потенциалов в 0.1 В является безопасной, 0.2 — приемлемой в зависимости от следующего условия.
- Темпы коррозии зависят помимо всего прочего от площадей поверхностей открытых металлов. Если крепеж менее инертен, чем деталь, он корродирует довольно скоро. Если же он из более благородного металла, срок его службы будет достаточен.
Каков практический смысл этой диаграммы?
- Из диаграммы понятно, почему элементы крепежа обычно делаются из материалов правой ее части. С алюминием у вас будут проблемы, поэтому позаботьтесь, чтобы вытяжные заклепки были из монеля (алюминиевые широко используются в автомобильной промышленности).
(Монель — сплав Ni с 23-27% Cu, 2-3% Fe, 1-2% Mn) - Вы сами можете решить, какой крепеж использовать для каких деталей (см. таблицу далее). Оцинкованного крепежа следует, естественно, избегать на нержавейке и алюминии. Менее явно то, что латунные винты представляют собой неудовлетворительный, а скорее даже опасный выбор для крепления бронзовых деталей.
- Существуют сплавы, сами по себе способные являться гальваническими парами. Самым ярким примером является латунь, у которой в присутствии электролита одна из «фаз» начинает корродировать.
 Явление именуется «децинкификация». Латунный элемент, подверженный этому явлению, представляет собой неприятное зрелище и теряет свою прочность.
Явление именуется «децинкификация». Латунный элемент, подверженный этому явлению, представляет собой неприятное зрелище и теряет свою прочность.
|
Крепеж
| ||
|
Материал детали
|
Допустимо
|
Недопустимо
|
|
Оцинкованная сталь
|
Оцинкованный или нерж.
|
Латунь и бронза
|
|
Алюминий
|
Нержавеющий
|
Оцинкованный, латунь
|
|
Латунь
|
Латунь или бронза
|
Нержавеющий
|
|
Бронза
|
Бронза или нерж.
|
Латунь
|
|
Нерж. сталь
|
Нерж. или монель
|
Оцинк. или латунь
|
Химическая коррозия
Второй вид коррозии, о котором не стоит забывать, является следствием воздействия различных химических веществ. Как правило, металлы защищают сами себя оксидной пленкой на поверхности и главное тут, является ли она самовосстанавливающейся, как в случае нержавеющей стали, алюминия и цветных металлов или же отваливается хлопьями, как у стали. Последствия этого могут быть разными — от чисто косметических в случае коррозии бронзового или оцинкованного палубного оборудования, до весьма серьезных — в случае коррозии гвоздей обшивки. Последнее в основном вызывается образованием в древесине кислот по мере ее пропитывания, дуб в этой ситуации является наихудшим вариантом. Всем хорошо известно, что может ожидать стальной крепеж, а стало быть килевые болты и гвозди. Гораздо чаще забывают, что нержавеющая сталь тоже уязвима.
Последствия этого могут быть разными — от чисто косметических в случае коррозии бронзового или оцинкованного палубного оборудования, до весьма серьезных — в случае коррозии гвоздей обшивки. Последнее в основном вызывается образованием в древесине кислот по мере ее пропитывания, дуб в этой ситуации является наихудшим вариантом. Всем хорошо известно, что может ожидать стальной крепеж, а стало быть килевые болты и гвозди. Гораздо чаще забывают, что нержавеющая сталь тоже уязвима.
Нержавеющая сталь
Поскольку существует огромное количество ложных представлений о нержавеющей стали (впрочем, само это название вводит в заблуждение), стоит провести небольшой ликбез по этой части. Помимо железа и углерода, нержавеющая сталь содержит ряд легирующих добавок. Из них самой важной является хром (Cr). Если сталь содержит его более 12%, вся поверхность покрывается пленкой из оксида хрома. Эта пленка «пассивна», стойка к большинству воздействий и самовосстанавливается в присутствии кислорода. Нержавеющая сталь, содержащая один только хром, довольно хрупкая и поэтому в нее добавляют в два раза меньшее хрома количество никеля (Ni). 304-я нержавейка (она же A2), одна из самых распространенных, содержит 18% Cr и 10% Ni. Мойка или выхлопная труба скорее всего сделаны именно из 304-й и если вы пробовали чистить раковину мойки или релинг, то могли обратить внимание, что они в некоторой степени подвержены воздействию органических кислот, образующихся в пищевых продуктах, отпечатков пальцев и прочих загрязнений.
Химическая и пищевая промышленность снижают остроту этой проблемы путем добавления в сталь небольшого количества молибдена (Mo). Таким образом 316-я нержавейка (она же А4) обычно содержит 17% Cr, 11% Ni, 2 % Mo и широко используется для хранения и транспортировки агрессивных жидкостей. Из этого напрашивается вывод, что она представляет собой идеальный материал для крепежа древесины (или к ней) и с точки зрения воздействия одних только химических веществ вы скорее всего будете правы. Но надо еще принимать во внимание и ту среду, в которой предстоит работать крепежному элементу. Представим себе болт, гвоздь или шуруп, крепящий доску обшивки к шпангоуту ниже ватерлинии. Его шляпка, находящаяся на поверхности или вблизи нее будет иметь достаточный приток кислорода для поддержания оксидной пленки. Само же тело, находящееся внутри конструкции, скорее всего будет испытывать его недостаток, при этом находясь в окружении разных кислот и хлоридов. При подобных обстоятельствах пассивная пленка может разрушиться, сделав таким образом нержавейку «активной». Последствий у этого может быть два. Во-первых, взгляните на гальваническую диаграмму, и вы увидите, что разность активных и пассивных потенциалов у 304-й нержавейки (у 316-й в меньшей степени) вполне достаточна, чтобы вызвать гальваническую коррозию. Подобно латуни, она способна сама собой образовывать гальваническую пару. Во-вторых, лишенная защитной пленки, нержавейка корродирует такими же темпами, как и самая обычная сталь. В результате этого нержавеющий крепеж ниже ватерлинии, независимо от его марки, может не иметь никаких преимуществ по сравнению с простой низкоуглеродистой сталью. Выше ватерлинии (где больше кислорода и меньше электролита) такой крепеж ведет себя превосходно.
Но надо еще принимать во внимание и ту среду, в которой предстоит работать крепежному элементу. Представим себе болт, гвоздь или шуруп, крепящий доску обшивки к шпангоуту ниже ватерлинии. Его шляпка, находящаяся на поверхности или вблизи нее будет иметь достаточный приток кислорода для поддержания оксидной пленки. Само же тело, находящееся внутри конструкции, скорее всего будет испытывать его недостаток, при этом находясь в окружении разных кислот и хлоридов. При подобных обстоятельствах пассивная пленка может разрушиться, сделав таким образом нержавейку «активной». Последствий у этого может быть два. Во-первых, взгляните на гальваническую диаграмму, и вы увидите, что разность активных и пассивных потенциалов у 304-й нержавейки (у 316-й в меньшей степени) вполне достаточна, чтобы вызвать гальваническую коррозию. Подобно латуни, она способна сама собой образовывать гальваническую пару. Во-вторых, лишенная защитной пленки, нержавейка корродирует такими же темпами, как и самая обычная сталь. В результате этого нержавеющий крепеж ниже ватерлинии, независимо от его марки, может не иметь никаких преимуществ по сравнению с простой низкоуглеродистой сталью. Выше ватерлинии (где больше кислорода и меньше электролита) такой крепеж ведет себя превосходно.
В заключение хотелось бы еще указать на неразумность пескоструйной обработки оборудования из нержавеющей стали с целью придания ему вида оцинкованного. Способность пассивной пленки к самовосстановлению выше, если поверхность отполирована. При образовании на поверхности миллионов маленьких «пиков» вы значительно снижаете такую способность, в результате чего деталь покрывается ржавчиной. Если вам надо, чтобы деталь выглядела как оцинкованная, лучше такую и взять.
Сталь и оцинковка
Низкоуглеродистой стали без защитного покрытия нет места на борту лодки по причине ее склонности к коррозии, но при наличии покрытия — это вполне пригодный материал. Обычно этого достигают, нанося на нее слой цинка, получая при этом два плюса. Во-первых, цинк хорошо сопротивляется химической коррозии, а во-вторых, в присутствии электролита он корродирует прежде стали. Существует ряд способов нанесения слоя цинка, основная разница между ними заключается в толщине формируемого слоя. Чтобы получить приемлемый срок службы в морской среде, слой должен иметь толщину порядка 100 мкм. Этого можно достичь лужением (до 125 мкм при горячем погружении), окраской (около 40 мкм на слой), но только не электрогальваникой, где толщина обычно ограничивается 20 мкм. Поэтому тот блестящий оцинкованный крепеж, что продается в магазинах хозтоваров, годится для строительства теплицы, на лодке же жизнь его будет недолгой. «Морской» крепеж должен быть луженый.
Во-первых, цинк хорошо сопротивляется химической коррозии, а во-вторых, в присутствии электролита он корродирует прежде стали. Существует ряд способов нанесения слоя цинка, основная разница между ними заключается в толщине формируемого слоя. Чтобы получить приемлемый срок службы в морской среде, слой должен иметь толщину порядка 100 мкм. Этого можно достичь лужением (до 125 мкм при горячем погружении), окраской (около 40 мкм на слой), но только не электрогальваникой, где толщина обычно ограничивается 20 мкм. Поэтому тот блестящий оцинкованный крепеж, что продается в магазинах хозтоваров, годится для строительства теплицы, на лодке же жизнь его будет недолгой. «Морской» крепеж должен быть луженый.
Медь
Медные гвозди с шайбами широко применяется в классической деревянной конструкции. Для такого рода сравнительно гибких конструкций медные гвозди представляют идеальный материал: легко крепятся, коррозионно-устойчивы, достаточно эластичны, чтобы позволить подвижку элементов. С выходом на сцену клееных конструкций и тем более стеклопластиковых корпусов, довольно удивительно, что медные корабельные гвозди до сих пор имеются в продаже. Однако их выбор постепенно сужается. К примеру, 5-6 мм шайбы более не выпускаются, поэтому строителям каноэ приходится теперь расклепывать гвозди. Также исчезают и нестандартные размеры, полезные при ремонте обшивки, когда выбор гвоздей на размер выше поможет решить проблему течи.
Латунь
Латунь чаще всего выступает в роли шурупов. Помня о проблемах децинкификации, латунный крепеж следует использовать только в защищенных местах — во внутренней обстройке или в тех местах, где от него не зависит ваша жизнь.
Бронза
Стандартным материалом для крепежа является кремниевая бронза. Помимо использования ее в виде болтов и гвоздей, она является одним из немногих материалов, из которого делают гигантского размера шурупы (вплоть до №30). Она достаточно коррозионно-устойчива и служит очень долго — от тридцати до пятидесяти лет. Поэтому, несмотря на свою стоимость, бронзовый крепеж конкурентоспособен.
Поэтому, несмотря на свою стоимость, бронзовый крепеж конкурентоспособен.
|
Виды медных сплавов и химический состав
| ||||
|
Наименование
|
Обозначение
|
Состав
|
Применение
| |
|
Латуни
|
Обычная латунь
|
CZ108
|
Zn 37%
|
Внутреннее оборудование
|
|
Морская латунь
|
CZ112
|
Zn 37% Sn1%
|
Оборудование довоенных лодок
| |
|
Высокопрочная латунь
|
CZ114
|
Zn 37% Mn 2% Al 1.5% Fe 1% Pb 1.5% Sn 0.8%
|
Такелажные скобы, гребные винты, лебедки
| |
|
Коррозионностойкая латунь
|
CZ132
|
Zn 36% Pb 2.8% As 0.1%
|
Водозапорная и трубная арматура
| |
|
Бронзы
|
Алюминиевая бронза
|
CA104
|
Al 10% Ni5% Fe5%
|
Высокопрочное оборудование
|
|
Фосфористая бронза
|
PB102
|
Sn 5% P 0.
|
Сборное и кованое оборудование
| |
|
Кремнистая бронза
|
CS101
|
Si 3% Mn1%
|
Крепеж
| |
|
Оружейная бронза
|
LG2
|
Sn 5% Pb5% Zn5%
|
Литье
| |
|
Алюминиевая бронза для литья
|
AB2
|
Al 10% Ni5% Fe3%
|
Леерное и мачтовое оборудование
| |
|
Al — алюминий, As — мышьяк, Fe — железо, Mn — марганец, Ni — никель
| ||||
|
« Назад Коррозия и гальваническая пара 08.11.2011 06:55
Металлы в виду своего разнородного характера не всегда подходят для непосредственного контакта друг с другом тем более, если они находятся в агрессивных средах. Нередко они образуют весьма сильную гальваническую пару, что приводит к быстрому образованию коррозии в местах их непосредственного соприкосновения. Слово «коррозия» заимствованно от латинского слова «corrodere», что означает — пожирать, изгладывать. Наиболее известная форма коррозии, это физико-химической реакция окружающей среды со сталью, которая приводит к появлению ржавчины. Аналогичные процессы проистекают и с другими материалами. Коррозия может быть химической и электрохимической в зависимости от вида процесса разрушения. Химическая коррозия, как правило, вызвана воздействием на сталь сухих газов и жидкостей без электролитных свойств и не сопровождается возникновениями электрических токов. При таком виде коррозии происходит равномерное воздействие на всю поверхность металла, в результате чего появляются окислы в виде рыхлых образований. Химическая коррозия представляет менее опасный вид разрушающих воздействий, в отличие от электрохимической коррозии. Коррозия, при которой происходит возникновение электрического тока, в среде жидкого электролита называется — электрохимическая коррозия. Все металлы и сплавы обладают электрическим потенциалом, из-за наличия в составе сплавов тех или иных веществ их потенциал не однороден. Если взять два материала с разными потенциалами и соединить их между собой, то они образовывают гальваническую пару. Поместив такую связку в электролит, между ними начинается активный электрообмен, что приводит к ускоренному разрушению более активного материала. Электролит, это вещество в среде которого, возможно протекание электрического тока. В качестве электролита может быть не только морская вода, но и обычная водопроводная вода, так как в ней присутствуют минеральные вещества. Коррозионное разрушение алюминиевых частей водной техники, приобретает ускоренный характер, если применять детали из нержавеющей стали в качестве дополнительных элементов. В состав сплава этой легированной стали входят такие вещества как никель и хром, которые не совместимы с алюминием. Какие материалы можно применять для совместного использования без образования гальванической пары можно посмотреть в таблице совместимости металлов и сплавов. К примеру, если металлические детали будет контактировать с деталями на медной основе, процесс разрушения металлических изделий в таком случае резко ускорится. Иногда для защиты стали от коррозии применяют покрытие из слоя олова, но оно будет выполнять свои защитные функции до тех пор, пока не нарушится их целостность. При проведении ремонтных работ нужно учитывать особенности материалов закрепляя их на основное изделие. Замена деталей, не предусмотренных конструкцией, может привести к их преждевременному разрушению и выходу из строя, а в некоторых случаях может повлечь возникновение аварийных ситуаций опасных для жизни. Вот некоторые комбинации несовместимых материалов и сплавов, которые создают гальваническую пару: Алюминий, а так же его сплавы не совместимы с такими материалами как, — медь, сплавы меди, серебро, золото, платина, палладий, родий, олово, никель, хром. Магниево-алюминиевые сплавы при их соединении создают отрицательное взаимодействие с веществами такими как, — никель, хром, олово, медь, свинец, палладий, родий, серебро, золото, платина. Цинк и сплавы на его основе по своей природе не совместимы с медью, славами на основе меди, а так же с некоторыми веществами, например: серебро, золото, платина, палладий, родий. Нелегированная сталь, олово, свинец, кадмий, не совместимы с веществами перечисленными далее: медь, серебро, золото, платина, палладий, родий. Никель и хром, если соединить их с серебром, золотом, платиной, палладием, родием, могут привести к не желательному взаимодействию.
|
Коррозия Джон Коттерил рассказывает о причинах коррозии и методах борьбы с ней С проблемой коррозии металлов на яхте встречается каждый из нас. Каждый металл занимает определенное место в таблице электрических потенциалов (Рис.1) Рис.1. Таблица электрических потенциалов Самые верхние позиции в таблице принадлежат графиту и платине, которые будут электрически положительными по отношению ко всем остальным металлам. Опускаясь вниз по таблице, где металлы становятся все более электрически отрицательными, нам встречаются: титан, серебро, никель, бронзы, медь, олово, латунь, алюминий, мягкая сталь, цинк, и, наконец, магний. Скрытые ресурсы гальванической коррозии Что такое электролитическая коррозия? Рис.2 Гальваническая и электролитическая коррозия Как то мне показали сифонный клапан, помещенный в деревянную коробку рядом с отключателем положительной клеммы аккумулятора. Протекающая из дефектного клапана соленая вода проложила путь из мокрого дерева коробки к положительной клемме 12 V аккумулятора. Отсюда, с « +», по этому пути, через корпус клапана и по системе охлаждения и теплообменник, ток пошел на корпус двигателя и к «-« батареи. Латунный патрубок скорродировал очень быстро, но теплообменник не пострадал. Болезнь двигателя Проблемы гребного вала
Нержавеющая сталь может также страдать от процесса, называемого « коррозия сварного шва». Вы неоднократно могли видеть полированные нержавеющие детали на яхтах, покрытые ржавчиной в районе сварного шва. В момент сварки, под воздействием высокой температуры, легирующий металл хром удаляется из расплавленного сварного шва, оставляя там железо, которое и ржавеет.
Из “Boat Owner” by John Cotterill |
Предотвращение гальванической коррозии с использованием Corrosion X ™
Гальваническая коррозия — Введение
Гальваническая коррозия — это давняя проблема, когда один металл корродирует по сравнению с другим.
Проще говоря, разные металлы и сплавы имеют различные электрические свойства и потенциалы. Когда два вступают в контакт, один будет действовать как анод, а другой — как катод.
Для возникновения коррозии должен присутствовать электролит и соответствующий путь проводимости.
Что такое гальваническая коррозия?
Два металла будут находиться в электрическом контакте друг с другом и иметь присутствие электролита.
Примером этого процесса может быть ржавчина на листе из гофрированного железа.
В данном случае лист стали или железа обычно имеет слой антикоррозионной защиты на основе цинка, который наносится в первую очередь, поскольку он является менее благородным металлом для самого железа или самой стали.
Сравните это с обычной жестяной банкой, в которой внешний оловянный слой подвергается немедленной и быстрой атаке, поскольку он считается более благородным металлом, чем нижележащая сталь.
Эта гальваническая реакция фактически поощряется и используется в бытовых батареях для производства самого электрического напряжения.
Где происходит гальваническая коррозия?
Все металлы в некоторой степени могут считаться «гальваническими» и, следовательно, обладают «электрическим потенциалом, вызывающим ржавчину и коррозию».
Статуя Свободы — Пример из практики
Наиболее известным примером будет коррозия, которая произошла на Статуе Свободы.
Это было выявлено в ходе последующих проверок качества сборки в 1980-х годах, но, конечно же, за предыдущие 100 лет это было бы медленно.
Это имело место между внешним медным слоем оболочки и надстройкой из кованого железа.
Подобного рода проблемы давно ожидались, поскольку проект статуй из-за того, что изоляционные слои из шеллака не были очень эффективными, но после обширной реставрации их заменили материалом из ПТФЭ.
USS Independent Case Study
С момента постройки этого корабля сообщалось о сильной коррозии. Это стало наглядным примером вредного воздействия, которое может быть вызвано гальванической коррозией.
Это было вызвано из-за контакта между стальными струйными системами водяного топлива и самим алюминиевым корпусом.
В этом случае алюминий действует как анод, в то время как нержавеющая сталь играет роль катода.
С тех пор эта проблема была устранена ВМС США.
Однако это был дорогостоящий ремонт и продемонстрировал стоимость агрессивной гальванической коррозии.
Предотвращение гальванической коррозии
Существует множество способов предотвращения гальванической коррозии. В большинстве случаев решения сосредоточены вокруг изоляции защищаемого материала металлом, обладающим различными свойствами.
— Чаще всего можно изолировать два металла друг от друга. Использование непроводящего материала, такого как ПТФЭ, может быть эффективным для предотвращения коррозии из-за различных свойств потенциала электрода.
– Использование антиоксидантной пасты оказалось успешным методом изоляции медных и алюминиевых разъемов. Он имеет более низкую оценку благородства, чем оба этих металла.
– Проще говоря, гальваническое покрытие — это то место, где выбирается металл с превосходной коррозионной стойкостью для изоляции от гальванического тока. Обычно это металлы, такие как хром, никель и золото.
– Катодная защита также обычно используется для металлических предметов, которые могут быть закопаны или погружены под воду. Именно здесь на жертвенный анод наносится «более активный» металл, такой как цинк, магний и алюминий.
– Однако лучший профилактический метод состоит в том, чтобы просто выбрать металлы для использования, которые имеют одинаковые электрические потенциалы и, следовательно, менее летучий гальванический ток.
Коррозия X ™
Коррозия X ™ антикоррозийный спрей является высокоэффективным средством для обработки ржавчины.
Он является лидером на рынке защиты от коррозии и обладает отличными пенетрантными, предохранительными и смазочными свойствами.
Также безопасно использовать с электроникой, такой как батареи, вентиляторы и двигатели.
Кроме того, он соответствует строгим требованиям по защите от коррозии и эксплуатационным характеристикам ВМС США, отвечающим требованиям MIL-PRF-8109F.
Для получения дополнительной информации о гальванической коррозии, пожалуйста, посетите нашего партнера веб-сайт Честного ЗНАКа.
Гальваническая коррозия — NACE
Гальваническая коррозия
Гальваническая коррозия (также называемая «коррозией разнородных металлов» или ошибочно «электролизом») относится к коррозионным повреждениям, вызванным соединением двух разнородных материалов в коррозионно-активном электролите. Это происходит, когда два (или более) разнородных металла вступают в электрический контакт под водой. Когда образуется гальваническая пара, один из металлов в паре становится анодом и корродирует быстрее, чем сам по себе, в то время как другой становится катодом и корродирует медленнее, чем в одиночку.
Когда образуется гальваническая пара, один из металлов в паре становится анодом и корродирует быстрее, чем сам по себе, в то время как другой становится катодом и корродирует медленнее, чем в одиночку.
Любой (или оба) металла в паре могут или не могут корродировать сам по себе. Однако при контакте с разнородным металлом скорость самокоррозии изменяется:
Коррозия анода ускоряется. Коррозия катода замедляется или даже прекращается. Гальваническая муфта — основа многих методов мониторинга коррозии
Движущей силой коррозии является разность потенциалов между различными материалами. Биметаллическая движущая сила была открыта в конце восемнадцатого века Луиджи Гальвани в серии экспериментов с обнаженными мышцами и нервами лягушки, которые сокращались при подключении к биметаллическому проводнику.Позже этот принцип был применен на практике Алессандро Вольта, который в 1800 году построил первый электрический элемент или батарею: серию металлических дисков двух типов, разделенных картонными дисками, пропитанными кислотными или солевыми растворами. Это основа всех современных батарей с жидкими элементами, и это было чрезвычайно важное научное открытие, потому что это был первый найденный метод генерации постоянного электрического тока.
Этот принцип был также разработан сэром Хамфри Дэви и Майклом Фарадеем для полезной защиты металлических конструкций в начале девятнадцатого века.Протекторная коррозия одного металла, такого как цинк, магний или алюминий, является широко распространенным методом катодной защиты металлических конструкций.
В биметаллической паре менее благородный материал станет анодом этой коррозионной ячейки и будет иметь тенденцию к коррозии с большей скоростью по сравнению с несвязанным состоянием. Более благородный материал будет действовать как катод в коррозионной ячейке. Гальваническая коррозия может быть одной из самых распространенных форм коррозии, а также одной из самых разрушительных.
Следующие примеры иллюстрируют этот тип атаки.
Гальваническая коррозия: винт из нержавеющей стали v стальная шайба с кадмиевым покрытием Гальваническая коррозия внутри горизонтального стабилизатора Гальваническая коррозия Статуи Свободы Контргайка с кадмиевым покрытием.
Относительное благородство материала можно предсказать, измерив его коррозионный потенциал. Хорошо известная гальваническая серия перечисляет относительное благородство определенных материалов в морской воде. Небольшое соотношение площадей анода и катода крайне нежелательно.В этом случае гальванический ток концентрируется на небольшой анодной площади. В этих условиях обычно происходит быстрая потеря толщины растворяющегося анода. Проблемы гальванической коррозии следует решать путем проектирования, в первую очередь избегая этих проблем. Ячейки гальванической коррозии могут быть созданы на макроскопическом или микроскопическом уровне. На микроструктурном уровне различные фазы или другие микроструктурные особенности могут подвергаться воздействию гальванических токов
Гальваническая коррозия — SSINA
Фотография: Боба Йованович на Unsplash
Определение
Когда два разных металла или сплава погружаются в коррозионный раствор или регулярно соединяются влагой, в каждом из них разовьется потенциал коррозии.При наличии условий для гальванической коррозии более благородный металл станет катодом, а более активный металл — анодом. Между анодом и катодом может протекать измеримый ток. Если это произойдет, скорость коррозии анода в рабочей среде будет увеличиваться, а скорость коррозии катода уменьшится. Повышенная коррозия анода называется «гальванической коррозией».
Гальваническая коррозия иногда используется для продления срока службы материалов (т.е.е. цинковые покрытия на углеродистой стали и цинковые аноды в водонагревателях), но, если это не будет учтено и созданы правильные условия, это может привести к неожиданным сбоям.
Требования к гальванической коррозии:
Для возникновения гальванической коррозии требуются три элемента.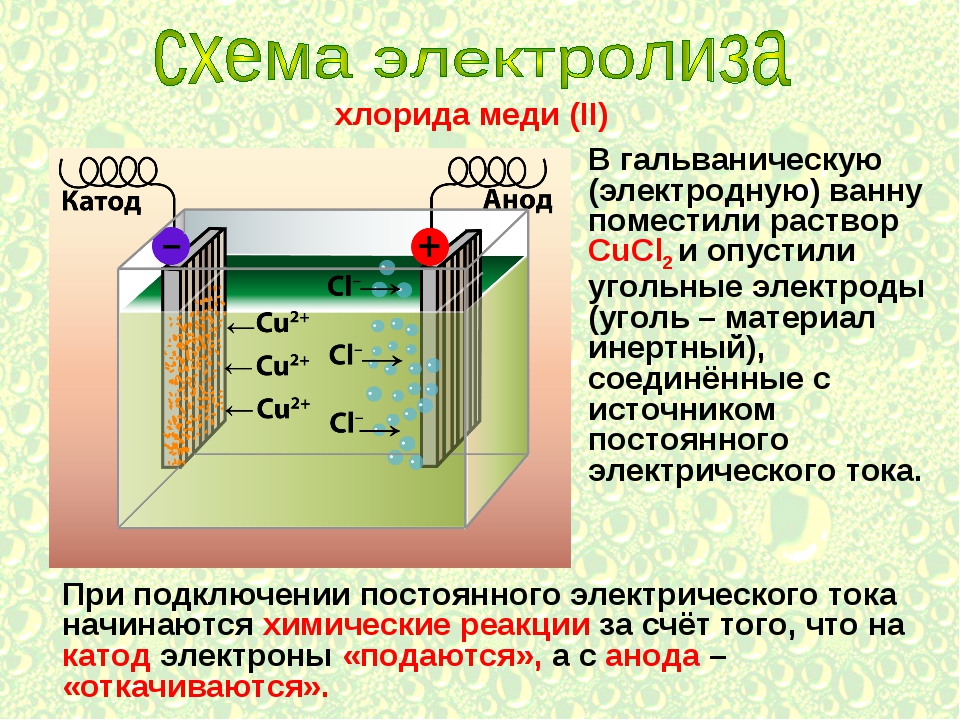
- Два металла с разным потенциалом коррозии
- Прямой электрический контакт металл-металл
- Проводящий раствор электролита (например, вода) должен регулярно соединять два металла.Раствор электролита создает «токопроводящую дорожку». Это может произойти при регулярном погружении в воду, конденсации, попадании дождя, тумана или других источников влаги, которые увлажняют и соединяют два металла.
Если какой-либо из этих элементов отсутствует, гальваническая коррозия не может возникнуть. Если, например, предотвращается прямой контакт между двумя металлами (пластиковая шайба, лакокрасочная пленка и т. Д.) Или если есть какое-либо другое прерывание проводящего пути, гальванической коррозии не может быть, и каждый металл будет корродировать со своей нормальной скоростью в эта служебная среда.На рисунке 1 показаны примеры условий, которые не соответствуют всем требованиям к гальванической коррозии.
Рисунок 1
Рисунок 1: Примеры биметаллических комбинаций, когда гальваническая коррозия не может возникнуть
Примеры биметаллических комбинаций, когда гальваническая коррозия не может возникнуть
Когда два разных металла соединяются вместе в атмосфере или воде, вероятность развития гальванической коррозии можно предсказать с помощью «гальванического ряда». В специализированных приложениях, например, при заделке разнородных металлов в бетон, следует использовать данные о коррозии для этой конкретной среды.
Рисунок 2
На рисунке 2 показаны гальванические серии, измеренные в морской воде для некоторых распространенных металлов и сплавов. Когда два металла находятся дальше друг от друга в списке (например, большая разница между двумя числами), движущая сила гальванической коррозии увеличивается. Самые анодные (активные) металлы находятся вверху, а самые катодные (благородные) — внизу. Для нержавеющих сталей показаны как сплошные, так и полые стержни. Полые стержни представляют собой активно корродирующую нержавеющую сталь, которая имеет другой потенциал, чем пассивная (не корродирующая) нержавеющая сталь. В большинстве случаев, когда сочетаются разнородные металлы, для определения положения нержавеющей стали следует использовать пассивный (сплошной) стержень.
В большинстве случаев, когда сочетаются разнородные металлы, для определения положения нержавеющей стали следует использовать пассивный (сплошной) стержень.
Например, если цинк (представьте оцинкованную сталь), который является активным материалом и находится в верхней части списка, и нержавеющая сталь, благородный металл и в нижней части списка находятся в прямом контакте и в присутствии электролита (воды ), гальваническая коррозия произойдет, если они регулярно подвергаются воздействию электролита.
Рисунок 2: Гальваническая серия в морской воде
Гальваническая коррозия | Американская ассоциация гальванизаторов
Дом »
Коррозия »
Процесс коррозии »
Гальваническая коррозия
Существует два основных типа гальванических элементов, вызывающих коррозию: биметаллическая пара и концентрационная ячейка.Биметаллическая пара похожа на батарею, состоящую из двух разнородных металлов, погруженных в раствор электролита. Электрический ток (поток электронов) генерируется, когда два электрода соединены внешним проводящим путем.
Концентрационная ячейка состоит из анода и катода из одного и того же металла или сплава и пути обратного тока. Электродвижущая сила обеспечивается разницей в концентрации поверхностей на внешнем пути.
Для возникновения коррозии в гальваническом элементе необходимы четыре элемента:
- Анод — Электрод, в котором гальваническая реакция (-ы) генерирует электроны — отрицательные ионы разряжаются и образуются положительные ионы.На аноде возникает коррозия.
- Катод — Электрод, который принимает электроны — положительные ионы разряжаются, отрицательные ионы образуются. Катод защищен от коррозии.
- Электролит Проводник, по которому проходит ток.
 Электролиты включают водные растворы или другие жидкости.
Электролиты включают водные растворы или другие жидкости. - Путь обратного тока — Металлический путь, соединяющий анод с катодом. Часто это нижележащая металлическая подложка.
Все четыре элемента (анод, катод, электриолит и обратный ток) необходимы для возникновения коррозии. Удаление любого из этих элементов остановит прохождение тока и не произойдет гальванической коррозии. Замена анода или катода на другой металл может привести к изменению направления тока на противоположное, что приведет к переключению на электрод, подверженный коррозии.
Гальваническая серия металлов (справа) перечисляет металлы и сплавы в порядке убывания их электрической активности.Металлы, расположенные ближе к вершине таблицы, являются менее благородными металлами и имеют большую тенденцию к потере электронов, чем более благородные металлы, находящиеся ниже в списке.
контактирующих разнородных металлов | Американская ассоциация гальванизаторов
Дом »
Дизайн и изготовление »
Рекомендации по дизайну »
Контакт разнородных металлов
Сталь
, оцинкованная горячим способом, хорошо подходит для использования в различных средах и в различных конструкциях, и иногда она контактирует с различными металлами, включая, среди прочего, нержавеющую сталь, алюминий, медь и погодостойкую сталь.
Когда два разных металла контактируют в коррозионной среде, один из металлов подвергается ускоренной гальванической коррозии, в то время как другой металл остается гальванически защищенным.
Металлы, расположенные рядом друг с другом в гальванической серии, мало влияют друг на друга. Как правило, по мере того, как расстояние между металлами в серии увеличивается, коррозионное воздействие на металл, находящийся выше в серии, также увеличивается.
Относительные площади поверхности контакта разнородных металлов также важны для определения того, какой металл проявляет ускоренную коррозию.Нежелательно иметь большую поверхность катода в контакте с относительно небольшой поверхностью анода.
Гальваническая коррозия возникает, когда два разных металла контактируют в коррозионной среде: один из металлов испытывает повышенную скорость коррозии. Контактирующие металлы образуют биметаллическую пару из-за их различного сродства (или притяжения) к электронам. Это различное сродство создает электрический потенциал между двумя металлами, позволяя течь току.
Металл более высокого уровня в гальваническом ряду металлов, анод, обеспечивает защиту металла нижнего ряда, катода.
Как видно из гальванической серии, цинк защищает низкую сталь.
Что касается соприкасающихся поверхностей двух металлов, хотя ток коррозии, протекающий между катодом и анодом, не зависит от площади, скорость проникновения на аноде зависит от плотности тока. Таким образом, большая площадь анода в контакте с относительно небольшой площадью катода обычно не является проблемой. Несмотря на это, условия окружающей среды остаются решающими факторами скорости коррозии.
Таблица 1: Влияние биметалла на оцинкованную сталь в различных областях применения
Объяснение гальванической коррозии | ProTradeCraft
Контакт между разнородными металлами — например, медные фитинги, ввинченные в стальную трубу или медные фитинги, закрепленные стальными гвоздями, — вызывает электрохимическую реакцию, которая вызывает коррозию и приводит к разрушению «менее благородного» металла
Это видео предназначено для персонала нефтяных буровых установок, работающего на океанских буровых установках, но оно как можно более ясно объясняет, почему разнородные металлы корродируют при контакте. Ниже представлена слегка отредактированная версия звуковой дорожки. Мы также вставили диаграмму гальванического ряда на тот случай, если вам будет трудно прочитать ту, что показана на видео. Помните, что при креплении металлов (например, труб или гидроизоляции) старайтесь использовать металлы, которые находятся близко друг к другу в гальванической серии.
Ниже представлена слегка отредактированная версия звуковой дорожки. Мы также вставили диаграмму гальванического ряда на тот случай, если вам будет трудно прочитать ту, что показана на видео. Помните, что при креплении металлов (например, труб или гидроизоляции) старайтесь использовать металлы, которые находятся близко друг к другу в гальванической серии.
Большая часть оборудования, используемого в нефтяной промышленности, крепится болтами, часто на высоте. Здесь он подвергается неблагоприятным погодным условиям. Если мы выберем неправильный метод крепления оборудования, может возникнуть гальваническая коррозия и оборудование может упасть.Это произошло на относительно новой платформе, где деки весом пять килограммов упали всего через пару лет после установки. Доски крепились непосредственно к стальной конструкции с помощью алюминиевых горячих заклепок. Доски упали из-за гальванической коррозии.
Но что такое гальваническая коррозия? Гальваническая коррозия возникает, когда два разных металла или сплава с разными благородными свойствами и, следовательно, с разными электрохимическими потенциалами вступают в контакт друг с другом под водой или во влажной среде.В случае такого контакта менее благородный металл действует как анод, а более благородный металл действует как катод.
всегда вызывает коррозию анода.
Если для крепления оборудования из нержавеющей стали используется обычный винт из оцинкованной стали, он становится анодом, поскольку нержавеющая сталь более благородна. Чем больше площадь катода по отношению к аноду, тем быстрее анод подвергнется коррозии. В нашем примере винт быстро подвергнется коррозии не только из-за большего размера катода, но и из-за большого электрохимического потенциала.Обратите внимание, что гальваническая коррозия может также возникать между деталями из одного и того же металла, если детали расположены в разных условиях, например в областях с разными значениями pH. Для этого анод и катод должны находиться в электрическом контакте друг с другом.
Специальная сталелитейная промышленность Северной Америки (SSINA)
Как предотвратить гальваническую коррозию при проектировании или установке нового оборудования? Например, как выбрать правильные болты для установки алюминиевого знака на высоте? Многие из нас были бы счастливы, если бы мы нашли болт подходящей длины и подходящего диаметра, но достаточно ли этого? Мы также ожидаем, что качественный болт обеспечит качественный монтаж, но всегда ли это правильно?
Если для крепления алюминия используются болты из кислотостойкой или оцинкованной стали, следует использовать неметаллическую шайбу для изоляции металлов друг от друга.В противном случае алюминий может действовать как анод и разъедать вокруг болта. В этом случае соединение будет ослаблено в случае дополнительных внешних воздействий, таких как ветер. В этом случае знак может ослабнуть и упасть, а болт останется позади. Помните, что слабым местом изолирующей шайбы может быть то, что винты или болты теряют свое предварительное натяжение.
Вот несколько советов по предотвращению гальванической коррозии.
1) Получите обзор и выберите правильные болты. Просмотрите типы материалов, используемых в оборудовании и конструкции, к которой оборудование будет крепиться. Выбирайте болты, соответствующие соответствующей нагрузке и окружающей среде.
2) Используйте металлы с таким же или почти таким же благородством.
3) Избегайте контакта между разными материалами. Если вам необходимо использовать разные материалы, используйте шайбы, чтобы предотвратить прямой контакт материалов друг с другом.
4) Используйте краску в качестве буфера. Альтернативный метод предотвращения контакта между материалами — окраска поверхности.Не забудьте покрасить самую благородную часть — катод. Если вы покрасите анод и в краске образуется трещина, гальванический ток, протекающий до этого места, может привести к значительной коррозии. Обратите внимание, что кривошипы из оцинкованных материалов также могут вызвать аналогичные проблемы.
Обратите внимание, что кривошипы из оцинкованных материалов также могут вызвать аналогичные проблемы.
5) Размер катода имеет значение. Размер области катодного контура, подверженной воздействию воды или другой жидкости, определяет, насколько быстро анод будет корродировать.
6) Для трубопровода следуйте спецификации трубы. Для трубопроводных соединений следуйте спецификациям труб, чтобы убедиться, что болты и уплотнительные кольца, используемые во фланцевых соединениях, изготовлены из правильного материала.
7) При соединении трубопроводов из двух разных материалов рассмотрите возможность использования изоляционных катушек. В системах морской воды изоляционные катушки должны быть как минимум в десять раз больше диаметра трубопровода. Изолирующие катушки должны быть непроводящими, например стеклопластиком, или должны быть обработаны изнутри, например, эпоксидной краской или вулканизированной резиной. Изолирующие катушки не рекомендуются для трубопроводов с углеводородными подшипниками.
8) Рассмотрите возможность использования расходных анодов для защиты металлов в морской воде и тем самым предотвращения коррозии.
9) Частые осмотры также могут помочь предотвратить гальваническую коррозию, вызывающую несчастные случаи или возможные аварии.
—Collaboration for Safety (Samarbeid for Sikkerhet) — это норвежское государственно-частное сотрудничество, направленное на повышение безопасности в нефтегазовой отрасли.
Несовместимые металлы, ответственные за коррозию — Monarch Metal
Во время технического обслуживания в 1980-х годах рабочие обнаружили, что у Статуи Свободы была серьезная структурная проблема: внутренняя опорная система статуи из кованого железа ржавела, потому что изолирующий слой шеллака между железом и медью вышел из строя, что привело к гальванической коррозии. происходить.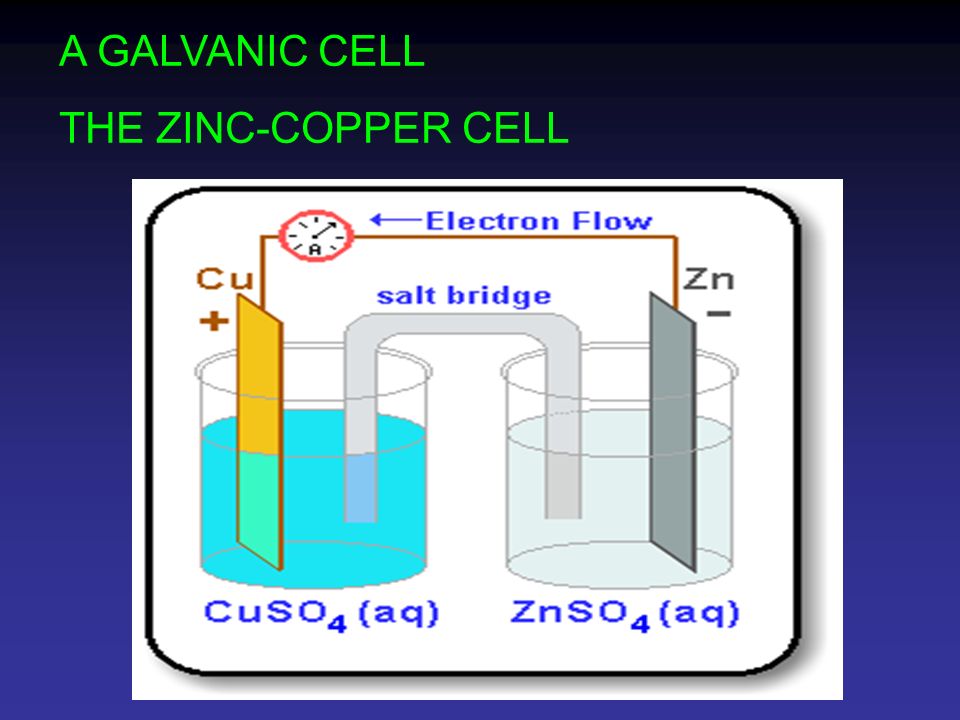 Хотя это не был верный рецепт структурной катастрофы, это все же была серьезная структурная проблема, на которую потребовались миллионы долларов и месяцы работы, чтобы гарантировать, что структурная целостность Леди Либерти будет лучше подготовлена к тому, чтобы выдержать испытание временем.
Хотя это не был верный рецепт структурной катастрофы, это все же была серьезная структурная проблема, на которую потребовались миллионы долларов и месяцы работы, чтобы гарантировать, что структурная целостность Леди Либерти будет лучше подготовлена к тому, чтобы выдержать испытание временем.
В то время как атмосферная и щелевая коррозия являются одними из наиболее распространенных причин ухудшения состояния металла в конструктивных элементах, гальваническая коррозия, еще одна распространенная причина ухудшения качества металла, также широко распространена. Тем не менее, эту пагубную химическую реакцию часто неправильно понимают многие представители строительной индустрии.
Как дизайнер, строитель, инженер или архитектор, работающий с наружными металлами, вы, возможно, слышали о термине гальваническая коррозия (также известная как биметаллическая коррозия) или, по крайней мере, знакомы с концепцией оцинкованных металлов. такие как сталь, покрытая тонким слоем цинка для предотвращения ржавчины, которые используют «контролируемую» форму гальванической коррозии для достижения своих коррозионных свойств.
В то время как большинство людей знают, что гальваническая коррозия опасна, немногие знают, как она работает, как ее реальные последствия сказываются с точки зрения структурной безопасности и что можно сделать, чтобы этого избежать.
В этой статье содержится важная информация о гальванической коррозии и связанных с ней соображениях безопасности.
Что такое гальваническая коррозия?
Проще говоря, гальваническая коррозия — это повреждение или разрушение металла, которое происходит между разнородными металлами из-за электрохимической реакции. В частности, это происходит, когда два разных металла вступают в контакт друг с другом и либо были погружены в воду, либо смочены электролитом, при этом коррозия происходит вокруг точки, где встречаются два металла.Кроме того, эта реакция может катализироваться веществами, которые увеличивают проводимость воды, например солью, и, таким образом, скорость коррозии может варьироваться в зависимости от среды, в которой происходит реакция.
Гальваническая коррозия возникает из-за того, что каждый металл имеет свой собственный потенциал электропроводности. Эта разница в потенциале электродов, в свою очередь, вызывает коррозионную атаку на положительно заряженный металл (анод), заставляя его растворяться в электролите.
Чаще всего гальваническую коррозию можно увидеть в водопроводных системах, где медная труба напрямую соединена со стальной или железной трубой.При контакте оба металла могут подвергнуться гальванической коррозии из-за электрического или гальванического тока, протекающего на аноде и катоде пары металлов.
Помимо солености окружающей среды, серьезность гальванической коррозии, которая возникает при соприкосновении двух металлов, зависит также от нескольких других факторов, в том числе:
- Несходство двух участвующих металлов и разность электродных потенциалов каждого из них.
- Поверхность каждого металла и наличие на ней защитной пленки.
- Свойства электролита, включая скорость потока, объем, температуру, ионные частицы, проводимость и pH.
- Наличие поблизости бетона, заделанного ацетатом натрия.
- Влажность, влажность, воздействие солнца, перепады температуры и т. Д. Окружающей среды.
- Геометрические и физические факторы, такие как площадь поверхности, точка контакта и расстояние между металлами.
- Металлургические свойства, такие как сплав сплава, механическое нарушение и термообработка.
- Другие факторы, такие как обратимые электродные потенциалы, химические реакции и микробиологические факторы.
Примеры электрохимической коррозии
В дополнение к примеру со Статуей Свободы, приведенному в начале этой статьи, было несколько других громких примеров гальванической коррозии, влияющей на целостность конструкции.
Еще один из этих известных примеров — собор Святой Марии в Токио, известная католическая церковь, построенная в 1964 году с уникальным металлическим дизайном. В 2002 году была опубликована фотография здания, на которой была запечатлена крыша из нержавеющей стали, и хотя она была грязной, она была полностью защищена от коррозии. Однако всего несколько лет спустя крыша здания обвалилась во время шторма. Как это произошло? Что ж, за прошедшие годы неметаллический разделитель между металлической крышей и металлической конструкцией значительно испортился. После того, как этот инертный сепаратор был потерян, гальванической коррозии, вызванной систему поддержки стали углерода, чтобы потерпеть неудачу. К сожалению, это общая тема для многих из этих ярких примеров: дизайнеры часто не понимают, что если система облицовки или крыши рассчитана на срок службы в течение всего срока службы здания, то то же самое должно относиться и к несущей конструкции.
В 2002 году была опубликована фотография здания, на которой была запечатлена крыша из нержавеющей стали, и хотя она была грязной, она была полностью защищена от коррозии. Однако всего несколько лет спустя крыша здания обвалилась во время шторма. Как это произошло? Что ж, за прошедшие годы неметаллический разделитель между металлической крышей и металлической конструкцией значительно испортился. После того, как этот инертный сепаратор был потерян, гальванической коррозии, вызванной систему поддержки стали углерода, чтобы потерпеть неудачу. К сожалению, это общая тема для многих из этих ярких примеров: дизайнеры часто не понимают, что если система облицовки или крыши рассчитана на срок службы в течение всего срока службы здания, то то же самое должно относиться и к несущей конструкции.
Конечно, не все из нас работают с ультрасовременными металлическими церквями в Японии, так какие еще реальные примеры последствий гальванической коррозии для безопасности, с которыми может столкнуться средний архитектор или дизайнер? Допустим, вы хотите построить фасад из нержавеющей стали, который крепится шурупами. Теперь, если вы выберете винты, покрытые цинком, нержавеющая сталь будет агрессивно разъедать цинк, потому что крепежные детали, покрытые цинком, атакуют этот разнородный металл со всех сторон.Очевидно, что это плохо: винты и анкеры жизненно важны для структурной целостности, а коррозия винтов может привести к разрушению конструкции. Не говоря уже об уродливых следах ржавчины и белой коррозии, которые будут кровоточить по обшивке здания, когда металл разъедает.
Поэтому выбирать крепежные детали с цинковым покрытием на металле рекомендуется только в том случае, если ваш металл такой же или имеет такое же благородство, что и цинк. Другими словами, вы можете выбрать оцинкованные крепежные детали для использования с алюминием, поскольку он намного ближе к цинку в гальванической серии (рейтинг молекулярного сходства различных металлов) и, следовательно, менее отличается, что, в свою очередь, означает, что не будет много коррозии.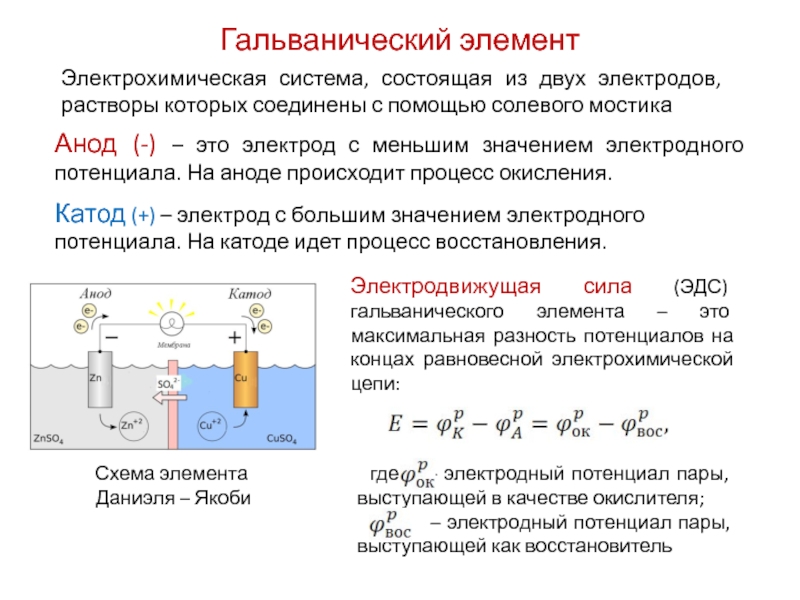 Однако вы можете полностью избежать гальванической коррозии, выбрав подходящие металлические анкеры. Так, например, выбор цинка вместо цинка будет иметь наименьший риск коррозии. Воспользуйтесь приведенной ниже таблицей, чтобы лучше понять, какие металлы лучше всего работают вместе без возможности гальванической коррозии:
Однако вы можете полностью избежать гальванической коррозии, выбрав подходящие металлические анкеры. Так, например, выбор цинка вместо цинка будет иметь наименьший риск коррозии. Воспользуйтесь приведенной ниже таблицей, чтобы лучше понять, какие металлы лучше всего работают вместе без возможности гальванической коррозии:
Нажмите, чтобы увеличить
Как предотвратить гальваническую коррозию
Принимая во внимание реактивность и благородство металлических конструкционных материалов при выборе строительных компонентов, это один из способов предотвращения коррозии в результате гальванического взаимодействия, но не единственный.Также возможно предотвратить гальваническую реакцию в металлических конструкциях и материалах, выбрав соответствующие строительные материалы и компоненты. Вот несколько примеров:
- Предотвращение электрических соединений: в случаях, когда необходимо соединить два разнородных металла, лучше всего разделить их любым непроводящим компонентом, например, диэлектрическими фитингами на трубах.
- Использование коррозионно-стойких соединителей: при соединении двух разнородных металлов, например, в случаях, когда медь используется с железными трубами, лучше использовать паяное или паяное соединение вместо резьбового или механического, поскольку первое более прочное, чем последний.
- Выбор правильного размера или площади соединяемых металлов: когда дело доходит до соединения двух разнородных металлов, более благородный металл должен иметь меньшую площадь, а менее благородный металл — большую площадь.
- Используйте антиоксиданты: при работе с медью или алюминием используйте антиоксидантные пасты.
- Предотвращение контакта с электролитом: покрытие металлов гидрофобными веществами, такими как смазка, предотвращает контакт с электролитом, замедляя любую потенциальную коррозию.
- Правильное использование защитных покрытий: если вы используете антикоррозионную краску или покрытие, убедитесь, что покрыты оба металла, а не только один.

- Использование расходуемого анода: в некоторых случаях вы также можете покрыть компонент материалом, который служит «жертвенным анодом». Таким образом, когда коррозия все же происходит, она только отколет жертвенный анод и не повредит компонент под ним до тех пор, пока весь расходуемый анод не будет корродирован (как в случае с гальванизированным железом или сталью, в которых в качестве расходуемого анода используется тонкий слой цинка. для предотвращения ржавчины).
Всегда ли вредна гальваническая коррозия?
Хотя гальванической коррозии обычно избегают любой ценой, в некоторых отраслях можно использовать контролируемую гальваническую реакцию для продления срока службы актива.Объединение металла с металлом, который находится выше в гальванической серии, может вызвать коррозию анода, одновременно защищая катоды анода, которые в противном случае были бы подвержены риску. Этот метод известен как катодная защита, и хотя он дорогостоящий, он часто используется для труднодоступных мест, таких как заглубленные трубопроводы или корпуса судов.
Заключение
Гальваническая коррозия — это дорогостоящая проблема, которая может не только привести к появлению некрасивых пятен ржавчины и металлической отделки, но также является серьезным фактором безопасности, который может привести к катастрофическому и смертельному разрушению конструкции, если его не остановить.Однако, приняв некоторые меры, можно обеспечить безопасность ваших зданий от гальванической коррозии. Помните об этих факторах, чтобы предотвратить и контролировать гальваническую реакцию, а также обеспечить безопасность и долговечность вашего здания.
Если вам нужна дополнительная информация о коррозионных свойствах металлов, которые мы используем в наших продуктах, позвоните нам по телефону (631) 750-3000.
Гальваническая коррозия: объяснение предотвращения и снижения рисков
Коррозия является серьезной проблемой при выборе материалов для трубопроводов и проектировании трубопроводных процессов. Несмотря на то, что нержавеющая сталь обладает высокой устойчивостью ко многим формам коррозии, важно помнить о рисках для безопасной долгосрочной эксплуатации и снижения затрат в течение всего срока службы вашей системы.
Несмотря на то, что нержавеющая сталь обладает высокой устойчивостью ко многим формам коррозии, важно помнить о рисках для безопасной долгосрочной эксплуатации и снижения затрат в течение всего срока службы вашей системы.
В этом руководстве мы обсудим гальваническую коррозию, где и когда она может произойти, и как вы можете минимизировать риск или предотвратить гальваническую коррозию при использовании труб из нержавеющей стали.
Что такое гальваническая коррозия?
Также известная как биметаллическая коррозия или коррозия разнородных металлов, гальваническая коррозия — это коррозионное повреждение, возникающее из-за соединения двух разнородных металлов в присутствии электролита.
Таким образом, это означает, что должны быть выполнены три условия, чтобы гальваническая коррозия стала проблемой:
- Должно присутствовать несколько металлов с разным электродным потенциалом или благородством. Чем больше разница, тем выше риск гальванической коррозии.
- Эти металлы должны находиться в электрическом контакте.
- Должно произойти воздействие электролита, например соленой воды.
В этом процессе один металл — анод — будет корродировать быстрее, чем один, в то время как другой — катод — будет корродировать медленнее, чем сам по себе.
Предотвращение гальванической коррозии
Во многом минимизация риска гальванической коррозии заключается в простом отказе от сочетания трех перечисленных выше элементов. Однако для многих отраслей — например, для обработки химикатов или работы на море в богатой солью среде — это легче сказать, чем сделать.
Учитывайте следующее при проектировании или обслуживании трубопроводов, в которых существует проблема гальванической коррозии.
Объяснение гальванической серии (электродный потенциал)
Одним из основных шагов по предотвращению гальванической коррозии является выбор металлов с аналогичными электродными потенциалами или благородством.
Как показано на изображении выше, многие сплавы нержавеющей стали расположены ближе к катодному концу шкалы. Это означает, что они с меньшей вероятностью пострадают от гальванической коррозии. Однако при использовании крепежных деталей с высоким содержанием анода, конструктивных элементов, клапанов или других компонентов большая разница в благородстве может привести к быстрой деградации других компонентов.
Это обычно наблюдается, когда углеродистая сталь или алюминий используются вместе с трубами из нержавеющей стали.
Компоненты гальванической коррозии, связанные с окружающей средой
Важно отметить, что риски гальванической коррозии также зависят от электролита, соединяющего оба металла.Например, риск гальванической коррозии в очень чистой воде минимален. Тем не менее, примените те же металлы в морской среде или среде, богатой хлоридом, и вы увидите, что коррозия происходит очень быстро.
Хотя ваш точный опыт будет зависеть от многих факторов, и вам всегда следует обращаться к инженеру за точной информацией, относящейся к вашим конкретным потребностям, в следующей таблице приведены примеры рисков гальванической коррозии, которых следует ожидать от обычных сочетаний металлов.
Варианты снижения риска гальванической коррозии
Даже при выборе идеальных материалов невозможно полностью исключить риск гальванической коррозии.Если это так, изоляция компонентов и прерывание электрического пути, где это возможно, являются эффективными вариантами для дальнейшего повышения коррозионной стойкости и обеспечения длительного срока службы.
Варианты включают:
- Изоляция разнородных материалов с использованием покрытий из непроводящих материалов, смазок, красок, пропиток или грунтовок. Оптимальная защита обеспечивается изоляцией обоих материалов. Однако изоляция только анодного материала может помочь замедлить развитие гальванической коррозии, даже если она не предотвращает ее полностью.

- Использование буферов, таких как обертки труб, зажимные вкладыши и изнашиваемые накладки, между разнородными металлами для исключения образования гальванических элементов и прерывания электрических цепей.
- Гальваника, или гальваника, также является эффективным средством снижения риска гальванической коррозии или изменения электродного потенциала компонентов без полного изменения их структуры. Например, крепежные детали из углеродистой стали обычно покрывают цинком для значительного повышения коррозионной стойкости. Однако можно использовать и любой благородный металл, например хром, никель или золото.
Основные выводы
В то время как трубы и компоненты трубопроводов из нержавеющей стали являются популярным выбором из-за их превосходной устойчивости к коррозии, такая же стойкость может также затруднить сопряжение других металлов с нержавеющей сталью, когда возникает проблема гальванической коррозии.
- Гальваническая коррозия требует электрического контакта двух разнородных металлов в присутствии электролита.
- Металлы, находящиеся дальше друг от друга по гальванической шкале (или с большим электродным потенциалом), подвергаются более высокому риску гальванической коррозии.
- Факторы окружающей среды (например, концентрация электролита, скорость потока и температура) могут еще больше повлиять на риски гальванической коррозии.
- Изоляция, буферы и покрытие — все это предлагает эффективные способы минимизировать риски коррозии при соединении других металлов с изделиями из нержавеющей стали.
Как ведущий поставщик труб из нержавеющей стали и других компонентов из нержавеющей стали в Канаде и Северной Америке, Unified Alloys понимает сложность выбора идеальных материалов для трубопроводных процессов и других проектов из нержавеющей стали в различных отраслях промышленности.Работаете ли вы в нефтяной промышленности, пищевой промышленности или здравоохранении, наши опытные аналитики по продажам обладают опытом, который поможет вам найти идеальные решения для ваших нужд.

 Явление именуется «децинкификация». Латунный элемент, подверженный этому явлению, представляет собой неприятное зрелище и теряет свою прочность.
Явление именуется «децинкификация». Латунный элемент, подверженный этому явлению, представляет собой неприятное зрелище и теряет свою прочность.  2%
2%
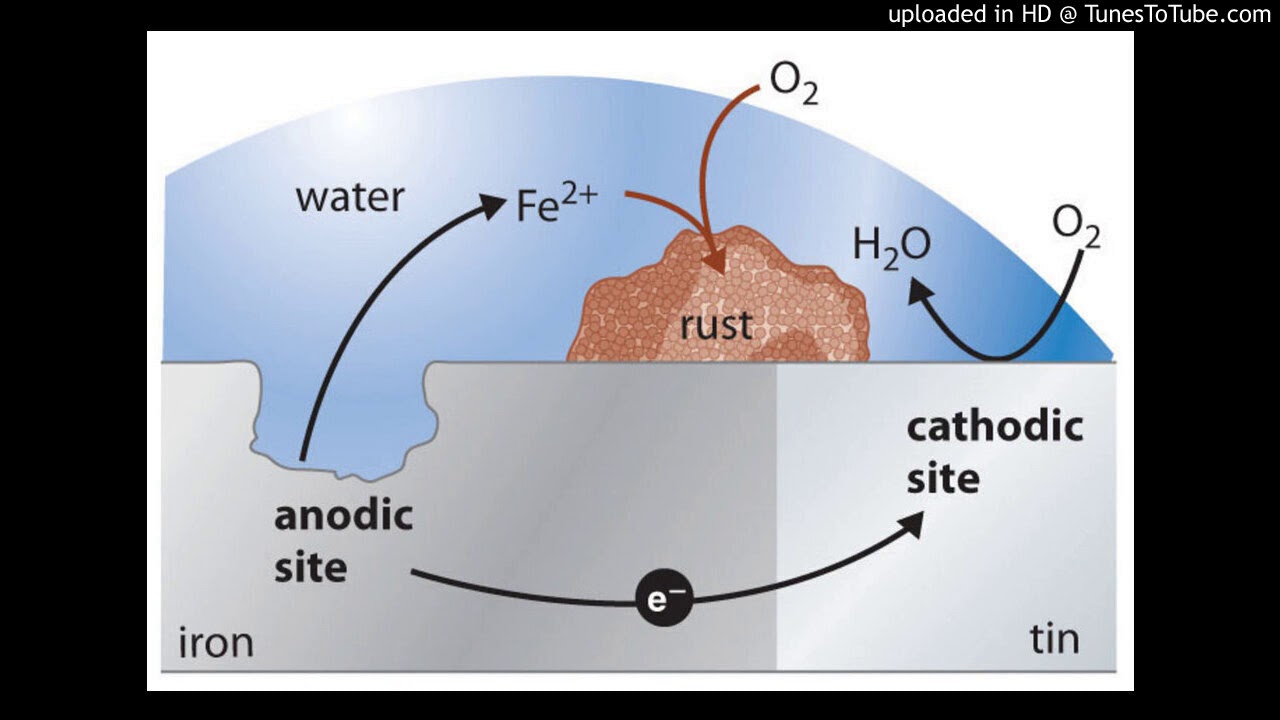 В результате механического воздействия оголяется поверхность материала находившегося под защищающим его слоем, что приводит к образованию гальванической пары олово-железо. Сталь в данном месте будет разрушаться очень быстро.
В результате механического воздействия оголяется поверхность материала находившегося под защищающим его слоем, что приводит к образованию гальванической пары олово-железо. Сталь в данном месте будет разрушаться очень быстро. Несмотря на героические попытки остановит ее, коррозия молчаливо съедает металлические детали вашей лодки, пока не остается другой альтернативы, как заменить их. Понимание процесса, однако, является первым шагом к предотвращению его. Фотография вверху показывает деталь, принесенную в нашу мастерскую – и это не самый «тяжелый» случай жестокости моря по отношению к металлу, что мне приходилось видеть. Морской воздух также может быть беспощаден.
Несмотря на героические попытки остановит ее, коррозия молчаливо съедает металлические детали вашей лодки, пока не остается другой альтернативы, как заменить их. Понимание процесса, однако, является первым шагом к предотвращению его. Фотография вверху показывает деталь, принесенную в нашу мастерскую – и это не самый «тяжелый» случай жестокости моря по отношению к металлу, что мне приходилось видеть. Морской воздух также может быть беспощаден.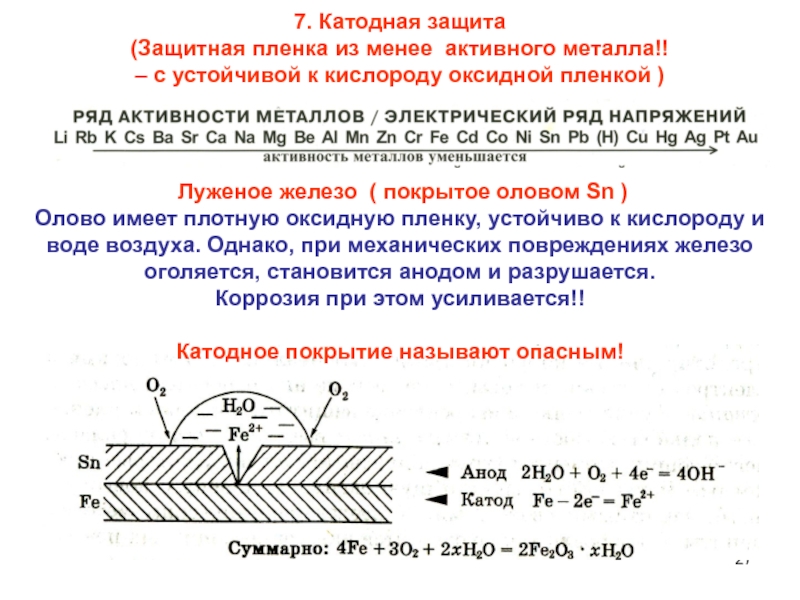 Металлы наверху таблицы называются «катоды», а те, что внизу – «аноды».
Металлы наверху таблицы называются «катоды», а те, что внизу – «аноды». С другой стороны, электролитическая коррозия – это результат принудительного протекания электрического тока через электролит к любому из двух металлов. И они не обязательно должны быть разными. Причиной тока служит внешний источник питания, и ток в электролите течет от анода (+) к катоду (-). Как и в предыдущем случае, анод будет разрушаться. Но в этом случае процесс более быстрый и зависит от силы тока. (Рис.2.)
С другой стороны, электролитическая коррозия – это результат принудительного протекания электрического тока через электролит к любому из двух металлов. И они не обязательно должны быть разными. Причиной тока служит внешний источник питания, и ток в электролите течет от анода (+) к катоду (-). Как и в предыдущем случае, анод будет разрушаться. Но в этом случае процесс более быстрый и зависит от силы тока. (Рис.2.) Но конвертация для морских условий автомобильных двигателей, приспособленных к охлаждению пресной водой или антифризами, выдвигает эту проблему на первый план. Выходом из ситуации служит применение водо-водяных холодильников, но, к сожалению, и они требуют замены через 5-7 лет. Здесь имеется несколько проблем. Обычная коррозия чугуна значительно ускоряется при повышении температуры, к тому же, после остановки двигателя, вода остается в системе, продолжая процесс. Любая влага в выхлопной системе также усугубляет ситуацию.
Но конвертация для морских условий автомобильных двигателей, приспособленных к охлаждению пресной водой или антифризами, выдвигает эту проблему на первый план. Выходом из ситуации служит применение водо-водяных холодильников, но, к сожалению, и они требуют замены через 5-7 лет. Здесь имеется несколько проблем. Обычная коррозия чугуна значительно ускоряется при повышении температуры, к тому же, после остановки двигателя, вода остается в системе, продолжая процесс. Любая влага в выхлопной системе также усугубляет ситуацию. Одним из таких мест является дейдвудная труба, в которой гребной вал находится в застойной воде, очень бедной на кислород. На фотографии показан гребной вал, подверженный серьезной точечной коррозии вследствие отсутствия кислорода в дейдвудной трубе.
Одним из таких мест является дейдвудная труба, в которой гребной вал находится в застойной воде, очень бедной на кислород. На фотографии показан гребной вал, подверженный серьезной точечной коррозии вследствие отсутствия кислорода в дейдвудной трубе. Электролиты включают водные растворы или другие жидкости.
Электролиты включают водные растворы или другие жидкости.
