Карбид кальция: формула, реакция с водой (гидролиз), получение и хранение
Карбид кальция имеет резкий чесночный запах и сильно поглощает воду. Его плотность повышается с увеличением количества примесей и изменяется в пределах 2,22-2,8 г/см3. Молекулярная масса — 64,102. Технический карбид кальция выпускают по ГОСТ 1460.
- Карбид кальция
- химическое соединение кальция с углеродом, в чистом виде представляющее собой белое кристаллическое вещество. Химическая формула — СаС2
- Технический карбид кальция
- твердый кускообразный материал, цвет излома которого меняется в зависимости от содержания карбида кальция. При содержании 60-75% СаС2 — имеет излом серого цвета, переходящий в фиолетовый при более высоком содержании CaC2. Высокопроцентный (80% СаС2 и выше) — имеет окраску от светло-коричневого до голубовато-черного.
История получения карбида кальция
Карбид кальция был получен случайно в 1862 г. Немецкий химик Фридрих Вёлер (Friedrich W?hler) при попытке выделения металлического кальция из извести (карбоната кальция СаСО3) путем длительного прокаливания смеси, состоящей из извести и угля, получил массу сероватого цвета, в которой не обнаружил признаков металла. Как результат неудавшегося эксперимента он выбросил эту массу на свалку во дворе. Во время дождя лаборант заметил выделение какого-то газа из выброшенной массы. Это заинтересовало Фридриха Вёлера, он провел анализ газа и установил, что это ацетилен (С2Н2), ранее открытый Эдмундом Дэви (Edmund Davy), в 1836 г.
Немецкий химик Фридрих Вёлер (Friedrich W?hler) при попытке выделения металлического кальция из извести (карбоната кальция СаСО3) путем длительного прокаливания смеси, состоящей из извести и угля, получил массу сероватого цвета, в которой не обнаружил признаков металла. Как результат неудавшегося эксперимента он выбросил эту массу на свалку во дворе. Во время дождя лаборант заметил выделение какого-то газа из выброшенной массы. Это заинтересовало Фридриха Вёлера, он провел анализ газа и установил, что это ацетилен (С2Н2), ранее открытый Эдмундом Дэви (Edmund Davy), в 1836 г.
Однако имя этому газу присвоил французский химик Пьер Эжен Марселен Бертло (Marcellin Berthelot) после того, как в 1863 году получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами.
Томас Уилсон (Thomas Leopold «Carbide» Willson) в 1888 году и Фердинанд Фредерик Анри Муассан (Ferdinand Frederic Henri Moissan) в 1892 независимо друг от друга открыли метод получения карбида кальция в дуговой электропечи, что послужило толчком для дальнейшего развития промышленного получения технического карбида кальция.
В России первые заводы по изготовлению карбида кальция были построены акционерным обществом «Перун» в 1908 г. в Земковицах, а в 1910 г. в Петербурге. В 1914 г. на этом заводе работали две карбидные печи мощностью по 500 кВт и две печи по 900 кВт.
В 1917 г. при Макеевском металлургическом заводе была построена установка с электропечью мощностью 1800 кВт. Почти одновременно на заводе в Баку для нужд нефтепромышленности и на Аллавердском медеплавильном заводе также были пущены карбидные печи.
В 1930 г. был построен и пущен первый большой карбидный завод в Растяпино (ныне г. Дзержинск Нижегородской области). На этом заводе карбид кальция впервые стал выпускаться не только как товарный продукт, но и для получения цианамида кальция.
Получение карбида кальция
Технический карбид кальция получают в результате взаимодействия обожженной извести (СаО) с коксом (3С) или антрацитом в электрических печах при температуре 1900-2300°С. Шихту, состоящую из смеси кокса или антрацита и извести в определенной пропорции, загружают в электропечь, шихта расплавляется, при этом происходит эндотермическая химическая реакция (с поглощением тепла) по формуле:
СаО+3С = СаС2+СО -108 ккал/моль
Таким образом, для получения 1 т карбида кальция требуется:
- 4000 кг извести
- 600 кг кокса
- 1965 кВт·ч электроэнергии
Однако вследствие значительных потерь энергии в карбидных печах практически для получения 1 т технического карбида кальция расходуется от 2800 до 3700 кВт·ч в зависимости от мощности печи. Если мощность печи меньше 1000 кВт, то расход электроэнергии может достичь 4000 кВт·ч/т и более.
Если мощность печи меньше 1000 кВт, то расход электроэнергии может достичь 4000 кВт·ч/т и более.
Расплавленный карбид кальция сливают из печи в специальные изложницы, в которых он остывает и затвердевает. После затвердевания его дробят в щековых дробилках и сортируют в решетчатых барабанах на куски различной величины от 2 до 80 мм.
Выход кусков различных размеров при дроблении приведен ниже:
| Грануляция, мм | 25-80 | 15-25 | 8-15 | 2-8 | до 2 |
|---|---|---|---|---|---|
| Выход, % | 66-80 | 8-10 | 6-14 | 4,5-6,5 | 1,5-3,0 |
Товарным карбидом кальция считается грануляцией от 2 до 100 мм. Карбидная пыль, получающаяся при дроблении, непригодна для нормальных ацетиленовых генераторов из-за слишком энергической реакции с водой, перегрева и опасности взрыва.
Зависимость удельного веса технического карбида кальция от содержания в нем СаС2, приведена в таблице ниже:
| Содержание СаС2 в техническом карбиде, % | 80 | 75 | 70 | 65 | 60 | 55 |
|---|---|---|---|---|---|---|
| Удельный вес технического карбида | 2,32 | 2,37 | 2,41 | 2. 45 45 | 2,49 | 2,53 |
Технический карбид кальция, получаемый в электропечах, содержит ряд примесей, попадающих в него из исходных материалов, которыми пользуются при его производстве. Средний химический состав применяемого для сварки:
| Компонент | Содержание, % (по массе) |
|---|---|
| Карбид кальция (СаС2) | 72,5 |
| Известь (СаО) | 17,3 |
| Окись магния (MgO) | 0,4 |
| Окись железа (Fe2O3) и окись алюминия (Al2O3) | 2,5 |
| Окись кремния (SiO2) | 2,0 |
| Сера (S) | 0,3 |
| Углерод (С) | 1,0 |
| Другие примеси | 4,0 |
Как видно из приведенного состава, основной примесью является известь.
Примеси, содержащиеся в исходных материалах, применяемых для производства, ухудшают его качество. Особенно вредными примесями являются фосфор и сера, которые переходят в карбид кальция в виде фосфористых и сернистых соединений кальция, а при разложении карбида попадают в ацетилен в виде фосфористого водорода и сероводорода.
Гидролиз или карбид кальция плюс вода
При взаимодействии карбида кальция и воды происходит реакция, которая называется гидролиз. Когда-то гидролиз карбида кальция был основным промышленным способом для получения ацетилена — горючего газа, применяемого при газовой сварке и газовой резке. Еще об одном способе получения можно узнать из статьи о получении ацетилена.
При взаимодействии карбида кальция (CaC2) с водой (H2O) получается газ — ацетилен (C2H2) и гашеная известь (Ca(OH)2), являющаяся отходом. Химическая активность карбида кальция по отношению к воде столь велика, что он разлагается даже кристаллизационной водой, содержащейся в солях.
Экзотермическая реакция (т.е. с выделением тепла) взаимодействия карбида кальция с водой протекает бурно по уравнению:
CaC2+2H2O=C2H2+Ca(OH)2 +30,4 ккал/моль
Тепловой эффект реакции слагается из тепла, выделяемого при взаимодействии с водой карбида кальция и негашеной извести. Взаимодействие извести с водой протекает по уравнению:
СаО+H2O = Ca(OH)2 +15,2 ккал/моль
- Выход ацетилена
- объем ацетилена в литрах, выделяемый при разложении 1 кг карбида, приведенный к 20° и 760 мм рт. ст.
Для разложения 1 кг химически чистого карбида кальция теоретически необходимо 0,562 кг воды, при этом получается 0,406 кг ацетилена (285 л) и 1,156 кг гашеной извести.
Значительный тепловой эффект реакции карбида кальция и опасность перегрева ацетилена заставляют вести процесс с большим избытком воды для охлаждения. Это делает процесс более безопасным. Температура выходящего из генератора ацетилена при этом превышает температуру окружающей среды всего на 10-15°С.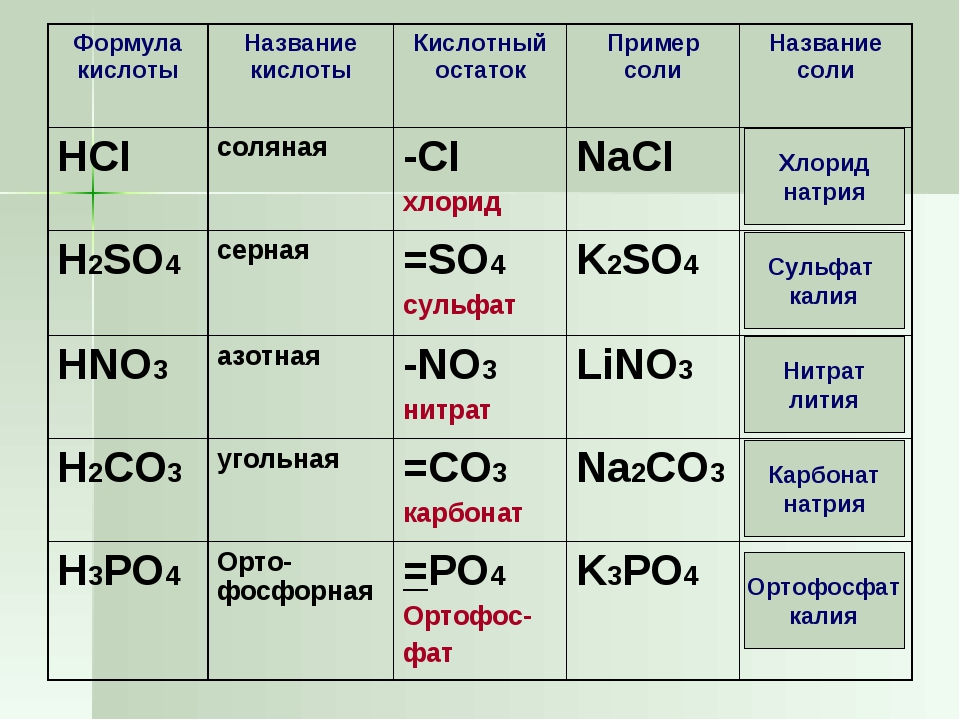
Количество воды необходимое для реакции с карбидом кальция
Минимальное количество воды, необходимое для охлаждения при реакции 1 кг карбида кальция, может быть рассчитано следующим образом.
При разложении 1 кг 70%-го карбида кальция образуется 0,284 кг ацетилена и 1,127 кг гидрата окиси кальция т.е. гашеной извести (принимая содержание окиси кальция в карбиде кальция равным 24%).
Принимаем, что начальная температура воды равна 15° С, а температура в генераторе во время работы равна 60° С. Уравнение теплового баланса для 1 кг карбида кальция выражается следующим образом:
q=q1+q2+q3+q4+q5
где q — количество тепла, выделяющееся при разложении 1 кг 70%-го карбида кальция, равное 397 ккал/кг
q1 — количество тепла, затрачиваемое на нагревание получаемой гашеной извести с 15 до 60°С:
q1= 1,127?(60-15)-0,23= 11,7 ккал
0,23 — средняя теплоемкость гидрата окиси кальция в ккал/кг
q2 — количество тепла, затрачиваемое на нагревание получаемого ацетилена с 15 до 60° С:
q2=0,284?(60-15)-0,336 = 4,3 ккал
0,336 — средняя теплоемкость 1 кг ацетилена в ккал в указанном интервале температур
q3 — тепло, затрачиваемое на испарение воды в количестве 0,034 кг (при 60° С содержание водяных паров, насыщающих ацетилен, полученный из 1 кг карбида кальция, равно 34 г) скрытая теплота парообразования воды — 539 ккал/кг
q3 = 0,034?539+0,034?1?(60-15) -19,9 ккал
q4 — потеря тепла в окружающую среду и на нагревание стенок генератора, она составляет примерно 7% от общего количества выделяющегося тепла:
q4=397?7/100=27,8 ккал
q5 — количество тепла, расходуемое на нагревание воды до температуры 60° С:
q5=q?(q1+q2+q3+q4)=397?(11,7+4,3+19,9+27,8) = 336,3 ккал
Искомый минимальный безопасный объем воды равен:
V=q5/(60-15)?1=336,3/45?7,5 л
Так как 1 м3 ацетилена при абсолютном давлении 1 кгс/мм2 и 20°С весит 1,09 кг, следовательно, из 1 кг химически чистого карбида кальция теоретически можно получить 0,406/1,09 = 0,3725 м3, или 372,5 л ацетилена.
Как уже говорилось выше, технический карбид кальция обычно содержит не более 70-80% CaC2. Поэтому из 1 кг технического карбида кальция можно получить от 230 до 280 л ацетилена.
Если учесть потери ацетилена на растворение в воде и продувку ацетиленового генератора, то для получения 1 м3 (1000 дм3) ацетилена практически приходится расходовать 4,3-4,5 кг карбида кальция. Более точные данные о фактическом выходе ацетилена в зависимости от количества примесей (сорта) и размеров «кусков» (грануляции) указаны в ГОСТ 1460.
Параметры влияющие на скорость реакции с водой
Чем меньше размеры кусков, тем быстрее происходит реакция карбида кальция с водой.
Карбид кальция размером 50?80 мм разлагается полностью в течение 13 мин, а размером 8?15 мм — в течение 6,5 мин.
При величине кусков менее 2 мм карбид кальция считается отходом и называется карбидной пылью. Карбидная пыль разлагается практически мгновенно.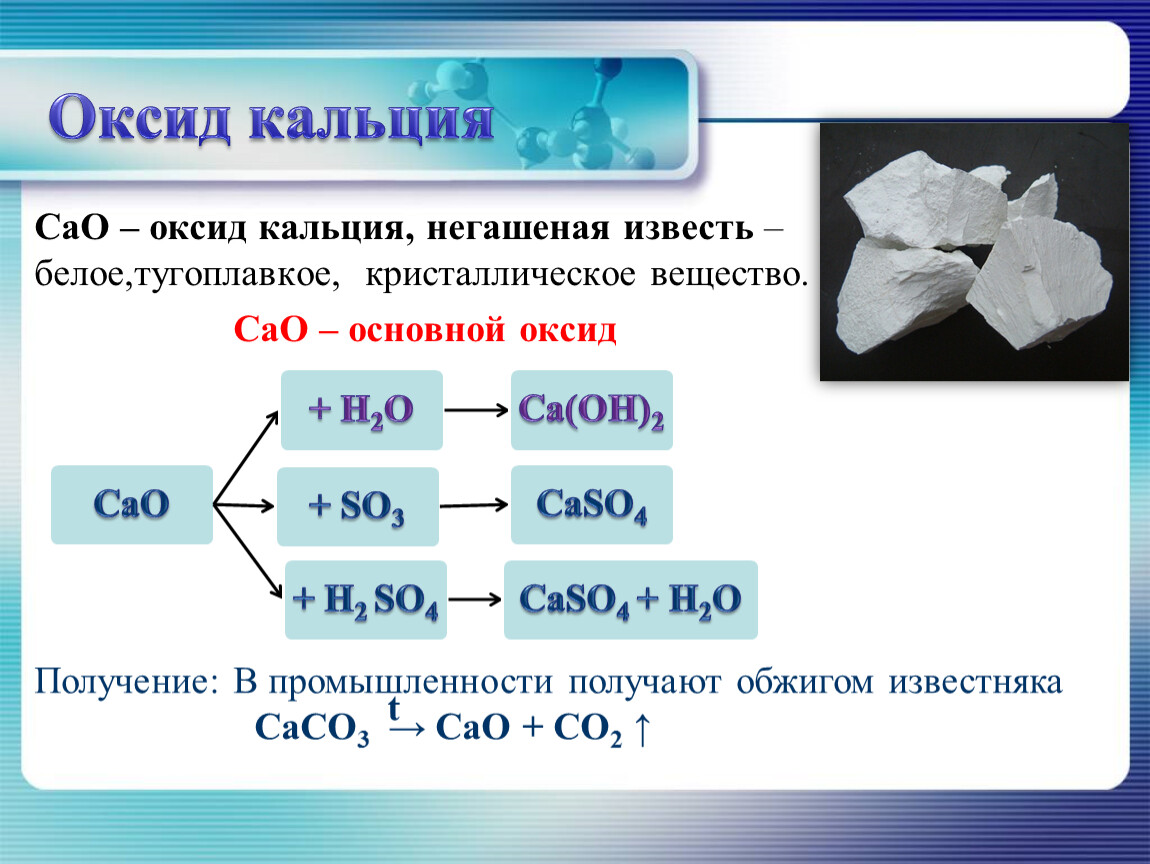 При взаимодействии с водой реакция карбидной пыли происходит на поверхности воды и выделяемое тепло не может быть быстро отведено. Это приводит к повышению температуры в зоне реакции и перегреву частиц карбида и выделяющегося ацетилена. При этом особенно опасно присутствие воздуха, так как быстро достигается температура воспламенения ацетилено-воздушной смеси. Поэтому карбидную пыль нельзя применять в обычных ацетиленовых генераторах, рассчитанных для работы на кусковом карбиде кальция, так как это может вызвать взрыв ацетилена в генераторе. Для разложения карбидной пыли применяют генераторы специальной конструкции.
При взаимодействии с водой реакция карбидной пыли происходит на поверхности воды и выделяемое тепло не может быть быстро отведено. Это приводит к повышению температуры в зоне реакции и перегреву частиц карбида и выделяющегося ацетилена. При этом особенно опасно присутствие воздуха, так как быстро достигается температура воспламенения ацетилено-воздушной смеси. Поэтому карбидную пыль нельзя применять в обычных ацетиленовых генераторах, рассчитанных для работы на кусковом карбиде кальция, так как это может вызвать взрыв ацетилена в генераторе. Для разложения карбидной пыли применяют генераторы специальной конструкции.
Чем выше температура воды, тем быстрее идет реакция карбида кальция. Если вода сильно загрязнена гашеной известью, образующейся при реакции карбида кальция, то реакция замедляется.
При разложении неподвижного карбида кальция в недостаточном количестве воды куски его могут покрываться коркой гашеной извести и сильно перегреваться, при этом может иметь место реакция:
СаС2+Ca(ОН)2 = C2H2+2СаО
В этом случае реакция карбида кальция происходит за счет отнятия влаги, содержащейся в гашеной извести. В результате повышается плотность корки, что приводит к еще большему перегреву. Поэтому непрерывное удаление извести из зоны реакции имеет большое значение, так как перегрев может привести к взрыву ацетилено-воздушной смеси или вызвать взрывчатый распад ацетилена.
В результате повышается плотность корки, что приводит к еще большему перегреву. Поэтому непрерывное удаление извести из зоны реакции имеет большое значение, так как перегрев может привести к взрыву ацетилено-воздушной смеси или вызвать взрывчатый распад ацетилена.
Если производить разложение одинаковых количеств карбида кальция различными постепенно уменьшающимися количествами воды, то температура получаемой смеси ацетилен — водяной пар будет соответственно повышаться. При температуре около 90°С почти все тепло (за исключением тепла, затрачиваемого на нагревание ацетилена и карбидного ила) расходуется на образование водяного пара. Эти условия реакции соответствуют процессу, при котором получается сухой гидрат окиси кальция, поскольку вся вводимая в реакцию вода расходуется на разложение карбида и образование водяного пара.
При погружении карбида кальция в воду процесс разложения протекает также весьма неравномерно: вначале реакция идет очень активно с бурным выделением ацетилена, а затем скорость реакции уменьшается.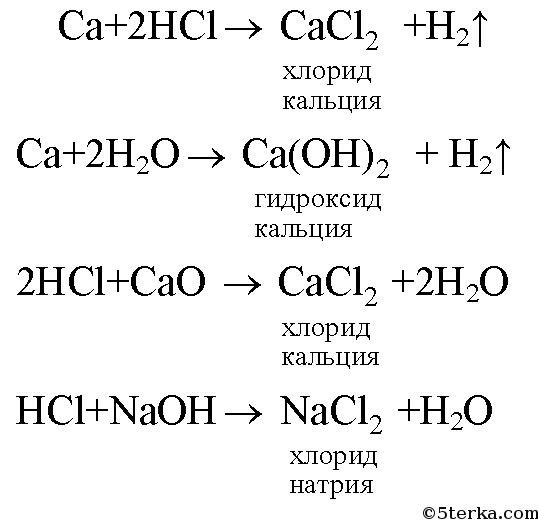 Это объясняется уменьшением поверхности кусков и тем, что они покрываются коркой извести, препятствующей свободному доступу воды.
Это объясняется уменьшением поверхности кусков и тем, что они покрываются коркой извести, препятствующей свободному доступу воды.
При перемешивании воды с находящимся в ней карбидом кальция реакция происходит быстрее и равномернее.
Скорость реакции карбида кальция в воде зависит от чистоты карбида кальция и поверхности соприкосновения кусков карбида кальция с водой.
Скорость реакции карбида кальция в воде является весьма важным элементом, характеризующим качество карбида кальция. Для практических целей пользуются понятием продолжительности разложения.
Продолжительностью разложения считают время, в течение которого выделяется 98% от всего количества ацетилена, который может быть выделенным из карбида кальция, так как остаток разлагается очень медленно и не характеризует процесс разложения применительно к условиям работы ацетиленовых генераторов.
В таблице ниже приведены экспериментальные данные о продолжительности разложения карбида кальция в зависимости от размеров его кусков.
| Размеры кусков, мм | Пыль | 2/4 | 5/8 | 8/15 | 15/25 | 25/50 | 50/80 |
|---|---|---|---|---|---|---|---|
| Продолжительность разложения, мин. | Несколько секунд | 1,17 | 1,65 | 1,82 | 4,23 | 13,5 | 16,6 |
Следует, оговорить, что данные таблицы характеризуют лишь те образцы карбида кальция, с которыми были проведены опыты. Практически могут иметь место значительные отклонения, главным образом в сторону уменьшения скорости реакции.
Скорость разложения в значительной степени зависит от выхода ацетилена из карбида кальция. Чем ниже выход, тем меньше скорость реакции.
На диаграмме ниже показаны изменения в скорости разложения карбида кальция двух сортов с одинаковыми размерами кусков (25/50).
При разложении 1 кг карбида кальция с выходом ацетилена 263 л/кг за первые 3 минуты выделяется 220 л ацетилена, а соответственно при выходе 226 л/кг — только 150 л.
Карбид кальция плюс азот
При температуре 1000°С карбид кальция, взаимодействуя с азотом, образует цианамид кальция. Уравнение реакции имеет следующий вид:
CaC2+N2=CaCN2+C
Эта реакция используется для промышленного производства цианамида кальция. Цианамид кальция применяется в качестве удобрения и как исходный продукт для получения цианидов.
Карбид кальция плюс водород
С водородом карбид кальция вступает в реакцию при температуре выше 2200°С с образованием ацетилена и металлического кальция. При высокой температуре карбид кальция восстанавливает большинство окислов металлов.
Хранение карбида кальция
После того как был получен карбид кальция хранение его допускается в специальных герметичных барабанах и специально оборудованных помещениях, но все это уже рассмотрено в статье о том, где и как хранить карбид кальция.
Кальций хлористый — Огнеупорные материалы
Все чаще в своей жизни мы встречаем химическое соединение под названием хлористый кальций, Давайте разберемся, что это такое и какой он бывает. Хлористый кальций можно получить даже в домашних условиях путем нагрева хлорной извести. В промышленности в основном хлорид кальция получают как отходы при производстве соды. Может встречаться в продаже в виде гранул или чешуек до 5 мм. Внешний вид кристаллов не влияет на химические свойства соединения, а зависит только от технологии приготовления. Изготовление хлористого кальция должно соответствовать ГОСТ 450-77. Химическая формула безводного соединения — CaCl2. При присоединении молекул воды может встречаться в виде гидратов и от количества молекул будет называться, соответственно, двухводный, четырех и шестиводным. Шестиводный хлористый кальций (CaCl2 6h3O) является неустойчивым соединением и при нагреве могут выделяться молекулы воды.
Хлористый кальций можно получить даже в домашних условиях путем нагрева хлорной извести. В промышленности в основном хлорид кальция получают как отходы при производстве соды. Может встречаться в продаже в виде гранул или чешуек до 5 мм. Внешний вид кристаллов не влияет на химические свойства соединения, а зависит только от технологии приготовления. Изготовление хлористого кальция должно соответствовать ГОСТ 450-77. Химическая формула безводного соединения — CaCl2. При присоединении молекул воды может встречаться в виде гидратов и от количества молекул будет называться, соответственно, двухводный, четырех и шестиводным. Шестиводный хлористый кальций (CaCl2 6h3O) является неустойчивым соединением и при нагреве могут выделяться молекулы воды.
Хлористый кальций применяют:
- В химической промышленности.
- В холодильной технике в качестве хладагента.
- Нефтяной, нефтеперерабатывающей промышленности.
- В строительстве в качестве добавки в бетон, ускоряющей схватывание и усадку цемента.
 Благодаря своим свойствам позволяет производить заливку бетона при отрицательных температурах воздуха. Все эти свойства позволяют увеличить производительность при строительных работах. Кроме того, применение хлористого кальция связано с увеличиваем долговечности и надежности возводимых конструкций.
Благодаря своим свойствам позволяет производить заливку бетона при отрицательных температурах воздуха. Все эти свойства позволяют увеличить производительность при строительных работах. Кроме того, применение хлористого кальция связано с увеличиваем долговечности и надежности возводимых конструкций. - Для обеспыливания при эксплуатации песчаных и гравийных дорог. Поливание раствором хлористого кальция покрытия увеличивает его вязкость и прочность и она долгое время остается во влажном состоянии. Данное свойство связано с тем, что кальций хлористый сильно гигроскопичен, его раствор впитывает воду из воздуха и поэтому дорожное покрытие долго остаётся влажным.
- В качестве пищевой добавки — Пищевая индустрия (Е 509). В данном случае, в основном, применяют пищевой двуводный кальций хлористый. И это конечно использование в молочной промышленности, для консервирования в перерабатывающих производствах, кондитерское производство, при производстве напитков. Химическая формула: CaCl2 2h3O.

- Медицина и фармацевтика. 6-водный в медицинской практике применение в виде растворов ,как противоаллергическое средство, в качестве сырья при приготовлении кальция хлорида для инъекций.
- В коммунальном хозяйстве смеси на основе хлорида кальция нашли широкое применение в борьбе с гололедом на скользких дорогах. Раствор кальция хлористого уменьшает наледь и уменьшает риск возникновения ДТП и получения различных травм. В данном случае, для удешевления, хлористый кальций применяется с различными добавками, например, с хлористым натрием. Обязательно в современные противогололедные реагенты на основе хлористого кальция добавляются антикоррозионные добавки, с ингибиторами коррозии.
Применение хлористого кальция шестиводного уменьшает эффект применения так, как активного действующего вещества меньше чем в безводном хлориде. Т.е. чтобы получить эффект такой же как от действия безводного СаCl2, шестиводного надо в 2 раза больше, чем безводного.
Огромное значение при применении хлористого кальция имеет отсутствие примесей и количество основного вещества. Только качественный хлористый кальций, выпускаемый в соответствии с ГОСТ, с содержанием 96-98% сможет обеспечить отсутствие усадки пенобетонных, и бетонных изделий и образования соляных выделений на них. Хлористый кальций выпускается в упаковке по 25 кг, МКР 600 кг и по 1 тонне. Гидрат шестиводного хлористого кальция имеет один недостаток, он очень плохо хранится, так как быстро слеживается.
Только качественный хлористый кальций, выпускаемый в соответствии с ГОСТ, с содержанием 96-98% сможет обеспечить отсутствие усадки пенобетонных, и бетонных изделий и образования соляных выделений на них. Хлористый кальций выпускается в упаковке по 25 кг, МКР 600 кг и по 1 тонне. Гидрат шестиводного хлористого кальция имеет один недостаток, он очень плохо хранится, так как быстро слеживается.
Изготовлен в соответствии с ГОСТ 450-77 с изм.1-3
Массовая доля хлорида кальция (CaCl2) — 94-98%
| 2835250000 | ФОСФАТ ДИКАЛЬЦИЯ 2-ГИДРАТ, ПИЩЕВАЯ ДОБАВКА, ВНЕШНИЙ ВИД-МЕЛКИЙ БЕЛЫЙ ПОРОШОК, ПРИМЕНЯЕТСЯ В ХЛЕБНОЙ ПРОМЫШЛЕННОСТИ В КАЧЕСТВЕ РАЗРЫХЛЯЮЩЕГО АГЕНТА В ХЛЕБОБУЛОЧНЫХ ИЗДЕЛИЯХ. НЕ ЯВЛЯЕТСЯ ОТХОДАМИ.; (ФИРМА) CHEMISCHE FABRIK BUDENHEIM KG; (TM) BUDENHEIM НЕ ЯВЛЯЕТСЯ ОТХОДАМИ.; (ФИРМА) CHEMISCHE FABRIK BUDENHEIM KG; (TM) BUDENHEIM |
| 2835250000 | ПИЩЕВАЯ ДОБАВКА — ДИКАЛЬЦИЙ ФОСФАТ ДИГИДРАТ,ХИМИЧЕСКАЯ ФОРМУЛА CAHPO4*2h3O, CAS № 7789-77-7,В МЕШКАХ ПО 25 КГ НЕТТО,ДЛЯ ИСПОЛЬЗОВАНИЯ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ; (ФИРМА) REEPHOS CHEMICAL CO.,LTD; (TM) REEPHOS CHEMICAL |
| 2835250000 | ФОСФАТ ДИКАЛЬЦИЯ АНГИДРИД: DI-CAFOS A 60. ДИКАЛЬЦИЙ ФОСФАТ. ХИМИЧЕСКАЯ ФОРМУЛА: CAHPO4. CAS -№: 7757-93-9. ПРЕДНАЗНАЧЕН ДЛЯ ИСПОЛЬЗОВАНИЯ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ (НЕ ОТХОДЫ, НЕ ИСТОЧНИКИ ИЗЛУЧЕНИЙ). УПАКОВАН В КОРОБКИ ПО 21КГ НЕТТО. ВСЕГО 3 КОРОБКИ.; (ФИРМА) «CHEMISCHE FABRIK BUDENHЕIM KG»; (TM) BUDENHЕIM |
| 2835250000 | ПОСТАВЛЯЕТСЯ КАК ОБРАЗЦЫ: ДВУХОСНОВНЫЙ КАЛЬЦИЯ ФОСФАТ ДИГИДРАТ, В ВИДЕ БЕЛОГО КРИСТАЛЛИЧЕСКОГО ПОРОШКА; (ФИРМА) PAULAUR CORPORATION; (TM) EMCOMPRESS |
| 2835250000 | ДВУХОСНОВНОЙ ФОСФАТ КАЛЬЦИЯ НЕРАСТВОРИМЫЙ В ВОДЕ В ПОРОШКООБРАЗНОМ ВИДЕ(ПИЩЕВАЯ ДОБАВКА), ХИМИЧЕСКАЯ ФОРМУЛА CAHPO4, МАРКА DI-CAFOS A 60, В МЕШКАХ ПО 25 КГ. ; (ФИРМА) CHEMISCHE FABRIK BUDENHEIM KG; (TM) BUDENHEIM ; (ФИРМА) CHEMISCHE FABRIK BUDENHEIM KG; (TM) BUDENHEIM |
| 2835250000 | 1-ДИКАЛЬЦИЯ ФОСФАТ ДИГИДРАТ ХИМ ФОРМУЛА CA(h3PO4)2 CAS#7789-77-7 99,8% В МЕШКАХ ПО 25КГ НЕТТО. ПРИМЕНЯЕТСЯ В КАЧЕСТВЕ СЫРЬЯ ПРИ ПРОИЗВОДСТВЕ ЗУБНЫХ ПАСТ В КАЧЕСТВЕ ЩАДАЩЕГО АБРАЗИВА. НЕ СОДЕРЖИТ, НЕ ОТХОД.; (ФИРМА) HUBEI XINGFA CHEMICALS GROUP CO., LTD; (TM) НЕТ |
| 2835250000 | ДИКАЛЬЦИЙ ФОСФАТ, НЕ ОТХОДЫ;; (ФИРМА) CHEMISCHE FABRIK BUDENHEIM KG; (TM) BUDENHEIM |
| 2835250000 | ВОДОРОДОФОСФАТ КАЛЬЦИЯ (ФОСФАТ ДИКАЛЬЦИЯ): УПАКОВАНЫ В МЕШКИ ПО 25КГ НЕТТО. ВСЕГО 160 МЕШКОВ. ТРАНСПОРТИРУЮТСЯ НА ПАЛЛЕТАХ.; (ФИРМА) CHEMISCHE FABRIK BUDENHEIM KG; (TM) BUDENHEIM |
| 2835250000 | ДИКАЛЬЦИЙ ГИДРОГЕН ФОСФАТ, ВНЕШНИЙ ВИД — МЕЛКИЙ БЕЛЫЙ ПОРОШОК, ПИЩЕВАЯ ДОБАВКА, ПРИМЕНЯЕТСЯ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ ДЛЯ МИНЕРАЛЬНОГО ОБОГАЩЕНИЯ, УПАКОВАН В МЕШКИ ПО 25 КГ. НЕ ОТХОДЫ;; (ФИРМА) CHEMISCHE FABRIK BUDENHEIM KG; (TM) BUDENHEIM |
| 2835250000 | ФОСФАТЫ ВОДОРОДФОСФАТ КАЛЬЦИЯ (ФОСФАТ ДИКАЛЬЦИЯ). КАЛЬЦИЯ ГИДРОФОСФАТ ДИГИДРАТ, АРТИКУЛ 85520. ХИМИЧЕСКАЯ ФОРМУЛА САНРО4Х2Н2О. БЕЛЫЙ КРИСТАЛЛИЧЕСКИЙ ПОРОШОК БЕЗ ЗАПАХА И ВКУСА. ПРАКТИЧЕСКИ НЕРАСТВОРИМ В ХОЛОДНОЙ ВОДЕ И В СПИРТЕ. РАСТВОРИМ В; (ФИРМА) INNOPHOS, INC; (TM) ОТСУТСТВУЕТ КАЛЬЦИЯ ГИДРОФОСФАТ ДИГИДРАТ, АРТИКУЛ 85520. ХИМИЧЕСКАЯ ФОРМУЛА САНРО4Х2Н2О. БЕЛЫЙ КРИСТАЛЛИЧЕСКИЙ ПОРОШОК БЕЗ ЗАПАХА И ВКУСА. ПРАКТИЧЕСКИ НЕРАСТВОРИМ В ХОЛОДНОЙ ВОДЕ И В СПИРТЕ. РАСТВОРИМ В; (ФИРМА) INNOPHOS, INC; (TM) ОТСУТСТВУЕТ |
Калия гидрат окиси технический | компания ГлавХим г.Москва, Тула
Калия гидрат окиси технический (гидрат окиси калия, едкий калий, гидроокись калия, гидроксид калия, кали едкое, калиевая щелочь) ГОСТ 9285-78
Получение
Технический гидрат окиси калия (кали едкое) получают диафрагменным электролизом раствора хлористого калия.
Формула: KOH
Требования
безопасности
Гидрат окиси калия негорюч и взрывобезопасен, по степени
воздействия на организм относится к веществам 2-го класса.
Гарантийный срок
хранения продукта
3 года со дня изготовления.
Физико-химические
показатели
|
Наименование показателя
|
Норма для марки и сорта
| |||
|
Твердый
|
Жидкий
| |||
|
Высший
|
Первый
|
Высший
|
Первый
| |
|
1.
|
Чешуйки зеленого,
|
Чешуйки или плав
|
Раствор голубого,
| |
|
2. Массовая доля едких щелочей (KOH + NaOH) в пересчете на
|
95.0
|
95.0
|
54.0
|
52.0
|
|
3. Массовая доля углекислого калия (K2CO3), %, не более
|
1.4
|
1.
|
0.4
|
0.8
|
|
4. Массовая доля хлоридов в пересчете на Cl–, %, не более
|
0.7
|
0.7
|
0.7
|
0.8
|
|
5. Массовая доля сульфатов (SO4²־), %, не более
|
0.025
|
0.05
|
0.03
|
0.1
|
|
6. Массовая доля железа (Fe2+), %, не более
|
0.
|
0.03
|
0.004
|
0.01
|
|
7. Массовая доля хлорноватистого калия (KClO3), %, не
|
0.1
|
0.2
|
0.15
|
0.3
|
|
8. Массовая доля кремния (Si), %, не более
|
0.01
|
0.02
|
0.015
|
–
|
|
9.
|
1.5
|
2.0
|
1.7
|
2.0
|
|
10. Массовая доля кальция (Ca2+), %, не более
|
0.01
|
0.01
|
0.005
|
–
|
|
11. Массовая доля алюминия (Al3+), %, не более
|
0.003
|
0.005
|
0.003
|
–
|
|
12.
|
0.003
|
0.003
|
0.003
|
–
|
Технический гидрат окиси калия применяют для производства
удобрений, синтетического каучука, электролитов для аккумуляторов, реактивов,
ксантогенатов, солей, в медицинской промышленности и в других отраслях
народного хозяйства.
Krisanalyt — Кальций углекислый
Кальций углекислый
Неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — . В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц. Нерастворим в воде и этаноле. Твердые белые кристаллы.
Применение. Используется как белый пищевой краситель Е170. Является основой мела. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве. Карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и в медицинской промышленности. Строительство — ещё один из основных потребителей карбоната кальция. Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви. Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
|
№ п/п
|
Наименование показателей
|
ГОСТ 4530-76
| ||
|
ХЧ
|
ЧДА
|
Ч
| ||
|
1
|
Кальций углекислый СаСО3, % не мене
|
99
|
99
|
98
|
|
2
|
Нерастворимые в HCl вещества, % не более
|
0,003
|
0,010
|
0,020
|
|
3
|
Растворимые щелочи и карбонаты, % не более
|
0,0015
|
0,003
|
0,008
|
|
4
|
Азот (N) общее: содержание из нитратов, нитритов и др., % не более
|
0,005
|
0,02
|
0,050
|
|
5
|
Сульфаты в % не более
|
0,01
|
0,01
|
0,05
|
|
6
|
Фосфаты в % не более
|
0,001
|
не нормируется
| |
|
7
|
Хлориды (Cl), % не более
|
0,001
|
0,002
|
0,010
|
|
8
|
Железо (Fe), % не более
|
0,001
|
0,005
|
0,010
|
|
9
|
Калий и натрий (K+Na), % не более
|
0,02
|
0,04
|
0,1
|
|
10
|
Магний (Mg), % не более
|
0,02
|
0,02
|
0,05
|
|
11
|
Тяжелые металлы (Pb), % не более
|
0,0005
|
0,002
|
0,005
|
Срок хранения — 1 год.
Калия гидрат окиси
Калия гидрат окиси технический (гидрат окиси калия, едкий калий, гидроокись калия, гидроксид калия, кали едкое, калиевая щелочь — по ГОСТ 9275-78)
Химическая формула: KOH
Получение. Технический гидрат окиси калия (кали едкое) получают диафрагменным электролизом раствора хлористого калия.
Применение. Технический гидрат окиси калия применяют для производства удобрений, синтетического каучука, электролитов для аккумуляторов, реактивов, ксантогенатов, солей, в медицинской промышленности и в других отраслях промышленности.
Упаковка. Гидрат окиси калия упакован в герметичные полиэтиленовые мешки – 50 кг.
Гарантийный срок хранения продукта: 3 года со дня изготовления.
| Наименование показателя | Норма для марки и сорта | |
| Твердый | ||
| Высший | Первый | |
| Внешний вид | Чешуйки зеленого, сиреневого или серого цвета | Чешуйки или сплав зеленого, сиреневого или серого цвета |
Массовая доля едких щелочей (KOH + NaOH) в пересчете на KOH, %, не менее | 95,0 | 95,0 |
Массовая доля углекислого калия (K2CO3), %, не более | 1,4 | 1,5 |
Массовая доля хлоридов в пересчете на Cl-, %, не более | 0,7 | 0,7 |
Массовая доля сульфатов (SO4??), %, не более | 0,025 | 0,05 |
Массовая доля железа (Fe2+), %, не более | 0,03 | 0,03 |
Массовая доля хлорноватистого калия (KClO3), %, не более | 0,1 | 0,2 |
Массовая доля кремния (Si), %, не более | 0,01 | 0,02 |
Массовая доля натрия в пересчете на NaOH, %, не более | 1,5 | 2,0 |
Массовая доля кальция (Ca2+), %, не более | 0,01 | 0,01 |
Массовая доля алюминия (Al3+), %, не более | 0,003 | 0,005 |
Массовая доля нитратов и нитритов в пересчете на азот (N), %, не более | 0,003 | 0,003 |
Фосфаты кальция — больше, чем просто наполнитель
Кальциевые соли используются в фармацевтической технологии на протяжении многих лет. Они обладают определенными физико-химическими свойствами, что делает их идеальными вспомогательными веществами при производстве твердых лекарственных форм. Преимущественно соли кальция используются в качестве наполнителя при разработке лекарственных рецептур, однако, функциональные возможности фосфатов кальция выходят далеко за рамки использования его как просто наполнителя. Грамотное применение данного вспомогательного ингредиента позволяет достигать поставленные перед разработчиками цели.
Соли кальция – неорганические вещества минерального происхождения, в связи с чем они характеризуются высокой химической стабильностью. По той же самой причине, они совместимы с большинством известных активных фармацевтических субстанций, за исключением некоторых антибиотиков — индометацина и тетрациклина, которые с ионами кальция образуют трудно абсорбируемые комплексы. Трехосновный кальция фосфат (USP) несовместим с токоферилацетатом, который связывает большое количество гидроксильных групп на поверхности вещества.
Кальциевые соли ортофосфорной кислоты не взаимодействуют с водой, вследствие чего могут успешно использоваться в любых технологиях с применением воды в качестве полностью инертного уплотнителя. Из-за высокого содержания кальция и фосфора соли часто используются в качестве пищевых добавок. В особенности, широкое применение в данной отрасли находят гидроксиапатиты, благодаря соотношению кальция и фосфора, которое также характерно для костей человека.
Вспомогательные вещества на основе фосфатов кальция – идеальные наполнители для прямого прессования благодаря присущей им многофункциональности. Подходящие размер и форма частиц обеспечивают фосфатам кальция превосходную текучесть. Кроме того, с их помощью можно регулировать текучесть плохо сыпучих порошков, что позволяет относительно легко получать массу для таблетирования, не прибегая к дополнительному этапу грануляции. Высокая плотность солей кальция позволяет использовать большее количество вспомогательных веществ без увеличения размера лекарственной формы, а также, при необходимости, уменьшать размер конечного продукта без изменения количества вспомогательных веществ в составе.
Двухосновные фосфаты кальция представляют собой твердые неорганические соединения, которые при сжатии подвергаются преимущественно хрупкому разрушению. Данное свойство обеспечивает высокую текучесть материала, таким образом, таблетки получаются достаточно твердыми. В дополнение к этому, таблетки, содержащие в своем составе фосфаты кальция, не подвержены расширению после выталкивания их из матрицы пресс-инструмента. Данное явление обычно наблюдается после декомпрессии упругих или пластично-упругих материалов. Другой важной особенностью фосфатов кальция является их низкая чувствительность к лубрикантам. Увеличение количества лубрикантов или длительное время перемешивания не оказывают существенного влияния на прессуемость порошковых смесей, содержащих в своем составе фосфаты кальция.
На сегодняшний день на фармацевтическом рынке представлен широкий выбор различных сортов фосфатов кальция. Сорта, содержащие крупные частицы, используют в основном для прямого прессования, а сорта, состоящие из мелких частиц, подходят для процессов грануляции. В данной статье представлены наиболее важные свойства различных сортов фосфатов кальция для прямого прессования:
- Двухосновный кальция фосфат безводный DI-CAFOS® A150 и DI-CAFOS® A60;
- Двухосновный кальция фосфат дигидрат DI-CAFOS® D160;
- Трехосновный кальция фосфат TRI-CAFOS® 500
Перечисленные выше сорта производит немецкая компания «Chemische Fabrik Budenheim» (далее «Budenheim»), и они предназначены для метода прямого прессования. В статье также представлены свойства таблеток, полученных при помощи данных веществ. Таким образом, данная статья позволяет получить представление о том, каких целей можно достичь при использовании фосфатов кальция в разработке лекарственных рецептур.
За дополнительной информацией о фосфатах производства Chemische Fabrik Budenheim обращайтесь в ЗАО ФПК «ФармВИЛАР» по электронной почте: [email protected] или по телефону: +7 (499) 372 13 23
Функциональные свойства фосфатов кальция
Частицы двухосновного фосфата кальция (DI-CAFOS® A150, DI-CAFOS® A60 и DI-CAFOS® D160) представляют собой агрегаты мелких частиц различной формы и размеров. На снимках под микроскопом можно увидеть практически сферическую форму частиц фосфата кальция (рис.1-3). В то же время поверхность частиц шероховатая, хорошо сформированная, что улучшает однородность смеси при перемешивании с другими ингредиентами.
Поверхность трехосновного фосфата кальция (TRI-CAFOS® 500) широкая, а ее структура напоминает губку (рис.4). Благодаря данной специфичной структуре, во время смешивания мелкие частицы других ингредиентов, включая АФИ, могут легко прилипать к более крупным частицам фосфата кальция, таким образом эффективность перемешивания повышается.
Фосфаты кальция характеризуются высокой объемной плотностью, что вкупе с подходящей формой частиц обеспечивает отличную сыпучесть. Кроме того, такой уровень плотности материала позволяет значительно уменьшить размер таблетки или капсулы без изменения их массы. Если же необходимо использовать большее количество вспомогательного вещества, например, с целью улучшения текучести и/или прессуемости смеси с трудным АФИ, этого также можно достичь благодаря высокой плотности фосфатов кальция без изменения размера лекарственной формы.
Очень важным аспектом является поведение фосфатов кальция в водной среде, поскольку это может повлиять на эффективность лекарственного препарата. Как правило, данные вещества не растворимы в водных средах при нейтральном или щелочном рН. Однако они растворимы в разбавленных кислотах, например, в 0,1М соляной кислоте. Это означает, что в кислой среде желудка они полностью растворяются, не препятствуя высвобождению препарата. Следовательно, исключены риски при растворении и всасывании препарата в ЖКТ. Также при контакте с водой или водными растворами фосфаты кальция не набухают и не образуют гидрогели. Они не распадаются сами по себе, однако, применение небольших количеств популярных дезинтегрантов (например, кроскармеллозы натрия или поперечно сшитого поливинилпирролидона) позволяет получать быстрораспадающиеся таблетки (рис.6).
Двухосновные фосфаты кальция не гигроскопичны и в условиях, обычно применяемых в лаборатории и при производстве, являются физически и химически стабильными. Прочность таблеток с данными веществами в составе не меняется при хранении в надлежащих условиях.
Известна тенденция безводных органических веществ к образованию гидратов при контакте даже с небольшим количеством водяного пара, присутствующего в воздухе. При использовании фосфатов кальция такого эффекта не наблюдается. Следует также отметить, что безводный двухосновный фосфат кальция (DI-CAFOS® A60 и DI-CAFOS® A150) не образует гидраты даже при перемешивании с водой в течение длительного времени.
Таблетируемость сортов кальция фосфата для прямого прессования
Двухосновные фосфаты кальция при сжатии подвергаются хрупкому разрушению. Благодаря такому механизму деформации удельная площадь поверхности частиц увеличивается и образуется большее количество потенциальных участков связывания. Улучшенная способность склеивания частиц позволяет производить таблетки с высокой прочностью даже при относительно низкой силе прессования. В отличие от двухосновного, трехосновный фосфат кальция (TRI-CAFOS® 500) претерпевает в основном пластические деформации при сжатии. Его высокая способность к связыванию обусловлена высокой удельной площадью поверхности и, следовательно, большим количеством участков связывания.
На рис.5-7 показано сравнение некоторых физических свойств таблеток, полученных с использованием четырех сортов фосфата кальция для прямого прессования, произведенных компанией «Budenheim» – прочность таблетки (сила разлома), пористость и размер, выраженный в виде объема таблетки. Таблетки содержали 99,5 % кальция фосфата и 0,5 % лубриканта (магния стеарат). Порошковые смеси прессовали в таблетки с использованием роторного таблеточного пресса «Fette», 102i («Fette Compacting», Шварценбек, Германия) при трех силах прессования: 10, 20 и 30 кН. Результаты на рис.5 показывают, что и безводный двухосновный фосфат кальция (DI-CAFOS® A150) и двухосновный фосфат кальция дигидрат (DI-CAFOS® D160) отлично таблетируются. Даже при относительно низком усилии прессования могут быть получены таблетки с высокой прочностью. Но следует отметить, что в случае DI-CAFOS® A150 сила прессования значительно влияет на прочность таблетки.
DI-CAFOS® A60 – вещество исключительно высокой плотности и низкой пористости. Эти свойства могут быть полезны при получении таблеток или капсул меньшего размера (рис.6). Лекарственные формы меньшего размера легче принимать, таким образом, пациенту проще соблюдать режим лечения. Это особенно актуально в педиатрической и гериатрической практике. Кроме того, DI-CAFOS® A60 может использоваться для создания лекарственных форм с высокой плотностью, превышающей плотность желудочного сока. Такая лекарственная форма оседает в нижней части антрального отдела желудка и влияет на время прохождения пищевого комка через желудок. Однако следует учитывать, что низкая удельная площадь поверхности DI-CAFOS® A60 требует более высоких усилий прессования для получения таблеток достаточной прочности.
TRI-CAFOS® 500 редко используется в качестве единственного наполнителя в составах для прямого прессования. Он успешно применяется в качестве дополнения к стандартным наполнителям. При использовании от 10 до 30 % TRI-CAFOS® 500 в рецептуре таблеток его большая удельная площадь поверхности способствует лучшему связыванию порошковых смесей. Таким образом, одновременно увеличивается прочность и пористость таблетки (рис.8-9). Помимо фосфатов кальция (DI-CAFOS® A150 и TRI-CAFOS® 500), таблетки в своем составе содержат 2 % кроскармеллозы натрия в качестве дезинтегранта и 0,5 % лубриканта (магния стеарата). Следует также отметить, что помимо увеличения прочности таблетки, добавление TRI-CAFOS® 500 может увеличить пористость таблетки и, как следствие, значительно сократить время дезинтеграции (рис.10).
Резюме
Многие свойства фосфатов кальция, такие как отличная сыпучесть или высокая прессуемость, делают их идеальными наполнителями для прямого прессования. Поскольку основным механизмом деформации при сжатии фосфатов кальция является хрупкое разрушение, данные вещества менее чувствительны к особенностям производственного оборудования, скорости таблетирования или лубрикантам. Такие преимущества могут быть полезны при масштабировании производства. Хотя данная статья посвящена функциональным особенностям фосфатов кальция при прямом прессовании, следует отметить, что сорта, содержащие в своем составе крупные частицы, также могут быть успешно применены в процессах влажной и сухой грануляции. Преимущество их использования – простота в обращении. Помимо высокой насыпной плотности они содержат мало мелких частиц. Таким образом, пылеобразование в процессах взвешивания и просеивания минимально. До недавнего времени вспомогательные вещества рассматривались исключительно как неактивные ингредиенты, используемые только в качестве порошков для наполнения и их дальнейшей переработки, но сейчас доподлинно известно, что они также могут оказывать влияние на эффективность и стабильность лекарственных препаратов.
Авторы статьи: Daniel Zakowiecki, Marek Lachmann и Tobias Heß
Перевод: Юлия Журавлева, ЗАО «ФПК ФармВИЛАР»
Список литературы
- Rowe CR, Sheskey PJ, Quinn ME. Handbook of Pharmaceutical Excipients (6th ed.). Pharmaceutical Press, London 2009.
- Khan MA, Reddy IK. Calcium phosphate in pharmaceutical product development. Calcium phosphates in biological and industrial systems (ed. Zahid Amjad). Kluwer Academic Publishers, Boston 1998, pp. 303–323.
- Marczynski Z. Tabletting technology of a dry extract from Solidago virgaurea L. with the use of silicified microcrystalline cellulose (Prosolv) and other selected auxiliary substances. Polim Med. 2009; 39 (4): 51–60.
- Zhang Y, Law Y, Chakrabarti S. Physical Properties and Compact Analysis of Commonly Used Direct Compression Binders. AAPS PharmSciTech. 2003; 4(4): 489–499.
- Kaushal AM, Vangala VR, Suryanarayanan R. Unusual effect of water vapor pressure on dehydration of dibasic calcium phosphate dihydrate. J Pharm Sci. 2011; 100 (4): 1456-1466.
- Bolhuis GK, Chowhan ZT. Materials for direct compaction. Pharmaceutical Powder Compaction Technology (ed. Alderborn G, Nyström C). Marcel Dekker Inc., New York 1996, pp. 419–478.
- Zebrowska W, Sawicki W. Excipients. The applied pharmacy (ed. Janicki S, Fiebig A, Sznitowska M). PZWL, Warsaw 2008, pp. 652 – 693.
- De Boer AH, Bolhuis GK, Lerk CF. Bonding characteristics by scanning electron microscopy of powders mixed with magnesium stearate. Powder Technol. 1978; 20 (1): 75-82.
- Bolhuis GK, Lerk CF, Zijlstra HT, De Boer AH. Film formation by magnesium stearate during mixing and its effect on tabletting. Pharm. Weekbl. 1975; 110: 317–325.
- Patel NK, Patel BR, Plakogiannis FM, Reier GE. An evaluation of tricalcium phosphate excipients particularly using instrumented rotary and single station tablet presses. Drug Dev. Ind. Pharm. 1987; 13: 2693-2718.
- Ahlneck C, Alderborn G. Moisture absorption and tableting II. The effect on tensile strength and air permeability of the relative humidity during storage of tablets of 3 crystalline materials. Int J Pharm 1989; 56: 143-150.
- Zakowiecki D, Emrich A, Lachmann M, Tiwari R, Hess T. Application of highly porous calcium phosphates in quickly disintegrating formulations. Poster presented at the 2nd European Conference on Pharmaceutics, 2017 April 3-4; Cracow, Poland.
- Zakowiecki D, Emrich A, Lachmann M, Hess T. The use of highly porous calcium phosphates in the development of a quickly disintegrating formulation: ibuprofen 250 mg / caffeine 50 mg tablets. Poster presented at the AAPS Annual Meeting and Exposition, 2017 November 12-15; San Diego, CA, US.
Карбонат кальция и его гидраты на JSTOR
Abstract
Данная статья посвящена наблюдениям за получением фаз, которые могут существовать в системе CaCO3-h3O в присутствии «добавок», с качественным объяснением появления нестабильных фаз в таких условиях. Было обнаружено, что склонность метастабильных фаз карбоната кальция к осаждению из водных растворов увеличивается не только за счет увеличения скорости осаждения, но также за счет увеличения концентрации определенных добавленных веществ.Таким образом, в присутствии небольших количеств калгона или иона магния и в насыщенном растворе хлорида натрия в присутствии иона магния получают ряд продуктов в соответствии с условиями осаждения, в частности, перемешиванием и температурой. Таким образом были получены кальцит (стабильная фаза), арагонит, ватерит (μ-карбонат кальция) и гексагидрат карбоната кальция вместе с новым гидратом CaCO3.h3O. Позволяя реакционным смесям, содержащим добавку, отстояться до кристаллизации геля, образующегося вначале, можно получить метастабильные фазы со значительной регулярностью.Могут быть построены метастабильные фазовые диаграммы, показывающие зависимость фаз от условий осаждения, например концентрация карбоната натрия и концентрация добавки. Путем разведки с использованием таких диаграмм все ранее упомянутые фазы, кроме ватерита, были получены в присутствии иона магния, а в присутствии Калгона были идентифицированы все, кроме арагонита. Это говорит о том, что в какой-то мере действие добавок носит специфический характер. В условиях реакции при перемешивании карбонат кальция можно выращивать без свежего зародышеобразования на затравочных кристаллах кальцита и фатерита с гораздо большей скоростью в присутствии ограниченных количеств Калгона, чем в его отсутствие.При относительно высоких концентрациях могут появиться другие фазы, и рост кальцита и ватерита прекращается, несмотря на присутствие затравочных кристаллов. Аналитические методы показали, что соединения, содержащие карбонат кальция, образованные в присутствии иона магния или калгона, содержат в заметных количествах магний или фосфор. Присутствие добавки приводит к модификации формы кристаллов кальцита и гексагидрата. Также было отмечено, что искажение рентгенограмм кристаллических частиц является обычным явлением.Это соответствует абсорбции добавки в искаженной фазе. Следовательно, абсорбция добавки, по-видимому, играет важную роль в влиянии на зародышеобразование и образование метастабильных фаз. Эти наблюдения объясняются тем, что ростки кристаллических фаз подвержены различным степеням искажения в зависимости от состава раствора. Таким образом, в разных случаях рост тормозится в разной степени. В пределе эффект искажения может быть таким, что рост зародышей определенных типов может быть подавлен, и имеется соответствующее изменение условий для самопроизвольной кристаллизации из раствора различных фаз.
Информация для издателя
Королевское общество — это самоуправляемое товарищество многих самых выдающихся ученых мира, представляющих все области науки, техники и медицины, и старейшая научная академия, которая постоянно существует. Основная цель Общества, отраженная в его учредительных документах 1660-х годов, заключается в признании, продвижении и поддержке передового опыта в науке, а также в поощрении развития и использования науки на благо человечества.Общество сыграло роль в некоторых из самых фундаментальных, значительных и изменяющих жизнь открытий в истории науки, и ученые Королевского общества продолжают вносить выдающийся вклад в науку во многих областях исследований.
Права и использование
Этот предмет является частью коллекции JSTOR.
Условия использования см. В наших Положениях и условиях
Философские труды Лондонского королевского общества.Серия A, Математические и физические науки
© 1950 Королевское общество
Запросить разрешения
Гидроксид кальция — объяснение, свойства, использование и часто задаваемые вопросы
Гидроксид кальция обычно называют гашеной известью и описывается химической формулой Ca (OH) 2. Это также белое неорганическое соединение, которое в твердом состоянии имеет порошкообразный вид. Однако в кристаллической форме он имеет бесцветный вид.
Другие названия этого соединения могут быть даны как гашеная известь, гашеная известь, каустическая известь и травильная известь. Обычно гидроксид кальция получают путем смешивания оксида кальция (также называемого негашеной извести) и воды.
Объяснение гидроксида кальция
Кроме того, химическая реакция между хлоридом кальция и гидроксидом натрия, растворенным в воде (водный CaCl2), дает это соединение. Структурное представление молекулы Ca (OH) 2 можно проиллюстрировать ниже.
(изображение будет скоро загружено)
Молекулы гидроксида кальция удерживаются вместе ионными связями между двумя ионами гидроксида (OH–) и ионами кальция (Ca2 +). Незащищенное воздействие этого соединения может оказаться опасным для людей, вызывая раздражение кожи и химические ожоги. Воздействие концентрированного Ca (OH) 2 может привести к повреждению легких и даже к слепоте.
Некоторые важные свойства гидроксида кальция можно свести в таблицу следующим образом:
Свойства гидроксида кальция
Название IUPAC или идентификатор IUPAC | Гидроксид кальция |
Химическая формула для символа гидроксида кальция или формула гидроксида кальция | Ca (OH) 2 |
Плотность | 2.211 грамм / кубический сантиметр |
Молекулярная масса или молярная масса | 74,093 грамма на моль |
Точка плавления | 852K |
Внешний вид или цвет гидроксида кальция цвет гидроксида кальция | Бесцветный кристалл или белый порошок |
Физические свойства
Давайте рассмотрим некоторые физические свойства гидроксида кальция, перечисленные ниже:
Ca (OH) 2 имеет структура гексагональных кристаллов.
Это соединение плохо растворяется в воде. Но его растворимость снижается с повышением температуры. Предположим, его растворимость при растворимости составляет 1,73 г / л при 20 ℃, а при 0 ℃ — 1,89 г / л.
Это соединение также имеет тенденцию терять воду и разлагаться при температурах, приближающихся к температуре плавления.
Произведение растворимости (Ksp) гидроксида кальция может быть выражено как 5,5 * 10 -6 .
Химические свойства
Давайте рассмотрим некоторые химические свойства гидроксида кальция, перечисленные ниже.
Гидроксид кальция хорошо растворим в кислотах и глицерине, но мало растворим только в воде. Он дает раствор, который действует как умеренная основа (называемая известковой водой), когда он растворяется в воде до точки насыщения.
Известковая вода вступает в реакцию с кислотами и образует соли.
Насыщенный раствор гидроксида кальция в воде также вступает в реакцию с металлами, такими как алюминий, и растворяет их.
Он также реагирует с диоксидом углерода и образует карбонат кальция (CaCO3).В общем, эту реакцию можно назвать карбонатацией.
Использование гидроксида кальция
Существует множество различных применений гидроксида кальция, некоторые из которых перечислены ниже. Давайте посмотрим на них.
Ca (OH) 2 может быть использован в бумажной промышленности в процессе крафт-обработки, который превращает древесину в древесную массу.
В процессе очистки сточных вод гидроксид кальция может использоваться в качестве флокулянта или осветлителя.
Это важное соединение при получении аммиака.
Обычно маринование огурцов производится с помощью Ca (OH) 2.
Кроме того, это соединение используется в качестве модификатора pH из-за его основности.
При производстве различных пластмасс используется гидроксид кальция в качестве основного ингредиента.
При лечении корневых каналов это соединение используется для пломбирования полостей человеческих зубов.
Мы можем использовать его в пестицидах, производстве эбонита и в средствах по уходу за волосами.
Гидроксид кальция может использоваться в кожевенной промышленности для отделения меха или волос от шкуры животного.
Сахарный тростник и сахарная свекла перерабатываются путем карбонизации, в которой используется Ca (OH) 2.
Индейцы используют
На испанском языке гидроксид кальция известен как кал. Кукуруза, приготовленная с кальцием (в процессе никстамализации), становится хоми (никстамал), что значительно увеличивает биодоступность ниацина (витамина B3), а также считается более вкусным и более легким для переваривания.
Гидроксид кальция обычно пережевывают вместе с листьями коки, чтобы химические стимуляторы алкалоидов оставались доступными для усвоения организмом. Точно так же коренные американцы жевали листья табака, традиционно с гидроксидом кальция, полученным из сожженных раковин моллюсков, чтобы усилить его действие. Кроме того, он использовался несколькими коренными американскими племенами в качестве основного ингредиента йопо, психоделического нюхательного табака, приготовленного из бобов некоторых видов Anadenanthera.
Различия между гашеной и негашеной известью
Факт добавления воды к измельченной негашеной извести, помещения ее в печь или духовку, а затем измельчения ее с водой, приводит к реакции CaO с h3O с образованием нового химического вещества Ca (OH) 2.
Разница между оксидом кальция и гидроксидом кальция заключается в том, что CaO имеет большую плотность (1 г / см³) и более активен, чем гашеная известь, плотность которой составляет 0,5 г / см. 3 .
Гашение оксида кальция (негашеной извести) необходимо в контролируемой среде, так как он может выделять тепло, достигающее 50 градусов Цельсия. Гидроксид кальция, или гашеная известь, уже нейтрализован, поэтому он не будет подвергаться окислению и может быть смешан с водой в нашей системе для контроля pH воды, добавления известкового раствора, смесей известкового раствора, восстановления почвы и многого другого.
Как вы определяете, использовать ли гашеную известь или негашеную известь?
Обычно известь используется для очистки воды и сточных вод, а также для десульфуризации дымовых газов. Выбор использования гашеной или негашеной извести будет зависеть от скорости подачи, необходимой для процесса. Также фактором выбора будет «реакционная способность» порошка.
Например, в процессе известкования ила для стабилизации ила негашеная известь более желательна из-за экзотермической реакции, когда повышение температуры помогает убить патогенный микроорганизм, присутствующий в иле.
Лучшим примером является очистка дымовых газов , также известная как Обессеривание дымовых газов , используемая в угольных пожарных установках, цементной промышленности, стекольной промышленности и мусоросжигательных заводах для снижения выбросов HCl, Sox и NOx . В некоторых из этих систем требуется гашеная известь для фильтрации или катализа частиц, выделяемых после сгорания, в то время как в других системах используется негашеная известь ..
Чтобы определить, какая известь гашеная или гашеная более рентабельна, проверьте количество порошка, необходимого для процесса.При большом расходе порошка лучше всего выбрать негашеную известь, поскольку ее плотность (1 г / см³) вдвое превышает плотность гашеной извести (0,5 г / см³), что снижает затраты на хранение и транспортировку.
С другой стороны, негашеная известь требует гашения извести из-за ее гидрофобной реакции с водой. Целью использования гашения извести является превращение негашеной извести в гашеную известь путем смешивания ее с водой. Гашение извести имеет возможность контролировать экзотермическую реакцию во время превращения СаО в Са (ОН) 2.В результате получится известковая суспензия, готовая к вводу в технологический процесс.
Напротив, когда потребность в извести низкая или средняя, используется гашеная известь. Фактически, оборудование проще, потому что для этого не требуется гашение извести, поскольку нет экзотермической реакции. Объем может быть уменьшен до винтового конвейера, который подает порошок непосредственно в резервуар для приготовления, оборудованный миксером для суспензии, куда добавляется вода до требуемой концентрации известковой суспензии (%).
Гипс — это гидратированный сульфат кальция.
Это сводится к пониманию эмпирических формул и мольных отношений, но это просто.
Сначала рассмотрим формулу безводной соли … «Сульфат кальция» Ионы кальция имеют заряд 2+, а ионы сульфата — 2 заряда … итак, формула — CaSO 4 . Как это гидратированная соль перед нагреванием. Это означает, что изначально молекулы воды были прикреплены в определенном соотношении. Мы выясним это соотношение в конце задачи, а пока давайте представим это, используя схему ниже:
1 CaSO 4 • X H 2 O по существу 1 : X мольное соотношение.Мы должны вычислить X .
Используя данные, мы можем вычислить массу воды в гидрате. (Проценты также можно использовать, если вам нужен дополнительный шаг). Мы будем использовать эти данные для определения «эмпирической формулы» этого гидратированного кристалла.
Перед нагреванием масса составляла 4,89 грамма
После нагрева масса составляла 3,87 грамма
1,02 грамма «покинула материал» во время нагрева. Это была испаряющаяся вода.
CaSO 4 : H 2 O
3.87 г: 1,02 г <--- мы собираемся разделить эти массы по формуле массы, чтобы получить молярное соотношение
3,87 г: 1,02 г
136 г 18 г <--- Формульные массы округлены до ближайшего целого числа . Ваш инструктор может потребовать более конкретные массы.
0,0285: 0,0567 <----- это молярное отношение, однако нам нужно попытаться получить целые числа. Итак, мы проверяем эти числа и обнаруживаем, что 0,0285 - наименьшее значение. Мы собираемся разделить оба этих числа на это маленькое значение, чтобы попытаться получить целое число
0.0285: 0,0567
0,0285 0,0285
1: 1,989 <---- значение 1,989 по существу равно 2. Таким образом, мольное соотношение между CaSO 4 : H 2 O является соотношением 1: 2. Это даст окончательную формулу:
1 CaSO 4 • X H 2 O, где X = 2
1 CaSO 4 •
07 9020 H 2 O <--- опустить коэффициент 1 перед CaSO 4
CaSO 4 • 2 H 2 O <---- окончательная химическая формула для гипса.... дигидрат сульфата кальция
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Молекулярная масса гидроксида кальция
Молярная масса of Ca (OH) 2 = 74,09268 г / моль
Перевести граммы гидроксида кальция в моль или моль гидроксида кальция в граммы
Расчет молекулярной массы:
40,078 + (15,9994 + 1,00794) * 2
| Элемент | Символ | Атомная масса | Количество атомов | Массовый процент |
| Кальций | Ca | 40.078 | 1 | 54,092% |
| Водород | H | 1,00794 | 2 | 2,721% |
| Кислород | O | 15,9994 | 2 | 43,188% |
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества.Этот сайт объясняет, как найти молярную массу.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Гидрат силиката кальция (C-S-H) | Concrete Sustainability Hub
Устойчивость бетона начинается с самого фундаментального уровня: понимания молекулярной структуры цементного теста — силикат-гидрат кальция (CSH) , основного продукта гидратации портландцемента и в первую очередь отвечающего за прочность цемента. материалы на основе.
Аналитические записки по теме
Отчеты
Рецензируемые публикации
- Abdolhosseini Qomi, M.J .; Bauchy, M .; И Пелленк, Р. «Наноразмерное соотношение состав-текстура-свойство-соотношение в гидратах силиката кальция», W. Andreoni & S. Yip, (Eds.), Справочник по моделированию материалов (стр. 1-32), Швейцария: Springer Nature AG, 2018.
- Bauchy, M .; Laubie, H .; Qomi, M. J. Abdolhosseini; и другие.«Вязкость разрушения гидрата силиката кальция по результатам моделирования молекулярной динамики» Журнал некристаллических твердых тел. Том 419, страницы 58-64, июль 2015.
- Del Gado, E .; Иоанниду, К .; Masoero, E .; и другие. «Мягкая материя в строительстве — подход статистической физики к образованию и механике гелей C-S-H в цементе» European Physical Journal — Special Topics, Volume 223, Issue 11, Pages 2285-2295, October 2014
- Bauchy, M; Коми, Абдолхоссейни Коми, MJ; Ulm, FJ; Пелленк, Р.Дж., Порядок и беспорядок в силикат-гидрате кальция, Журнал химической физики, том 140, выпуск 21, номер статьи 214503, 2014
- Ioannidou, K; Пелленк, RJM; Дель Гадо, Э., Контроль локальной упаковки и роста гелей силикат-гидрата кальция, Мягкое вещество, Том 10, выпуск 8, страницы 1121-1133, 2014
- Masoero, E; Дель Гадо, Э; Пелленк, RJM; Yip, S; Ульм, Ф.Дж., Наномасштабная механика коллоидных гелей C-S-H, Мягкое вещество, Том 10, Выпуск 3, страницы 491-499, 2014
- Вандамм, М.; Ульм, Ф.Дж., Исследование свойств ползучести гидратов силиката кальция с помощью наноиндентирования, Исследование цемента и бетона, Том 52, страницы 38-52, 2013
- Manzano, H .; Masoero, E .; Lopez-Arbeloa, I .; Дженнингс, Х.М., Деформации сдвига в гидратах силиката кальция, Мягкое вещество, Том 9, выпуск 30, страницы 7333-7341, 2013
- Bonnaud, P.A .; Ji, Q .; Ван Влит, К.Дж., Влияние повышенной температуры на структуру и свойства гелей силикат-гидрата кальция: роль замкнутой воды, Мягкое вещество, Том 9, выпуск 28, страницы 6418, 2013
- Бонно, Пенсильвания; Джи, Q; Coasne, B; Пелленк, RJM; Ван Влит К.Дж., Термодинамика воды, заключенной в пористых гидратах силиката кальция, Ленгмюр, том 28, выпуск 31, страницы 11422-11432, 2012
- Thomas, JJ; Аллен, AJ; Дженнингс, HM, Плотность и содержание воды наноразмерного твердого C-S-H, образованного в пасте из активированного щелочами шлака (AAS), и последствия для химической усадки, Cement and Concrete Research, Volume 42, Issue 2, Pages 377-383, 2012
.

 Благодаря своим свойствам позволяет производить заливку бетона при отрицательных температурах воздуха. Все эти свойства позволяют увеличить производительность при строительных работах. Кроме того, применение хлористого кальция связано с увеличиваем долговечности и надежности возводимых конструкций.
Благодаря своим свойствам позволяет производить заливку бетона при отрицательных температурах воздуха. Все эти свойства позволяют увеличить производительность при строительных работах. Кроме того, применение хлористого кальция связано с увеличиваем долговечности и надежности возводимых конструкций.
 Внешний вид
Внешний вид 5
5 03
03 Массовая доля натрия в пересчете на NaOH, %, не более
Массовая доля натрия в пересчете на NaOH, %, не более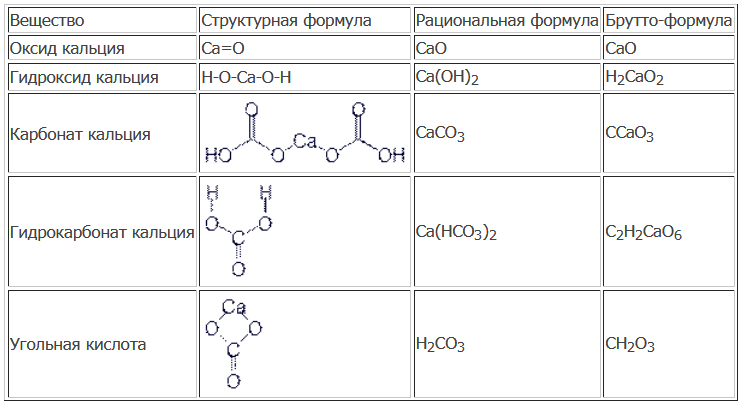 Массовая доля нитратов и нитритов в пересчете на азот
Массовая доля нитратов и нитритов в пересчете на азот