Примеры электрохимической коррозии — Справочник химика 21
В качестве примера электрохимической коррозии можно привести коррозию железа в контакте с медью в растворе электролита — соляной кислоты (т. е. при высокой концентрации ионов водорода Н»). При таком контакте возникает гальванический элемент(рнс. 5.8). [c.161]
Примеры электрохимической коррозии [c.72]
В качестве примера электрохимической коррозии рассмотрим коррозию железа в контакте с медью в растворе соляной кислоты. При таком контакте возникает гальванический элемент (рис. 83) [c.190]
Примерами электрохимической коррозии металлов являются ржавление различных металлических изделий и конструкций в атмосфере (металлических станков и оборудования заводов, стальных мостов, каркасов зданий, средств. транспорта и др.) коррозия наружной металлической обшивки судов в речной и морской воде ржавление стальных сооружений гидросооружений ржавление стальных трубопроводов в земле разрушение баков и аппаратов растворами кислот, солей н щелочей на химических и других заводах, коррозионные потери металла при кислотном травлении окалины коррозионные потери металлических деталей при нагревании их в расплавленных солях и щелочах и др. [c.148]
[c.148]
Электрохимическая коррозия вызывается образованием на поверхности металла или сплава гальванических микроэлементов, состоящих из частиц металла, расположенных рядом и имеющих разные потенциалы (основной металл и металл покрытия, компоненты сплава, включения других металлов в основной и т. д.) наличием влаги с растворенной в ней углекислотой или другими химическими соединениями, т. е. электролита. Пример электрохимической коррозии. — ржавление металла. [c.57]
Наибольший вред приносит электрохимическая коррозия. Электрохимической коррозией называется разрушение металла в среде электролита с возникновением внутри системы электрического тока. В этом случае наряду с химическими процессами (отдача электронов) протекают и электрические (перенос электронов от одного участка к другому). В качестве примера электрохимической коррозии рассмотрим коррозию железа в контакте с медью в растворе соляной кислоты. При таком контакте возникает гальванический элемент (рис. 87) (—)Fe H l u(+). Более активный металл — железо — окисляется, посылая электроны атомам меди, и переходит в раствор в виде ионов Fe +, а ионы водорода разряжаются восстанавливаются) на меди 2Н++2е-=Нг. [c.178]
87) (—)Fe H l u(+). Более активный металл — железо — окисляется, посылая электроны атомам меди, и переходит в раствор в виде ионов Fe +, а ионы водорода разряжаются восстанавливаются) на меди 2Н++2е-=Нг. [c.178]
В качестве второго примера электрохимической коррозии можно привести коррозию днища и нижних поясов резервуаров, которая происходит между металлом резервуара и донной водой, представляющей собой раствор электролита. [c.64]
Цель работы. 1. Изучение коррозионной устойчивости окисных пленок. 2. Ознакомление с примерами электрохимической коррозии и некоторыми методами защиты. [c.184]
Примеры электрохимической коррозии металлов ржавление различных металлических изделий и конст- [c.103]
Процессы электрохимической коррозии могут развиваться не только в больших объемах электролитов, но и в тонких пленках влаги, конденсирующейся на поверхности изделия. Типичным примером электрохимической коррозии 1В тонкой пленке является атмосферная коррозия.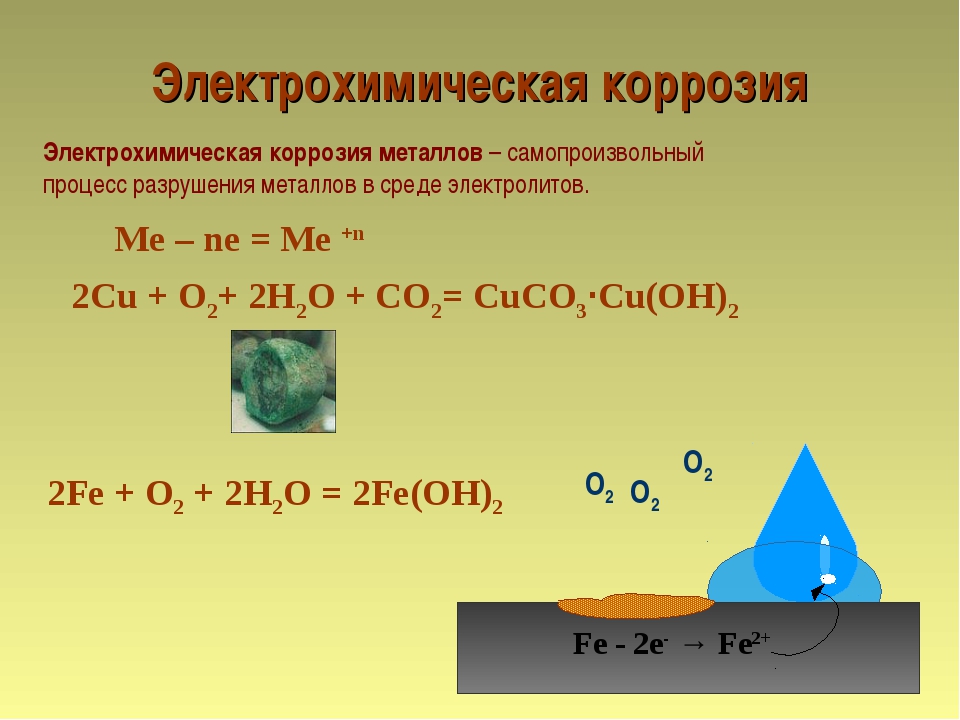 [c.75]
[c.75]
Рассмотрим классический пример электрохимической коррозии в серной кислоте цинка, загрязненного примесями других металлов, которые катодны по отношению к цинку. С течением времени на поверхности цинка, первоначально имевшей относительно небольшое количество примесей, примесей становится все больше и больше, так как по мере растворения цинка все новые и новые включения (катоды) будут выходить на поверхность металла, а также возможно вторичное осаждение нонов частично растворившихся катодных примесей. Количество микроэлементов на поверхности с течением времени будет увеличиваться. Увеличение числа ми1сроэлементов за счет обнажения новых катодных участков схематично показагю на фиг. 10. [c.29]
электрохимическая коррозия, химическая коррозия, катодная коррозия, атмосферная коррозия, газовая коррозия и др.
Коррозионные процессы классифицируют по механизму взаимодействия металлов с внешней средой; по виду коррозионной среды и условиям протекания процесса; по характеру коррозионных разрушений; по видам дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
По механизму процесса различают химическую и электрохимическую коррозию металлов.
Химическая коррозия — это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены.
Электрохимическая коррозия — это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.
По виду коррозионной среды и условиям протекания различают несколько видов коррозии.
Газовая коррозия — это химическая коррозия металлов в газовой среде при минимальном содержании влаги (как правило не более 0,1%) или при высоких температурах. В химической и нефтехимической промышленности такой вид коррозии встречается часто. Например, при получении серной кислоты на стадии окисления диоксида серы, при синтезе аммиака, получении азотной кислоты и хлористого водорода, в процессах синтеза органических спиртов, крекинга нефти и т.д.
Например, при получении серной кислоты на стадии окисления диоксида серы, при синтезе аммиака, получении азотной кислоты и хлористого водорода, в процессах синтеза органических спиртов, крекинга нефти и т.д.
Атмосферная коррозия — это коррозия металлов в атмосфере воздуха или любого влажного газа.
Подземная коррозия — это коррозия металлов в почвах и грунтах.
Биокоррозия — это коррозия, протекающая под влиянием жизнедеятельности микроорганизмов.
Контактная коррозия — это вид коррозии, вызванный контактом металлов, имеющих разные стационарные потенциалы в данном электролите.
Радиационная коррозия — это коррозия, обусловленная действием радиоактивного излучения.
Коррозия внешним током и коррозия блуждающим током. В первом случае — это коррозия металла, возникающая под воздействием тока от внешнего источника. Во втором случае — под воздействием блуждающего тока.
Коррозия под напряжением — коррозия, вызванная одновременным воздействием коррозионной среды и механических напряжений. Если это растягивающие напряжения, то может произойти растрескивание металла. Это очень опасный вид коррозии, особенно для конструкций, испытывающих механические нагрузки (оси, рессоры, автоклавы, паровые котлы, турбины и т.д.). Если металлические изделия подвергаются циклическим растягивающим напряжениям, то можно вызвать коррозионную усталость. Происходит понижение предела усталости металла. Такому виду коррозии подвержены рессоры автомобилей, канаты, валки прокатных станов.
Если это растягивающие напряжения, то может произойти растрескивание металла. Это очень опасный вид коррозии, особенно для конструкций, испытывающих механические нагрузки (оси, рессоры, автоклавы, паровые котлы, турбины и т.д.). Если металлические изделия подвергаются циклическим растягивающим напряжениям, то можно вызвать коррозионную усталость. Происходит понижение предела усталости металла. Такому виду коррозии подвержены рессоры автомобилей, канаты, валки прокатных станов.
Коррозионная кавитация — разрушение металла, обусловленное одновременным коррозионным и ударным воздействием внешней среды.
Фреттинг-коррозия — это коррозия, вызванная одновременно вибрацией и воздействием коррозионной среды. Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т.д.
Коррозия называется сплошной, если она охватывает всю поверхность металла. Сплошная коррозия может быть равномерной, если процесс протекает с одинаковой скоростью по всей поверхности металла, и неравномерной когда скорость процесса неодинакова на различных участках поверхности. Равномерная коррозия наблюдается, например, при коррозии железных труб на воздухе.
Равномерная коррозия наблюдается, например, при коррозии железных труб на воздухе.
При избирательной коррозии разрушается одна структурная составляющая или один компонент сплава. В качестве примеров можно привести графитизацию чугуна или обесцинкование латуней.
Местная (локальная) коррозия охватывает отдельные участки поверхности металла. Местная коррозия может быть выражена в виде отдельных пятен, не сильно углубленных в толщу металла; язв — разрушений, имеющих вид раковины, сильно углубленной в толщу металла, или точек (питтингов), глубоко проникающих в металл.
Первый вид наблюдается, например, при коррозии латуни в морской воде. Язвенная коррозия отмечена у сталей в грунте, а питтинговая — у аустенитной хромоникелевой стали в морской воде.
Подповерхностная коррозия начинается на поверхности, но затем распространяется в глубине металла. Продукты коррозии оказываются сосредоточенными в полостях металла. Этот вид коррозии вызывает вспучивание и расслоение металлических изделий.
Межкристаллитная коррозия характеризуется разрушением металла по границам зерен. Она особенно опасна тем, что внешний вид металла не меняется, но он быстро теряет прочность и пластичность и легко разрушается. Связано это с образованием между зернами рыхлых малопрочных продуктов коррозии. Этому виду разрушений особенно подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы.
Щелевая коррозия вызывает разрушение металла под прокладками, в зазорах, резьбовых креплениях и т.д.
Примеры электрохимической коррозии — Цветные металлы
Примеры электрохимической коррозии
Категория:
Цветные металлы
Примеры электрохимической коррозии
В качестве примеров электрохимической коррозии можно рассмотреть работу гальванических микропар, коррозию под каплей влаги и разрушение подземных конструкций.
Гальванические микропары. В основе развития процессов электрохимической коррозии сплава при наличии в нем двух или нескольких разнородных фаз лежит деятельность большого числа микрогальванических элементов или микропар. Процессы, протекающие на микроэлектродах, аналогичны ранее рассмотренным процессам работы гальванической пары из двух различных металлов. Так, например, в отожженном алюминиево-медном сплаве, имеющем двухфазную структуру и находящемся в соприкосновении с 3%-м раствором NaCl (рис. 1,а), коррозионному разрушению подвергается твердый раствор, имеющий потенциал—0,60 в и являющийся анодом по отношению к включениям СиА12, потенциал которых — 0,37 в. Химическое соединение, являющееся катодом, не разрушается. Процесс протекает с кислородной деполяризацией на катоде. При работе микропары с анода в раствор переходят ионы алюминия. На катоде образуются гидроксильные ионы ОН. Продукт коррозии представляет собой гидрат окиси алюминия А1(ОН)3.
Процессы, протекающие на микроэлектродах, аналогичны ранее рассмотренным процессам работы гальванической пары из двух различных металлов. Так, например, в отожженном алюминиево-медном сплаве, имеющем двухфазную структуру и находящемся в соприкосновении с 3%-м раствором NaCl (рис. 1,а), коррозионному разрушению подвергается твердый раствор, имеющий потенциал—0,60 в и являющийся анодом по отношению к включениям СиА12, потенциал которых — 0,37 в. Химическое соединение, являющееся катодом, не разрушается. Процесс протекает с кислородной деполяризацией на катоде. При работе микропары с анода в раствор переходят ионы алюминия. На катоде образуются гидроксильные ионы ОН. Продукт коррозии представляет собой гидрат окиси алюминия А1(ОН)3.
Рис. 1. Схема электрохимической коррозии:
а — двухфазного сплава; б — чистого металла под каплей влаги
Коррозия под каплей влаги. При эксплуатации изделий на поверхности металла возможно оседание мелких водяных капель. При растворении в этих каплях атмосферных газов образуется электролит. Особенно вредными являются: для стали — сернистый газ, сероводород и хлористый водород; для алюминиевых и магниевых сплавов — хлористый водород; для медных сплавов — аммиак.
Особенно вредными являются: для стали — сернистый газ, сероводород и хлористый водород; для алюминиевых и магниевых сплавов — хлористый водород; для медных сплавов — аммиак.
Коррозия под каплей влаги (рис. 1,б) развивается в результате неоднородности пассивирования отдельных участков поверхности металла под каплей по причине неодинакового доступа кислорода воздуха. Вследствие большого притока кислорода к периферийным участкам поверхности под каплей последние находятся в более пассивном состоянии, чем центральные участки. Железо, например, в активном состоянии имеет потенциал от —0,4 до —0,5 в, а в пассивном +1,0 в и более. Поэтому разрушению подвергаются центральные участки, потенциал которых имеет более отрицательное значение.
Разрушение подземных конструкций. Увлажненная земля обычно является проводником тока и, находясь в контакте с металлическими конструкциями, способствует развитию в них электрохимической коррозии. Большое влияние на коррозию подземных сооружений оказывают «блуждающие токи».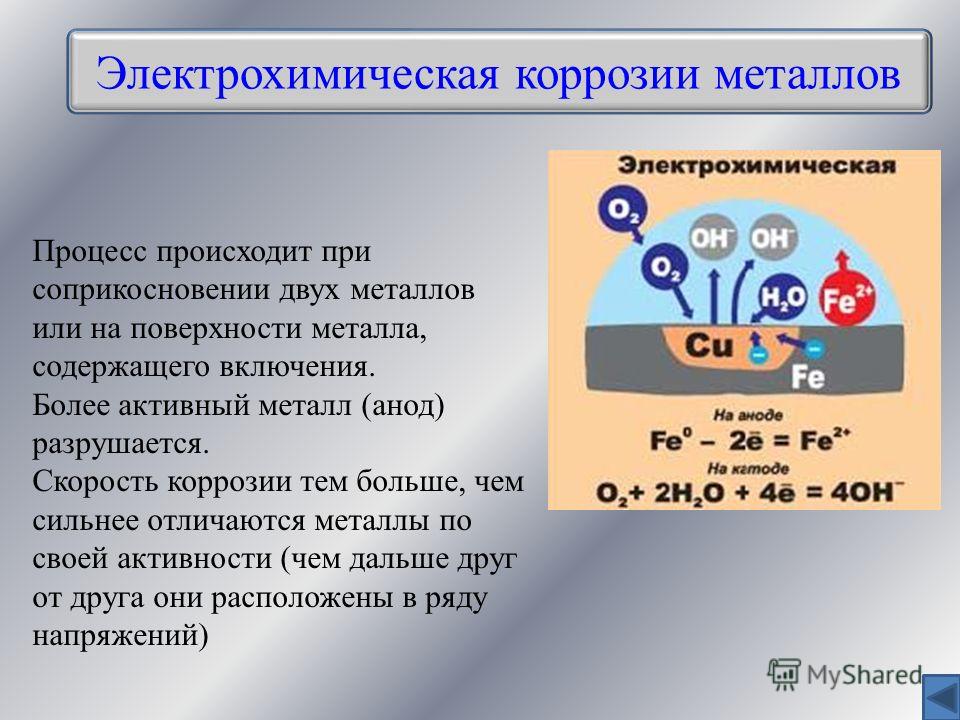 Вредное влияние имеет только постоянный ток, ответвляющийся, например, от рельсовых путей электрических железных дорог, заземлений установок, питаемых постоянным током, и т. д. При этом участок вхождения тока является катодной зоной и коррозионному разрушению не подвергается, а участок выхода блуждающих токов из металла в почву представляет собой анодную зону, подверженную коррозионному разрушению в виде глубоких местных раковин.
Вредное влияние имеет только постоянный ток, ответвляющийся, например, от рельсовых путей электрических железных дорог, заземлений установок, питаемых постоянным током, и т. д. При этом участок вхождения тока является катодной зоной и коррозионному разрушению не подвергается, а участок выхода блуждающих токов из металла в почву представляет собой анодную зону, подверженную коррозионному разрушению в виде глубоких местных раковин.
Реклама:
Читать далее:
Выбор химического состава и обработки
Статьи по теме:
Процесс коррозии железа. Химическая коррозия, электрохимическая коррозия, элетрокоррозия
Процесс коррозии железа чаще всего сводится к его окислению кислородом воздуха или кислотами, содержащимися в растворах, и превращению его в оксиды. Коррозия металлов (ржавление) вызывается окислительно-восстановительными реакциями, протекающими на границе металла и окружающей среды. В зависимости от механизма возникновения, различают такие виды коррозии железа, как: химическая, электрохимическая и электрическая.
Процесс химической коррозии железа
Окислительно-восстановительные реакции в данном случае проходят через переход электронов на окислитель. В процессе коррозии такого типа кислород воздуха взаимодействует с поверхностью железа. При этом образуется оксидная пленка, которая называется ржавчиной:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
В отличие от плотно прилегающих оксидных пленок, которые образуются в процессе коррозии на щелочных металлах, алюминии, цинке, рыхлая оксидная пленка на железе свободно пропускает к поверхности металла кислород воздуха, а также другие газы и пары воды. Это способствует дальнейшей коррозии железа.
Процесс электрохимической коррозии
Этот вид коррозии проходит в среде, которая проводит электрический ток. Металл в грунте подвергается, преимущественно, электрохимической коррозии. Процесс коррозии такого типа – это результат химических реакций с участием компонентов окружающей среды. Также электрохимическая коррозия возникает в случае контакта металлов, находящихся в ряду напряжений на некотором расстоянии друг от друга, в результате чего возникает гальваническая пара катод-анод.
Также электрохимическая коррозия возникает в случае контакта металлов, находящихся в ряду напряжений на некотором расстоянии друг от друга, в результате чего возникает гальваническая пара катод-анод.
Атмосферный и грунтовый процесс коррозии выражается схемой:
Fe + O2 + H2O → Fe2O3 · xH2O
В результате образуется ржавчина различной расцветки, что обусловлено тем, что образуются различные окислы железа. Какое именно вещество образуется в процессе коррозии железа, зависит от давления кислорода, влажности воздуха, температуры, длительности процесса, состава железного сплава, состояния поверхности изделия и т. д. Скорость разрушения разных металлов различна.
Процесс коррозии металла в растворах электролитов – это результат работы большого количества микроскопических гальванических элементов, у которых в качестве катода выступают примеси в металле, а в качестве анода – сам металл. В результате чего возникают микроскопические гальванические элементы.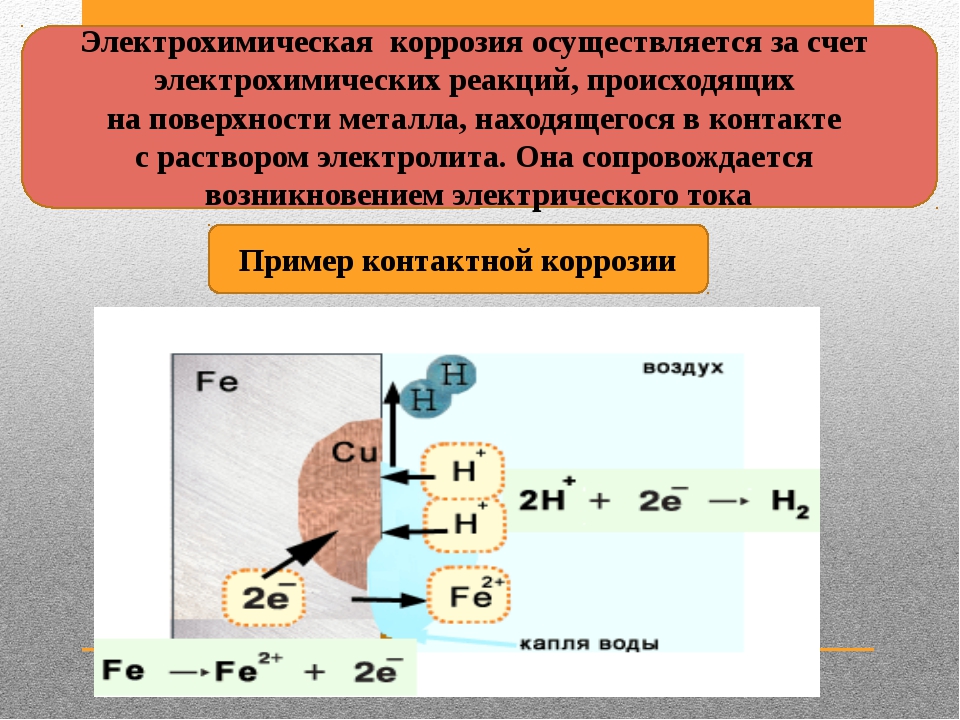
Также атомы железа на разных участках имеют различную способность отдавать электроны (окисляться). Участки металла, на котором протекает этот процесс, выступают в роли анода. Остальные участки – катодные, на которых происходят процессы восстановления воды и кислорода:
H2O + 2e– = 2OH– + H2↑
O2 + 2H2O + 4e– = 4OH–
Результат – из ионов железа (II) и гидроксид-ионов образуется гидроксид железа (II). Далее идет его окисление до гидроксида железа (III) – основного компонента ржавчины:
Fe2+ + 2OH– = Fe(OH)2
Fe(OH)2 + O2 + H2O → Fe2O3 · xH2O
Для того чтобы гальванический элемент работал, необходимо наличие двух металлов различной химической активности и среды, которая проводит электрический ток, – электролита. При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
Процесс электрической коррозии
Такой вид разрушения металлических подземных конструкций, кабелей и сооружений могут вызывать блуждающие токи, исходящие от трамваев, метро, электрических железных дорог и различных электроустановок с постоянным током.
Ток с металлических конструкций выходит в грунт в виде положительных ионов металла – происходит электролиз металла. Участок выхода токов – это анодные зоны. Именно в них и протекают активные процессы электрической коррозии железа. Блуждающие токи могут достигать 300 А и действовать в радиусе нескольких десятков километров.
Блуждающими токами, исходящими от источников переменного тока, вызывается слабая коррозия подземных стальных конструкций, и сильная – конструкций из цветных металлов. Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Основные виды коррозии металлов | «ЧелМетСнаб»
Содержание:
Коррозией металлов называется их разрушение вследствие химического или электрохимического взаимодействия с окружающей средой. По механизму протекания процесса различают два типа коррозии металлов: химическую и электрохимическую.
Химическая коррозия — это коррозийный процесс, протекающий в средах, не проводящий электрический ток. Химическая коррозия имеет место, например, при высокотемпературном нагреве стали для горячей обработки давлением или термической обработки. При этом на поверхности металла образуются различные химические соединения — оксиды, сульфиды и другие — в виде пленки.
В отдельных случаях образовавшиеся при химической коррозии пленки, особенно сплошные, предохраняют металл от дальнейшей коррозии. Например, алюминий, олово, свинец, никель и хром способны к образованию на поверхности металлов плотных защитных пленок. пленки же на поверхности стальных и чугунных изделий непрочны, способны к растрескиванию и проникновению коррозии в глубь металла.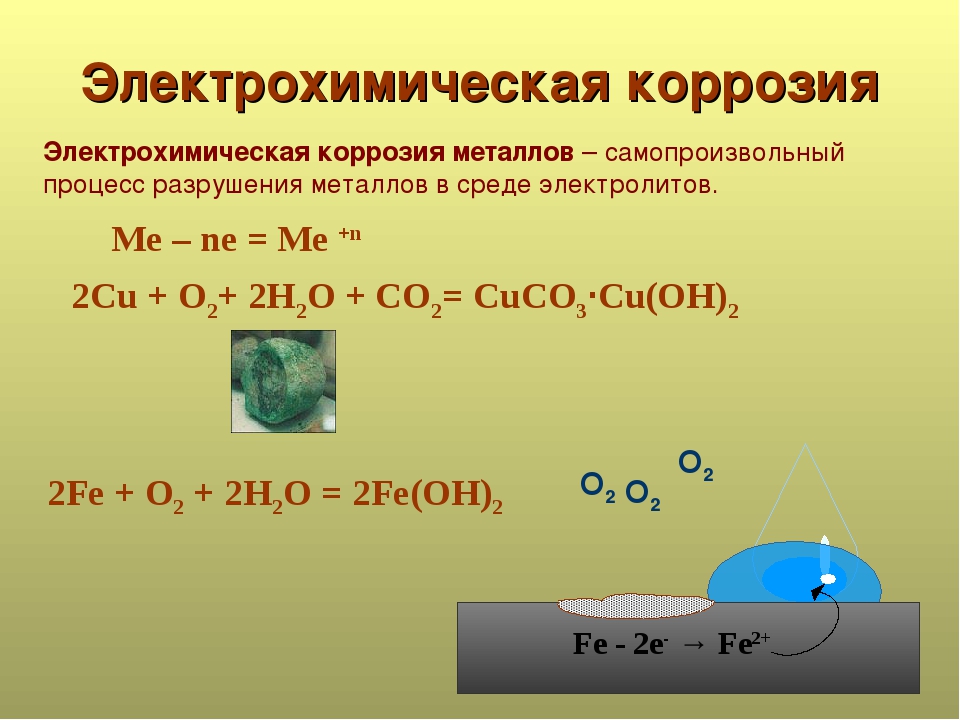
Электрохимическая коррозия обычно сопровождается протеканием электрического тока. Примерами могут служить ржавление металлических конструкций и изделий в атмосфере, корпусов судов и стальной арматуры гидросооружений в речной и морской воде и т.п.
Детальное рассмотрение механизмов химической и электрохимической коррозии показывает, что резкого различия между ними не существует. В ряде случаев возможен постепенный переход химической коррозии в электрохимическую и, наоборот, механизм коррозии металлов в растворах электролитов может иметь двоякий характер.
Коррозия по условиям протекания бывает следующая. Газовая- коррозия металла в газах при высоких температурах. Коррозия в неэлектролитах (например, коррозия стали в бензине). Атмосферная коррозия различных металлических конструкций на воздухе. Коррозия в электролитах- в проводящих электрический ток жидких средах. Почвенная (например, коррозия подземных трубопроводов). Коррозия внешним током или электрокоррозия (например, коррозия подземной трубы блуждающими токами). Контактная — электрохимическое разрушение металлов, происходящее в результате контакта различных металлов в электролите (например, коррозия деталей из алюминиевых сплавов, соприкасающихся с деталями из меди). Структурная- связанная со структурной неоднородностью металлов; например, ускорение коррозионного процесса чугуна в растворе серной кислоты в результате имеющихся в нем включений графита. Коррозия под напряжением, изменяющимся по значению и знаку, что часто вызывает коррозионную усталость- понижение предела выносливости металла. Коррозия при трении; например, разрушение шейки вала при вращении в морской воде. Щелевая, протекающая в узких щелях и зазорах между отдельными деталями. Биокоррозия- коррозия металлов под воздействием продуктов, выделяемых микроорганизмами, и пота рук человека. По характеру коррозионных процессов и месту их распределения различают сплошную, местную и межкристаллитную коррозию. Сплошная коррозия характеризуется тем, что металлическое изделие разрушается почти равномерно и коррозия охватывает всю его поверхность.
Контактная — электрохимическое разрушение металлов, происходящее в результате контакта различных металлов в электролите (например, коррозия деталей из алюминиевых сплавов, соприкасающихся с деталями из меди). Структурная- связанная со структурной неоднородностью металлов; например, ускорение коррозионного процесса чугуна в растворе серной кислоты в результате имеющихся в нем включений графита. Коррозия под напряжением, изменяющимся по значению и знаку, что часто вызывает коррозионную усталость- понижение предела выносливости металла. Коррозия при трении; например, разрушение шейки вала при вращении в морской воде. Щелевая, протекающая в узких щелях и зазорах между отдельными деталями. Биокоррозия- коррозия металлов под воздействием продуктов, выделяемых микроорганизмами, и пота рук человека. По характеру коррозионных процессов и месту их распределения различают сплошную, местную и межкристаллитную коррозию. Сплошная коррозия характеризуется тем, что металлическое изделие разрушается почти равномерно и коррозия охватывает всю его поверхность. Этот вид коррозии сравнительно легко поддается контролю и оценке.
Этот вид коррозии сравнительно легко поддается контролю и оценке.
Местная коррозия обычно бывает сосредоточенна на отдельных участках поверхности изделия. Это более опасный вид коррозии, так как распространяется на значительную глубину, а следовательно, приводит к потере работоспособности изделий. Чаще всего этот вид коррозии наблюдается в местах механических повреждений поверхности изделий. При межкристаллитной коррозии процесс разрушения начинается с поверхности изделия и распространяется в глубь его, в основном по границам зерен. Межкристаллитная коррозия вызывает хрупкость металла и значительное снижение его несущей способности. Этот часто встречающийся на практике вид коррозии является весьма опасным и обычно имеет место при термической обработке металлов или сварке. Степень коррозийной стойкости сталей существенно зависит от содержания углерода. Так, с уменьшением содержания углерода в легированной хромоникелевой стали марки Х18Н9 до 0.015% практически устраняется склонность ее к межкристаллитной коррозии.
Методы защиты металлов от коррозии, их эффективность
Существуют многочисленные способы защиты металлов от коррозии. Выбор того или иного способа определяется конкретными условиями работы и хранения металлических изделий. Применяются следующие способы защиты: легирование сталей, нанесение металлических покрытий, электрохимическая защита.
Легирование наиболее надежно защищает металл от коррозии, причем наиболее эффективно в условиях воздействия механических напряжений и коррозийной среды. Легирование позволяет предотвратить и коррозийное растрескивание изделий.
Так, например, к группе сталей с особыми химическими свойствами относят коррозионно-стойкие стали. Их получают путем введения в углеродистые и низколегированные стали значительных добавок хрома или хрома и никеля. При содержании хрома 13, 17 и 25% хромистые стали являются не только коррозионно-, но и жаростойкими. Хромоникелевые стали обладают большей коррозионной стойкостью, чем хромистые, и находят широкое применение в химической промышленности.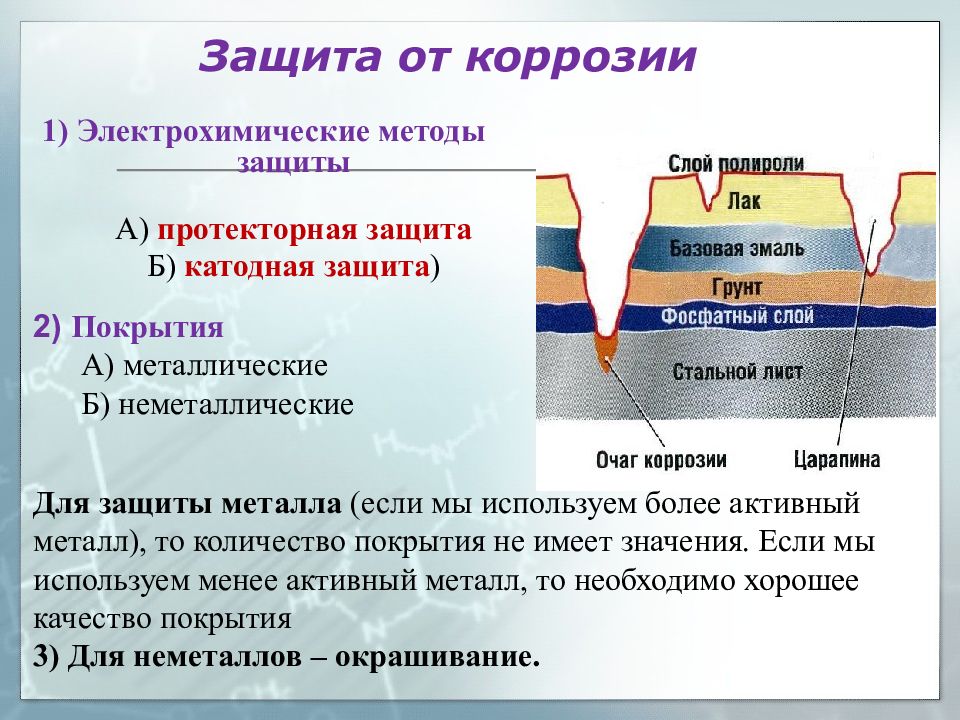
Механизм защиты сталей от коррозии их легированием различен и связан либо с повышением коррозионной стойкости всего объема металла, либо с образованием на поверхности изделия защитных пленок.
Металлические покрытия наносят на поверхность изделия тонким слоем металла, обладающего достаточной стойкостью в данной среде. Металлические покрытия придают также поверхностным слоям металлоизделий требуемую твердость, износостойкость. Различают два типа металлических покрытий- анодное и катодное. Для железоуглеродистых сплавов таким анодным покрытием может служить покрытие из цинка и кадмия. В воде и во влажном воздухе цинк покрывается слоем основной углекислой соли белого цвета, защищающим его от дальнейшего разрушения. Широкое применение получили цинковые покрытия для защиты арматуры, труб и резервуаров от действия воды и горячих жидкостей.
Металлические покрытия наносят различными способами. Наиболее часто применяется горячий метод, гальванизация и металлизация.
При горячем методе изделие погружают в расплавленный металл, который смачивает его поверхность и покрывает тонким слоем. Затем изделие вынимают из ванны и охлаждают. Таким методом изделие покрывают слоем олова или цинка. Лужение применяют при изготовлении белой жести, при устройстве покрытий на внутренних поверхностях пищевых котлов и других изделий. Цинкованием предохраняют от коррозии, например, кровельное железо, водопроводные трубы.
Затем изделие вынимают из ванны и охлаждают. Таким методом изделие покрывают слоем олова или цинка. Лужение применяют при изготовлении белой жести, при устройстве покрытий на внутренних поверхностях пищевых котлов и других изделий. Цинкованием предохраняют от коррозии, например, кровельное железо, водопроводные трубы.
При гальваническом способе металлические изделия помещают в гальваническую ванну. Под действием электрического тока на поверхности изделия происходит катодное осаждение пленки защитного металла. Толщину гальванического покрытия можно регулировать в широких пределах. Покрытия получают также распылением расплавленного металла с помощью специальных металлизационных пистолетов и напылением на его поверхность защищаемого металла. Этот вид защиты используют для крупногабаритных конструкций: ж./д мостов и т. д. В качестве защитного металла используют алюминий, цинк, хром, коррозионно-стойкие стали.
Неметаллические покрытия выполняются из лаков, красок, эмалей и др. веществ и изолируют изделие от воздействия внешней среды. Эти покрытия имеют преимущество перед металлическими. Они легко наносятся на изделие, хорошо закрывают поры, не изменяют свойств металла и являются относительно дешевыми. При хранении и перевозке изделий металлические изделия покрывают специальными смазочными материалами, минеральными маслами и жирами. Для защиты изделий, работающих в высокоагрессивных средах, применяют пластмассовые покрытия из винипласта, поливинилхлорида.
веществ и изолируют изделие от воздействия внешней среды. Эти покрытия имеют преимущество перед металлическими. Они легко наносятся на изделие, хорошо закрывают поры, не изменяют свойств металла и являются относительно дешевыми. При хранении и перевозке изделий металлические изделия покрывают специальными смазочными материалами, минеральными маслами и жирами. Для защиты изделий, работающих в высокоагрессивных средах, применяют пластмассовые покрытия из винипласта, поливинилхлорида.
Химические покрытия — защитные оксидные иные пленки- создаются при воздействии на металл сильных химических реагентов. Широко применяются также оксидирование и фосфатирование металлоизделий.
Оксидирование заключается в создании на поверхности изделия оксидной пленки, обладающей большой коррозийной стойкостью. Наиболее широко применяют оксидирование для защиты от коррозии изделий из алюминия и его сплавов.
Фосфатирование стальных изделий заключается в создании поверхностного слоя из фосфатов марганца и железа. Фосфатные покрытия используются в дальнейшем в качестве подслоя. Фосфатные покрытия часто применяются в сочетании со смазочными материалами для уменьшения трения при обработке металлов давлением, волочением, для хорошей приработке трущихся деталей машин.
Фосфатные покрытия используются в дальнейшем в качестве подслоя. Фосфатные покрытия часто применяются в сочетании со смазочными материалами для уменьшения трения при обработке металлов давлением, волочением, для хорошей приработке трущихся деталей машин.
В отдельных случаях прибегают к защите металлов от коррозии при помощи протекторов. Сущность протекторной защиты заключается в том, что к поверхности защищаемого изделия прикрепляют протекторы- куски металла. Образуется гальваническая пара , в которой анод- протектор, катод- изделие. В результате протектор разрушается, защищая изделие. Таким образом, защищают, например, подводные металлические части кораблей, прикрепляя к ним пластины цинка.
Возможно вас заинтересует
Народнохозяйственное значение борьбы с коррозией
Одним из основных факторов, определяющих долговечность машин и оборудования, является коррозия металлов. Потери от коррозии можно разделить на прямые и косвенные. Прямые потери- это стоимость заменяемых изделий, затраты на защитные мероприятия и безвозвратные потери металла вследствие коррозии. По подсчетам специалистов, безвозвратные потери металла в мировом масштабе составляют в настоящее время около 10…15% от объема производства стали. Косвенные потери продукта в результате утечек, снижение производительности агрегата, загрязнение продуктами коррозии целевого продукта и т.п.
Прямые потери- это стоимость заменяемых изделий, затраты на защитные мероприятия и безвозвратные потери металла вследствие коррозии. По подсчетам специалистов, безвозвратные потери металла в мировом масштабе составляют в настоящее время около 10…15% от объема производства стали. Косвенные потери продукта в результате утечек, снижение производительности агрегата, загрязнение продуктами коррозии целевого продукта и т.п.
Значительная часть мощности предприятий черной металлургии затрачивается на восполнение потерь металла вследствие коррозии. Однако это далеко не полностью отражает действительный ущерб, связанный с выходом из строя изделий из металла. Значительные потери обусловлены авариями оборудования, простоями его, потерями и отходами в металлообработке, нарушениями качества продукции и в конечном счете повышением ее себестоимости и снижением производительности труда. Поэтому экономия металла, повышение качества металлов и металлоизделий, уменьшение коррозионных потерь — непременное условие повышения эффективности производства и качества продукции, которое должно обеспечиваться в государственном масштабе.
Коррозия металлов и её виды
Химические и физико-химические реакции, возникающие в момент взаимодействия окружающей среды с металлами и сплавами, в большинстве случаев приводят к их самопроизвольному разрушению. Процесс саморазрушения имеет собственный термин – «коррозия». Результатом коррозии является существенное ухудшение свойств металла, вследствие чего изделия из него быстро выходят из строя. Каждый металл обладает свойствами, позволяющими ему сопротивляться разрушению. Коррозийная стойкость или, как ее еще называют, химическое сопротивление материала, является одним из главных критериев, по которым осуществляется отбор металлов и сплавов для изготовления тех или иных изделий.
В зависимости от интенсивности и длительности коррозийного процесса металл может быть подвергнут как частичному, так и полному разрушению. Взаимодействие коррозийной среды и металла приводят к образованию на поверхности металла таких явлений, как окалина, оксидная пленка и ржавчина. Данные явления отличаются друг от друга не только внешним видом, но еще и степенью адгезии с поверхностью металлов. Так, например, в процессе окисления такого металла, как алюминий, его поверхность покрывает пленка оксидов, отличающаяся высокой прочностью. Благодаря этой пленке разрушительные процессы купируются и не проникают вовнутрь. Если говорить о ржавчине, то результатом ее воздействия является образование рыхлого слоя. Процесс коррозии в данном случае очень быстро проникает во внутреннюю структуру металла, что способствует его скорейшему разрушению.
Взаимодействие коррозийной среды и металла приводят к образованию на поверхности металла таких явлений, как окалина, оксидная пленка и ржавчина. Данные явления отличаются друг от друга не только внешним видом, но еще и степенью адгезии с поверхностью металлов. Так, например, в процессе окисления такого металла, как алюминий, его поверхность покрывает пленка оксидов, отличающаяся высокой прочностью. Благодаря этой пленке разрушительные процессы купируются и не проникают вовнутрь. Если говорить о ржавчине, то результатом ее воздействия является образование рыхлого слоя. Процесс коррозии в данном случае очень быстро проникает во внутреннюю структуру металла, что способствует его скорейшему разрушению.
Показатели, по которым осуществляется классификация коррозийных процессов:
-
вид коррозийной среды; -
условия и механизм протекания; -
характер коррозийных разрушений; -
вид дополнительных воздействий на металл.
По механизму коррозийного процесса различают как химическую, так и электрохимическую коррозию металлов и сплавов.
Химическая коррозия – это взаимодействие металлов с коррозийной средой, в процессе которого наблюдается единовременное осуществление окисления металла и восстановление окислительного компонента среды. Взаимодействующие между собой продукты не разделены пространственно.
Электрохимическая коррозия – это взаимодействие металлов с коррозийно-активной средой, представляющей собой раствор электролита. Процесс ионизации атомов металла, а также процесс восстановления окислительного компонента данной коррозийной среды протекают в разных актах. Электродный потенциал раствора электролита оказывает существенное влияние на скорость этих процессов.
В зависимости от типа агрессивной среды существует несколько видов коррозии
Атмосферная коррозия представляет собой саморазрушение металлов в воздушной атмосфере, либо в газовой атмосфере, отличающейся повышенной влажностью.
Газовая коррозия – это коррозия металлов, происходящая в газовой среде, содержание влаги в которой минимально. Отсутствие влаги в газовой среде не единственное условие, способствующее саморазрушению металла. Также коррозия возможна и при высоких температурах. Наиболее часто встречается данный вид коррозии в нефтехимической и химической промышленности.
Радиационная коррозия представляет собой саморазрушение металла под воздействием на него радиоактивного излучения разной степени интенсивности.
Подземная коррозия – это коррозия, происходящая в почвах и различных грунтах.
Контактная коррозия представляет вид коррозии, образованию которого способствует контакт нескольких металлов, отличающихся друг от друга стационарными потенциалами в конкретном электролите.
Биокоррозия – это коррозия металлов, происходящая под воздействием различных микроорганизмов и их жизнедеятельности.
Коррозия током (внешним и блуждающим) – еще один вид коррозии металлов. Если на металл воздействует ток от внешнего источника, то это коррозия внешним током. Если же воздействие осуществляется посредством блуждающего тока, то это коррозия блуждающего тока.
Коррозийная кавитация представляет собой процесс саморазрушения металлов, возникновению которого способствует как ударное, так и коррозионное воздействие внешней среды.
Коррозия под напряжением представляет собой коррозию металла, причиной появления которой является взаимодействие коррозийно-активной среды и напряжений механического типа. Данный вид коррозии представляет существенную опасность для конструкций из металла, которые подвергаются сильнейшим механическим нагрузкам.
Фреттинг-коррозия — вид коррозии металлов, к которой приводит совокупность вибрации и воздействие коррозийной среды. Чтобы минимизировать вероятность возникновения коррозии при трении и вибрации, необходимо внимательно подходить к выбору конструкционного материала. Также необходимо применять специальные покрытия и по возможности снизить коэффициент трения.
Также необходимо применять специальные покрытия и по возможности снизить коэффициент трения.
По характеру разрушений коррозия разделяется на сплошную и избирательную
Сплошная коррозия полностью покрывает поверхность металла. Если скорость разрушений на всей поверхности одинакова, то это равномерная коррозия. Если разрушение металла на различных его участках происходит с разной скоростью, то коррозия называется неравномерной.
Избирательная коррозия подразумевает разрушение одного из компонентов сплава или же одной структурной составляющей.
Местная коррозия, проявляющаяся в виде отдельно разбросанных по поверхности металла пятен, представляет собой углубления разной толщины. Разрушения могут представлять собой раковины или точки.
Подповерхностная коррозия образуется непосредственно на поверхности металла, после чего активно проникает вглубь. Данный вид коррозии сопровождается расслоением изделий из металла.
Данный вид коррозии сопровождается расслоением изделий из металла.
Межкристаллитная коррозия проявляется в разрушении металла по границам зерен. По внешнему виду металла ее достаточно сложно определить. Однако очень быстро меняются показатели прочности и пластичности металла. Изделия из него становятся хрупкими. Наиболее опасен этот вид коррозии для хромистых и хромоникелевых видов стали, а также для алюминиевых и никелевых сплавов.
Щелевая коррозия образуется на тех участках металлов и сплавов, которые находятся в резьбовых креплениях, различных зазорах и под всевозможными прокладками.
Коррозия металлов
Коррозия – это самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Различают два вида коррозии – химическую и электрохимическую.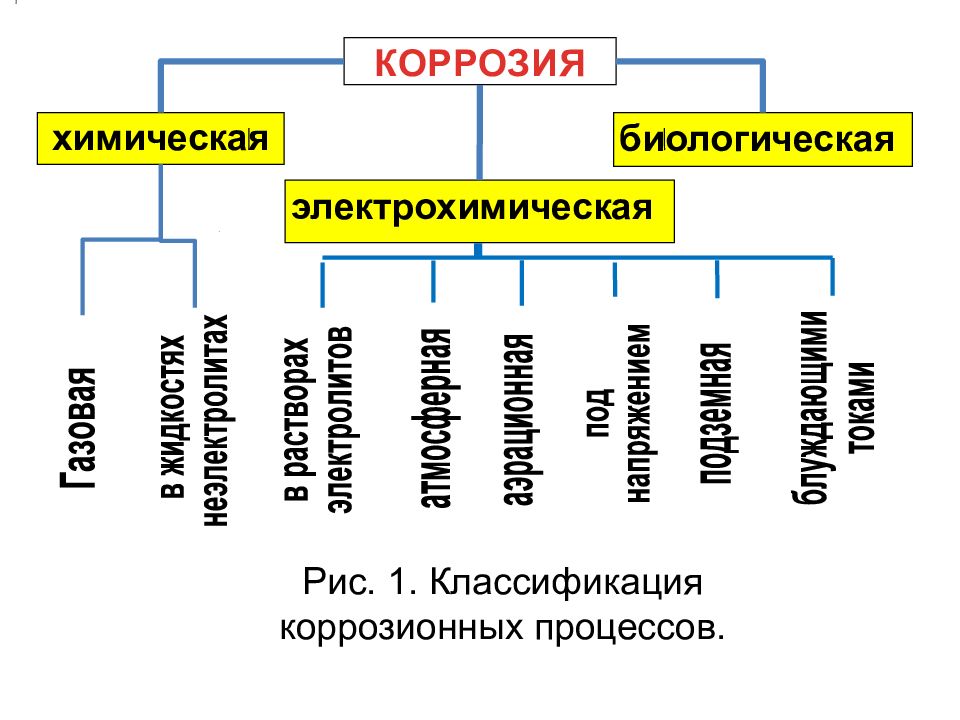 Химическая коррозия обусловлена взаимодействием металлов с веществами, содержащимися в окружающей среде. В производственных условиях такими веществами, помимо О2, являются SO2, CO2, H2S, NH3 и др.
Химическая коррозия обусловлена взаимодействием металлов с веществами, содержащимися в окружающей среде. В производственных условиях такими веществами, помимо О2, являются SO2, CO2, H2S, NH3 и др.
Химическую коррозию, обусловленную взаимодействием металлов с газами, называют газовой. Основной вклад в газовую коррозию металла вносит кислород воздуха. Различные металлы обладают различной устойчивостью по отношению к О2. Некоторые металлы (Al, Cr, Zn, Pb, Sn) образуют на воздухе плотные пленки оксидов, не разрушающиеся при изгибе или нагревании. Такие пленки защищают металл от дальнейшего доступа к нему газов и жидкостей, и процесс коррозии резко замедляется. Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования. Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
Процесс химической коррозии Fe схематически можно представить следующими уравнениями:
2Fe + O2=2FeO
4Fe + 3O2 = 2Fe2O3
3Fe + 2O2 =FeO · Fe2O3
4Fe + 3O2 +6H2O=4Fe(OH)3
Fe(OH)3=t H2O+FeOOH (ржавчина)
Однако наибольший вред приносит не химическая, а электрохимическая коррозия, связанная с переходом электронов от одних участков металла к другим. Химическая коррозия сопровождает электрохимическую и усиливает ее.
Сущность электрохимической коррозии
Металлы обычно содержат примеси других металлов и неметаллов. При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода, а атомы менее активного – роль катода.
В этих парах атомы более активного металла (обычно Fe) играют роль анода, а атомы менее активного – роль катода.
На катоде идет процесс восстановления молекул О2 в нейтральной и щелочной средах, или ионов Н+ – в кислой среде.
На аноде происходит окисление атомов металла, из которых состоит анод, с образованием катионов Men+.
Последние переходят в электролит (растворение анода) и соединяются с ионами ОН–, с образованием гидроксида Me(OH)n и других продуктов. Называемых ржавчиной. В результате металл, играющий роль анода, разрушается.
Скорость электрохимической коррозии тем больше, чем дальше друг от друга расположены металлы в ряду напряжений, и чем выше температура окружающей среды.
Чистые металлы устойчивы к коррозии. Однако, так ка абсолютно чистым металлов нет, а также вследствие того, что гальваническая пара может быть образована отдельными участками одного и того же металла, находящимися в различных условиях (под разными электролитами или под одним и тем же электролитом разной концентрации), то электрохимическая коррозия имеет место всегда при соприкосновении металла с электролитом (атмосферной влагой).
Роль катода при электрохимической коррозии могут выполнять не только менее активные металлы, но и примеси неметаллов, способных принимать электроны.
Коррозия – процесс поверхностный и при отсутствии трещин внутри металла развиваться не может. Поэтому одним из способов защиты от коррозии является нанесение на поверхность металла металлических и неметаллических покрытий.
В качестве металлических покрытий используются пленки Au, Ag, Ni, Cr, Zn и других металлов, которые мало подвергаются коррозии из-за своей индифферентности или по причине образования прочных оксидных пленок. Некоторые из этих металлов (Au, Ag, Ni, Cr), помимо защитной, выполняют и эстетическую – придают изделиям приятный внешний вид.
Различают два вида металлических покрытий – анодное и катодное. Покрытие называется
- анодным, если оно изготовлено из металла более активного, чем защищаемый;
- катодным, если изготовлено из менее активного металла.

Примером анодных покрытий для изделий из железа являются пленки из Cr, Zn, примером катодных – пленки из Ni, Sn, Ag, Au. Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Неметаллические покрытия также делятся на два вида: неорганические и органические. В качестве органических покрытий используются пленки лаков, красок, пластмасс, резины, битума, в качестве неорганических – эмали.
Протекторная защита заключается в соединении защищаемого изделия проводником с протектором – пластиной из более активного металла (Al, Mg, Zn). В процессе коррозии протектор служит анодом и разрушается, предохраняя от коррозии металлическое изделие или конструкцию.
Электрохимическая (катодная) защита заключается в соединении защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Анодом служит вспомогательный, обычно стальной, электрод (кусок металла), который и разрушается в процессе коррозии.
Автор: Метельский А.В.
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
Электрохимическая коррозия — обзор
4.4 Экспериментальные кривые поляризации
Экспериментальные исследования электрохимической коррозии для определения скорости и поведения коррозии часто используют потенциостатическую схему, которая включает в себя поляризационную ячейку, как схематически показано на рисунке 4.12. Рабочий электрод (WE) представляет собой образец коррозии (т. Е. Оцениваемый материал). Вспомогательный электрод (AE) или противоэлектрод в идеале изготовлен из материала, который будет поддерживать реакции электрохимического окисления или восстановления с реагентами в электролите, но сам по себе не будет подвергаться коррозии и тем самым загрязнять электролит. АЭ обычно изготавливают из платины или графита высокой плотности. Электрод сравнения (RE) поддерживает постоянный потенциал, относительно которого измеряется потенциал WE с помощью электрометра, вольтметра с высоким импедансом (> 10 14 Ом), который ограничивает ток, проходящий через электрометр, до чрезвычайно малых значений, которые пренебрежимо малы. влияют на потенциал RE или WE. Потенциостат — это быстродействующий источник постоянного тока (DC), который будет поддерживать потенциал WE относительно RE на постоянном (заданном или заданном) значении, даже если ток внешней цепи, I ex , может изменяться. на несколько порядков.Когда потенциостат отключен от образца коррозии (WE), существует состояние разомкнутой цепи или разомкнутой ячейки, WE свободно корродирует, измеренный потенциал представляет собой потенциал коррозии разомкнутой цепи, E corr и, конечно же, , I от = 0.
АЭ обычно изготавливают из платины или графита высокой плотности. Электрод сравнения (RE) поддерживает постоянный потенциал, относительно которого измеряется потенциал WE с помощью электрометра, вольтметра с высоким импедансом (> 10 14 Ом), который ограничивает ток, проходящий через электрометр, до чрезвычайно малых значений, которые пренебрежимо малы. влияют на потенциал RE или WE. Потенциостат — это быстродействующий источник постоянного тока (DC), который будет поддерживать потенциал WE относительно RE на постоянном (заданном или заданном) значении, даже если ток внешней цепи, I ex , может изменяться. на несколько порядков.Когда потенциостат отключен от образца коррозии (WE), существует состояние разомкнутой цепи или разомкнутой ячейки, WE свободно корродирует, измеренный потенциал представляет собой потенциал коррозии разомкнутой цепи, E corr и, конечно же, , I от = 0.
Рисунок 4.12. Потенциостатическая цепь.
Потенциостат может быть настроен на поляризацию WE либо анодно, и в этом случае итоговая реакция на поверхности WE является окислением (электроны удаляются из WE), либо катодно, и в этом случае итоговая реакция на поверхности WE является восстановлением ( электроны, потребляемые в WE). Что касается потенциостатической цепи на рисунке 4.12, определение поляризационной кривой обычно начинается с первого измерения потенциала коррозии холостого хода, E corr , до тех пор, пока не будет достигнуто установившееся значение (например, изменение менее 1,0 мВ пятиминутный период). Затем потенциостат настраивается на управление на E или Corr и подключается к поляризационной ячейке. Затем уставка потенциала сбрасывается непрерывно или ступенчато для управления историей потенциала-времени WE, пока измеряется I ex .Если заданный потенциал постоянно увеличивается (выше E или ), создается кривая анодной поляризации. И наоборот, если потенциал непрерывно снижается (ниже E или ), создается кривая катодной поляризации.
Что касается потенциостатической цепи на рисунке 4.12, определение поляризационной кривой обычно начинается с первого измерения потенциала коррозии холостого хода, E corr , до тех пор, пока не будет достигнуто установившееся значение (например, изменение менее 1,0 мВ пятиминутный период). Затем потенциостат настраивается на управление на E или Corr и подключается к поляризационной ячейке. Затем уставка потенциала сбрасывается непрерывно или ступенчато для управления историей потенциала-времени WE, пока измеряется I ex .Если заданный потенциал постоянно увеличивается (выше E или ), создается кривая анодной поляризации. И наоборот, если потенциал непрерывно снижается (ниже E или ), создается кривая катодной поляризации.
Интерпретация экспериментально определенной поляризационной кривой, включая понимание информации, получаемой из нее, основана на форме поляризационной кривой, которая получается из поляризационных кривых для отдельных реакций анодной и катодной полуэлементов, протекающих на поверхности металла. .Эти отдельные поляризационные кривые, предполагающие поведение Тафеля во всех случаях, показаны на рисунке 4.13 (пунктирные кривые) с обозначениями E corr и I corr . Предполагается, что в рассматриваемом потенциальном диапазоне вклады I ox, X и I red, M в чистые анодные и катодные кривые пренебрежимо малы. Следовательно, I a = I ox, M и I c = I красный, X . При любом потенциале WE, установленном потенциостатом, экспериментально измеренный внешний ток, I ex , представляет собой разность между I ox, M и I красный, X .Эта разница в терминах тафелевских выражений для отдельных реакций составляет
.Эти отдельные поляризационные кривые, предполагающие поведение Тафеля во всех случаях, показаны на рисунке 4.13 (пунктирные кривые) с обозначениями E corr и I corr . Предполагается, что в рассматриваемом потенциальном диапазоне вклады I ox, X и I red, M в чистые анодные и катодные кривые пренебрежимо малы. Следовательно, I a = I ox, M и I c = I красный, X . При любом потенциале WE, установленном потенциостатом, экспериментально измеренный внешний ток, I ex , представляет собой разность между I ox, M и I красный, X .Эта разница в терминах тафелевских выражений для отдельных реакций составляет
Рисунок 4.13. Схематические экспериментальные поляризационные кривые (сплошные кривые), предполагающие тафелевское поведение для индивидуального окисления, и поляризационные кривые восстановления катодного реагента (штриховые кривые).
(4.83) Iex = Iox, M − Ired, X = Io, Me2. 3 (E − E′M) βoX, M − Io, Xe2.3 (E − E′x) βred, x
3 (E − E′M) βoX, M − Io, Xe2.3 (E − E′x) βred, x
Это Очевидно, что I ex изменяется с положительного на отрицательный, когда I красный, X становится больше, чем I ox, M .Это изменение знака происходит, когда I ex проходит через I ex = 0, в этой точке E = E corr и I ox, M = I красный, X = I corr . Таким образом, можно выделить два диапазона тока: I ex > 0 (в котором преобладает анодная реакция или реакция окисления) и I ex <0 (в котором преобладает катодная реакция или реакция восстановления). Свойства этих двух диапазонов суммированы ниже.
В диапазоне токов, I ex > 0, потенциал WE, установленный потенциостатом, больше, чем E corr .Электроны, произведенные в единицу времени реакцией M → M m + + me, превышают количество электронов, потребляемых в единицу времени реакцией X x + + xe → X, и чистое окисление происходит в WE. Положительный ток соответствует соглашению о знаках, которое присваивает положительное значение току внешней цепи, когда чистое окисление происходит в WE. Для I ex > 0 график зависимости E от log I ex принимает форму верхней сплошной кривой на рисунке 4.13, анодной ветви экспериментальной поляризационной кривой.Когда E достаточно увеличивается выше E corr , чтобы вызвать I красный, X становится незначительным по сравнению с I ox, M (обычно 50–100 мВ),
Положительный ток соответствует соглашению о знаках, которое присваивает положительное значение току внешней цепи, когда чистое окисление происходит в WE. Для I ex > 0 график зависимости E от log I ex принимает форму верхней сплошной кривой на рисунке 4.13, анодной ветви экспериментальной поляризационной кривой.Когда E достаточно увеличивается выше E corr , чтобы вызвать I красный, X становится незначительным по сравнению с I ox, M (обычно 50–100 мВ),
(4.84) Iex = Iox, M
и I ex становится прямой мерой скорости окисления, I ox, M , металла в этом диапазоне потенциалов. Этот линейный участок экспериментальной кривой показывает тафелевскую кривую анодной реакции металла, а экстраполяция тафелевской кривой на E’M дает оценку экспериментальной плотности тока обмена металла, I o, M / A a , где A a — площадь ЗЕ.
В диапазоне токов, I ex <0, потенциал WE, установленный потенциостатом, меньше, чем E corr .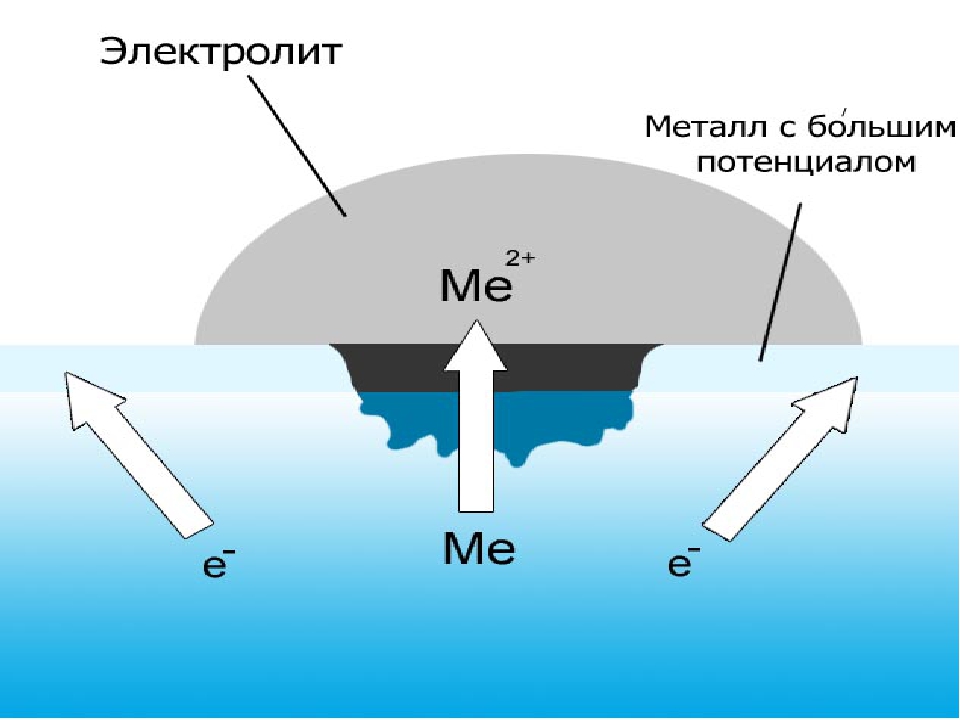 На поверхности металла количество электронов, потребляемых в единицу времени реакцией X x + + xe → X, превышает количество электронов, произведенных в единицу времени реакцией M → M m + + me. Происходит чистое восстановление, и электроны должны поступать в WE по внешней цепи; ток внешней цепи (I ex ) будет отрицательным. График зависимости E от log | I ex | принимает форму нижней сплошной кривой на рисунке 4.13. Когда E уменьшается до уровня ниже E corr , чтобы вызвать I ox, M становится незначительным (обычно 50–100 мВ),
На поверхности металла количество электронов, потребляемых в единицу времени реакцией X x + + xe → X, превышает количество электронов, произведенных в единицу времени реакцией M → M m + + me. Происходит чистое восстановление, и электроны должны поступать в WE по внешней цепи; ток внешней цепи (I ex ) будет отрицательным. График зависимости E от log | I ex | принимает форму нижней сплошной кривой на рисунке 4.13. Когда E уменьшается до уровня ниже E corr , чтобы вызвать I ox, M становится незначительным (обычно 50–100 мВ),
(4.85) Iex = −Ired, X
или
(4.86) | Iex | = Ired, X
и I ex становится прямой мерой скорости катодной реакции, I красный, X , на металле. Этот линейный участок экспериментальной кривой показывает тафелевскую кривую катодной реакции, и экстраполяция тафелевской кривой на E’X дает оценку экспериментальной плотности тока обмена катодной реакции, I o, X / A c , где A c — площадь ЗЕ.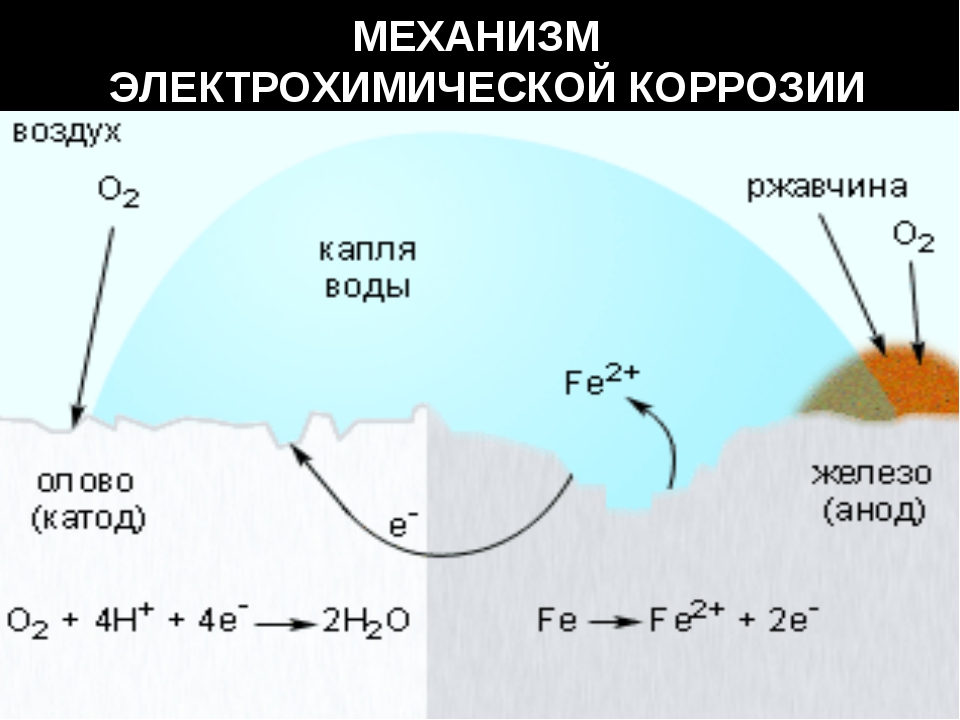
Подчеркивается, что в более общем смысле I ex — это экспериментально измеренный ток, представляющий чистую разницу между суммой всех токов реакций окисления и суммой всех токов реакций восстановления на границе раздела:
(4.87 ) Iex = ΣIox − ΣIred.
Для двух рассматриваемых полуэлементных реакций
(4.88) Iex = (Iox, M + Iox, X) — (Ired, X + Ired, M).
При условии, что I ox, X и I красный, M незначительны,
(4.89) Iex = Iox, M — Ired, X.
Приведенное выше соотношение в равной степени применимо, если кривая скорости окисления металла или кривая скорости восстановления катодного реагента не подчиняется поведению Тафеля. Чтобы проиллюстрировать эту точку зрения, исследуются три дополнительные схематические пары индивидуальных анодных и катодных поляризационных кривых. На рис. 4.14 металл подвергается активному-пассивному окислению, а E corr находится в пассивной области. На рисунке 4. 15, где кривая общей скорости восстановления включает восстановление как растворенного кислорода (O 2 + 4H + + 4e → 2H 2 O), так и ионов водорода (2H + + 2e → H 2). ) и их соответствующие предельные токи диффузии, показанный металл проявляет активно-пассивное окислительное поведение, а E corr находится в пассивной области.Для примера на рисунке 4.15 следует отметить, что если бы растворенный кислород был удален из электролита, E corr был бы в активной области, I corr был бы значительно больше, а экспериментальные поляризационные кривые выглядели бы как на рисунке 4.16.
15, где кривая общей скорости восстановления включает восстановление как растворенного кислорода (O 2 + 4H + + 4e → 2H 2 O), так и ионов водорода (2H + + 2e → H 2). ) и их соответствующие предельные токи диффузии, показанный металл проявляет активно-пассивное окислительное поведение, а E corr находится в пассивной области.Для примера на рисунке 4.15 следует отметить, что если бы растворенный кислород был удален из электролита, E corr был бы в активной области, I corr был бы значительно больше, а экспериментальные поляризационные кривые выглядели бы как на рисунке 4.16.
Рисунок 4.14. Схематические экспериментальные поляризационные кривые.
Рисунок 4.15. Схематические экспериментальные поляризационные кривые.
Рисунок 4.16. Схематические экспериментальные поляризационные кривые.
Измерения электрохимической коррозии — Гальваническая коррозия
Обзор электрохимических основ коррозии
Большая часть коррозии металлов происходит в результате электрохимических реакций на границе раздела между металлом и раствором электролита. Например, тонкая пленка влаги на поверхности металла образует электролит для атмосферной коррозии. Второй пример — это когда влажный бетон является электролитом для коррозии арматурных стержней в мостах. Хотя большая часть коррозии происходит в воде, коррозия в неводных системах известна.
Например, тонкая пленка влаги на поверхности металла образует электролит для атмосферной коррозии. Второй пример — это когда влажный бетон является электролитом для коррозии арматурных стержней в мостах. Хотя большая часть коррозии происходит в воде, коррозия в неводных системах известна.
Коррозия обычно происходит со скоростью, определяемой равновесием противоположных электрохимических реакций. Одна из реакций — это анодная реакция, при которой металл окисляется, высвобождая электроны в металл.Другой — катодная реакция, в которой частицы раствора (часто O 2 или H + ) восстанавливаются, удаляя электроны из металла. Когда эти две реакции находятся в равновесии, поток электронов от каждой реакции уравновешен, и чистый поток электронов (электрический ток) не возникает. Две реакции могут происходить на одном металле или на двух разнородных металлах (или участках металла), которые электрически связаны.
На рисунке 1 показан этот процесс. По вертикальной оси отложен электрический потенциал, а по горизонтальной оси — логарифм абсолютного тока.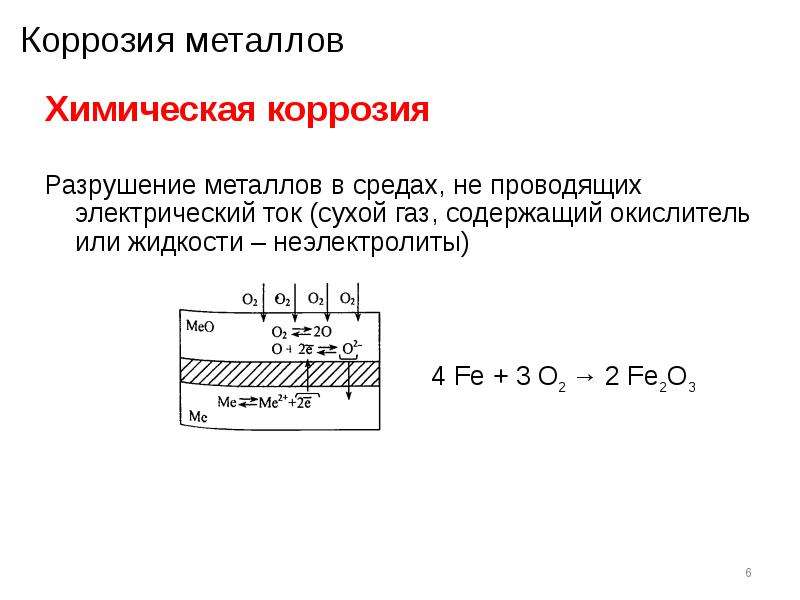 Теоретический ток анодной и катодной реакций представлен прямыми линиями. Кривая линия — это полный ток: сумма анодного и катодного токов. Это ток, который вы измеряете, когда проверяете потенциал металла своим потенциостатом. Острая точка на кривой — это фактически точка, в которой ток меняет полярность, когда реакция меняется с анодной на катодную или наоборот. Острый момент вызван нанесением графика по логарифмической оси. Использование логарифмической оси необходимо из-за широкого диапазона значений тока, которые необходимо регистрировать во время эксперимента по коррозии.Из-за явления пассивности ток часто изменяется на шесть порядков во время эксперимента по коррозии.
Теоретический ток анодной и катодной реакций представлен прямыми линиями. Кривая линия — это полный ток: сумма анодного и катодного токов. Это ток, который вы измеряете, когда проверяете потенциал металла своим потенциостатом. Острая точка на кривой — это фактически точка, в которой ток меняет полярность, когда реакция меняется с анодной на катодную или наоборот. Острый момент вызван нанесением графика по логарифмической оси. Использование логарифмической оси необходимо из-за широкого диапазона значений тока, которые необходимо регистрировать во время эксперимента по коррозии.Из-за явления пассивности ток часто изменяется на шесть порядков во время эксперимента по коррозии.
Рис. 1. Процесс коррозии, показывающий анодную и катодную составляющие тока.
Потенциал металла — это средство, с помощью которого анодная и катодная реакции поддерживаются в равновесии. См. Рисунок 1. Обратите внимание на то, что ток каждой полуреакции зависит от электрохимического потенциала металла. Предположим, что анодная реакция высвобождает в металл слишком много электронов.Таким образом, избыток электронов смещает потенциал металла в более отрицательную сторону, что замедляет анодную реакцию и ускоряет катодную реакцию. Это противодействует начальному возмущению системы.
Предположим, что анодная реакция высвобождает в металл слишком много электронов.Таким образом, избыток электронов смещает потенциал металла в более отрицательную сторону, что замедляет анодную реакцию и ускоряет катодную реакцию. Это противодействует начальному возмущению системы.
Равновесный потенциал, принимаемый металлом при отсутствии электрических соединений с металлом, называется потенциалом холостого хода E oc . В большинстве экспериментов по электрохимической коррозии первым шагом является измерение E oc .
Значение анодного или катодного тока при E oc называется током коррозии, I corr .Если бы мы могли измерить I corr , мы могли бы использовать его для расчета скорости коррозии металла. К сожалению, I corr нельзя измерить напрямую. Однако его можно оценить с помощью электрохимических методов. В любой реальной системе I corr и скорость коррозии являются функцией многих параметров системы, включая тип металла, состав раствора, температуру, движение раствора, историю металла и многие другие.
Приведенное выше описание процесса коррозии ничего не говорит о состоянии металлической поверхности.На практике многие металлы в процессе коррозии образуют оксидный слой на своей поверхности. Если оксидный слой препятствует дальнейшей коррозии, говорят, что металл пассивируется. В некоторых случаях локальные участки пассивной пленки разрушаются, что приводит к значительной коррозии металла на небольшой площади. Это явление называется точечной коррозией или просто точечной коррозией.
Поскольку коррозия происходит в результате электрохимических реакций, электрохимические методы идеально подходят для изучения процессов коррозии. В электрохимических исследованиях образец металла с площадью поверхности в несколько квадратных сантиметров используется для моделирования металла в корродирующей системе.Металлический образец погружают в раствор, характерный для окружающей среды металла в исследуемой системе. Дополнительные электроды погружаются в раствор, и все электроды подключаются к устройству, называемому потенциостатом. Потенциостат позволяет изменять потенциал металлического образца контролируемым образом и измерять протекающий ток в зависимости от приложенного потенциала.
Потенциостат позволяет изменять потенциал металлического образца контролируемым образом и измерять протекающий ток в зависимости от приложенного потенциала.
Полезны поляризации как с регулируемым потенциалом (потенциостатическая), так и с регулируемым током (гальваностатическая).Когда поляризация выполняется потенциостатически, измеряется ток, а когда это делается гальваностатически, измеряется потенциал. Это обсуждение будет сосредоточено на методах с контролируемым потенциалом, которые гораздо более распространены, чем гальваностатические методы. За исключением зависимости потенциала холостого хода от времени, электрохимического шума, гальванической коррозии и некоторых других, потенциостатический режим используется для нарушения равновесного процесса коррозии. Когда потенциал металлического образца в растворе отклоняется от E oc , это называется поляризацией образца.Отклик (то есть результирующий ток) металлического образца измеряется по мере его поляризации. Отклик используется для разработки модели коррозионного поведения образца.
Количественная теория коррозии
В предыдущем разделе мы указали, что I corr нельзя измерить напрямую. Во многих случаях вы можете оценить это по данным зависимости тока от напряжения. Вы можете измерить логарифмическую кривую зависимости тока от потенциала в диапазоне около половины вольта. Сканирование напряжения сосредоточено на E oc .Затем вы подгоняете измеренные данные к теоретической модели процесса коррозии.
Модель, которую мы используем для процесса коррозии, предполагает, что скорость как анодного, так и катодного процессов контролируется кинетикой реакции переноса электрона на поверхности металла. Обычно это характерно для коррозионных реакций. Электрохимическая реакция под кинетическим контролем подчиняется уравнению. 1, уравнение Тафеля.
В этом уравнении
I | — ток реакции |
I 0 | — это зависящая от реакции константа, называемая током обмена |
E | — потенциал электрода |
E 0 | — равновесный потенциал (константа для данной реакции) |
β | — постоянная Тафеля реакции (постоянная для данной реакции, с единицами измерения вольт / декада. |
Уравнение Тафеля описывает поведение одной изолированной реакции. В системе коррозии мы имеем две противоположные реакции: анодную и катодную.
Уравнения Тафеля для анодных и катодных реакций в коррозионной системе можно объединить, чтобы получить уравнение Батлера-Фольмера (уравнение 2).
где
I | — измеренный ток от ячейки в амперах |
I корр. | — ток коррозии в амперах |
E | — потенциал электрода |
E корр. | — потенциал коррозии в вольтах |
β а | — анодная постоянная β Тафеля в вольтах на декаду |
β в | — катодная постоянная Тафеля β в вольтах на декаду |
Что означает уравнение.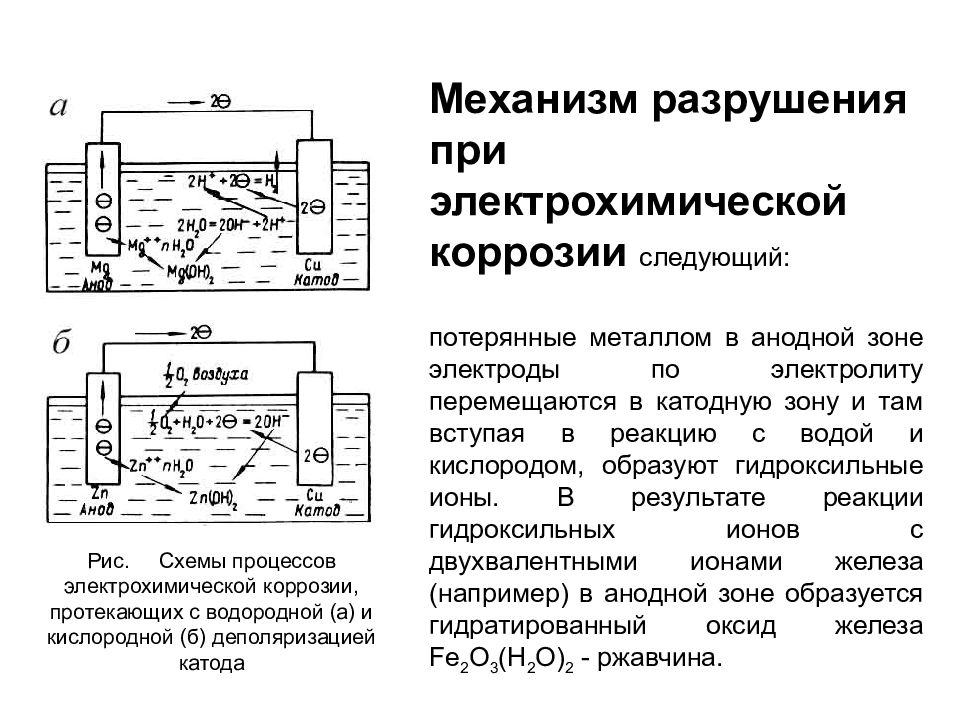 2 предсказать кривую зависимости тока от напряжения? В E corr каждый экспоненциальный член равен единице. Следовательно, ток ячейки равен нулю, как и следовало ожидать. Вблизи E или оба экспоненциальных члена вносят вклад в общий ток. Наконец, поскольку потенциал управляется потенциостатом далеко от E или , преобладает один экспоненциальный член, а другой член можно игнорировать. Когда это происходит, график зависимости логарифмического тока от потенциала становится прямой линией.
2 предсказать кривую зависимости тока от напряжения? В E corr каждый экспоненциальный член равен единице. Следовательно, ток ячейки равен нулю, как и следовало ожидать. Вблизи E или оба экспоненциальных члена вносят вклад в общий ток. Наконец, поскольку потенциал управляется потенциостатом далеко от E или , преобладает один экспоненциальный член, а другой член можно игнорировать. Когда это происходит, график зависимости логарифмического тока от потенциала становится прямой линией.
График зависимости логарифма I от E называется графиком Тафеля.График Тафеля на рисунке 1 был построен непосредственно из уравнения Батлера-Фольмера. Обратите внимание на линейные участки кривой тока ячейки.
На практике многие системы коррозии контролируются кинетически и, таким образом, подчиняются уравнению. 2. Кривая логарифмического тока в зависимости от потенциала, линейная по обе стороны от E или Corr , свидетельствует о кинетическом управлении исследуемой системой. Однако могут возникнуть сложности, такие как:
Однако могут возникнуть сложности, такие как:
- Концентрационная поляризация, где скорость реакции контролируется скоростью, с которой реагенты достигают поверхности металла.Часто катодные реакции демонстрируют концентрационную поляризацию при более высоких токах, когда диффузия иона кислорода или водорода не достаточно быстра для поддержания кинетически контролируемой скорости.
- Образование оксида, которое может приводить или не приводить к пассивации. Этот процесс может изменить поверхность исследуемого образца. Исходная поверхность и измененная поверхность могут иметь разные значения констант в формуле. 2.
- Другие эффекты, изменяющие поверхность, такие как преимущественное растворение одного компонента сплава, также могут вызывать проблемы.
- Процесс смешанного управления, при котором одновременно происходит более одной катодной или анодной реакции, может усложнить модель. Примером смешанного управления является одновременное восстановление ионов кислорода и водорода.

- Наконец, падение потенциала в результате протекания тока ячейки через сопротивление раствора ячейки вызывает ошибки в кинетической модели. Этот последний эффект, если он не слишком серьезен, можно исправить с помощью ИК-компенсации в потенциостате.
В большинстве случаев сложности, подобные перечисленным выше, вызывают нелинейность графика Тафеля.С осторожностью используйте результаты, полученные на графике Тафеля без четко определенной линейной области.
Классический анализ Тафеля выполняется путем экстраполяции линейных частей графика зависимости логарифмического тока от потенциала обратно до их пересечения. См. Рисунок 2 (который представляет собой рисунок 1, перепечатанный с аннотациями, демонстрирующими анализ). Значение анодного или катодного тока на пересечении составляет I corr . К сожалению, многие реальные антикоррозионные системы не обеспечивают достаточной линейной области для точной экстраполяции.Наиболее современное программное обеспечение для испытаний на коррозию, такое как программа Gamry Instruments Corrosion Techniques, выполняет более сложную численную аппроксимацию уравнения Батлера-Фольмера. Измеренные данные соответствуют формуле. 2 путем корректировки значений E corr , I corr , β a и β c . Преимущество метода аппроксимации кривой состоит в том, что он не требует полностью развернутой линейной части кривой.
Измеренные данные соответствуют формуле. 2 путем корректировки значений E corr , I corr , β a и β c . Преимущество метода аппроксимации кривой состоит в том, что он не требует полностью развернутой линейной части кривой.
Рис. 2. Классический анализ Тафеля.
Сопротивление поляризации
Ур. 2 можно еще больше упростить, ограничив возможность быть очень близкой к E corr . Вблизи E или кривая зависимости тока от напряжения представляет собой прямую линию. Наклон этой линии выражен в единицах сопротивления (Ом). Наклон, следовательно, называется сопротивлением поляризации, R p . Значение R p может быть объединено с оценкой коэффициентов β для получения оценки тока коррозии.
Если мы аппроксимируем экспоненциальные члены в уравнении. 2 с первыми двумя членами разложения в степенной ряд () и упрощением, мы получаем одну форму уравнения Штерна-Гири:
В эксперименте с поляризационным сопротивлением вы записываете кривую зависимости тока от напряжения как напряжение ячейки колеблется в небольшом диапазоне потенциалов, который очень близок к E oc (обычно ± 10 мВ). Числовая аппроксимация кривой дает значение поляризационного сопротивления R p .Данные о сопротивлении поляризации не дают никакой информации о значениях коэффициентов β. Таким образом, чтобы использовать уравнение. 3 необходимо указать значения β. Их можно получить из графика Тафеля или оценить, исходя из вашего опыта работы с системой, которую вы тестируете.
Числовая аппроксимация кривой дает значение поляризационного сопротивления R p .Данные о сопротивлении поляризации не дают никакой информации о значениях коэффициентов β. Таким образом, чтобы использовать уравнение. 3 необходимо указать значения β. Их можно получить из графика Тафеля или оценить, исходя из вашего опыта работы с системой, которую вы тестируете.
Расчет скорости коррозии по току коррозии
Численный результат, полученный путем подгонки данных коррозии к модели, обычно представляет собой ток коррозии. Нас интересуют скорости коррозии в более полезных единицах скорости проникновения, таких как миллиметры в год.Как ток коррозии используется для увеличения скорости коррозии? Предположим, что в реакции электролитического растворения участвует химическое вещество, S:
S ® S n + + n e–
Вы можете связать текущий поток с массой с помощью закона Фарадея.
Q = nFM Ур. 4
где
К | — заряд в кулонах в результате реакции S |
n | — количество электронов, перенесенных на молекулу или атом S . |
Факс | — постоянная Фарадея = 96 485 кулонов / моль |
м | — число молей реагирующего вещества S |
Более полезная форма уравнения.4 требует концепции эквивалентного веса. Эквивалентный вес (EW) — это масса разновидностей S, которые будут реагировать с одним зарядом Фарадея. Для атомарного компонента EW = AW / n (где AW — атомный вес компонента).
Вспоминая, что M = m / AW и подставляя в уравнение. 4 получаем:
, где м — масса прореагировавшего вещества S.
В случаях, когда коррозия происходит равномерно по всей поверхности металла, скорость коррозии может быть рассчитана в единицах расстояния в год.Будьте осторожны: этот расчет действителен только для равномерной коррозии; он резко недооценивает проблему, возникающую при локальной коррозии!
Для сложного сплава, который подвергается равномерному растворению, эквивалентный вес представляет собой средневзвешенное значение эквивалентных весов компонентов сплава. В качестве весового коэффициента используется мольная доля, а не массовая доля. Если растворение неоднородно, возможно, придется измерить продукты коррозии для расчета EW.
В качестве весового коэффициента используется мольная доля, а не массовая доля. Если растворение неоднородно, возможно, придется измерить продукты коррозии для расчета EW.
Преобразование потери веса в скорость коррозии (CR) несложно.Нам нужно знать плотность d и площадь образца A. Заряд определяется как Q = It, где t — время в секундах, а I — ток. Мы можем подставить значение постоянной Фарадея. Изменение уравнения. 5,
где
Я корр | Ток коррозии в амперах |
К | Константа, определяющая единицы скорости коррозии |
EW | Эквивалентный вес в граммах / эквивалент |
д | Плотность в г / см 3 |
А | Площадь образца в см 2 |
Таблица 1. Константы скорости коррозии
Константы скорости коррозии
Единицы скорости коррозии | К | Единицы |
мм / год (мм / год) | 3272 | мм (А-см-год) |
миллидюймов в год (mpy) | 1,288 × 10 5 | миллидюйма (А-см-год) |
ИК-компенсация
Когда вы пропускаете ток между двумя электродами в проводящем растворе, в растворе всегда есть области с разными потенциалами.Большая часть общего изменения потенциала происходит очень близко к поверхности электродов. Здесь градиенты потенциала в значительной степени вызваны градиентами ионной концентрации, возникающими вблизи металлических поверхностей. Кроме того, всегда существует разность потенциалов (падение потенциала), вызванная протеканием тока через сопротивление в объеме раствора.
Кроме того, всегда существует разность потенциалов (падение потенциала), вызванная протеканием тока через сопротивление в объеме раствора.
В электрохимическом эксперименте потенциал, который вы хотите контролировать или измерять, — это потенциал металлического образца (так называемого рабочего электрода) по сравнению с электродом сравнения.Обычно нас не интересуют падения потенциала, вызванные сопротивлением раствора, поскольку они незначительны в типичных растворах электролитов, таких как 1 M H 2 SO 4 или 5% NaCl.
Потенциостаты Gamry Instruments, как и все современные электрохимические инструменты, представляют собой трехэлектродные потенциостаты. Они измеряют и регулируют разность потенциалов между нетоковедущим электродом сравнения и одним из двух токоведущих электродов (рабочим электродом).Падение потенциала возле другого токоведущего электрода (противоэлектрода) не имеет значения при использовании трехэлектродного потенциостата.
Тщательное размещение электрода сравнения может компенсировать некоторое падение ИК-излучения, возникающее из-за тока ячейки I, протекающего через сопротивление раствора R. Вы можете думать об электроде сравнения как о измерении потенциала где-то вдоль сопротивления раствора. Чем ближе он к рабочему электроду, тем ближе вы к измерению потенциала без ИК-ошибок.Однако на практике полная ИК-компенсация не может быть достигнута путем размещения электрода сравнения из-за конечных физических размеров электрода. Часть сопротивления ячейки, которая остается после размещения электрода сравнения, называется нескомпенсированным сопротивлением, R и .
Вы можете думать об электроде сравнения как о измерении потенциала где-то вдоль сопротивления раствора. Чем ближе он к рабочему электроду, тем ближе вы к измерению потенциала без ИК-ошибок.Однако на практике полная ИК-компенсация не может быть достигнута путем размещения электрода сравнения из-за конечных физических размеров электрода. Часть сопротивления ячейки, которая остается после размещения электрода сравнения, называется нескомпенсированным сопротивлением, R и .
Потенциостаты Gamry могут использовать прерывание по току или ИК-компенсацию с положительной обратной связью для динамической коррекции нескомпенсированных ошибок сопротивления. В технике прерывания тока ток ячейки периодически отключается на очень короткое время.При отсутствии тока, протекающего через сопротивление раствора, падение ИК-излучения мгновенно исчезает. Падение потенциала на поверхности электрода остается постоянным в быстром масштабе времени. Разница потенциалов при текущем и отсутствии тока является мерой нескомпенсированного падения ИК-излучения.
Потенциостат выполняет измерение прерывания тока сразу после получения каждой точки данных. Потенциостат фактически снимает три потенциальных показания: E 1 до отключения тока, и E 2 и E 3 , когда он выключен (см. Рисунок 3).Обычно последние два используются для экстраполяции разности потенциалов ∆E обратно к точному моменту, когда ток был прерван. Время прерывания зависит от тока ячейки. Время прерывания составляет 40 мкс для более высоких диапазонов тока. В более низких диапазонах тока прерывание длится дольше.
Рисунок 3 . Потенциал прерывания тока в зависимости от времени.
В режимах с контролируемым потенциалом приложенный потенциал можно динамически корректировать с учетом измеренной ИК-погрешности одним из нескольких способов.В простейшем из них ИК-ошибка из предыдущего пункта применяется как поправка к приложенному потенциалу. Например, если требуется потенциал без ИК-излучения 1 В, а измеренная ошибка ИК-излучения составляет 0,2 В, потенциостат применяет 1,2 В. Поправка всегда на одну точку ниже, поскольку ИК-ошибка из одной точки применяется для исправления приложенного потенциал для следующей точки. В дополнение к этому нормальному режиму потенциостат Gamry Instruments предлагает более сложные режимы обратной связи, в которых две точки на кривой затухания усредняются.
Поправка всегда на одну точку ниже, поскольку ИК-ошибка из одной точки применяется для исправления приложенного потенциал для следующей точки. В дополнение к этому нормальному режиму потенциостат Gamry Instruments предлагает более сложные режимы обратной связи, в которых две точки на кривой затухания усредняются.
По умолчанию в режимах с управляемым потенциалом потенциальная ошибка, измеренная с помощью прерывания по току, используется для корректировки приложенного потенциала. В режимах регулируемого тока коррекция не требуется. Если выбрана ИК-компенсация, измеренная ИК-ошибка вычитается из измеренного потенциала. Таким образом, все сообщаемые потенциалы не содержат ИК-ошибки.
Подробное теоретическое обсуждение нескомпенсированной устойчивости см. В Keith B. Oldham, et al., Analytical Chemistry, 72 (2000), 3972 и 3981.
Условные обозначения тока и напряжения
Полярность тока при электрохимических измерениях может быть несовместимой. Значение тока -1,2 мА может означать разные вещи для работников разных отраслей электрохимии или в разных странах или даже для разных потенциостатов.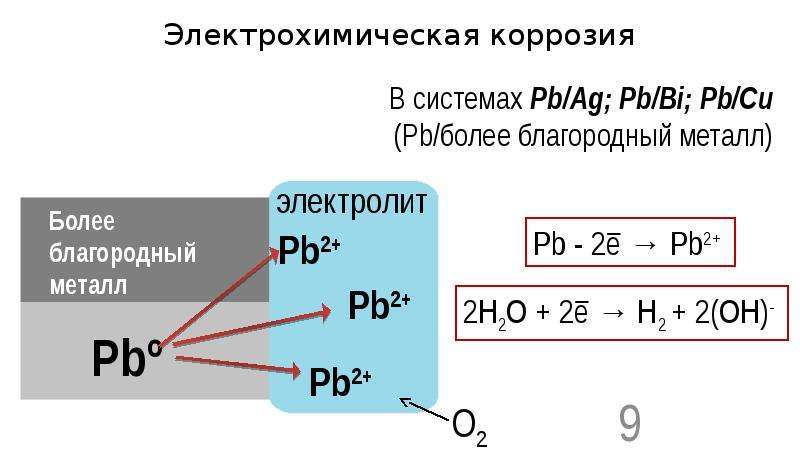 Для электрохимика-аналитика это составляет 1,2 мА анодного тока. Для исследователя коррозии это означает катодный ток 1,2 мА. Потенциостат Gamry Instruments в режиме по умолчанию следует соглашению о коррозии для тока, в котором положительные токи являются анодными, а отрицательные — катодными.Для удобства наших пользователей по всему миру потенциостаты Gamry Instruments могут предоставить текущую полярность в соответствии с вашими предпочтениями с помощью простой программной команды.
Для электрохимика-аналитика это составляет 1,2 мА анодного тока. Для исследователя коррозии это означает катодный ток 1,2 мА. Потенциостат Gamry Instruments в режиме по умолчанию следует соглашению о коррозии для тока, в котором положительные токи являются анодными, а отрицательные — катодными.Для удобства наших пользователей по всему миру потенциостаты Gamry Instruments могут предоставить текущую полярность в соответствии с вашими предпочтениями с помощью простой программной команды.
Полярность потенциала также может быть источником путаницы. При измерении электрохимической коррозии равновесный потенциал, принимаемый металлом при отсутствии электрических соединений с металлом, называется потенциалом разомкнутой цепи, E oc . Мы используем термин «потенциал коррозии», E corr , для обозначения потенциала в электрохимическом эксперименте, при котором ток не протекает, как это определено путем численной аппроксимации данных зависимости тока от потенциала.В идеальном случае значения для E oc и E corr идентичны. Одна из причин, по которой два напряжения могут различаться, заключается в том, что во время сканирования на поверхности электрода произошли изменения.
Одна из причин, по которой два напряжения могут различаться, заключается в том, что во время сканирования на поверхности электрода произошли изменения.
В большинстве современных потенциостатов все потенциалы указываются или сообщаются как потенциал рабочего электрода относительно электрода сравнения или потенциала холостого хода. Первое всегда обозначается как «vs. E ref », а последний как« vs. E oc ”.Уравнения для преобразования одной формы потенциала в другую:
E против E
oc = (E против E ref ) — E oc
E против E
ref = (E vs. E oc ) + E oc
Независимо от того, соответствуют ли потенциалы E ref или E oc , используется одно знаковое соглашение. Чем более положительный потенциал, тем он более анодный. Более высокие анодные потенциалы ускоряют окисление на рабочем электроде.И наоборот, отрицательный потенциал ускоряет восстановление на рабочем электроде.
Некоторые источники по теории коррозии и испытаниям на электрохимическую коррозию
Методы электрохимических испытаний на постоянном токе, N.G. Томпсон и Дж. Плательщик, Национальная ассоциация инженеров-коррозионистов. ISBN: 1-877914-63-0.
Принципы и предотвращение коррозии, Денни А. Джонс, Прентис-Холл, 1996. ISBN 0-13-359993-0.
Метод сопротивления поляризации для определения мгновенных скоростей коррозии, J.R. Scully, Corrosion, 56 (2000), 199.
Некоторые методы электрохимической коррозии одобрены ASTM (Американское общество испытаний и материалов, 100 Barr Harbor Drive, West Conshohocken, PA 19428. Их можно найти в томе 3.02). стандартов ASTM:
G 5: Измерения потенциостатической и потенциодинамической анодной поляризации
G 59: Измерения сопротивления поляризации
G 61: Измерения циклической поляризации для определения подверженности локальной коррозии сплавов на основе железа, никеля и кобальта
G 100: Циклическая поляризация гальвано-лестничной клетки
G 106: Проверка алгоритма и оборудования для измерения электрохимического импеданса
G 108: Электрохимическая потенциокинетическая реактивация (ЭПР) для обнаружения сенсибилизации
G 150: Электрохимическая критическая температура точечной коррозии, испытание нержавеющей стали
Методы коррозионной инженерии, Национальная ассоциация Corrosio Русские инженеры, 1986.
Испытания и оценка коррозии, STP 1000, Ed. Р. Бабоян, С.В. Декан, Американское общество испытаний и материалов, Вест Коншохокен, Пенсильвания, 1991. ISBN 0-8031-1406-0.
Электрохимические испытания на коррозию, СТП 727, Под ред. Ф. Мансфельд и У. Берточчи, Американское общество испытаний и материалов, Вест Коншохокен, Пенсильвания, 1979.
Коррозия и контроль коррозии, 3-е изд., Герберт Х. Улиг, Джон Вили и сыновья, Нью-Йорк, 1985.
Электрохимические испытания на коррозию | Анализ электрохимической коррозии
Описание техники
Всякая коррозия — это электрохимический процесс реакций окисления и восстановления.Когда происходит коррозия, электроны высвобождаются металлом (окисление) и приобретаются элементами (восстановление) в корродирующем растворе. Поскольку в реакции коррозии возникает поток электронов (ток), его можно измерять и контролировать с помощью электроники. Таким образом, контролируемые электрохимические экспериментальные методы могут быть использованы для характеристики коррозионных свойств металлов и металлических компонентов в сочетании с различными растворами электролитов. Характеристики коррозии уникальны для каждой системы металл / раствор.
Таким образом, контролируемые электрохимические экспериментальные методы могут быть использованы для характеристики коррозионных свойств металлов и металлических компонентов в сочетании с различными растворами электролитов. Характеристики коррозии уникальны для каждой системы металл / раствор.
В практике испытаний поляризационная ячейка представляет собой установку, состоящую из раствора электролита, электрода сравнения, противоэлектрода (ов) и исследуемого металлического образца, соединенного с держателем образца. (Образец называется рабочим электродом.) Электроды подключаются к электронному прибору, называемому потенциостатом. Рабочий, эталонный и счетный электроды помещают в раствор электролита, обычно раствор, который наиболее близко соответствует реальной среде применения испытываемого материала.В растворе между различными электродами создается электрохимический потенциал (напряжение). Потенциал коррозии (E CORR ) измеряется потенциостатом как разность энергий между рабочим электродом и электродом сравнения.
Эксперименты по электрохимической коррозии позволяют измерять и / или контролировать потенциал и ток реакций окисления / восстановления. Возможны несколько типов экспериментов, манипулируя этими двумя переменными и измеряя их.
В большинстве экспериментов на рабочий электрод накладывается потенциал и измеряется результирующий ток.Потенциостатический эксперимент накладывает постоянный потенциал на рабочий электрод в течение определенного периода времени. Измеренный ток отображается в зависимости от времени.
Для потенциодинамических экспериментов прикладываемый потенциал увеличивается со временем, в то время как ток постоянно контролируется. График зависимости силы тока (или плотности тока) от потенциала. После сканирования потенциала до заданной плотности тока или потенциала сканирование потенциала может быть изменено на противоположное, в то время как ток продолжает измеряться.Подобное потенциодинамическое сканирование называется обратной поляризацией или циклической поляризацией.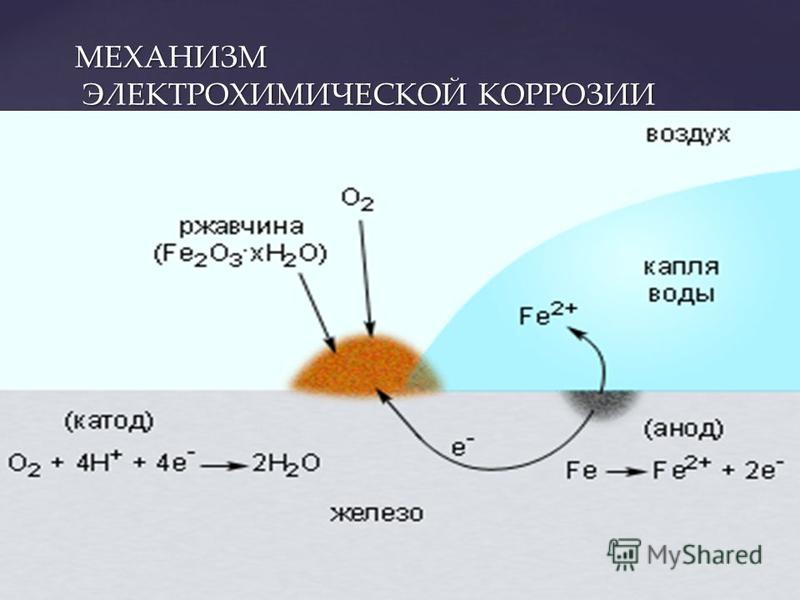
Также можно контролировать ток и измерять результирующий потенциал. Эксперименты, в которых применяется ток, а не потенциал, называются гальванодинамическими или гальваностатическими. Гальванодинамические методы показывают изменение потенциала в зависимости от контролируемого тока. Гальваностатические тесты поддерживают постоянный ток и определяют изменение потенциала во времени.
Аналитическая информация
Потенциодинамические эксперименты могут предоставить различные данные, относящиеся к питтингу, щелевой коррозии и пассивации для конкретных комбинаций образец / раствор.По мере увеличения потенциала точечная коррозия начнется при определенном значении, известном как потенциал пробоя (E B , самый низкий потенциал, при котором возникает точечная коррозия). Поскольку точечная коррозия связана с увеличением скорости окисления, E B определяется соответствующим увеличением измеренного тока. Увеличение E B связано с более высокой стойкостью к точечной коррозии. Поскольку потенциал уменьшается при обратном сканировании, происходит уменьшение тока.Однако при обратном сканировании наблюдается гистерезис и прослеживается петля гистерезиса. Образец повторно пассивируется при потенциале, когда обратное сканирование пересекает прямое сканирование. Потенциал репассивации или защитный потенциал (E P ) возникает при более низком потенциале, чем E B . Разница между E B и E P связана с восприимчивостью к щелевой коррозии; Чем больше гистерезис поляризационной кривой, тем больше подверженность щелевой коррозии.
Увеличение E B связано с более высокой стойкостью к точечной коррозии. Поскольку потенциал уменьшается при обратном сканировании, происходит уменьшение тока.Однако при обратном сканировании наблюдается гистерезис и прослеживается петля гистерезиса. Образец повторно пассивируется при потенциале, когда обратное сканирование пересекает прямое сканирование. Потенциал репассивации или защитный потенциал (E P ) возникает при более низком потенциале, чем E B . Разница между E B и E P связана с восприимчивостью к щелевой коррозии; Чем больше гистерезис поляризационной кривой, тем больше подверженность щелевой коррозии.
Эксперименты по электрохимической коррозии также могут использоваться для определения скорости коррозии (график Тафеля), активных / пассивных характеристик для конкретной системы образец / раствор, скорости пассивации, а также анодной и катодной защиты.
Типичные области применения
- Анализ готовых медицинских изделий на подверженность точечной и щелевой коррозии
- Сравнение сырья (отсев) по коррозионным характеристикам
- Оценка влияния пассивации или модификации поверхности на коррозионное поведение
- Оценить / сравнить влияние обработки на коррозионные свойства
- Оценка биметаллических комбинаций на гальваническую коррозию
Образец требований
Образцы для испытаний на электрохимическую коррозию должны быть электрическими проводниками и должны быть достаточно маленькими, чтобы поместиться в поляризационной ячейке. Компоненты могут быть протестированы как целое, так и меньшее по размеру. Металлические купоны специально подготовлены для некоторых тестов.
Компоненты могут быть протестированы как целое, так и меньшее по размеру. Металлические купоны специально подготовлены для некоторых тестов.
Завод Инжиниринг | Коррозия: электрохимическая
Коррозия окружает нас повсюду, в нашей повседневной жизни, тихо работает и идет своим чередом. Коррозия — это ухудшение свойств материала из-за реакции с окружающей средой. КДЕС определяет коррозию как «разрушение вещества (обычно металла) или его свойств из-за реакции с окружающей средой» 1 Хотя это утверждение верно, оно также указывает на тот факт, что коррозируют не только металлы, бетон, пластмассы, и другие материалы также подвержены коррозии.
Последствия коррозии можно увидеть повсюду: в наших домах, на детских площадках, в наших автомобилях, зданиях и мостах. Если его не остановить, это может привести к серьезным авариям, таким как обрушившийся 1 августа 2007 года мост Миннеаполис I-35W, в результате которого погибло 13 человек и было ранено 145 человек. 2 или рейс Aloha 243, который испытал взрывную декомпрессию в середине полета, оторвав часть. фюзеляжа, в результате чего погиб член экипажа и было ранено 65 пассажиров и членов экипажа 3 .
2 или рейс Aloha 243, который испытал взрывную декомпрессию в середине полета, оторвав часть. фюзеляжа, в результате чего погиб член экипажа и было ранено 65 пассажиров и членов экипажа 3 .
Коррозия также имеет финансовые последствия. В США коррозия вызывает ежегодные убытки в размере 47,9 миллиарда долларов в коммунальной отрасли, 29,7 миллиарда долларов в транспортной отрасли, 22,6 миллиарда долларов в сфере инфраструктуры, 20,1 миллиарда долларов в государственных структурах и 17,6 миллиарда долларов в производстве и обрабатывающей промышленности 4 . Это составляет 275,7 миллиардов долларов в год из-за коррозии, при этом самые большие затраты приходятся на питьевую воду и канализационные системы — 36 миллиардов долларов и увеличиваются на 5 .
Исследования коррозии показали нам, что существует два основных механизма коррозии: электрохимическое и химическое окисление. Оба этих типа имеют множество форм и ответвлений, некоторые из которых более выражены, чем другие, но механизм, с помощью которого они разлагают вещество или материал, всегда можно проследить до одного из этих двух типов. В этой части статьи мы рассмотрим механизм электрохимической коррозии и ее наиболее распространенные формы.
В этой части статьи мы рассмотрим механизм электрохимической коррозии и ее наиболее распространенные формы.
Электрохимическая коррозия
Электрохимическая коррозия — это процесс, в результате которого металл возвращается в состояние окисления с наименьшей энергией.Чтобы правильно понять электрохимическую коррозию, нужно понять, как руды находят и превращают в металл.
Необработанные руды добываются в природе, где некоторые из них находятся в химическом соединении с другими элементами в термодинамически стабильном состоянии. Железо, например, содержится, среди прочего, вместе с оксидами, гидратами и сульфидами. Чтобы извлечь или очистить железо, энергия (тепло) нагнетается в руду, чтобы превратить ее в металл. Это приводит к восстановлению железной руды и ее термодинамической нестабильности.Фундаментальные законы термодинамики диктуют, что нестабильная система в конечном итоге возвращается к своей стабильной форме, равновесию.
Некоторые металлы, однако, встречаются в природе уже в металлической форме, например, золото, и поэтому уже стабильны в металлической форме, поэтому золото не подвержено коррозии.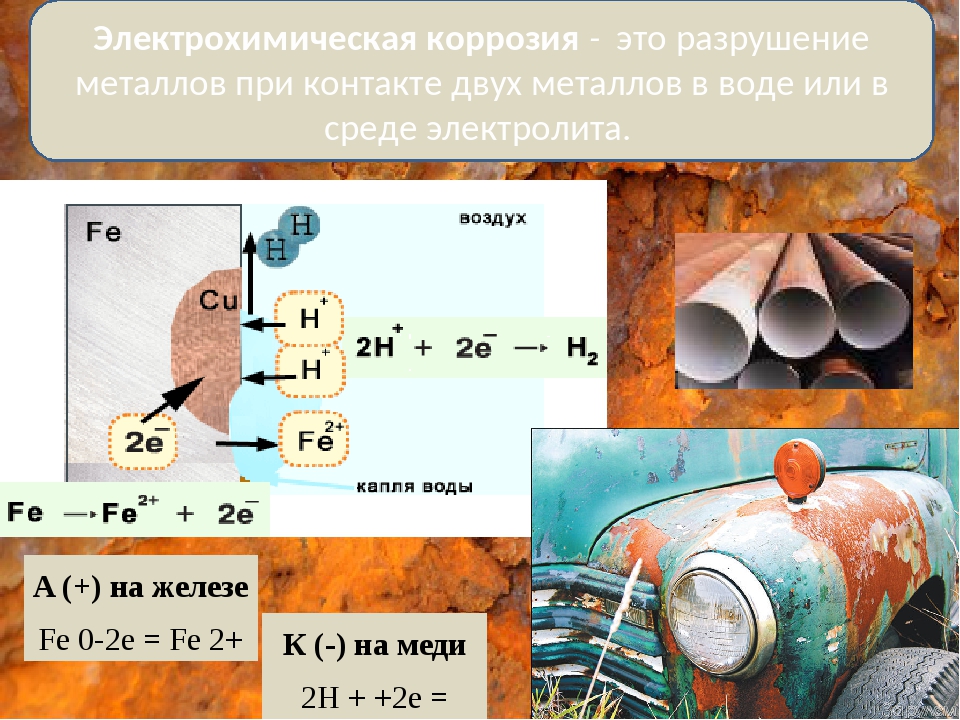 Это не означает, что только те металлы, которые встречаются в природе в чистой металлической форме, являются единственными, которые не подвержены коррозии, есть руды, которые при окислении производят металл, который не подвергается коррозии, разница в том, что количество энергия (тепло), необходимая для окисления руды, в этом случае минимальна.
Это не означает, что только те металлы, которые встречаются в природе в чистой металлической форме, являются единственными, которые не подвержены коррозии, есть руды, которые при окислении производят металл, который не подвергается коррозии, разница в том, что количество энергия (тепло), необходимая для окисления руды, в этом случае минимальна.
Нестабильные металлы с годами становятся стабильными в результате электрохимической коррозии, если их не защищать. Для возникновения электрохимической коррозии необходимо наличие коррозионного элемента. Ячейка для защиты от коррозии представляет собой комбинацию четырех элементов, анода, катода, электролита и металлического пути, соединяющего анод и катод. Без любого из этих четырех элементов коррозия не произойдет, все элементы должны присутствовать. Современные исследования показали, что кислород может сильно влиять на коррозию, и эксперты часто считают его очень важным элементом, заявляя, что в некоторых формах коррозии кислород является заключительным завершающим этапом для достижения действительно самого низкого энергетического состояния.
- На аноде происходит фактическая потеря металла. Ионизируя электролит, ионы высвобождают электроны через сложную серию химических реакций с образованием оксида железа (Fe2O3) и кислорода. Оксид железа — это то, что мы обычно называем ржавчиной.
- Катод — чрезвычайно важный элемент коррозионной ячейки, поскольку он определяет скорость коррозии. Электроны от анода перемещаются к катоду и размещаются там. Чем больше электронов может вместить катод, тем быстрее будет коррозия анода.Это первичное соотношение между анодом и катодом в коррозионной ячейке.
- Электролит также является важным элементом коррозионной ячейки, поскольку это раствор, окружающий анод и катод. Электролит также влияет на скорость коррозии, поскольку проводимость электролита либо позволяет электронам свободно перемещаться от анода к катоду, либо ограничивает их поток, тем самым снижая скорость коррозии.
- Metallic Pathway — это то, что некоторые могут назвать внутренней схемой, поскольку она обеспечивается металлом, в котором находятся анод и катод.
 Металлический путь замыкает контур коррозии.
Металлический путь замыкает контур коррозии.
Кислород считается важным фактором коррозии, поскольку без кислорода коррозия замедляется и в конечном итоге останавливается. Кислород отвечает за реакцию с ионами водорода, которые высвобождаются на катоде из-за аккомодации электронов. В отсутствие кислорода ионы водорода накапливаются на катоде и препятствуют аккомодации электронов, тем самым останавливая процесс коррозии. Это явление называется поляризацией 6 .
Хотя электрохимическая коррозия относится к механизму коррозии, она может проявляться во многих формах. Гальваническая, точечная и щелевая коррозия — самые распространенные.
Гальваническая коррозия
Гальваническая коррозия возникает, когда два разных металла погружаются в раствор и соединяются металлическим путем. Примером может служить железный корабль с алюминиевыми гребными винтами. Электролит — это море, а металлический путь — это настоящая конструкция корабля. Анод и катод определяются путем изучения гальванической серии. В таблице 1 представлена упрощенная гальваническая серия.
В таблице 1 представлена упрощенная гальваническая серия.
Из таблицы 1 видно, что на железном корабле алюминиевые гребные винты будут наиболее активным металлом или анодом и, следовательно, подвержены коррозии. Следует отметить, что чем дальше друг от друга находятся два металла в гальваническом ряду, тем быстрее будет скорость коррозии.
В этом конкретном случае также стоит отметить размер анода в зависимости от размера катода. Чем больше катод, тем больше электронов он может принять от анода, заставляя его ионизироваться с большей скоростью, что приводит к гораздо большей коррозии.Это соотношение между ними линейно, чем больше разница в размерах между катодом и анодом, тем быстрее анод будет корродировать. Это применимо только в том случае, если катод больше анода. Если анод больше катода, скорость коррозии снижается. Следовательно, отношения теперь обратные.
Питтинговая коррозия
Точечная коррозия — это форма коррозии, которая часто связана с соотношением размеров между анодом и катодом, описанным выше. Наиболее частая причина питтинга — неоднородность металлов.Иногда металлы непостоянны по своему содержанию, в них могут быть включены горшечные металлы или другие крупинки легко корродируемых металлов. Если в металле есть включения такого рода, которые являются более анодными, чем остальной металл, эти примеси корродируют с большей скоростью и вызывают ямки. Возможно и обратное, примеси могут быть катодными по отношению к остальному металлу, что приведет к образованию ямок в области, окружающей примеси.
Наиболее частая причина питтинга — неоднородность металлов.Иногда металлы непостоянны по своему содержанию, в них могут быть включены горшечные металлы или другие крупинки легко корродируемых металлов. Если в металле есть включения такого рода, которые являются более анодными, чем остальной металл, эти примеси корродируют с большей скоростью и вызывают ямки. Возможно и обратное, примеси могут быть катодными по отношению к остальному металлу, что приведет к образованию ямок в области, окружающей примеси.
Неоднородность — не единственная причина питтинга.Защитные покрытия могут сломаться и обнажить часть подложки, которую она должна была защищать. Это заставляет остальную часть металла с покрытием действовать как катод, а небольшая неоднородность становится анодом. В соответствии с соотношением размеров анода и катода скорость коррозии на этом небольшом аноде будет высокой, что приведет к образованию ямок.
Щелевая коррозия
Это особая форма коррозии, которая возникает в очень маленьких трещинах на металле.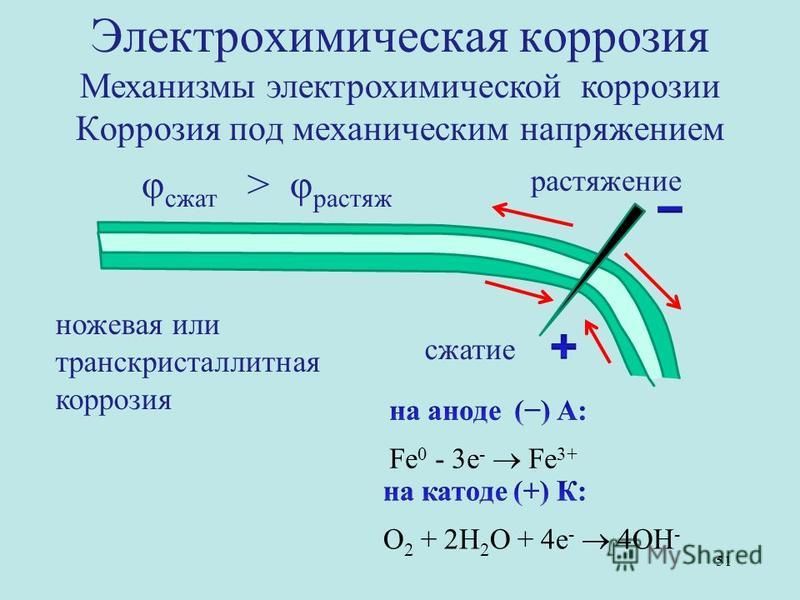 Щелевая коррозия — очень интересная форма, потому что в какой-то момент она включает один из двух основных механизмов, электрохимический и химический.Щелевая коррозия часто возникает в местах застаивания электролита. Эти места часто включают соединения внахлестку, под прокладками и под изоляцией. В этих местах щелевая коррозия обычно начинается как электрохимическая коррозия с попаданием электролита в щель. Из-за небольшого размера щели кислород, необходимый для поддержания электрохимической коррозии, быстро истощается, и электролит становится кислым. Это происходит в результате гидролиза ионов металлов, образующихся в результате электрохимической коррозии 7 .На этом этапе тип или механизм коррозии связан с химическим воздействием.
Щелевая коррозия — очень интересная форма, потому что в какой-то момент она включает один из двух основных механизмов, электрохимический и химический.Щелевая коррозия часто возникает в местах застаивания электролита. Эти места часто включают соединения внахлестку, под прокладками и под изоляцией. В этих местах щелевая коррозия обычно начинается как электрохимическая коррозия с попаданием электролита в щель. Из-за небольшого размера щели кислород, необходимый для поддержания электрохимической коррозии, быстро истощается, и электролит становится кислым. Это происходит в результате гидролиза ионов металлов, образующихся в результате электрохимической коррозии 7 .На этом этапе тип или механизм коррозии связан с химическим воздействием.
Хотя определение ячейки коррозии может показаться трудным процессом, это происходит гораздо проще, чем можно было подумать. Электрохимическая коррозия может происходить повсюду, она может взаимодействовать более чем с одним металлом, а также проникать внутрь бетона и разъедать арматурные стержни. Вся наша инфраструктура подвержена коррозии. Многие другие формы коррозии могут наблюдаться в промышленных условиях, однако, как объяснялось, все эти формы можно проследить до электрохимических.Эти другие формы могут включать нитевидную коррозию, атмосферную коррозию и коррозию прокатной окалины.
Вся наша инфраструктура подвержена коррозии. Многие другие формы коррозии могут наблюдаться в промышленных условиях, однако, как объяснялось, все эти формы можно проследить до электрохимических.Эти другие формы могут включать нитевидную коррозию, атмосферную коррозию и коррозию прокатной окалины.
Электрохимическая коррозия — наиболее распространенный механизм в современной промышленности, и ее последствия можно измерить с точки зрения экономики, здоровья, безопасности и даже культуры. Этот механизм коррозии может существовать внутри нашего тела, в кардиостимуляторах, он может вызывать падение мостов, разрыв газопроводов и даже такие культурные сооружения, как статуя Свободы, если о них не позаботиться должным образом. Электрохимическая коррозия — это сила, с которой нужно считаться в современном мире, и с ней нужно бороться как с таковой.В следующем выпуске мы расскажем о механизме химического окисления и его наиболее распространенных формах.
См. Также Коррозия: химическое окисление
Цитаты
1 VanDelinder, L.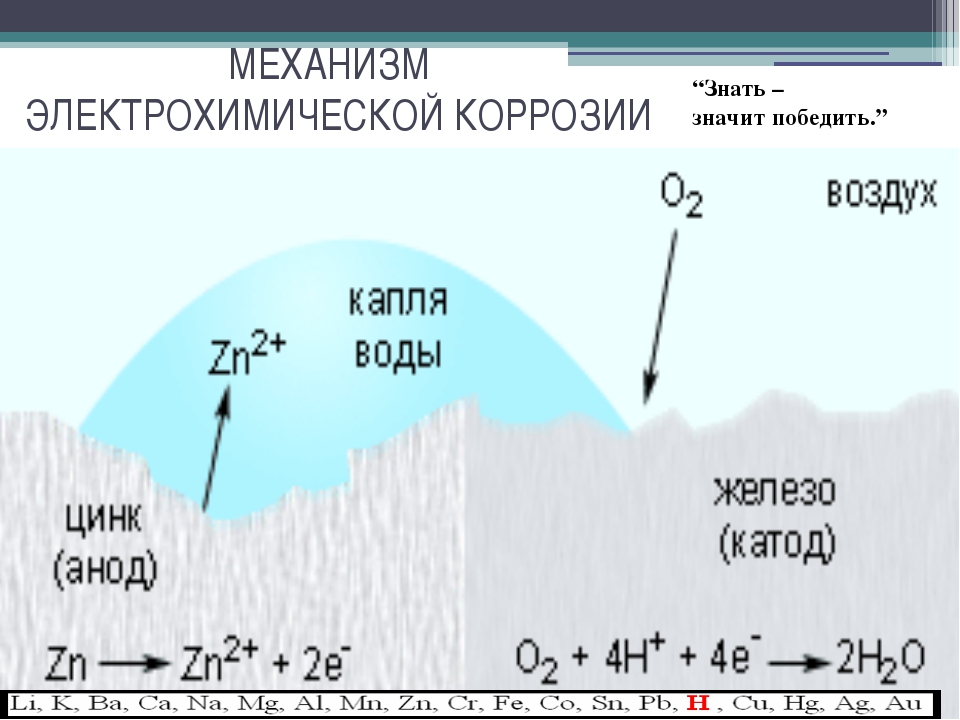 S. изд. Основы коррозии — Введение, Глава 1, Объем и язык коррозии. Национальная ассоциация инженеров-коррозионистов, стр.14, 1984
S. изд. Основы коррозии — Введение, Глава 1, Объем и язык коррозии. Национальная ассоциация инженеров-коррозионистов, стр.14, 1984
2 Фроммер, Фредерик и Лоуи, Джоан. «Недостатки конструкции моста могут быть не так редки, как думали» USA Today. 25 декабря 2010 г.
3 Кристофф, Сьюзен. «Усталостный отказ самолета Aloha Flight 243: как циклическая нагрузка и коррозия вызвали отказ в середине полета» Suite 101. 27 декабря 2010 г.
4 Томпсон, Нил. «Стоимость коррозии: в США 276 миллиардов долларов в год». Коррозия Стоимость. 28 декабря 2010 г.
5 Томпсон, Нил. «Стоимость коррозии: в США 276 миллиардов долларов в год». Коррозия Стоимость. 28 декабря 2010 г.
6 Мангер, Чарльз. Предотвращение коррозии с помощью защитных покрытий, Глава 1, Коррозионная ячейка.Национальная ассоциация инженеров-коррозионистов, стр.21, 1984
7 Томпсон, Нил. «Хронология расщелины». Коррозийные врачи. 28 декабря 2010 г.
28 декабря 2010 г.
Электрохимическая теория коррозии
Коррозия определяется как «разрушение или ухудшение и последующая потеря металлов или сплавов в результате химического или электрохимического воздействия окружающей среды».
В простой коррозии и извлечении металла может рассматриваться как
Металл Металлическая руда
Основными факторами, вызывающими коррозию металлов, являются атмосферный воздух, вода, а также проводящая поверхность металла.
Например: Ржавчина железа, на медных сосудах образуются зеленые чешуйки
Коррозия металла происходит в результате прямого химического воздействия или электрохимического воздействия на металл коррозионной среды.
Если коррозия происходит из-за прямого химического воздействия (в отсутствие влаги), этот тип коррозии известен как сухая коррозия.
Если коррозия металла происходит из-за электрохимического воздействия в присутствии влаги или проводящей среды, такая коррозия известна как влажная коррозия или электрохимическая коррозия.
Электрохимическая теория коррозии:
Большая часть коррозии происходит на основе электрохимических реакций на поверхности металла. Такой тип коррозии известен как мокрая коррозия.
Электрохимическая теория коррозии может взять в качестве примера железо.
Когда металл, подобный железу, подвергается воздействию окружающей среды, согласно электрохимической теории, коррозия металла происходит из-за образования анодных и катодных областей на одной и той же металлической поверхности или когда два металла контактируют друг с другом в коррозионной среде.
Эти аноды и катоды образуются из-за неоднородностей на границе раздела металла и окружающей среды. Неоднородности на металлической поверхности могут возникать из-за нескольких факторов, таких как
1. На поверхности металла, если концентрация кислорода отличается (если в металле область, которая подвергается большему воздействию кислорода, действует как катод, область, которая подвергается воздействию меньшей концентрации кислорода, действует как анод).
2. Из-за контакта двух разных металлов (например: если медь и железо находятся в контакте друг с другом, тогда Fe действует как анод, а медь действует как катод из-за изменения потенциала электрода).
3. Если металлическая поверхность подвергается напряжению (область, находящаяся под напряжением, действует как анод).
Таким образом формируются анодная и катодная области в присутствии коррозионной среды (например, влаги и т. Д.)
На аноде происходит окисление, так что металл превращается в ионы металла с выделением электронов.
M Mn + + ne-
Например: Fe Fe2 + + 2e-
В катодных областях происходит восстановление, поскольку металл в катодной области не может быть восстановлен дальше, поэтому некоторые компоненты коррозионной среды принимают участие в катодной реакции.Поскольку в катодной реакции в качестве компонентов коррозионной среды участвуют, они более сложны и зависят от природы окружающей среды. Наиболее распространенный тип катодной реакции: 1. Выделение водорода 2. Поглощение кислорода.
Наиболее распространенный тип катодной реакции: 1. Выделение водорода 2. Поглощение кислорода.
Катодные реакции:
- Освобождение водорода типа
- Если среда кислая и в отсутствие O2
2H + + 2e- h3
- Если среда нейтральная или щелочная в отсутствие O2.
2h3O + 2e- 2OH- + h3
- Поглощение кислорода типа
- Если среда кислая и в присутствии О.
4H + + O2 + 4e- 2h3O
- Если среда нейтральная или щелочная и в присутствии O2.
2h3O + O2 + 4e- 4OH-
Ионы металла (Fe2 +), высвобождающиеся на аноде, и некоторые анионы (OH-), образующиеся на катоде, диффундируют друг к другу через проводящую среду и образуют продукт коррозии где-то между анодом и катодом, как
2Fe2 + + 4OH- 2Fe (OH) 2
В окислительной среде нерастворимый Fe (OH) 2 окисляется до оксида трехвалентного железа по следующей реакции.
4Fe (OH) 2 + O2 + 2h3O 2 (Fe2O3. 3h3O) + h3
желтая ржавчина
, если концентрация кислорода ограничена, то Fe (OH) 2 превращается в магнитный оксид Fe и известен как черная ржавчина.
3Fe (OH) 2 + ½ O2 Fe3O4.3h3O
ЧЕРНАЯ РЖАВКА
Типы коррозии: Коррозия металлов, имеющая место в зависимости от природы металлов и в зависимости от типа окружающей среды, с помощью различных механизмов, вызывая различные типы коррозии.
- Гальваническая коррозия или дифференциальная коррозия металла:
Это происходит, когда два разнородных металла контактируют друг с другом в коррозионной проводящей среде; создается разность потенциалов, в результате чего возникает гальванический ток. Эти два металла различаются по своей склонности к окислению. Металл с более низким электродным потенциалом или более активный металл действует как анод, а металл с более высоким электродным потенциалом действует как катод. Разность потенциалов является основным фактором возникновения коррозии. Анодный металл подвергается коррозии, тогда как катодный металл не подвергается атакам.
Разность потенциалов является основным фактором возникновения коррозии. Анодный металл подвергается коррозии, тогда как катодный металл не подвергается атакам.
Egs: Когда контакт железа с медью имеет более низкий электродный потенциал, железо действует как анод и подвергается окислению, как,
Fe Fe2 + + 2e-
Если медь, имеющая более высокий электродный потенциал, действует как катод, это не затрагивает. Скорость гальванической коррозии зависит от разницы потенциалов между анодным и катодным металлами, соотношением анодной и катодной площадей, факторами окружающей среды, а также склонностью металла к пассивности и т. Д.
Другие примеры: Когда Fe контактирует с Sn, тогда Fe действует как анод, а Sn действует как катод, но когда Fe контактирует с Zn, Fe действует как катод, тогда как Zn действует как анод.
- Дифференциальная коррозия при аэрации:
Дифференциальная аэрационная коррозия возникает, когда металлическая поверхность подвергается воздействию разной концентрации воздуха или кислорода, которая создает гальванический элемент и инициирует коррозию. Часть металла, подвергнутая воздействию более низкой концентрации кислорода, действует как анод, а часть металла, подвергнутая воздействию более высокой концентрации, действует как катод, так что слабо насыщенная кислородом область подвергается коррозии.
Часть металла, подвергнутая воздействию более низкой концентрации кислорода, действует как анод, а часть металла, подвергнутая воздействию более высокой концентрации, действует как катод, так что слабо насыщенная кислородом область подвергается коррозии.
Когда металлическая полоса железа частично погружена в аэрированный раствор NaCl, концентрация O2 на поверхности выше, чем внутри раствора. Поскольку для катодной реакции требуется кислород, катодная область имеет тенденцию концентрироваться около линии воды, так что нижняя часть образца действует как анод, где начинается коррозия.
На аноде: Fe Fe2 + + 2e-
На катоде (около водопровода): O2 + 2h30 + 4e- 4OH-
Коррозия на водопроводе : Это случай дифференциальной коррозии при аэрации, обычно наблюдаемой в стали резервуары для воды, океанские корабли и т. д.в какой части металла всегда находится под водой
Часть металла ниже уровня воды подвергается воздействию только растворенного кислорода, в то время как часть металла над водой подвергается воздействию более высокой концентрации кислорода.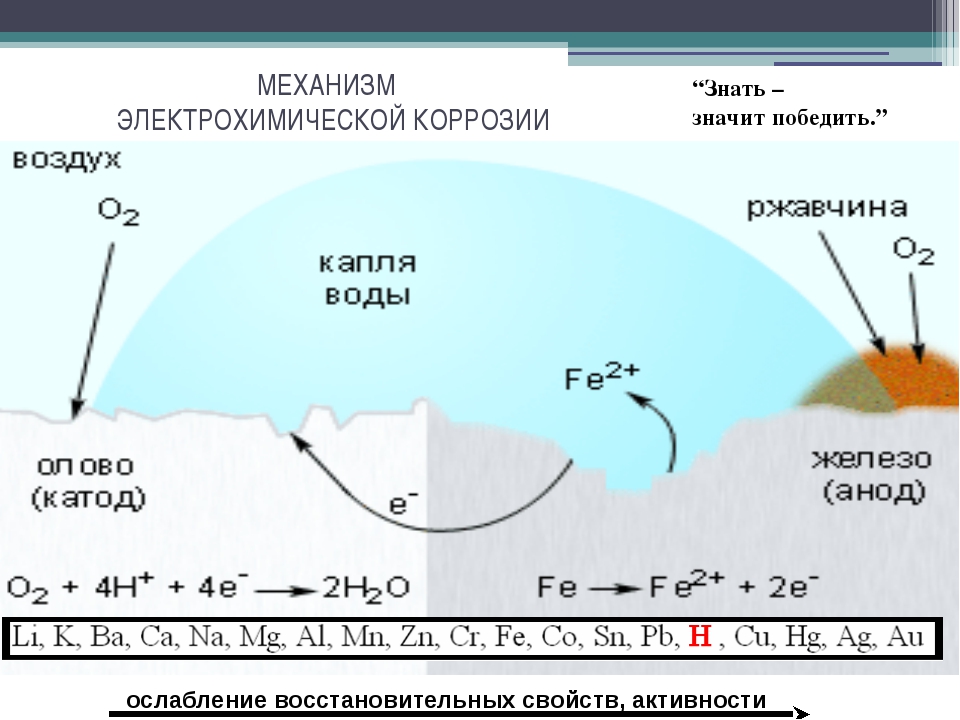
Таким образом, металлическая часть ниже ватерлинии действует как анод, а над ватерлинией действует как катод, и начинается процесс коррозии. Металл чуть ниже ватерлинии более анодный, а ползучесть (мениск) — это тот металл, который более насыщен кислородом, действует как катод и не подвергается влиянию.Степень ползучести воды определяет скорость коррозии, но массовая интенсивная коррозия происходит на уровне воды; там же образуется коричневая линия из-за отложений продуктов коррозии. Этот тип коррозии обычно наблюдается на судах, плавающих в морской воде в течение длительного периода времени.
PITTING CORROISON : Питтинговая коррозия — это локальная и ускоренная коррозия. Когда небольшие частицы пыли или воды оседают на металле (например, на стали).Часть, покрытая пылью, не будет хорошо проветриваемой областью по сравнению с открытой поверхностью, поэтому покрытая поверхность становится анодной по отношению к открытой поверхности. При наличии проводящей среды (влаги) коррозия начинается ниже пылевой части и образует яму. После образования ямки степень коррозии увеличивается из-за образования меньшей анодной и большей катодной площади, имеет место интенсивная коррозия.
После образования ямки степень коррозии увеличивается из-за образования меньшей анодной и большей катодной площади, имеет место интенсивная коррозия.
Точечная коррозия — одна из самых разрушительных форм коррозии.Это приводит к отказу оборудования из-за перфорации с незначительной потерей веса всей конструкции. Из-за небольших размеров ямок выявить точечную коррозию очень сложно. Точечная коррозия — это автокаталитический процесс, и как только продукты коррозии образуются, они также создают условия для дифференциальной аэрации под продуктом коррозии и окружающими металлическими частями. Яма разрастается и в конечном итоге может стать причиной разрушения металла.
STRESS CORROISON : Коррозия металла под напряжением, образованная комбинированным действием растягивающего напряжения и определенной коррозионной среды на металл.Во время коррозии под напряжением металл или сплав практически не подвергаются воздействию на большей части своей поверхности, в то время как мелкие трещины проходят через них перпендикулярно направлению растягивающего напряжения.
Напряжение на металл может быть внутренним или внешним, и это напряжение возникает из-за некоторых механических или эксплуатационных условий. Атомы металла, находящиеся под напряжением, всегда находятся на более высоком уровне энергии, поэтому действуют как анод, а свободные от напряжения части металла действуют как катод в определенных коррозионных условиях окружающей среды, начинается процесс коррозии.
Например: латунь подвергается коррозии в присутствии аммиака.
Нержавеющая сталь с наличием Cl- и каустиков.
Но лучшим примером коррозии под напряжением является щелочное охрупчивание.
Едкое охрупчивание: это форма коррозии под напряжением, имеющая место в котлах, работающих при высокой температуре и давлении. Фокус каустического охрупчивания в нагруженных частях котла, таких как трещины, заклепки, изгибы, соединения и т. Д.
Вода, подаваемая в котел, обычно содержит остаточный карбонат натрия (используемый в процессе умягчения).При высокой температуре и давлении он подвергается гидролизу с образованием гидроксида натрия.
Na2CO3 + h3O 2NaOH + CO2
Щелочная вода проникает через мельчайшие трещины, щели между заклепками и стыками за счет капиллярного действия. Внутри трещин вода испаряется, оставляя после себя NaOH. Концентрация NaOH на этих участках постепенно увеличивается из-за плохой циркуляции воды. Когда концентрация NaOH достигает 10%, он атакует металл в напряженной области, растворяя его в форме ферроата натрия (Na2FeO2).Ферроат натрия подвергается гидролизу с осаждением магнетита следующим образом
3Na2FeO2 + 4h3O 6NaOH + Fe3O4 + h3
6Na2FeO2 + 6h3O + O2 12NaOH + 2Fe3O4
Таким образом, NaOH регенерируется в процессе, и его концентрация постоянно увеличивается, поддерживая необходимую среду. Таким образом, в процессе коррозии образуются трещины и металл становится хрупким из-за осаждения продукта.
Ячейку коррозии можно представить как
Fe (под напряжением) / конц.NaOH / разбав. NaOH / Fe (без напряжений)
Анод Катод
Щелочное охрупчивание можно предотвратить добавлением таких соединений, как сульфит натрия, танин, лигнин, фосфаты и т.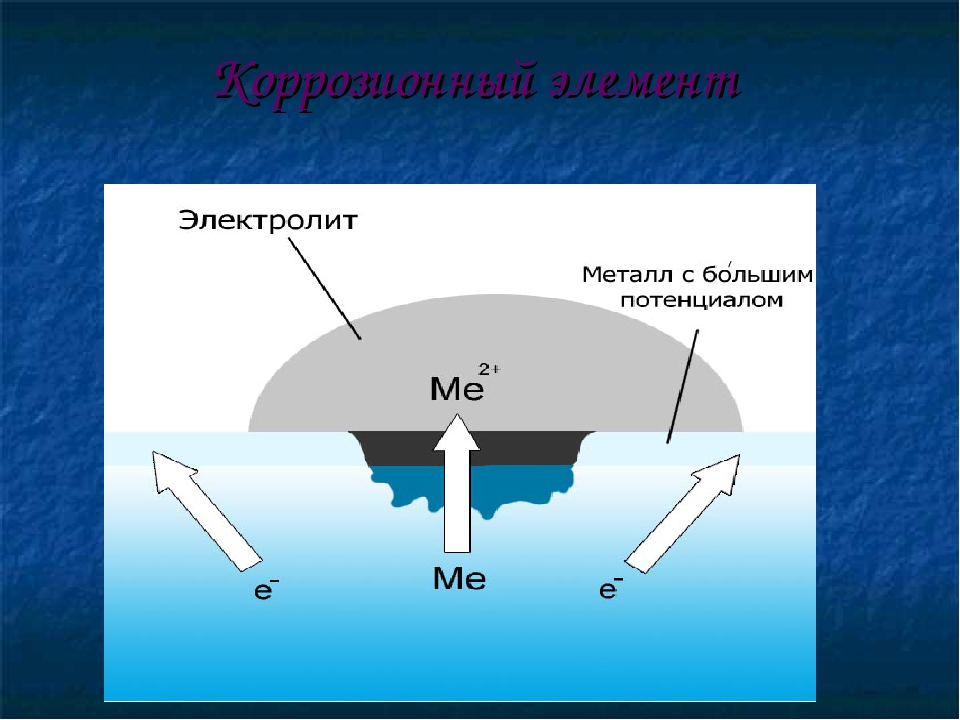 Д., Которые блокируют трещины, тем самым предотвращая проникновение щелочи.
Д., Которые блокируют трещины, тем самым предотвращая проникновение щелочи.
Факторы, влияющие на скорость коррозии :
Несколько факторов, влияющих на скорость коррозии, которые можно разделить на две части
- Факторы, влияющие на металл (связанные с металлом)
- Факторы, влияющие на агрессивную среду.
Факторы, влияющие на металлы:
- Природа металла: Склонность металла к коррозии в основном зависит от природы металла. В общем, металл с более низким электродным потенциалом более реактивен и более подвержен коррозии, а металл с высоким электродным потенциалом менее реактивен и менее подвержен коррозии, например: такие металлы, как K, Na, Mg, Zn и т. Д., Имеют низкий электродный потенциал, подвергаются коррозии. очень легко, поскольку благородные металлы, такие как Ag, Au, Pt, имеют более высокий электродный потенциал, их скорость коррозии незначительна, но есть несколько исключений из этой общей тенденции, поскольку некоторые металлы проявляют свойство пассивности, например Al, Cr, Ti, Ta и т.
 д.
д. - Состояние поверхности металла или характер продукта коррозии (пассивность):
Продуктом коррозии обычно является оксид металла; характер продукта определяет скорость дальнейшего процесса коррозии.
Если оксидный слой, который образуется на поверхности, является стехиометрическим, сильно нерастворимым и непористым по природе с низкой ионной и электронной проводимостью, то такой слой продуктов эффективно предотвращает дальнейшую коррозию, действуя как защитная пленка.Например: Al, Cr, Ti образуют такой слой на своей поверхности и становятся пассивными по отношению к коррозии, а некоторые металлы, такие как Ta, Zr и Mo, не только образуют такие защитные слои, но и способны к самовосстановлению оксидных пленок при их повреждении. Следовательно, это чрезвычайно пассивные металлы.
Если оксидный слой, образующийся на поверхности металла, нестехиометрический, растворимый, нестабильный и пористый по своей природе и имеет заметную проводимость, они не могут контролировать коррозию на поверхности металла, например: оксидный слой, образованный на таких металлах, как Zn, Fe, Mg и т. Д. .
Д. .
- Анодная и катодная зона:
На скорость коррозии сильно влияет относительный размер катодной и анодной областей.
Если металл имеет меньшую анодную площадь и большую катодную площадь, подверженную воздействию коррозионной атмосферы, более интенсивная и более быстрая коррозия происходит в анодной области, потому что при аноде происходит окисление и высвобождаются электроны. На катоде эти электроны расходуются. Когда анод меньше, а катодная область больше, все высвободившиеся электроны на аноде быстро расходуются.Этот процесс заставляет анодную реакцию протекать с максимальной скоростью, что увеличивает скорость коррозии. Если размер катода меньше и происходит обратный процесс, скорость коррозии снижается.
Например: если олово (Sn) покрыто железом (Fe) и в этой части некоторые области не покрыты или остаются некоторые отверстия для штифтов, образуется меньшая анодная площадь и большая катодная площадь, поскольку олово является катодным по отношению к железу, поэтому локальная коррозия очень интенсивна. происходит. С другой стороны, если Zn покрыт Fe, то при наличии штифтовых отверстий они создают большую анодную площадь и меньшую катодную площадь, потому что Fe является катодным по отношению к цинку, поэтому скорость коррозии очень низкая.
происходит. С другой стороны, если Zn покрыт Fe, то при наличии штифтовых отверстий они создают большую анодную площадь и меньшую катодную площадь, потому что Fe является катодным по отношению к цинку, поэтому скорость коррозии очень низкая.
- Повышенное напряжение водорода :
Металл с низким уровнем водородного перенапряжения на поверхности более подвержен коррозии. Когда катодная реакция представляет собой тип выделения водорода с низким перенапряжением водорода, выделение газа h3 происходит более легко, так что катодная реакция происходит очень быстро, что ускоряет анодную реакцию, следовательно, общий процесс коррозии происходит очень быстро. Если перенапряжение h3 велико, катодная реакция идет медленно, следовательно, и реакция коррозии медленнее.
Факторы, связанные с агрессивной средой:
- pH среды : Обычно более кислая природа (низкий pH) выше скорость коррозии.
 Если pH больше 10, коррозия железа очень меньше из-за образования защитного покрытия из водно-оксидов железа.
Если pH больше 10, коррозия железа очень меньше из-за образования защитного покрытия из водно-оксидов железа.
Если pH составляет от 10 до 3, то присутствие кислорода необходимо для коррозии железа. Если pH равен 3 или ниже 3, происходит сильная коррозия в отсутствие воздуха из-за непрерывного выделения h3 на катоде.Однако такие металлы, как Al, Zn и т. Д., Подвергаются быстрой коррозии в сильно щелочной среде.
- Температура : При увеличении темп. Скорость коррозионного процесса также увеличивается, потому что с увеличением температуры. Электропроводность водной среды увеличивается, следовательно, и скорость диффузии.
В некоторых случаях при повышении темп. Уменьшите пассивность, что снова приведет к увеличению скорости коррозии.
- Поляризация в анодной и катодной областях : Поляризация катода или анода снижает скорость коррозии.Если анодная поляризация происходит из-за какой-либо реакции, то склонность металла к окислению уменьшается, следовательно, растворение металлов по мере уменьшения иона металла.
 Обычно это происходит из-за увеличения конц. Из-за ионов растворенных металлов вблизи электрода или также из-за анодной пассивности. Катодная поляризация снижает катодную реакцию, что затрудняет комбинацию катодного реагента и электрона. Чтобы коррозия продолжалась, и анодная, и катодная реакции должны происходить одновременно, если какая-либо из реакций протекает медленнее, то скорость коррозии ниже.Использование деполяризаторов снижает эффект поляризации, следовательно, скорость реакции коррозии увеличивается.
Обычно это происходит из-за увеличения конц. Из-за ионов растворенных металлов вблизи электрода или также из-за анодной пассивности. Катодная поляризация снижает катодную реакцию, что затрудняет комбинацию катодного реагента и электрона. Чтобы коррозия продолжалась, и анодная, и катодная реакции должны происходить одновременно, если какая-либо из реакций протекает медленнее, то скорость коррозии ниже.Использование деполяризаторов снижает эффект поляризации, следовательно, скорость реакции коррозии увеличивается.
КОНТРОЛЬ КОРРОЗИИ: Коррозия металла — это естественный самопроизвольный процесс, в результате которого металл превращается в более стабильный состав, поэтому контроль коррозии более реалистичен, чем предотвращение коррозии. В целом предотвращение образования гальванических элементов позволяет контролировать коррозию.
Для борьбы с коррозией используются следующие методы
- Защитные покрытия :
Коррозию металлов можно контролировать, изолировав их от агрессивной атмосферы. Это можно сделать, покрыв металл (основной металл) слоем другого металла. Этот процесс известен как покрытие металла.
Это можно сделать, покрыв металл (основной металл) слоем другого металла. Этот процесс известен как покрытие металла.
Основным типом покрытий, наносимых на поверхность металла, являются
.
1. Металлическое покрытие 2. Неорганическое покрытие 3. Органическое покрытие.
Металлическое покрытие: Это покрытие представляет собой нанесение защитного металла на поверхность основного металла. Метод может применяться электроосаждением, напылением пламенем, плакировкой, горячим погружением и т. Д.
По основанию покрытия различают два класса:
- Анодное покрытие : Его получают путем покрытия основного металла более активным металлом, который является более анодным по отношению к основному металлу, например: железо покрывается Zn, Mg, Al и т. Д.,
Одним из важных свойств этого типа покрытия является то, что даже при разрыве покрытия основной металл не подвергается коррозии. Открытая часть основного металла является катодной по отношению к покрывающему металлу, и покрывающий металл подвергается коррозии только там, защищая основной металл.Защита существует, пока есть покрытие. Гальванизация — один из лучших способов анодирования.
Открытая часть основного металла является катодной по отношению к покрывающему металлу, и покрывающий металл подвергается коррозии только там, защищая основной металл.Защита существует, пока есть покрытие. Гальванизация — один из лучших способов анодирования.
Гальваника: Это процесс покрытия основного металла (железа) цинком (Zn). Этот процесс обычно осуществляется методом горячего окунания.
Процесс: сначала поверхность основного металла тщательно промывается органическими растворителями для удаления любых органических веществ (например, масла, жира и т. Д.) С поверхности, затем ее промывают разбавителем. h3SO4 для удаления любых неорганических веществ (например, ржавчины).Наконец, основной металл хорошо промывают водой и сушат на воздухе. Затем основной металл погружали в ванну с расплавленным цинком, поддерживающую температуру 425-4300 ° C, и покрывали флюсом Nh5Cl для предотвращения окисления расплавленного цинка. Затем излишки цинка с поверхности удаляются путем пропускания через пару горячих валков, так что получается должное тонкое покрытие.
Применение: Оцинкованные изделия в основном используются в кровельных листах, ограждающей проволоке, ведрах, болтах, гайках, трубах и трубках и т. Д., Но оцинкованные изделия не используются для приготовления и хранения продуктов питания.Поскольку цинк растворяется в дил. Кислоты становятся токсичными.
- Катодное покрытие: Это покрытие, полученное путем покрытия основного металла более катодным (благородным металлом), например: железо покрыто оловом, никелем, Cr и Cu. Но эти покрытия обеспечивают защиту только тогда, когда они неповреждены и абсолютно не имеют зазоров, в противном случае происходит быстрая коррозия основного металла в результате образования большой катодной и небольшой анодной площади.
Лужение — лучший пример объяснения катодного покрытия.
Лужение: Это процесс покрытия основного металла (железа) оловом (Sn). Это может быть выполнено методом горячего окунания.
Железный лист (основной металл) сначала тщательно промывают органическими растворителями для удаления любых органических веществ. Потом обработал дил. h3SO4, чтобы удалить ржавчину и уплотнительные отложения, в конце хорошо промывают водой и сушат на воздухе. Затем он пропускается через флюс ZnCl2 и Nh5Cl (расплавленный), так что расплавленное олово может должным образом прилипать к поверхности металла, а затем основной металл проходит через резервуар, содержащий расплавленное олово.
Наконец прошли через серию роликов, погруженных в пальмовое масло. Так происходит равномерное, неповрежденное, непрерывное осаждение олова. Лужение обеспечит полную защиту от коррозии, если полностью покроет поверхность.
Применение: консервированные изделия широко используются при производстве контейнеров для хранения пищевых продуктов, медную посуду покрывают оловом, чтобы предотвратить загрязнение продуктов медью.
Неорганическое покрытие или конверсионное покрытие поверхности или химическое конверсионное покрытие:
Здесь поверхностный слой металла превращается в стабильное соединение с помощью химических или электрохимических реакций, которые образуют барьер между основным металлом и коррозионной средой. Эти типы покрытий отличаются от металлических покрытий, поскольку они являются неотъемлемой частью самого металла и помимо коррозионной стойкости они также обеспечивают повышенную электрическую изоляцию, а также внешний вид металла. В поверхностном конверсионном покрытии важны два типа:
Эти типы покрытий отличаются от металлических покрытий, поскольку они являются неотъемлемой частью самого металла и помимо коррозионной стойкости они также обеспечивают повышенную электрическую изоляцию, а также внешний вид металла. В поверхностном конверсионном покрытии важны два типа:
.
1. Анодирование или анодирование :
Анодирование цветных металлов, таких как Al, Mg, Cr, Ni и т. Д., Или их сплавов, обычно проводят с помощью процесса анодного окисления, в котором основной металл изготавливается как анод, в электролитической ванне подходящего состава и путем пропускания постоянного тока.Однако в промышленных масштабах только алюминий и его сплав анодируются для обеспечения коррозионной стойкости.
Процесс: Анодируемое изделие должным образом обезжиривается и полируется. Затем делается анод, а катод — медь или свинец. Электролит состоит из 5-10% хромовой кислоты, температура около 350 ° С. Напряжение запрограммировано на увеличение от 0 до 50 В (оптимальное 40 В)
Чтобы поддерживать плотность анодного тока 10-20 миллиампер / см2.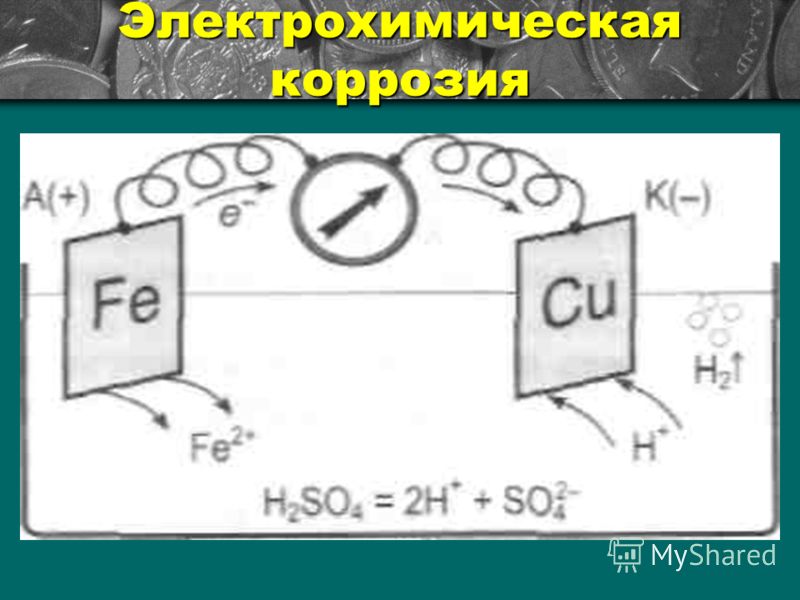 В первые десять минут потенциал увеличивается с 0-40 В и при 40 В продолжается анодирование в течение примерно 20 минут, после того как потенциал увеличивается с 40 до 50 В и поддерживается на уровне 50 В в течение 5 минут, получается непрозрачный оксидный слой толщиной 2-8 микрометров.Если требуется более высокая толщина, в качестве электролита при 220 ° C используется 10% -ная серная кислота с плотностью тока около 160 миллиампер / см2 при 24 В, получается бесцветный слой толщиной 25 мкм. После этого изделие следует должным образом окрасить и, наконец, обработать кипяченой водой, содержащей кобальт или сульфат или ацетат никеля, для повышения коррозионной стойкости.
В первые десять минут потенциал увеличивается с 0-40 В и при 40 В продолжается анодирование в течение примерно 20 минут, после того как потенциал увеличивается с 40 до 50 В и поддерживается на уровне 50 В в течение 5 минут, получается непрозрачный оксидный слой толщиной 2-8 микрометров.Если требуется более высокая толщина, в качестве электролита при 220 ° C используется 10% -ная серная кислота с плотностью тока около 160 миллиампер / см2 при 24 В, получается бесцветный слой толщиной 25 мкм. После этого изделие следует должным образом окрасить и, наконец, обработать кипяченой водой, содержащей кобальт или сульфат или ацетат никеля, для повышения коррозионной стойкости.
Фосфатирование : Обычно его получают на стальной поверхности путем преобразования поверхностных атомов металла в их фосфат с помощью химического или электрохимического процесса.
Ванна для фосфатирования, содержащая три основных компонента: 1. Свободная фосфорная кислота. 2. Первичный фосфат, такой как фосфат Fe, Mn или Mg. 3. Ускоритель, такой как нитраты, нитриты, перекись водорода и pH, обычно в диапазоне 1,8–3,2, если процесс является иммерсионным. Если процесс распыления, то pH находится в диапазоне от 3,2 до 7,8, а температура поддерживается на уровне 35 ° C.
3. Ускоритель, такой как нитраты, нитриты, перекись водорода и pH, обычно в диапазоне 1,8–3,2, если процесс является иммерсионным. Если процесс распыления, то pH находится в диапазоне от 3,2 до 7,8, а температура поддерживается на уровне 35 ° C.
Механизм фосфатирования включает следующие этапы.
- Первое растворение металла в виде ионов металла.
- Ионы металлов реагируют с ионами фосфата с образованием фосфата металла.
- Отложение фосфата металла на поверхности металла.
Фосфатирование всегда выполняется как подчеркивание (под покрытием) перед финишной обработкой, потому что фосфатирование наряду с устойчивостью к коррозии также придает поверхности хорошее качество адгезии краски.
Применение: Грунтовка перед окраской кузовов автомобилей, холодильников, стиральных машин и т. Д.
Одним из наиболее важных применений фосфатирования является оцинкованное железо, которое иначе трудно покрасить.
ОРГАНИЧЕСКОЕ ПОКРЫТИЕ:
Покрытие из инертных органических материалов, таких как краски и лаки, на металлическую поверхность для защиты металла, обычно толщина органического покрытия составляет менее 0,4 мм.
Функции органического покрытия:
- Органическое покрытие служит барьером между металлической поверхностью и агрессивной средой.
- Пигмент или высыхающие масла, присутствующие в краске, часто оказывают тормозящее действие с помощью электрохимических и других средств.
Для хорошего органического покрытия существуют определенные требования:
- Органическое покрытие должно прочно прилегать к металлической поверхности и улучшать ее внешний вид.
- Образующаяся пленка должна быть однородной, непрерывной и действовать как барьер для воздуха и воды.
- Он должен химически увеличиваться, чтобы не было загрязнения атмосферы.
- Должен иметь достаточно долгий срок службы.

- Должен быть легкодоступным, недорогим, простым и надлежащим образом применимым.
Характеристики краски зависят от техники нанесения.
Нанесение органического покрытия включает следующие этапы
- Подготовка поверхности : включает обезжиривание поверхности и удаление с нее ржавчины и окалины.
- Грунтовка : Это первый слой грунтовки, такой как фосфатное покрытие, которое должно прочно прилипать к поверхности, чтобы окраска могла быть выполнена должным образом.
- Наполнитель : Наполнители, такие как эпоксиды нитроцеллюлозы и т. Д., Наносятся на хорошо высушенную поверхность для улучшения внешнего вида.
- Шлифовка: Шероховатости и неровности на поверхности сглаживаются наждачной бумагой.
- Финишный слой органических красок в два или три слоя.
Органическое покрытие обычно наносится кистью, распылением, окунанием и т. д. Разрушение органического покрытия вызывает сильную коррозию.
д. Разрушение органического покрытия вызывает сильную коррозию.
ИНГИБИТОРЫ КОРРОЗИИ :
Использование определенных химических веществ, известных как ингибиторы, может снизить скорость коррозии. Ингибиторы замедляют анодные или катодные реакции, образуя защитную пленку на этих участках. Ингибиторы, которые в основном используются для защиты систем, в которых коррозионная среда рециркулирует или ограничивается в течение длительного времени, таких как двигатель внутреннего сгорания, система рециркуляции воды и т. Д.
АНОДНЫЕ ИНГИБИТОРЫ :
Сюда входят окислители, такие как хроматы, молибдаты, вольфраматы и нитраты. Эти анионы реагируют с ионами металлов, образующимися на аноде во время реакции окисления, с образованием труднорастворимых соответствующих солей. Эти соединения осаждаются на анодных участках, образуя защитные пленки, что дополнительно предотвращает анодные реакции.
Было обнаружено, что эти ингибиторы эффективны только при добавлении достаточного количества ингибиторов в коррозионную среду. Таким образом, вся анодная поверхность может быть покрыта, иначе происходит интенсивная коррозия.
Таким образом, вся анодная поверхность может быть покрыта, иначе происходит интенсивная коррозия.
ii) КАТОДНЫЕ ИНГИБИТОРЫ:
Они могут действовать, ингибируя катодную реакцию, которая включает выделение водорода или поглощение кислорода.
Если катодная реакция представляет собой высвобождение типа h3, то путем добавления органических ингибиторов, таких как амины, мочевина, тиомочевина, гетероциклическое соединение. Они образуют защитный слой на катодной области, так что выделение водорода замедляется.Выделение h3 также можно предотвратить, увеличивая перенапряжение водорода.
Этого можно добиться, добавляя оксиды мышьяка или сурьмы.
Если катодная реакция относится к типу абсорбции кислорода, то при добавлении определенного окислителя, такого как N2h5 (гидразин), сульфит натрия, эти соединения поглощают кислород как
N2h5 + O2 N2 + 2h3O
2Na2SO3 + O2 2Na2SO4
Таким образом, катодная реакция замедляется в противном случае добавлением неорганических ингибиторов, таких как сульфаты цинка, Mg, Mn и т. Д.Они реагируют с ионами OH- (которые высвобождаются на катоде), образуя нерастворимые гидроксиды, которые образуют защитную пленку на катодной поверхности и, следовательно, снижают скорость коррозии. Ингибиторы коррозии имеют определенные ограничения
Д.Они реагируют с ионами OH- (которые высвобождаются на катоде), образуя нерастворимые гидроксиды, которые образуют защитную пленку на катодной поверхности и, следовательно, снижают скорость коррозии. Ингибиторы коррозии имеют определенные ограничения
1. Они загрязняют окружающую среду
2. Многие ингибиторы токсичны по своей природе.
3. Может использоваться только в закрытых системах
4. Обычно ингибиторы теряют свою эффективность как конц. И температура повышается.
Катодная защита:
Это метод защиты металла или сплава от коррозии, и никакая его часть не может выступать в качестве анода.
Метод обеспечения катодной защиты образца (металла) от коррозии путем предоставления электронов от внешнего источника.
Есть два метода обеспечения электронов для катодных реакций.
1. Метод протекторного анода:
Метод предполагает использование более активных металлов в качестве расходуемого анода, контактирующего с образцом (например, железа, меди или латуни). Активные металлы, такие как Zn, Mg, Al и их сплавы, действуют как вспомогательный анод и подвергаются преимущественной коррозии, защищая металлическую структуру.Здесь анодные металлы приносятся в жертву для защиты металла, этот метод известен как метод жертвенного анода, израсходованные аноды заменяются новыми по мере необходимости.
Активные металлы, такие как Zn, Mg, Al и их сплавы, действуют как вспомогательный анод и подвергаются преимущественной коррозии, защищая металлическую структуру.Здесь анодные металлы приносятся в жертву для защиты металла, этот метод известен как метод жертвенного анода, израсходованные аноды заменяются новыми по мере необходимости.
Например: 1. Блок Mg или Zn, подключенный к заглубленному масляному резервуару
2. Магнезиальные стержни подключены к океанским судам.
Методы расходуемого анода просты, имеют низкую стоимость установки и не требуют источника питания, но требуют периодических затрат на замену израсходованных анодов.
2.Метод наложенного тока :
Это еще один метод обеспечения катодной защиты за счет подачи электронов. Они могут быть обеспечены источником постоянного тока.
Защищаемую конструкцию следует сделать отрицательной (подключенной к отрицательной клемме источника постоянного тока). Графитовый стержень, связанный смолой, платинированный Ti, Pb, используется в качестве анода и подключается к положительному выводу. Основная структура, являющаяся катодом, не подвергается коррозии, а анод, будучи инертным, остается неизменным.
Основная структура, являющаяся катодом, не подвергается коррозии, а анод, будучи инертным, остается неизменным.
.
Этот метод используется для защиты морских сооружений, резервуаров для хранения воды и других газовых или нефтепроводов. Этот метод прост, может защитить большую металлическую поверхность с низкими затратами на обслуживание, но дорогостоящий, потому что для него требуется большой ток.
Анодная защита:
Некоторые металлы, такие как Ti, и сплавы, такие как нержавеющая сталь, которые легко пассивируются, так что в таких случаях не может быть обеспечена катодная защита, процесс коррозии можно замедлить с помощью анодного тока.Пропуская анодный ток в эти металлы, оксидный слой будет расти, и этот оксидный слой будет защищать металлы. Потенциал, необходимый для роста оксидной пленки и защиты металла, может быть получен из кривой потенциал-ток.
В заранее определенном диапазоне приложенного потенциала изучаются наблюдаемые изменения потенциала и соответствующие изменения тока. На начальных стадиях (AB) ток увеличивается с увеличением потенциала, что указывает на растворение металла, поэтому имеет место коррозия.Когда ток достигает критической точки (Icrit), начинается пассивация, связанная с развитием оксидного слоя, и этот потенциал (Ep) называется пассивирующим потенциалом (Ep). Выше Ep вдоль BC ток уменьшается до очень небольшого значения, называемого током пассивирования (Ip). Это минимальная плотность защитного тока для поддержания пассивации. В этой точке (C) увеличение потенциала не вызовет коррозии металла, поскольку металл находится в крайне пассивном состоянии. Небольшой ток (Ip) достаточен для поддержания пассивности, что снижает скорость коррозии.
На начальных стадиях (AB) ток увеличивается с увеличением потенциала, что указывает на растворение металла, поэтому имеет место коррозия.Когда ток достигает критической точки (Icrit), начинается пассивация, связанная с развитием оксидного слоя, и этот потенциал (Ep) называется пассивирующим потенциалом (Ep). Выше Ep вдоль BC ток уменьшается до очень небольшого значения, называемого током пассивирования (Ip). Это минимальная плотность защитного тока для поддержания пассивации. В этой точке (C) увеличение потенциала не вызовет коррозии металла, поскольку металл находится в крайне пассивном состоянии. Небольшой ток (Ip) достаточен для поддержания пассивности, что снижает скорость коррозии.
Анодная защита конструкции осуществляется с помощью устройства, называемого потенциостатом. Это электронное устройство, которое поддерживает постоянный потенциал металла относительно вспомогательного платинового электрода сравнения и каломельного электрода сравнения.
Металлическая конструкция, находящаяся в подходящей окислительной атмосфере, действует как рабочий электрод (анод). Затем потенциал немного увеличивается до Ep (пассивирующий потенциал) для начала начальной коррозии. Затем потенциал немного увеличивают до тех пор, пока ток не упадет до очень небольшого значения (Тр), указывающего на пассивацию металла.Теперь потенциал поддерживается на постоянном уровне Ep, а ток — на уровне Ip.
Затем потенциал немного увеличивается до Ep (пассивирующий потенциал) для начала начальной коррозии. Затем потенциал немного увеличивают до тех пор, пока ток не упадет до очень небольшого значения (Тр), указывающего на пассивацию металла.Теперь потенциал поддерживается на постоянном уровне Ep, а ток — на уровне Ip.
Этот метод имеет преимущество, поскольку он требует очень небольшого тока, но этот метод может применяться только для пассивных металлов, таких как Ti, Ta, Al, Cr и т. Д., А также при использовании этого метода скорость коррозии не может быть снижена до нуля.
Этот метод обычно применяется при транспортировке кислоты.
Если вы являетесь автором приведенного выше текста и не соглашаетесь делиться своими знаниями для обучения, исследований, стипендий (для добросовестного использования, как указано в авторских правах США), отправьте нам электронное письмо, и мы удалим ваши текст быстро.Добросовестное использование — это ограничение и исключение из исключительного права, предоставленного законом об авторском праве автору творческой работы. В законах США об авторском праве добросовестное использование — это доктрина, которая разрешает ограниченное использование материалов, защищенных авторским правом, без получения разрешения от правообладателей. Примеры добросовестного использования включают комментарии, поисковые системы, критику, репортажи, исследования, обучение, архивирование библиотек и стипендии. Он предусматривает легальное, нелицензионное цитирование или включение материалов, защищенных авторским правом, в работы другого автора в соответствии с четырехфакторным балансирующим тестом.(источник: http://en.wikipedia.org/wiki/Fair_use)
В законах США об авторском праве добросовестное использование — это доктрина, которая разрешает ограниченное использование материалов, защищенных авторским правом, без получения разрешения от правообладателей. Примеры добросовестного использования включают комментарии, поисковые системы, критику, репортажи, исследования, обучение, архивирование библиотек и стипендии. Он предусматривает легальное, нелицензионное цитирование или включение материалов, защищенных авторским правом, в работы другого автора в соответствии с четырехфакторным балансирующим тестом.(источник: http://en.wikipedia.org/wiki/Fair_use)
Информация о медицине и здоровье, содержащаяся на сайте, носит общий характер и цель , которая является чисто информативной и по этой причине не может в любом случае заменить совет врача или квалифицированного лица, имеющего законную профессию.
Тексты являются собственностью их авторов, и мы благодарим их за предоставленную нам возможность бесплатно делиться своими текстами с учащимися, преподавателями и пользователями Интернета, которые будут использоваться только в иллюстративных образовательных и научных целях.
CET Коррозия — формы коррозии
В описанных здесь формах коррозии используется терминология, используемая в NASA-KSC. Существуют и другие не менее действенные методы классификации коррозии, но общепринятой терминологии нет. Имейте в виду, что данная ситуация может привести к нескольким формам коррозии одного и того же куска материала.
Равномерная коррозия
Это также называется общей коррозией.Поверхностный эффект, вызываемый большинством прямых химических воздействий (например, кислотой), представляет собой равномерное травление металла. На полированной поверхности этот тип коррозии сначала проявляется как общее потускнение поверхности, и, если позволить ей продолжаться, поверхность становится шероховатой и, возможно, матовой. Изменение цвета или общее потускнение металла, вызванное его воздействием повышенных температур, не следует рассматривать как однородную коррозию травлением. Использование химически стойких защитных покрытий или более стойких материалов решит эти проблемы.
Изменение цвета или общее потускнение металла, вызванное его воздействием повышенных температур, не следует рассматривать как однородную коррозию травлением. Использование химически стойких защитных покрытий или более стойких материалов решит эти проблемы.
Хотя это наиболее распространенная форма коррозии, она, как правило, не имеет большого инженерного значения, поскольку конструкции обычно становятся неприглядными и требуют технического обслуживания задолго до того, как на них возникнут структурные повреждения. Объекты, показанные на рисунке ниже, показывают, как эта коррозия может прогрессировать, если не будут приняты меры контроля.
Вернуться наверх
Гальваническая коррозия
Гальваническая коррозия — это электрохимическое воздействие двух разнородных металлов в присутствии электролита и пути, проводящего электроны.Это происходит при контакте разнородных металлов.
Его можно распознать по образованию коррозии на стыке между разнородными металлами. Например, когда алюминиевые сплавы или сплавы магния контактируют со сталью (углеродистой сталью или нержавеющей сталью), может возникнуть гальваническая коррозия, которая ускорит коррозию алюминия или магния. Это можно увидеть на фотографии выше, где алюминиевая лопасть вертолета корродировала в месте контакта со стальным противовесом.
Гальваническая серия в морской воде
Благородный
(наименее активный)
Платина
Золото
Графит
Серебро
18-8-3 Нержавеющая сталь, тип 316 (пассивный)
18-8 Нержавеющая сталь, тип 304 (пассивный)
Титан
Нержавеющая сталь с 13% хрома, тип 410 (пассивный)
Сплав 7НИ-33Cu
Сплав 75НИ-16Cr-7Fe (пассивный)
Никель (пассивный)
Серебряный припой
M-Бронза
G-Бронза
70-30 Купроникель
Кремниевая бронза
Медь
Красный латунь
Алюминиевая бронза
Латунь Admiralty
Желтая латунь
76NI-16Cr-7Fe сплав (активный)
Никель (активный)
Морская латунь
Марганцевая бронза
Металл Muntz
Олово
Свинец
18-8-3 Нержавеющая сталь, тип 316 ( активный)
18-8 Нержавеющая сталь, тип 304 (активный)
Нержавеющая сталь с 13-процентным содержанием хрома, тип 410 (активный)
Чугун
Низкоуглеродистая сталь
Алюминий 2024
Кадмий
Альклад
Алюминий 6053
Оцинкованная сталь
Цинк
Магниевые сплавы
Магний
A nodic
(наиболее активный)
Естественные различия в потенциалах металлов вызывают гальванические различия, такие как гальванический ряд в морской воде. Если между любыми двумя из этих материалов возникает электрический контакт в присутствии электролита, между ними должен протекать ток. Чем дальше друг от друга находятся металлы в гальванической последовательности, тем больше будет эффект или скорость гальванической коррозии. Металлы или сплавы на верхнем конце благородны, а на нижнем — активны. Более активным металлом является анод или тот, который подвержен коррозии.
Если между любыми двумя из этих материалов возникает электрический контакт в присутствии электролита, между ними должен протекать ток. Чем дальше друг от друга находятся металлы в гальванической последовательности, тем больше будет эффект или скорость гальванической коррозии. Металлы или сплавы на верхнем конце благородны, а на нижнем — активны. Более активным металлом является анод или тот, который подвержен коррозии.
Контроль гальванической коррозии достигается за счет использования металлов ближе друг к другу в гальванической последовательности или путем электрической изоляции металлов друг от друга.Катодная защита также может использоваться для контроля эффектов гальванической коррозии.
Акваланг выше подвергся гальванической коррозии, когда латунный клапан и стальной резервуар были увлажнены конденсатом. Фланцы с гальванической изоляцией, подобные показанным справа, используются для предотвращения гальванической коррозии. Между фланцами вставляются изоляционные прокладки, обычно полимерные, а изолирующие втулки и шайбы изолируют болтовые соединения
Акваланг выше подвергся гальванической коррозии, когда латунный клапан и стальной резервуар были увлажнены конденсатом.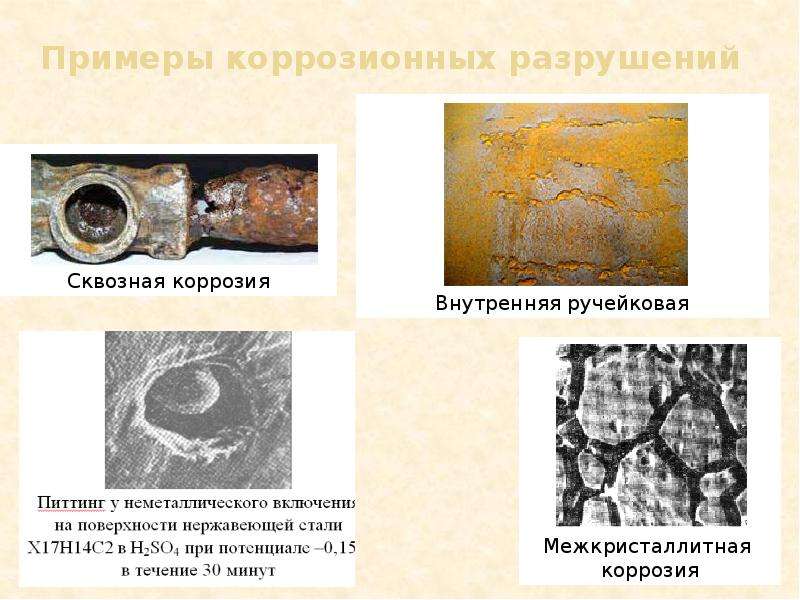 Фланцы с гальванической изоляцией, подобные показанным справа, используются для предотвращения гальванической коррозии. Между фланцами вставляются изоляционные прокладки, обычно полимерные, а изолирующие втулки и шайбы изолируют болтовые соединения.
Фланцы с гальванической изоляцией, подобные показанным справа, используются для предотвращения гальванической коррозии. Между фланцами вставляются изоляционные прокладки, обычно полимерные, а изолирующие втулки и шайбы изолируют болтовые соединения.
KSC проводит исследования воздействия гальванической коррозии. На фото ниже показана коррозия, вызванная винтом из нержавеющей стали, вызывающим гальваническую коррозию алюминия. На снимке показана коррозия, возникшая в результате всего лишь шести месяцев пребывания на испытательном полигоне в атмосфере.
Вернуться наверх
Коррозия ячейки концентрации
Коррозия ячейки концентрации возникает, когда два или более участков металлической поверхности контактируют с разными концентрациями одного и того же раствора. Существует три основных типа коррозии концентрационных ячеек:
- Ячейки для концентрации ионов металлов
- ячеек концентрации кислорода и
- активно-пассивных ячеек.

Ячейки для концентрирования ионов металлов
В присутствии воды высокая концентрация ионов металлов будет существовать под прилегающими поверхностями, а низкая концентрация ионов металлов будет существовать рядом с щелью, созданной прилегающими поверхностями. Между двумя точками будет существовать электрический потенциал. Область металла, контактирующая с ионами металла с низкой концентрацией, будет катодной и будет защищена, а область металла, контактирующая с ионами металла с высокой концентрацией, будет анодной и корродированной.Это состояние может быть устранено путем герметизации прилегающих поверхностей таким образом, чтобы исключить попадание влаги. Правильное нанесение защитного покрытия с неорганическими цинковыми грунтовками также эффективно снижает коррозию поверхности.
Ячейки для концентрации кислорода
Водный раствор, контактирующий с поверхностью металла, обычно содержит растворенный кислород. Кислородная ячейка может развиться в любой точке, где кислород из воздуха не может равномерно диффундировать в раствор, тем самым создавая разницу в концентрации кислорода между двумя точками. Обычно ячейки для измерения концентрации кислорода находятся под металлическими или неметаллическими отложениями (грязью) на металлической поверхности и под прилегающими поверхностями, такими как заклепочные соединения внахлест. Кислородные ячейки также могут образовываться под прокладками, деревом, резиной, пластиковой лентой и другими материалами, контактирующими с металлической поверхностью. Коррозия произойдет в области с низкой концентрацией кислорода (анод). Серьезность коррозии из-за этих условий может быть сведена к минимуму за счет герметизации, поддержания чистоты поверхностей и отказа от использования материала, позволяющего впитывать влагу между прилегающими поверхностями.
Обычно ячейки для измерения концентрации кислорода находятся под металлическими или неметаллическими отложениями (грязью) на металлической поверхности и под прилегающими поверхностями, такими как заклепочные соединения внахлест. Кислородные ячейки также могут образовываться под прокладками, деревом, резиной, пластиковой лентой и другими материалами, контактирующими с металлической поверхностью. Коррозия произойдет в области с низкой концентрацией кислорода (анод). Серьезность коррозии из-за этих условий может быть сведена к минимуму за счет герметизации, поддержания чистоты поверхностей и отказа от использования материала, позволяющего впитывать влагу между прилегающими поверхностями.
Активно-пассивные элементы
Металлы, для защиты от коррозии которых используется плотно прилегающая пассивная пленка (обычно оксидная); например, аустенитная коррозионно-стойкая сталь может подвергаться коррозии под действием активно-пассивных ячеек. Коррозионное действие обычно начинается с ячейки концентрации кислорода; например, отложения солей на поверхности металла в присутствии воды, содержащей кислород, могут создать кислородный элемент. Если пассивная пленка разрушена под солевым отложением, активный металл под пленкой подвергнется коррозии.Электрический потенциал будет развиваться между большой площадью катода (пассивная пленка) и небольшой площадью анода (активный металл). Это приведет к быстрой питтинговой коррозии активного металла. Этого типа коррозии можно избежать путем частой очистки и нанесения защитных покрытий.
Если пассивная пленка разрушена под солевым отложением, активный металл под пленкой подвергнется коррозии.Электрический потенциал будет развиваться между большой площадью катода (пассивная пленка) и небольшой площадью анода (активный металл). Это приведет к быстрой питтинговой коррозии активного металла. Этого типа коррозии можно избежать путем частой очистки и нанесения защитных покрытий.
Вернуться наверх
Питтинговая коррозия
Пассивные металлы, такие как нержавеющая сталь, устойчивы к коррозионным средам и могут хорошо работать в течение длительных периодов времени.Однако, если коррозия все же возникает, она случайным образом образуется в ямах. Язвенная коррозия наиболее вероятна в присутствии хлорид-ионов в сочетании с такими деполяризаторами, как кислород или окисляющие соли. Методы, которые можно использовать для борьбы с точечной коррозией, включают поддержание чистоты поверхностей, нанесение защитного покрытия и использование ингибиторов или катодной защиты при работе с погружением. Добавки молибдена в нержавеющую сталь (например, в нержавеющую сталь 316) предназначены для уменьшения точечной коррозии.
Добавки молибдена в нержавеющую сталь (например, в нержавеющую сталь 316) предназначены для уменьшения точечной коррозии.
(любезно предоставлено www.eci-ndt.com)
Пузырьки или бугорки ржавчины на чугуне выше указывают на то, что происходит точечная коррозия. Исследователи обнаружили, что среда внутри пузырей ржавчины почти всегда содержит больше хлоридов и ниже по pH (более кислая), чем общая внешняя среда. Это приводит к сосредоточенной атаке внутри боксов.
Подобные изменения в окружающей среде происходят внутри щелей, трещин, вызванных коррозией под напряжением, и трещин коррозионной усталости. Все эти формы коррозии иногда включают в термин «коррозия окклюзионных ячеек».«
Точечная коррозия может привести к неожиданному и катастрофическому отказу системы. Раскол в трубке вверху слева возник в результате точечной коррозии нержавеющей стали. Типичная яма на этой трубке показана вверху справа.
Иногда точечная коррозия может быть совсем небольшой на поверхности и очень большой под поверхностью. На рисунке внизу слева показан этот эффект, который характерен для нержавеющих сталей и других металлов с защитной пленкой. Точечная коррозия, показанная внизу справа (белая стрелка), привела к коррозионному разрушению под напряжением, показанному черными стрелками.
На рисунке внизу слева показан этот эффект, который характерен для нержавеющих сталей и других металлов с защитной пленкой. Точечная коррозия, показанная внизу справа (белая стрелка), привела к коррозионному разрушению под напряжением, показанному черными стрелками.
Полное обсуждение этой коррозии содержится в Steven J. McDanels, «Анализ отказов трубопровода стартовой площадки из Космического центра Кеннеди», Microstructural Science, Vol. 25, 1998, ASM International, Materials Park, OH, стр. 125–129.
Вернуться наверх
Щелевая коррозия
Щелевая или контактная коррозия — это коррозия, возникающая в области контакта металлов с металлами или металлов с неметаллами.Это может произойти на шайбах, под ракушками, на песчинках, под нанесенными защитными пленками и в карманах, образованных резьбовыми соединениями. Независимо от того, свободны ли нержавеющие стали от зародышей ямок, они всегда подвержены такому виду коррозии, потому что зародыши не нужны.
Чистота, правильное использование герметиков и защитных покрытий — эффективные средства решения этой проблемы. Сорта нержавеющей стали, содержащие молибден (например, 316 и 316L), обладают повышенной стойкостью к щелевой коррозии.
Показанная выше щелевая коррозия произошла при использовании аэрокосмического сплава (титан — 6, алюминий — 4 ванадий) вместо более стойкого к коррозии сорта титана. В титан добавляют специальные легирующие добавки, чтобы получить сплавы, устойчивые к щелевой коррозии даже при повышенных температурах.
Винты и крепежные детали — частые источники проблем щелевой коррозии. Показанные ниже винты из нержавеющей стали корродировали во влажной атмосфере корпуса прогулочного катера.
(любезно предоставлено marinesurvey.com)
Вернуться наверх
Нитевидная коррозия
Этот тип коррозии возникает под окрашенными или покрытыми покрытиями поверхностями, когда влага проникает в покрытие.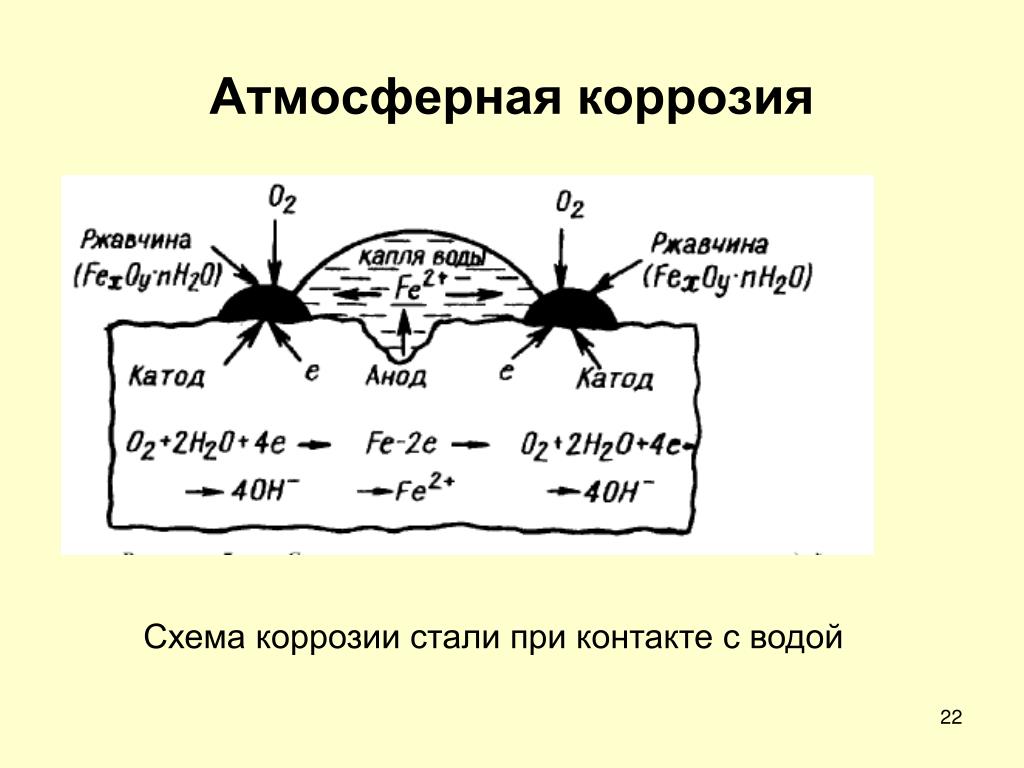 Наиболее подвержены этой проблеме лаки и «быстросохнущие» краски. Их использования следует избегать, если отсутствие побочного эффекта не было доказано практическим опытом.Если требуется покрытие, оно должно обладать низкими характеристиками пропускания водяного пара и отличной адгезией. Покрытия с высоким содержанием цинка также следует рассматривать для покрытия углеродистой стали из-за их качества катодной защиты.
Наиболее подвержены этой проблеме лаки и «быстросохнущие» краски. Их использования следует избегать, если отсутствие побочного эффекта не было доказано практическим опытом.Если требуется покрытие, оно должно обладать низкими характеристиками пропускания водяного пара и отличной адгезией. Покрытия с высоким содержанием цинка также следует рассматривать для покрытия углеродистой стали из-за их качества катодной защиты.
(любезно предоставлено www.cp.umist.ac.uk)
Нитевидная коррозия обычно начинается с небольших, иногда микроскопических, дефектов покрытия.
На рисунке слева показана нитевидная коррозия, вызывающая просачивание сварного резервуара.На рисунке справа показаны «червеобразные» туннели нитевидной коррозии, образующиеся под покрытием на Атмосферном испытательном полигоне.
Нитевидная коррозия сводится к минимуму за счет тщательной подготовки поверхности перед нанесением покрытия, использования покрытий, устойчивых к этой форме коррозии (см. Выше), и тщательного осмотра покрытий, чтобы убедиться, что прослойки или отверстия в покрытии сведены к минимуму. .
Выше), и тщательного осмотра покрытий, чтобы убедиться, что прослойки или отверстия в покрытии сведены к минимуму. .
Вернуться наверх
Межкристаллитная коррозия
Межкристаллитная коррозия — это поражение границ зерен металла или сплава или вблизи них.Сильно увеличенное поперечное сечение большинства промышленных сплавов покажет его зернистую структуру. Эта структура состоит из множества отдельных зерен, и каждое из этих крошечных зерен имеет четко определенную границу, которая химически отличается от металла в центре зерна. Термическая обработка нержавеющих сталей и алюминиевых сплавов обостряет эту проблему.
На рисунке выше показана нержавеющая сталь, которая корродировала в зоне термического влияния на небольшом расстоянии от сварного шва.Это типично для межкристаллитной коррозии аустенитных нержавеющих сталей. Эту коррозию можно устранить, используя стабилизированные нержавеющие стали (321 или 347) или низкоуглеродистые марки нержавеющей стали (304L или 3I6L).
Термообрабатываемые алюминиевые сплавы (сплавы серий 2000, 6000 и 7000) также могут иметь эту проблему. См. Раздел о расслаивающейся коррозии ниже.
Вернуться наверх
Отслаивающая коррозия
Отслоение — это форма межкристаллитной коррозии.Он проявляется в поднятии поверхностных зерен металла вверх под действием силы расширения продуктов коррозии, возникающих на границах зерен чуть ниже поверхности. Это видимое свидетельство межкристаллитной коррозии и чаще всего наблюдается на экструдированных профилях, где толщина зерна меньше, чем у прокатных форм. Эта форма коррозии характерна для алюминия и может возникать на углеродистой стали.
На рисунке слева показано расслоение алюминия.В канале на панели экспонирования покрытия справа видно отслоение углеродистой стали. Расширение металла, вызванное отслаивающейся коррозией, может создавать напряжения, которые изгибают или разрывают соединения и приводят к разрушению конструкции.
Расширение металла, вызванное отслаивающейся коррозией, может создавать напряжения, которые изгибают или разрывают соединения и приводят к разрушению конструкции.
Вернуться наверх
Коррозионное растрескивание под напряжением
Коррозионное растрескивание под напряжением (SCC) вызывается одновременным воздействием растягивающего напряжения и определенной коррозионной среды.Напряжения могут возникать из-за приложенных нагрузок, остаточных напряжений в процессе производства или их комбинации.
Поперечные сечения SCC часто показывают разветвленные трещины. Эта схема разветвления реки уникальна для SCC и используется при анализе отказов, чтобы определить, когда возникла эта форма коррозии.
На фотографии ниже показан SCC изолированного трубопровода конденсата из нержавеющей стали. Вода смочила изоляцию и вызвала выщелачивание хлоридов из изоляции на горячую металлическую поверхность.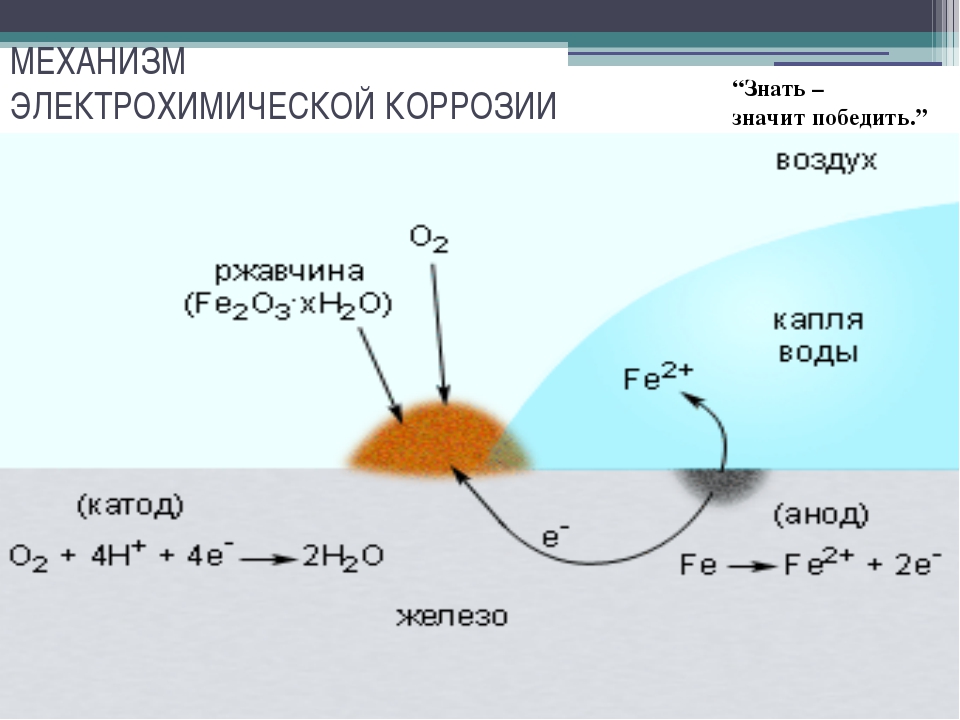 Это обычная проблема паропроводов и конденсатопроводов. Контроль заключается в поддержании куртки вокруг строп, чтобы влага не попадала в изоляцию или быстро отводилась.
Это обычная проблема паропроводов и конденсатопроводов. Контроль заключается в поддержании куртки вокруг строп, чтобы влага не попадала в изоляцию или быстро отводилась.
На следующих двух фотографиях показан межкристаллитный SCC алюминиевой аэрокосмической детали. Межкристаллитный характер коррозии можно увидеть на изображении, полученном с помощью сканирующего электронного микроскопа, слева и на микроскопическом поперечном сечении справа. Стрелки указывают на первичную трещину, показанную на обоих рисунках.Обратите внимание, что вторичные трещины также очевидны. Эти вторичные трещины обычны при коррозионном растрескивании под напряжением.
Указанный выше отказ произошел на алюминиевом сплаве, подверженном остаточным напряжениям и соленой воде. Изменения в термообработке сплавов, рекомендованные Лабораторией материалов КНЦ, устранили эту проблему. McDanels, S.J., «Обзор режимов усталости и других металлургических отказов и анализ в Космическом центре Кеннеди» , Воспламеняемость и чувствительность материалов в атмосферах, обогащенных кислородом: восьмой том , ASTM STP 1319, W.Т. Роялс, Т. Чжоу, Т.А. Steinberg, Eds., American Society for Testing and Materials, 1997.
.
Вернуться наверх
Коррозионная усталость
Коррозионная усталость — это особый случай коррозии под напряжением, вызванной комбинированным воздействием циклического напряжения и коррозии. Ни один металл не застрахован от некоторого снижения его устойчивости к циклическим нагрузкам, если металл находится в агрессивной среде.Повреждение от коррозионной усталости превышает сумму повреждений от циклических напряжений и коррозии. Контроль коррозионной усталости может быть достигнут либо путем снижения циклических напряжений, либо путем контроля коррозии.
«Следы пляжа» на гребном винте, показанные ниже, указывают на прогрессирование усталости на этой поверхности.
Подобные отметки пляжа показаны на аэрокосмической части внизу слева. На изображении, полученном с помощью сканирующего электронного микроскопа с большим увеличением, справа видны бороздки (отдельные следы развития трещин).Часть, показанная ниже, также обсуждается в разделе, посвященном фреттинг-коррозии.
Печально известный пример коррозионной усталости произошел в 1988 году на авиалайнере, летевшем между Гавайскими островами. Эта катастрофа, стоившая одной жизни, побудила авиакомпании посмотреть на свои самолеты и проверить их на коррозионную усталость.
Вернуться наверх
Фреттинг-коррозия
Быстрая коррозия, которая возникает на границе соприкасающихся, сильно нагруженных металлических поверхностей, когда они подвергаются легким вибрационным движениям, известна как фреттинг-коррозия.
На фото выше показана фреттинг-коррозия столба забора и проводов, которые раскачиваются на ветру и изнашиваются о столб. Столб ограды и соединительные провода подвержены коррозии.
Этот тип коррозии наиболее распространен на опорных поверхностях машинного оборудования, таких как шатуны, шлицевые валы и опоры подшипников, и часто вызывает усталостное разрушение. Это может происходить в элементах конструкции, таких как фермы, где используются сильно нагруженные болты, и между ними происходит относительное движение.
(любезно предоставлено www.emersonbearing.com)
Фреттинг-коррозия значительно замедляется, если контактирующие поверхности могут быть хорошо смазаны, как в опорных поверхностях механизмов, чтобы исключить прямой контакт с воздухом.
Обойма подшипника, показанная выше, является классическим примером фреттинг-коррозии. Это значительно замедляется, когда контактирующие поверхности могут быть хорошо смазаны, как в опорных поверхностях машин, чтобы исключить прямой контакт с воздухом.
Заедание большой алюминиевой детали (вверху слева) привело к отложению мусора (показано на поперечных сечениях справа).Вибрационные движения, трение вперед и назад, также вызывают усталостные трещины, показанные в разделе, посвященном усталостной коррозии.
Вернуться наверх
Эрозия Коррозия
Эрозионная коррозия является результатом сочетания агрессивной химической среды и высоких скоростей движения поверхности жидкости. Это может быть результатом быстрого потока жидкости мимо неподвижного объекта, например, в случае с обратным клапаном нефтяного месторождения, показанного слева внизу, или это может быть результатом быстрого движения объекта в неподвижной жидкости, например, когда гребной винт корабля взбивает океан.
Поверхности, подвергшиеся эрозионной коррозии, обычно довольно чистые, в отличие от поверхностей, подвергшихся многим другим формам коррозии.
Эрозионную коррозию можно контролировать, используя более твердые сплавы (включая напыленные пламенем или сварные твердые покрытия) или используя более устойчивый к коррозии сплав. Изменения скорости жидкости и изменения схемы потока также могут уменьшить эффекты эрозионной коррозии.
Эрозионная коррозия часто является результатом удаления защитной окалины или покрытия с металлической поверхности.Показанная справа эксплуатационная колонна нефтяного месторождения корродировала, когда давление в скважине стало достаточно низким, чтобы вызвать многофазный поток жидкости. Удар схлопывающихся пузырьков газа вызвал повреждение стыков, к которым подсоединялись трубы, и турбулентность была сильнее.
Многие люди предполагают, что эрозионная коррозия связана с турбулентным потоком. Это верно, потому что все практические системы трубопроводов требуют турбулентного потока — жидкость не будет течь достаточно быстро, если бы поддерживался пластинчатый (нетурбулентный) поток.Большая часть, если не вся, эрозионная коррозия может быть связана с многофазным потоком флюида. Обратный клапан слева вверху вышел из строя из-за песка и других частиц в некоррозионной жидкости. Трубка справа вышла из строя из-за разницы давлений, вызванной схлопыванием пузырьков газа на стенке трубы и разрушением защитной минеральной накипи, которая ограничивала коррозию.
Вернуться наверх
Дилинг
Легирование — это редкая форма коррозии, обнаруживаемая в медных сплавах, сером чугуне и некоторых других сплавах.Расплавление происходит, когда сплав теряет активный компонент металла и сохраняет более устойчивый к коррозии компонент в пористой «губке» на поверхности металла. Это также может происходить при повторном осаждении благородного компонента сплава на поверхности металла. Контроль осуществляется за счет использования более стойких латуни с ингибиторами сплавов, а также ковкого чугуна или чугуна с шаровидным графитом.
Латунь слева подверглась децинковке, оставив на поверхности пористую медную пробку.Водопроводная труба из серого чугуна, показанная на правой фотографии, имеет заглушки с графитированной и левой графитовой поверхностью, которые можно увидеть на поверхности среза. Бугорки или пузыри ржавчины также указывают на точечную коррозию.
На нижнем снимке показан слой меди на поверхности трубки теплообменника из очищенного 70% меди и 30% никеля и мельхиора, снятой с корабля. Застойная морская вода настолько агрессивна, что даже этот обычно устойчивый к коррозии сплав подвергся коррозии. Практически все медные сплавы в некоторых средах подвергаются удалению легирования.
Вернуться наверх
Повреждение водородом
Водород может вызвать ряд проблем с коррозией. Водородная хрупкость — это проблема высокопрочных сталей, титана и некоторых других металлов. Контроль осуществляется путем удаления водорода из окружающей среды или использования стойких сплавов.
Водородные пузыри могут возникать, когда водород попадает в сталь в результате реакции восстановления на металлическом катоде.Затем одноатомные атомы водорода диффундируют через металл, пока не встретятся с другим атомом, обычно во включениях или дефектах в металле. Получающиеся в результате молекулы двухатомного водорода слишком велики, чтобы мигрировать и попасть в ловушку. В конце концов образуется пузырек газа, который может расколоть металл, как показано на рисунке ниже.
Водородные пузыри контролируются путем минимизации коррозии в кислой среде. Это не проблема в нейтральной или едкой среде или с высококачественной сталью с низким уровнем примесей и включений.
Сломанная пружина вверху слева была доставлена в лабораторию материалов KSC для анализа отказов. Исследование при большом увеличении в сканирующем электронном микроскопе (вверху справа) выявило межзеренный раскол, характерный для водородного растрескивания (водородное охрупчивание). Деталь была оцинкована во время ремонта, и водород, попавший в металл во время процесса нанесения покрытия, не прогорелся. Процедура отжига после нанесения покрытия должна быть стандартной для высокопрочных сталей.
Вернуться наверх
Коррозия бетона
На рисунке слева показаны трещины и пятна на дамбе возле Космического центра Кеннеди. Точечная коррозия на правой фотографии произошла на алюминиевом ограждении бетонной дороги над входом в Атлантический океан.
Бетон — широко используемый конструкционный материал, который часто армируют арматурными стержнями из углеродистой стали, тросом для предварительного натяжения или проволокой для предварительного напряжения.Сталь необходима для сохранения прочности конструкции, но она подвержена коррозии. Растрескивание, связанное с коррозией в бетоне, является серьезной проблемой в районах с морской средой (например, KSC) и в районах, где используются противообледенительные соли.
Существуют две теории возникновения коррозии в бетоне:
- Соли и другие химические вещества попадают в бетон и вызывают коррозию. Коррозия металла приводит к появлению расширяющих сил, вызывающих растрескивание бетонной конструкции.
- Трещины в бетоне позволяют влаге и солям достигать поверхности металла и вызывать коррозию.
У обеих возможностей есть свои сторонники, и также возможно, что коррозия в бетоне может произойти в любом случае. Механизм на самом деле не важен, коррозия приводит к повреждению, и повреждение необходимо контролировать.
В новом строительстве коррозию в бетоне обычно контролируют путем заделки стали на достаточно большую глубину, чтобы химические вещества с поверхности не достигли стали (достаточная глубина покрытия).Другие меры контроля включают поддержание отношения вода / цемент ниже 0,4, наличие высокого коэффициента цементации, надлежащую детализацию для предотвращения растрескивания и образования отложений, а также использование химических добавок. Эти методы очень эффективны, и большинство бетонных конструкций, даже в морской среде, не подвержены коррозии.
К сожалению, некоторые бетонные конструкции подвержены коррозии. Когда это происходит, корректирующие действия могут включать ремонт треснувшего и отслаивающегося бетона, покрытие поверхности для предотвращения дальнейшего проникновения коррозионных химикатов в конструкцию и катодную защиту, электрические средства контроля коррозии.KSC имеет опыт применения всех этих методов борьбы с коррозией существующих бетонных конструкций.
Вернуться наверх
Микробная коррозия
Микробная коррозия (также называемая микробиологической коррозией или MIC) — это коррозия, вызванная присутствием и деятельностью микробов. Эта коррозия может принимать различные формы, и ее можно контролировать с помощью биоцидов или обычных методов борьбы с коррозией.
Существует ряд механизмов, связанных с этой формой коррозии, и подробные объяснения доступны на веб-сайтах, перечисленных в нижней части этого раздела. Большая часть МПК имеет форму ям, которые образуются под колониями живого органического вещества, минералов и биологических отложений. Эта биопленка создает защитную среду, в которой условия могут стать очень агрессивными, а коррозия ускоряется.
На рисунке ниже показана биопленка на металлической поверхности конденсатора. Эти биопленки могут позволять агрессивным химическим веществам скапливаться внутри и под пленками.Таким образом, коррозионные условия под биопленкой могут быть очень агрессивными, даже в местах, где объемная среда не вызывает коррозии.
(любезно предоставлено www.asm.org) | (любезно предоставлено www.micscan.com) |
MIC может быть серьезной проблемой в системах стоячей воды, таких как система противопожарной защиты, в которой образовались ямы, показанные выше.Использование биоцидов и методов механической очистки может снизить МПК, но МПК может возникать везде, где может скапливаться застойная вода.
Коррозия (окисление металла) может произойти только в том случае, если присутствует какое-либо другое химическое вещество, подлежащее восстановлению. В большинстве сред восстанавливаемое химическое вещество представляет собой растворенный кислород или ионы водорода в кислотах. В анаэробных условиях (отсутствие кислорода или воздуха) некоторые бактерии (анаэробные бактерии) могут процветать. Эти бактерии могут обеспечивать восстанавливаемые химические вещества, которые способствуют возникновению коррозии.Так возникла ограниченная коррозия, обнаруженная на корпусе Титаника. На картинке ниже изображен «рустик», снятый с корпуса Титаника. Эта комбинация ржавчины и органического мусора ясно показывает расположение отверстий для заклепок и перекрытие двух стальных пластин.
(Couresy www.dbi.sk.ca)
Большая часть микробной коррозии связана с анаэробными или застойными условиями, но ее также можно найти на конструкциях, подверженных воздействию воздуха. На фотографиях ниже показаны водосбросные ворота плотины гидроэлектростанции на реке Колумбия.Коррозионные трещины под напряжением были вызваны голубиным пометом, который производил аммиак — химическое вещество, которое вызывает коррозионное растрескивание под напряжением медных сплавов, таких как шайбы, используемые на этой конструкции. Поскольку приучить голубей к горшку невозможно, потребовался новый сплав, устойчивый к аммиаку.
(любезно предоставлено www.meic.com)
Помимо использования коррозионно-стойких сплавов, контроль МПК включает использование биоцидов и методов очистки, удаляющих отложения с металлических поверхностей.Бактерии очень мелкие, и часто очень трудно получить достаточно гладкую и чистую металлическую систему, чтобы предотвратить образование микробов.
Вернуться наверх
Сравните разницу между электрохимической коррозией и химической эрозией
В нашей повседневной жизни мы находим множество случаев износа или износа по разным причинам, обычно формованные предметы часто окисляются до ржавчины. Люди часто используют краску, чтобы предотвратить это.
1.Химическая коррозия
Химическая коррозия вызывается реакцией металла с водяным паром или газом при высоких температурах. Или я вижу, что люди говорят более сложное:
Химическая коррозия — это окислительно-восстановительный процесс, при котором электроны металла передаются непосредственно веществам в окружающей среде.
Электрохимическая коррозия — это окислительно-восстановительный процесс, при котором металл подвергается коррозии под действием раствора электролита, который генерирует электроны, которые перемещаются от анода к катоду.
Условия для электрохимической коррозии:
1) Электроды должны быть разными. Например Fe и Cu. Прочные металлы являются катодами и быстро разрушаются
2) Электроды должны контактировать друг с другом (прямо или косвенно через проводник) и контактировать с электролитом
2. Электрохимическая коррозия
Электрохимическая коррозия — это разрушение металла путем контакта с раствором электролита для создания электрического тока.
Например: корпус затопленного корабля, канал, проложенный в земле, металл, контактирующий с влажным воздухом … Таким образом, электрохимическая коррозия является наиболее распространенной и наиболее серьезной коррозией металла.
a) Условия электрохимической коррозии: Необходимые и достаточные условия:
— Электроды должны быть разными: это могут быть пары металлов, пары металлов — неметаллы (C), пары металлов — химические соединения (xmentment). Металл с более высоким коэффициентом восстановления — катод.Так что чистые металлы трудно поддаются эрозии.
— Электроды должны контактировать друг с другом (прямо или косвенно через проводник)
— Электроды контактируют с раствором электролита
b) Механизмы электрохимической коррозии: железо или сталь являются сплавами Fe-C, в котором катодами являются кристаллы Fe, электронно-лучевые кристаллы. Эти электроды находятся в прямом контакте друг с другом и с покрытием из жидкого электролита. Таким образом, корродированные объекты являются электрохимическими:
На катоде: атомы Fe окисляются.Эти ионы растворяются в растворе электролита, содержащем некоторое количество кислорода, где они дополнительно окисляются.
На аноде: ионы водорода электролита перемещаются к положительному заряду, где они восстанавливаются до свободного водорода, а затем высвобождаются из раствора.
Кристаллы Fe окисляются извне по очереди. Через некоторое время железо (сталь) вылезет.
c) Природа электрохимической коррозии: окислительно-восстановительный процесс происходит на поверхности электродов.На катоде происходит окисление металла. На положительном электроде восстановление ионного (если раствор электролита кислотный)
3. Сравнение электрохимической коррозии и химической эрозии


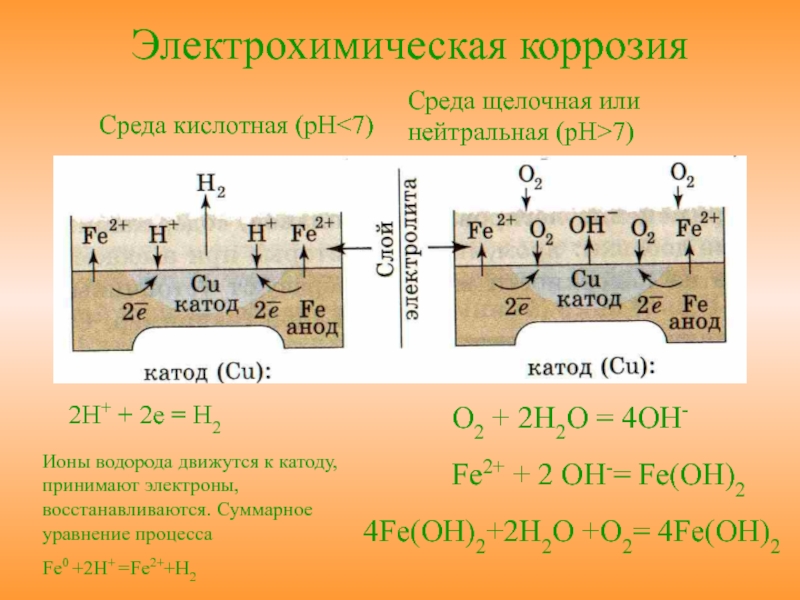

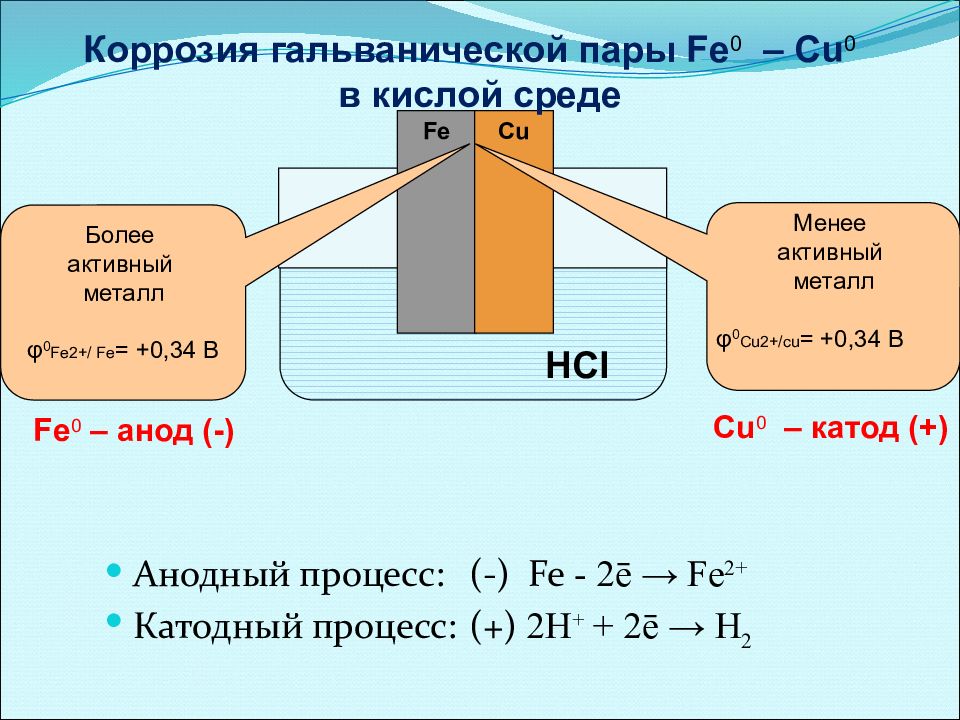
 Металлический путь замыкает контур коррозии.
Металлический путь замыкает контур коррозии. д.
д. Если pH больше 10, коррозия железа очень меньше из-за образования защитного покрытия из водно-оксидов железа.
Если pH больше 10, коррозия железа очень меньше из-за образования защитного покрытия из водно-оксидов железа. Обычно это происходит из-за увеличения конц. Из-за ионов растворенных металлов вблизи электрода или также из-за анодной пассивности. Катодная поляризация снижает катодную реакцию, что затрудняет комбинацию катодного реагента и электрона. Чтобы коррозия продолжалась, и анодная, и катодная реакции должны происходить одновременно, если какая-либо из реакций протекает медленнее, то скорость коррозии ниже.Использование деполяризаторов снижает эффект поляризации, следовательно, скорость реакции коррозии увеличивается.
Обычно это происходит из-за увеличения конц. Из-за ионов растворенных металлов вблизи электрода или также из-за анодной пассивности. Катодная поляризация снижает катодную реакцию, что затрудняет комбинацию катодного реагента и электрона. Чтобы коррозия продолжалась, и анодная, и катодная реакции должны происходить одновременно, если какая-либо из реакций протекает медленнее, то скорость коррозии ниже.Использование деполяризаторов снижает эффект поляризации, следовательно, скорость реакции коррозии увеличивается.
