Электрохимическая коррозия: причины, типы, скорость протекания
Электрохимическая коррозия относится к наиболее часто встречающимся процессам постепенного разрушения металла.
Как мы знаем, наше окружение наполнено электричеством.
В зависимости от среды, меняются показатели проводимости. Не отличается то, что при контакте с такой средой сталь начинает постепенно портиться.
У процесса есть несколько важных отличий.
В первую очередь – неодновременное протекание восстановления окислительного процесса и ионизации атомов металла.
На интенсивность распространения при этом влияет такой параметр, как электродный потенциал металла.
Главная причина электрохимической коррозии в том, что большинство металлов проявляют термодинамическую неустойчивость.
Примеры распространения коррозии такого типа встречаются в воде, почве, на открытом воздухе.
Она часто становится причиной потери прочности и постепенного разрушения металла на днище судов, трубопроводов, опор ЛЭП и других объектов.
Если говорить о типах электрохимической коррозии, то называют 3 разновидности:
- щелевые поражения;
- питтинги;
- межкристаллическое повреждение.
Повреждаться могут разные типы металлов в зависимости от их расположения. Ржавчина появляется при контакте со стоячей и текущей водой, в местах соединения разных металлов, а также на сварных швах.
Какие механизмы отвечают за протекание электрохимической коррозии
Такое повреждение металла проводится двумя механизмами – гомогенным и гетерогенным. Рассмотрим каждый из них подробно.
- Гомогенный. Первоначально затрагивается поверхностный слой металлического изделия. Постепенно металл начинает растворяться под действием актов – катодного или анодного. На протяжении определенного времени происходит миграция катода и анода.
 Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения.
Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения. - Гетерогенный. У большинства твердых металлов не наблюдается гомогенной поверхности. Это связано с тем, что в самом материале состав кристаллической решетки может отличаться. Также как и в описанном выше случае, формируется анодный и катодный процессы, металл начинает постепенно разрушаться.
У такого вида процесса есть несколько особенностей.
В первую очередь – четкое деление на катодный и анодный процесс. Один из основных факторов, влияющих на их скорость протекания относительно друг друга – это время.
Схема электрохимической коррозии
В зависимости от типа металла, коррозия может быть локализована на отдельных участках. Также наблюдается растворение поверхностного слоя на анодах, что позволяет поражению затронуть обширные площади.
Здесь появляется еще одна особенность протекания процесса – формирование гальванических элементов. Это происходит из-за специфики структуры поверхности, на которой присутствуют микроэлектроды.
Из-за чего начинает развиваться коррозия
После того, как мы рассмотрели суть электрохимической коррозии, пришло время обратить внимание на причины распространения коррозии.
Среди них три распространенные:
- Сплав имеет неоднородную структуру. В большинстве сплавов поверхность негомогенная, потому что в кристаллической решетке присутствуют посторонние включения. Ухудшает ситуацию и присутствие пор макро и микротипа. Это приводит к тому, что продукты коррозии также начинают образовываться неравномерно.
- Неоднородная среда, в которой находится металл. Чтобы коррозия протекла быстрее, важен фактор доступа окислителя. Электрохимическая реакция может быть ускорена.
- Отличие физических условий.
 Коррозия усиливается в том случае, если происходит облучение, в среде присутствуют блуждающие тока. Негативно влияет и температура, особенно при перепадах. В таком случае разница между холодными и теплыми местами становится причиной появления анода.
Коррозия усиливается в том случае, если происходит облучение, в среде присутствуют блуждающие тока. Негативно влияет и температура, особенно при перепадах. В таком случае разница между холодными и теплыми местами становится причиной появления анода.
Именно по причине различия в критических факторах, скорость электрохимической коррозии может сильно меняться.
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозийного поражения влияют две группы факторов – внешние и внутренние.
Текущее состояние поверхности металла
Когда поверхность металла неровная, коррозийный процесс протекает намного интенсивнее. Если на поверхности присутствуют небольшие выступы, они начинают накапливать воду.
Это может негативно повлиять на интенсивность распространения.
Чтобы не допустить такого фактора, важно использовать отшлифованный или отполированный металл.
Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности.
Также хорошим средством для уменьшения поражения становится применение пассивирования, а также ряд других способов.
Степень термодинамической стойкости металла
Разные виды материалов отличаются разными показателями термодинамической устойчивости.
Наиболее стойкие разновидности материала не разрушаются при помещении в агрессивную среду.
Чтобы понять, есть ли у металла склонность к коррозии под действием термодинамических факторов, измеряют потенциал анодного и катодного процесса, а также изобарно-изотермического.
Именно такой фактор оказывает большое влияние на потенциальное воздействие среды на постепенное развитие коррозии.
К сожалению, у большинства представленных в продаже марок металлов стойкость невысокая. Есть и неустойчивые разновидности, у которых этот риск нивелируется благодаря склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке располагаются по-разному. Лучше защищены те разновидности, у которых атомы упакованы неплотно.
Особенности решетки также учитывают при планировании защиты материала методом создания на нем специальных пленок. И пленка и сам основной материал должны четко соответствовать по составу друг другу или быть максимально приближенными.
В этом случае исключается появление напряжения, которое негативно отражается на текущем состоянии заготовки. Если контакт с агрессивной средой все-таки происходит, материал начинает разрушаться слой за слоем.
Гетерогенность
Этот фактор рассматривается в непосредственной связи с величиной зерна металла.
Если в сплаве есть выраженные анодные включения, они сильно влияют на ускорение протекания коррозии.
Катодные включения не столь опасны, потому что на интенсивности процесса не отражаются. Величина зерна как фактор риска рассматривается не так часто и этим показателем можно пренебречь.
Не стоит сбрасывать со счетов и механические факторы
Важно понимать, что многие конструкции из металла используются под постоянным напряжением.
К этой категории относится повышенное внутреннее напряжение, когда сильно увеличивается риск деформации.
Негативно влияют на качество металла также воздействие истирания, периодические контакты с другими металлическими изделиями.
Такой фактор оказывает значительное влияние на интенсивность распространения повреждения.
Даже если само сырье первоначально обладало стойкостью к потенциальным повреждениям, в таком случае она уменьшится – формируемые пленки просто не будут закрепляться на поверхности.
Потому лучше сразу исключить это условие электрохимической коррозии – постараться не использовать металлоконструкции под пиковыми сильными нагрузками, не допускать возникновения трения и соприкосновения между собой стальных деталей.
Основные внешние факторы электрохимической коррозии
Кроме внутренних, на металл также влияют и внешние факторы.
Они могут не только ускорять, но и замедлять процесс, а также влиять на характер его протекания.
К ним относятся следующие:
- Температура. Температура сильно влияет на то, как себя ведет металл в разных условиях. От нее сильно зависит то, насколько быстро будут растворяться вторичные продукты коррозии. Среди других особенностей – запуск и стимуляция диффузионных процессов в металле, создание перенапряжения на электродах и другие проявления. Когда металлическое изделие помещается в растворы с кислородной деполяризацией, по мере прогрева электролита диффузия окислителя ускоряется. На фоне этого наблюдается сильное снижение перенапряжения ионизации кислорода.
Если деталь помещается в растворы неокисляющихся кислот, наблюдается коррозия с водородной деполяризацией.
Повышение температуры уменьшает скорость распространения повреждений, потому что сильно снижается перенапряжение водорода.
Отдельно стоит отметить ситуацию, когда металл уже покрывается специальной защитной пленкой. В этом случае сам тип пленки будет влиять на то, как именно она поведет себя при контакте с разными видами внешних угроз, в том числе, с повышением температуры.
Нагрев и охлаждение могут отразиться на состоянии катодов и анодов через их внутренние процессы.
В некоторых случаях полярность электродов значительно меняется.
Как мы уже отмечали выше, проблемы могу возникать из-за того, что разные участки детали нагреты до отличающихся друг от друга температур.
В этом случае стремительно увеличивается количество термогальванических пар, стимулирующих распространение коррозии на новые участки.
- Уровень рН раствора, в который помещен металл. Такой показатель как рН указывает, насколько в растворе будут активными ионы водорода, и как быстро коррозия будет распространяться по материалу.
 Это опасно, потому что может непредсказуемо менять потенциал катодных процессов, формирование окисных пленок. Также создается значительное перенапряжение реакции на электродах. Рекомендуется не допускать контакта металла со средами, у которых показатель рН высокий.
Это опасно, потому что может непредсказуемо менять потенциал катодных процессов, формирование окисных пленок. Также создается значительное перенапряжение реакции на электродах. Рекомендуется не допускать контакта металла со средами, у которых показатель рН высокий.
Если по каким-то причинам металлическая заготовка оказалась помещена в раствор, большое значение будет иметь скорость, с которой он движется, а также само наличие внутренних колебаний.
Заранее определить точное воздействие будет сложно по той причине, что всегда непросто предсказать, как поведут себя нейтральные электролиты.
Cчитается, что при смешении электролита, меняются показатели диффузии кислорода, что значительно отражается на процессе протекания коррозии.
Можно уделять меньше внимания скорости движения электролита в том случае, если вы имеете дело со средами повышенной кислотности.
На них подобное поражение оказывает минимум влияния.
Чем отличаются анодный и катодный процессы
Если вы внимательно проследите за тем, как работает гальванический элемент, то увидите, что в нем протекают сразу два связанных друг с другом процесса – анодный и катодный.
Рассмотрим их более подробно.
Анодный процесс
В химии показывается формулой Fe → Fe2+ + 2e. Она показывает, что постепенно запускается окисление, ионы металла начинают переход в раствор.
Катодный процесс
Может протекать по-разному.
В частности, переизбыток электронов решается ассимиляцией атомами электролита и его молекул. На фоне этого происходит восстановительная реакция непосредственно на самом катоде.
Формула будет зависеть от того, в каких условиях протекает реакция.
Так при наличии водородной деполяризации можно записать процесс как 2 H+ + 2e → h3.
Важно понимать, что оба процесса сильно связаны друг с другом под влиянием кинетического фактора.
С течением времени может происходить взаимное замедление или ускорение анодного или катодного процесса. При этом сам анод всегда будет оставаться тем местом, на котором формируется коррозия металла.
При этом сам анод всегда будет оставаться тем местом, на котором формируется коррозия металла.
Во время анализа протекания процесса коррозии часто обращают внимание на электропроводящие фазы и момент после их соприкосновения.
Обычно одна фаза имеет положительный заряд, в то время как другая – отрицательный. Это приводит к появлению разности потенциалов.
Таким образом возникает ДЭС или как его часто называют ученые – двойной электрический слой с ассиметричным расположением частиц в местах, где фазы разделяются.
Опасным для металла становится скачок потенциалов. Он может стимулироваться двумя центральными причинами:
- Большая накопленная энергия гидратации. В таком случае наблюдается отрыв ионов металла и постепенное перетекание их в раствор. На поверхности в результате остается аналогичное число электронов, заряд становится отрицательным. Далее, в соответствии с законами физики, наблюдается перетекание катионов из раствора, формируется ДЭС на границе, как мы уже описывали выше.
- Разряжение катионов электролита. В результате металл начинает стремительно принимать положительный заряд. ДЭС появляется из-за активности анионов раствора в контакте с катионами электролита.
Что происходит в том случае, если поверхностный слой металла совсем не имеет определенного заряда?
В таком случае ДЭС наблюдаться не будет, возникнет явление нулевого заряда.
Его потенциал будет отличаться в зависимости от того, с каким металлом вам приходится работать.
Описанный процесс значительно отражается на том, как протекает коррозия и как быстро она захватывает все новые и новые участки металла.
В современной науке нет средств, которые могли бы точно измерить величину скачка потенциала, значит и процесс формирования электродвижущей силы оказывается на таким интенсивным.
Если рассматривать вопросы, связанные с процессом поляризации, можно написать отдельную статью на эту тему.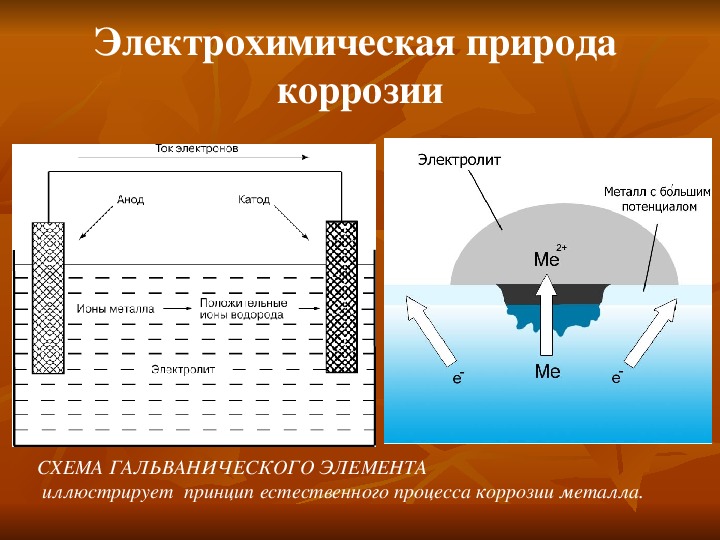
Потому далее мы рассмотрим другой важный показатель – поляризацию.
Поляризация и ее влияние на скорость протекания коррозии
Процесс поляризации связан с интенсивностью распространения электрохимической коррозии.
Этот показатель отражает, насколько сильное перенапряжение наблюдается на определенном участке.
Принято выделять три вида поляризации:
- Электрохимическая. Чаще всего наблюдается в ситуации, когда катодный и анодный процессы начинают замедляться.
- Фазовая. Возникает в том случае, если на поверхности материала формируется новая фаза.
- Концентрационная. Этот процесс появляется в том случае, если есть очень малые показатели скорости отвода продуктов коррозии, а также подхода деполяризатора.
Особенности поляризации также стоит учитывать в том случае, если вы заинтересованы в дополнительной защите металлов от постепенного разрушения.
Обеспечиваем эффективную защиту от коррозии
Наша компания предлагает заказчикам защиту металлоконструкций разных типов от коррозии.
Мы используем методику горячего цинкования.
В пользу работы с нами говорит сразу несколько факторов:
- Опыт работы с 2007 года, есть постоянные заказчики.
- Большие производственные площади. Три цеха для горячего цинкования, мощность 120 тысяч тонн в год.
- Универсальность. Работаем со множеством видов изделий благодаря установленной на предприятии самой глубокой ванны в ЦФО – 3,43 метра.
Мы используем в процессе проверенное европейское оборудование. Даем гарантию соответствия качества товаров требованиям ГОСТ 9.307-89.
Чтобы получить дополнительные консультации и ответы на интересующие вас вопросы, звоните нам или оставляйте заявку на сайте.
Вернуться к статьям
Поделиться статьей
Коррозия металлов и способы защиты от неё
Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.
Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях.Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.
Методы борьбы с коррозией
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция. Наиболее эффективны следующие методы:
Наиболее эффективны следующие методы:
- Нанесение поверхностных атмосферостойких покрытий;
- Поверхностная металлизация;
- Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
- Изменение химического состава окружающей среды.
Механические поверхностные покрытия
Поверхностная защита металла может быть выполнена его окрашиванием либо нанесением поверхностных плёнок, по своему составу нейтральных к воздействию кислорода. В быту, а также при обработке сравнительно больших площадей (главным образом, подземных трубопроводов) применяется окраска. Среди наиболее стойких красок – эмали и краски, содержащие алюминий. В первом случае эффект достигается перекрытием доступа кислороду к стальной поверхности, а во втором – нанесением алюминия на поверхность, который, являясь химически инертным металлом, предохраняет сталь от коррозионного разрушения.
Положительными особенностями данного способа защиты являются лёгкость его реализации и сравнительно небольшие финансовые затраты, поскольку процесс достаточно просто механизируется. Вместе с тем долговечность такого способа защиты невелика, поскольку, не обладая большой степенью сродства с основным металлом, такие покрытия через некоторое время начинают механически разрушаться.
Химические поверхностные покрытия
Коррозионная защита в данном случае происходит вследствие образования на поверхности обрабатываемого металла химической плёнки, состоящей из компонентов, стойких к воздействию кислорода, давлений, температур и влажности. Например, углеродистые стали обрабатывают фосфатированием. Процесс может выполняться как в холодном, так и в горячем состоянии, и заключается в формировании на поверхности металла слоя из фосфатных солей марганца и цинка. Аналогом фосфатированию выступает оксалатирование – процесс обработки металла солями щавелевой кислоты. Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Недостатком данных методов является трудоёмкость и сложность их применения, требующая наличия специального оборудования. Кроме того, конечная поверхность изменяет свой цвет, что не всегда приемлемо по эстетическим соображениям.
Легирование и металлизация
В отличие от предыдущих способов, здесь конечным результатом является образование слоя металла, химически инертного к воздействию кислорода. К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.
Изменение состава окружающей среды
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция. Это может быть вакуумирование (для сравнительно небольших объектов), или работа в среде инертных газов (аргон, неон, ксенон). Данный метод весьма эффективен, однако требует дополнительного оборудования — защитных камер, костюмов для обслуживающего персонала и т.д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них — закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
Урок 9. коррозия металлов и её предупреждение — Химия — 11 класс
Химия, 11 класс
Урок № 9. Коррозия металлов и её предупреждение
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению видов коррозии, особенностям химической и электрохимической коррозии, методам защиты металлических изделий от коррозионного разрушения.
Глоссарий
Анодное покрытие – способ защиты металлического изделия от коррозии, когда защищаемый металл покрывается металлическим покрытием из более активного металла.
Газовая коррозия – разрушение металла в среде агрессивных газов (кислорода, оксида серы, хлороводорода) обычно при высоких температурах.
Гальванокоррозия – вид электрохимической коррозии, при которой два контактирующих металла в среде электролита образуют коррозионный гальванический элемент с возникновением электрического тока между металлами.
Жидкостная коррозия – разрушение металла в жидкостях, не проводящих электрический ток (органические растворители, нефтепродукты).
Ингибиторы – вещества, вводимые в коррозионную среду, в результате чего снижается её окисляющая способность.
Катодная защита – способ защиты металла от коррозии, когда защищаемое металлическое изделие подсоединяется к отрицательному полюсу внешнего источника электрического тока.
Катодное покрытие – способ защиты металла от коррозии, когда металлическое изделие покрывается тонким слоем из менее активного металла.
Коррозия – разрушение металла в результате окислительно-восстановительных реакций между металлом и окружающей средой
Осушение – удаление из окружающей среды влаги для предотвращения возникновения коррозии.
Протекторная защита – способ защиты металла от коррозии, когда к защищаемому металлическому изделию присоединяют кусок другого, более активного металла.
Химическая коррозия – разрушение металла в среде, не проводящей электрический ток.
Электрокоррозия – вид электрохимической коррозии, возникающей в среде электролита под действием внешнего электрического поля.
Электрохимическая коррозия – разрушение металла в среде электролита при контакте двух металлов с образованием коррозионного элемента и возникновением электрического тока.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Коррозия и её виды
Коррозия металлов – процесс разрушения металлического изделия в результате окислительно-восстановительной реакции металла с окружающей средой. В зависимости от механизма различают два вида коррозии: химическую и электрохимическую. Химическая коррозия происходит в среде, не проводящей электрический ток. К этому виду коррозии относится газовая коррозия, в результате которой металл разрушается под действием агрессивных газов: кислорода, оксида серы, хлороводорода. Газовая коррозия обычно происходит при высоких температурах. Другой вид химической коррозии – жидкостная коррозия, которая возникает в агрессивных жидкостях, не проводящих электрический ток, например, в органических растворителях или нефтепродуктах.
В зависимости от механизма различают два вида коррозии: химическую и электрохимическую. Химическая коррозия происходит в среде, не проводящей электрический ток. К этому виду коррозии относится газовая коррозия, в результате которой металл разрушается под действием агрессивных газов: кислорода, оксида серы, хлороводорода. Газовая коррозия обычно происходит при высоких температурах. Другой вид химической коррозии – жидкостная коррозия, которая возникает в агрессивных жидкостях, не проводящих электрический ток, например, в органических растворителях или нефтепродуктах.
Электрохимическая коррозия происходит в среде электролитов, которые хорошо проводят электрический ток. Различают два вида электрохимической коррозии: гальванокоррозия и электрокоррозия. Гальванокоррозия возникает в месте контакта двух металлов, наличия в металле примесей, разной температуры на соседних участках металлов, разной концентрации электролитов в среде, контактирующей с металлом и в случае разной концентрации кислорода на соседних участках металла. Например, в чугуне примеси углерода и карбида железа играют роль катода, на котором происходит восстановление молекулярного кислорода в присутствии паров воды: 2Н2О + О2 + 4е → 4ОН-, а железо становится анодом и окисляется.
Fe0 – 2e → Fe2+. В результате среда становится щелочной, образуется сначала «белая» ржавчина Fe(ОН)2: Fe2+ + 2OH— → Fe(ОН)2↓, которая окисляется кислородом воздуха во влажной среде до трёхвалентного гидроксида железа.
4Fe(ОН)2↓ + 2Н2О + О2 → 4Fe(ОН)3↓, Fe(OH)3 + nh3O → Fe2O3·xh3O (ржавчина).
Если в атмосфере присутствует большое количество кислых газов (СО2, SO2, NO2), то при растворении их в воде образуются кислоты. В кислой среде коррозия идет ещё интенсивнее. В присутствии кислорода на катоде образуется вода, а в бескислородной среде выделяется водород.
На аноде: Fe0 – 2е → Fe2+;
На катоде: О2 + 4Н+ + 4е → 2Н2О
или в бескислородной среде: 2Н+ + 2е → Н20↑.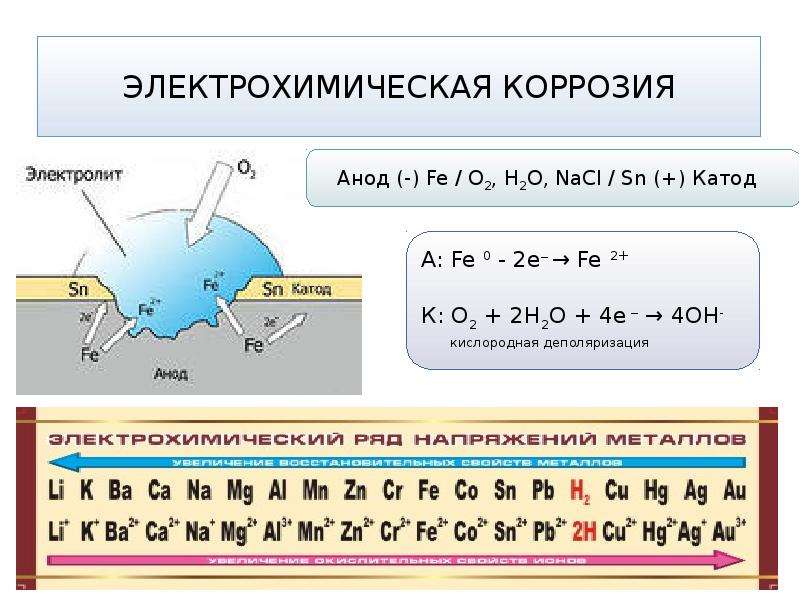
Ионы железа образуют соли с кислотными остатками образовавшихся при растворении газов кислот. В дальнейшем под действием кислорода воздуха, соли двухвалентного железа окисляются до солей трёхвалентного железа.
Электрокоррозия возникает под действием на металл электрического тока от внешнего источника постоянного тока. Часто она происходит под действием блуждающих токов от рельсов электротранспорта, от плохо изолированных опор линий электропередач. Участок, на который попадает ток от внешнего источника, заряжается отрицательно и становится катодом. На нём происходит восстановление элементов среды. А соседний участок становится анодом, на нём металл окисляется.
Факторы, увеличивающие скорость коррозии
Возникновение коррозионного гальванического элемента увеличивает скорость коррозии. При контакте двух металлов более активный металл отдает электроны менее активному. Возникает электрический ток. Активный металл растворяется и в результате реакции со средой, и за счет передачи электронов менее активному металлу. Принятые электроны менее активный металл отдает в окружающую среду, таким образом, окисление активного металла и восстановление компонентов окружающей среды происходит быстрее. Скорость коррозии зависит от количества кислорода, который контактирует с металлом. Железный гвоздь, погруженный в воду на половину своей длины, разрушается быстрее всего, так как доступу кислорода ничего не препятствует. Гвоздь, полностью погруженный в воду, разрушается медленнее, так как количество кислорода, участвующего в реакции, ограничивается скоростью растворения кислорода в воде. В пробирке, где сверху воды налили масло, коррозия идет медленнее всего, так как масло препятствует поступлению кислорода в воду.
Методы защиты металлов от коррозии
Одним из распространённых методов защиты металлов от коррозии является нанесение защитных покрытий. Покрытия бывают металлическими и неметаллическими. Если металлическое изделие покрыто слоем более активного металла, покрытие называют анодным. Если покрытие изготовлено из менее активного металла, оно называется катодным. Неметаллические покрытия – это различные эмали, лаки, краски, резиновые, битумные и полимерные покрытия. По отношению к железу анодными покрытиями будут цинковые, хромовые, алюминиевые покрытия. Эти покрытия защищают металл даже в случае появления царапин или трещин. Так как покрытие изготовлено из более активного металла, оно является анодом по отношению к защищаемому металлу и будет разрушаться. Защищаемое металлическое изделие разрушаться не будет. Катодные покрытия обычно делают из малоактивных металлов. Это никель, олово, свинец, медь, серебро, золото. Из-за низкой активности такие металлы слабо подвергаются воздействию коррозии, но в случае нарушения покрытия, возникнет коррозионный элемент, в котором анодом станет защищаемое металлическое изделие. Оно начнет разрушаться. Защитные оксидные покрытия на поверхности металла можно создать путем химической обработки концентрированной азотной кислотой (пассивация алюминия, хрома), концентрированным раствором щелочи и горячего масла (воронение), фосфорной кислотой и её кислыми солями (фосфатирование).
Если покрытие изготовлено из менее активного металла, оно называется катодным. Неметаллические покрытия – это различные эмали, лаки, краски, резиновые, битумные и полимерные покрытия. По отношению к железу анодными покрытиями будут цинковые, хромовые, алюминиевые покрытия. Эти покрытия защищают металл даже в случае появления царапин или трещин. Так как покрытие изготовлено из более активного металла, оно является анодом по отношению к защищаемому металлу и будет разрушаться. Защищаемое металлическое изделие разрушаться не будет. Катодные покрытия обычно делают из малоактивных металлов. Это никель, олово, свинец, медь, серебро, золото. Из-за низкой активности такие металлы слабо подвергаются воздействию коррозии, но в случае нарушения покрытия, возникнет коррозионный элемент, в котором анодом станет защищаемое металлическое изделие. Оно начнет разрушаться. Защитные оксидные покрытия на поверхности металла можно создать путем химической обработки концентрированной азотной кислотой (пассивация алюминия, хрома), концентрированным раствором щелочи и горячего масла (воронение), фосфорной кислотой и её кислыми солями (фосфатирование).
Эффективным, но дорогим методом защиты металлов от коррозии является введение в сплав антикоррозионных легирующих добавок: хрома, никеля, молибдена, титана. Для повышения стойкости к коррозии в кислой среде в сплав добавляют кремний.
К методам электрохимической защиты относятся протекторная и катодная защита. Протекторная защита предусматривает закрепление на защищаемом изделии пластин из активного металла: цинка, алюминия, магния. Попадая в агрессивную среду, протектор становится анодом, начинает разрушаться, а металлическое изделие, являясь катодом, не разрушается до полного разрушения протектора. Катодная защита производится путём подсоединения защищаемого металлического изделия к отрицательному полюсу внешнего источника постоянного электрического тока. В результате защищаемый металл приобретает отрицательный заряд и становится катодом. В качестве анода используют вспомогательный кусок металла (железный лом, старый рельс), который заземляют.
В качестве анода используют вспомогательный кусок металла (железный лом, старый рельс), который заземляют.
Важным направлением предотвращения коррозии металлов является снижение агрессивности окружающей среды. Для этого проводят осушение почвы, воздуха. В жидкие среды добавляют ингибиторы – вещества, реагирующие с окислительными компонентами среды и снижающие скорость коррозии. Для борьбы с блуждающими токами проводят надёжную изоляцию токопроводящих конструкций, организацию бесстыкового пути.
Предотвращение потерь металла от коррозии позволит не только сберечь тонны металла, но и предотвратить аварии на производстве и транспорте, сберечь человеческие жизни.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Расчёт массы металла, предохраняемого от разрушения за счёт нанесения защитных покрытий
Условие задачи: В результате атмосферной коррозии толщина стального изделия уменьшается на 0,12 мм/год. Потерю какой массы стального изделия плотностью 7750 кг/м3 и площадью 10 м2 можно предотвратить путем нанесения лакокрасочного покрытия, которое сохраняет свои защитные свойства в течение 4 лет? Ответ запишите в виде целого числа в килограммах.
Шаг первый: необходимо перевести скорость коррозии из мм/год в м/год.
Для этого скорость коррозии умножим на 10-3:
0,12·10-3 = 1,2·10-4 (м/год).
Шаг второй: Найдём объём слоя металла, который может быть разрушен коррозией за 1 год. Для этого толщину слоя разрушенного в течение года металла умножим на площадь стального изделия:
1,2·10-4·10 = 1,2·10-3 (м3/год).
Шаг третий: Найдём массу вычисленного объёма металла.
Для этого объём металла умножим на его плотность:
1,2·10-3·7750 = 9,3 (кг/год).
Шаг четвёртый: Найдём массу металла, которая могла бы разрушиться за 4 года. Для этого массу сохранённого за год металла умножим за 4 года:
9,3·4 = 37,2 (кг). Округляем до целого числа, получаем 37 (кг).
Округляем до целого числа, получаем 37 (кг).
Ответ: 37
2. Расчёт массы металла, разрушенного в результате коррозии
Условие задачи: Через железную решётку, предохраняющую от попадания в канализацию крупного мусора, проходит 20 м3 воды в сутки. Содержание кислорода в воде 1 % от объёма воды. Какая масса железа окислится за 6 месяцев использования решётки, если на окисление металла расходуется 60% содержащегося в воде кислорода? Ответ записать в килограммах в виде целого числа.
Шаг первый: найдём объём кислорода, который содержится в 20 м3 воды.
Для этого разделим 20 м3 на 100:
20 : 100 = 0,2 (м3/сутки) = 200 (л/сутки)
Шаг второй: Найдём объём кислорода, который проходит в воде через решётку в течение 6 месяцев.
Для этого объём кислорода, проходящий через решетку в сутки, умножим на 30 дней и на 6 месяцев:
200·30·6 = 36000 (л).
Шаг третий: Найдём объём кислорода, который расходуется на окисление железа. Для этого умножим найденный объём кислорода на 60 и разделим на 100:
(36000·60) : 100 = 21600 (л).
Шаг четвёртый: Запишем уравнение реакции взаимодействия железа с кислородом в нейтральной среде:
2Fe + O2 + 2H2O → 2Fe(OH)2.
Шаг пятый: Найдём массу железа, окисленного 21600 л кислорода.
Для этого составим пропорцию с учётом того, что масса 1 моль железа равна 56 г/моль, а 1 моль газа в нормальных условиях занимает 22,4 л.
2·56 г железа реагирует с 22,4 л кислорода;
х г железа реагирует с 21600 л кислорода.
х = (2·56·21600) : 22,4 = 108000 (г) = 108 кг.
Ответ: 108.
1. Коррозия металлов | Разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой | 1. Для процесса коррозии следует применять термин «коррозионный процесс», а для результата процесса — «коррозионное разрушение». |
2. Под металлом следует понимать объект коррозии, которым может быть металл или металлический сплав | ||
2. Коррозионная среда | Среда, в которой происходит коррозия металла | |
2а. | — | |
2б. Газообразная коррозионная среда | — | |
2в. Окислительная газовая среда | Газовая среда, вызывающая окисление металла | |
2г. Инертная газовая среда | Газообразная среда, не взаимодействующая с металлом | |
3. Корродирующий металл | Металл, подвергающийся коррозии | |
4. Коррозионные потери | Количество металла, превращенного в продукты коррозии за определенное время | |
5. Продукты коррозии | Химические соединения, образующиеся в результате взаимодействия металла и коррозионной среды | При электрохимической коррозии образование продуктов коррозии является результатом анодной и катодной реакций коррозионного процесса |
6. Скорость коррозии | Коррозионные потери единицы поверхности металла в единицу времени | Применим для терминов 1, 30-34 |
7. Скорость проникновения коррозии | Глубина коррозионного разрушения металла в единицу времени | |
8. Коррозионная стойкость | Способность металла сопротивляться коррозионному воздействию среды | Коррозионная стойкость определяется качественно и количественно (скоростью коррозии в данных условиях, группой или баллом стойкости по принятой шкале). |
а) изменением веса металла в результате коррозии, отнесенным к единице поверхности и единице времени; | ||
б) объемом выделившегося водорода (или поглощенного кислорода) в процессе коррозии, отнесенным к единице поверхности и единице времени; | ||
в) уменьшением толщины металла вследствие коррозии, выраженным в линейных единицах и отнесенным к единице времени; | ||
г) изменением какого-либо показателя механических свойств за определенное время коррозионного процесса, выраженным в процентах, или временем до разрушения образца заданных размеров; | ||
д) изменением отражательной способности поверхности металла за определенное время коррозионного процесса, выраженным в процентах; | ||
е) плотностью тока, отвечающей скорости данного коррозионного процесса; | ||
ж) временем до появления первого коррозионного очага на образце заданных размером или числом коррозионных очагов на образце по истечении заданного времени | ||
9. Коррозионностойкий металл | Металл, обладающий высокой коррозионной стойкостью | |
10. Внутренние факторы коррозии | Факторы, влияющие на скорость, вид и распределение коррозии, связанные с природой металла (состав, структура, внутренние напряжения, состояние поверхности) | |
11. | Факторы, влияющие на скорость, вид и распределение коррозии, связанные с составом коррозионной среды и условиями коррозии (температура, давление, скорость движения металла относительно среды и т.д.) | |
12. Коррозионный очаг | Участок поверхности металла, на котором сосредоточен коррозионный процесс | |
13. Критическая влажность | Значение относительной влажности, выше которой наступает быстрое увеличение скорости атмосферной коррозии металла | |
16. Газовая коррозия | Химическая коррозия металла в газах при высоких температурах | Коррозия, протекающая в условиях любого влажного газа, относится к атмосферной коррозии |
17. Атмосферная коррозия | Коррозия металла в атмосфере воздуха | |
18. Коррозия при неполном погружении | Коррозия металла, частично погруженного в жидкую коррозионную среду | |
19. Коррозия по ватерлинии | Коррозия металла вблизи ватерлинии при неполном погружении его в жидкую коррозионную среду | |
20. Коррозия при полном погружении | Коррозия металла, полностью погруженного в жидкую коррозионную среду | |
21. Подводная коррозия | Коррозия металла, полностью погруженного в воду | |
22. | Коррозия металла при переменном погружении его целиком или частично в жидкую коррозионную среду | |
23. Подземная коррозия | Коррозия металла в почвах и грунтах | |
24. Биокоррозия | Коррозия металла под влиянием жизнедеятельности микроорганизмов | |
25. Коррозия внешним током | Электрохимическая коррозия металла под воздействием тока от внешнего источника | |
26. Коррозия блуждающим током | Электрохимическая коррозия металла под воздействием блуждающего тока | |
27. Контактная коррозия | Электрохимическая коррозия, вызванная контактом металлов, имеющих разные стационарные потенциалы в данном электролите | |
28. Коррозия при трении | Разрушение металла, вызываемое одновременным воздействием коррозионной среды и трения | |
29. Фреттинг-коррозия | Коррозия при колебательном перемещении двух поверхностей относительно друг друга в условиях воздействия коррозионной среды | |
30. Сплошная коррозия | Коррозия, охватывающая всю поверхность металла | |
31. Равномерная коррозия | Сплошная коррозия, протекающая с одинаковой скоростью по всей поверхности металла | |
32. | Сплошная коррозия, протекающая с неодинаковой скоростью на различных участках поверхности металла | |
33. Местная коррозия | Коррозия, охватывающая отдельные участки поверхности металла | |
34. Подповерхностная коррозия | Местная коррозия, начинающаяся с поверхности, но преимущественно распространяющаяся под поверхностью металла таким образом, что разрушение и продукты коррозии оказываются сосредоточенными в некоторых областях внутри металла | Обычно начало коррозионного разрушения не обнаруживается макроскопическим обследованием поверхности, но всегда обнаруживается при микроскопическом обследовании |
Подповерхностная коррозия часто вызывает вспучивание металла и его расслоение | ||
35. Точечная коррозия | Местная коррозия металла в виде отдельных точечных поражений | |
Питтинг | ||
36. Коррозия пятнами | Местная коррозия металла в виде отдельных пятен | |
37. Сквозная коррозия | Местная коррозия, вызвавшая разрушение металла насквозь | |
38. Послойная коррозия | Коррозия, распространяющаяся преимущественно в направлении пластической деформации металла | |
39. Нитевидная коррозия | Коррозия, распространяющаяся в виде нитей, преимущественно под неметаллическими защитными покрытиями | |
40. | Коррозия, связанная со структурной неоднородностью металла | |
41. Межкристаллитная коррозия | Коррозия, распространяющаяся по границам кристаллов (зерен) металла | |
Ндп. Интеркристаллитная коррозия | ||
42. Избирательная коррозия | Коррозия, разрушающая одну структурную составляющую или один компонент сплава | |
Ндп. Селективная коррозия | ||
43. Графитизация чугуна | Избирательная коррозия серого литейного чугуна, протекающая вследствие растворения ферритных и перлитных составляющих с образованием относительно мягкой массы графитного скелета без изменения формы | |
44. Обесцинкование | Избирательное растворение латуней, приводящее к обеднению сплава цинком и образованию на поверхности губчатого медного осадка | |
45. Щелевая коррозия | Усиление коррозии в щелях и зазорах между двумя металлами, а также в местах неплотного контакта металла с неметаллическим коррозионно-инертным материалом | |
Ндп. Щелевой эффект | ||
46. Ножевая коррозия | Локализованный вид коррозии металла в зоне сплавления сварных соединений в сильно агрессивных средах | |
47. Коррозионная язва | Местное коррозионное разрушение, имеющее вид отдельной раковины | |
48. | Коррозия металла при одновременном воздействии коррозионной среды и внешних или внутренних механических напряжений растяжения с образованием транскристаллитных или межкристаллитных трещин | |
49. Коррозия под напряжением | Коррозия металла при одновременном воздействии коррозионной среды и постоянных или переменных механических напряжений | |
50. Коррозионная усталость | Понижение предела усталости металла, возникающее при одновременном воздействии циклических растягивающих напряжений и коррозионной среды | |
51. Предел коррозионной усталости | Максимальное механическое напряжение, при котором еще не происходит разрушение металла после одновременного воздействия установленного числа циклов переменной нагрузки и заданных коррозионных условий | |
52. Коррозионная хрупкость | Хрупкость, приобретенная металлом в результате коррозии | Под хрупкостью следует понимать свойство материала разрушаться без заметного поглощения механической энергии в необратимой форме |
56. Коррозионный элемент | Гальванический элемент, возникающий при взаимодействии металла и среды, влияющей на скорость и характер коррозии металла | |
57. Коррозионный макроэлемент | Коррозионный элемент, электроды которого имеют размеры, хорошо различаемые невооруженным глазом | |
58. | Коррозионный элемент, электроды которого могут быть обнаружены лишь при помощи микроскопа (структурные составляющие сплава, включения примесей и др.) | |
59. Коррозионный субмикроэлемент | Коррозионный элемент, электроды которого имеют величину, лежащую за пределами разрешающей способности оптического микроскопа | |
60. Многоэлектродный элемент | Коррозионный элемент, имеющий более двух электродов | |
61. Концентрационный элемент | Коррозионный элемент с электродами из одного и того же металла, возникающий за счет различной концентрации реагирующих веществ у поверхности металла | |
62. Аэрационный элемент | Коррозионный элемент с электродами из одного и того же металла, возникающий за счет большего притока кислорода к одной из частей поверхности металла | |
63. Поляризация | Изменение потенциала электрода в результате протекания тока | |
64. Контролирующий процесс | Процесс, кинетика которого определяет скорость коррозии | |
65. Поляризационный контроль | Ограничение скорости электрохимической коррозии поляризационными явлениями на электродах | |
66. Анодный контроль | Ограничение скорости электрохимической коррозии анодной реакцией | |
67. | Ограничение скорости электрохимической коррозии катодной реакцией | |
68. Омический контроль | Ограничение скорости электрохимической коррозии омическим сопротивлением | |
69. Диффузионный контроль | Ограничение скорости коррозии диффузией исходных или конечных продуктов электродных реакций | |
70. Поляризационная коррозионная диаграмма | Диаграмма зависимости истинных скоростей сопряженных анодной и катодной реакций коррозионного процесса от потенциала | |
71. Коррозионный ток | Скорость электрохимической коррозии, выраженная величиной электрического тока | |
Ндп. Ток саморастворения | ||
72. Максимальный коррозионный ток | Максимально возможное значение коррозионного тока, отвечающее точке пересечения анодной и катодной кривых на поляризационной диаграмме | |
73. Потенциал коррозии | Потенциал металла, установившийся в результате протекания сопряженных анодного и катодного процесса без внешней поляризации | |
74. Поляризационная кривая | Кривая зависимости скорости электродного (анодного или катодного) процесса от потенциала | |
75. Идеальная поляризационная кривая | Кривая зависимости истинной скорости электродного процесса (с учетом скорости саморастворения) от потенциала | |
76. | Кривая зависимости измеряемой скорости электродного процесса от потенциала | |
77. Деполяризация | Уменьшение поляризации электрода | |
78. Водородная деполяризация | Катодная реакция восстановления ионов водорода | |
79. Окислительная деполяризация | Катодная реакция восстановления окисленных частиц среды | |
80. Кислородная деполяризация | Катодная реакция восстановления (ионизации) кислорода | |
81. Разностный эффект | Изменение скорости саморастворения металла при внешней поляризации | |
Ндп. Дифференц-эффект | ||
82. Положительный разностный эффект | Уменьшение скорости саморастворения металла при внешней поляризации | |
83. Отрицательный разностный эффект | Увеличение скорости саморастворения металла при внешней поляризации | |
84. Пассивация | Резкое уменьшение скорости коррозии вследствие торможения анодной реакции ионизации металла при образовании на его поверхности фазовых или адсорбционных слоев | |
85. Пассивное состояние | Состояние относительной высокой коррозионной стойкости, вызванное торможением анодной реакции ионизации металла в определенной области потенциала | |
Пассивность | ||
86. | Сумма всех условий, необходимых для наступления пассивного состояния металла | |
87. Устойчивость пассивного состояния | Способность металла сохранять пассивное состояние при изменении внешних условий | |
88. Анодная пассивность | Пассивность, вызванная анодной поляризацией металла | |
89. Потенциал начала пассивации | Потенциал, соответствующий переходу металла из области активного анодного растворения в область активно-пассивного состояния | |
90. Плотность тока пассивации | Плотность тока анодного растворения металла при потенциале начала пассивации | |
91. Потенциал полной пассивации | Потенциал, соответствующий переходу металла в пассивное состояние | |
92. Плотность тока полной пассивации | Плотность тока анодного растворения металла при потенциале полной пассивации | |
93. Пассивирующее вещество | Вещество, способствующее переходу металла в пассивное состояние в условиях пассивации | |
Пассиватор | ||
94. Активация | Переход металла из пассивного состояния в активное | |
Ндп. Депассивация | ||
95. | Вещество (реагент), способствующее переходу металла из пассивного состояния в активное или затрудняющее наступление пассивности | |
Активатор | ||
96. Перепассивация | Резкое увеличение скорости анодного растворения металла (при смещении потенциала в положительную сторону) вследствие нарушения пассивного состояния | При нарушении пассивного состояния и увеличении скорости растворения металла лишь на отдельных участках поверхности наблюдается пробой пассивной пленки |
97. Потенциал активации | Потенциал, соответствующий переходу металла из пассивного состояния в активное при смещении потенциала к более отрицательным значениям | В большинстве случаев соответствует потенциалу пассивации |
97а. Потенциал питтингообразования | Потенциал, соответствующий возникновению точечной коррозии в результате локального нарушения пассивности металла | |
98. Потенциал перепассивации | Потенциал, соответствующий переходу металла из пассивного состояния в состояние перепассивации | |
99. Ржавчина | Продукты коррозии железа и его сплавов, образующиеся при электрохимической коррозии и состоящие преимущественно из окислов | |
100. Ингибитор коррозии | Вещество, которое при введении в коррозионную среду (в незначительном количестве) заметно снижает скорость коррозии металла | |
101. | Ингибитор, снижающий скорость коррозии металла в кислой среде | |
102. Ингибитор щелочной коррозии | Ингибитор, снижающий скорость коррозии металла в щелочной среде | |
103. Ингибитор коррозии в нейтральных средах | Ингибитор, снижающий скорость коррозии металла в нейтральных средах | |
104. Ингибитор атмосферной коррозии | Ингибитор, снижающий скорость коррозии металлов в атмосферных условиях | |
105. Контактный ингибитор | Ингибитор, действие которого проявляется при искусственном нанесении его на поверхность металла | |
106. Летучий ингибитор | Ингибитор, способный в обычных условиях испаряться и самопроизвольно попадать из газовой фазы на поверхность металла | |
107. Универсальный ингибитор | Ингибитор коррозии, пригодный для защиты черных и цветных металлов | |
108. Анодный ингибитор | Ингибитор, защитное действие которого обусловлено торможением анодной реакции коррозионного процесса | |
109. Катодный ингибитор | Ингибитор, защитное действие которого обусловлено торможением катодной реакции коррозионного процесса | |
110. Анодно-катодный ингибитор | Ингибитор, защитное действие которого обусловлено торможением анодной и катодной реакций коррозионного процесса | |
111. | Вещество, которое при введении в коррозионную среду увеличивает скорость коррозии | |
112. Противокоррозионная защита | Процессы и средства, применяемые для уменьшения или прекращения коррозии металла | |
112а. Ингибирование | Противокоррозионная защита, осуществляемая введением ингибиторов | |
113. Степень защиты | Оценка эффективности выбранного метода защиты от коррозии | |
114. Защитная пленка | Пленка, образующаяся на металле в естественных условиях при его взаимодействии с коррозионной средой или создаваемая искусственно путем химической или электрохимической обработки и затрудняющая протекание процесса коррозии | |
115. Адсорбционный слой | Слой, возникающий на металле в результате адсорбции атомов или молекул окружающей среды и затрудняющий протекание процесса коррозии | |
116. Окисная пленка | Пленка, состоящая преимущественно из окислов металла | |
117. Покрытие | По ГОСТ 9.008-82 | |
117а, 117б (Исключены, Изм. N 2). | ||
118. Электрохимическая защита | Защита металла от коррозии, осуществляемая поляризацией от внешнего источника тока или путем соединения с металлом (протектором), имеющим более отрицательный или более положительный потенциал, чем у защищаемого металла | В зависимости от направления поляризации различают катодную и анодную защиты |
118а. | Потенциал металла, при котором достигается определенная степень защиты | Защитный потенциал может задаваться анодной или катодной поляризацией от внешнего источника или путем соединения с протектором |
119. Протектор | Металл, применяемый для электрохимической защиты и имеющий более отрицательный или более положительный потенциал, чем у защищаемого металла | |
120. Катодная защита | Электрохимическая защита металла, осуществляемая катодной поляризацией от внешнего источника тока или путем соединения с металлом, имеющим более отрицательный потенциал, чем у защищаемого металла | |
121. Анодный протектор | Металл, имеющий более отрицательный потенциал, чем у защищаемого металла | |
122. Анодная защита | Электрохимическая защита металла, способного пассивироваться анодной поляризацией, осуществляемая от внешнего источника тока или посредством соединения с металлом, имеющим более положительный потенциал, чем у защищаемого металла | |
123. Катодный протектор | Металл, имеющий более положительный потенциал, чем у защищаемого металла | |
124-125а | (Исключены, Изм. N 2). | |
126. Неметаллическое изолирующее покрытие | Неметаллическое покрытие, механически изолирующее металл от воздействия коррозионной среды | |
126а. | — | |
127. Грунт | Прилегающий к металлу слой покрытия, обеспечивающий прочность сцепления с металлом и улучшающий защитные свойства покрытия | |
128. Внешний слой покрытия | Слой многослойного покрытия, соприкасающийся с коррозионной средой | |
129-142б (Исключены, Изм. N 2). | ||
143. Ингибитированная бумага | Бумага, содержащая ингибитор и применяемая для защиты металла от атмосферной коррозии | |
144. Защитная смазка | Невысыхающий слой, состоящий из смеси масел с различными добавками, нанесенный на металл и предназначенный для временной защиты металла от коррозии | |
145. Защитная атмосфера | Атмосфера, искусственно создаваемая для защиты металла от газовой коррозии | |
146. Деаэрация | Удаление из коррозионной среды кислорода воздуха | |
146а. (Исключен, Изм. N 2). | ||
146б. Коррозионные испытания | Испытания для определения коррозионной стойкости металла и (или) защитных покрытий | |
147. Лабораторные испытания | Коррозионные испытания металла, проводимые в искусственных условиях | |
148. | Коррозионные испытания металла, проводимые в атмосфере, в море, в почве и т.п. | |
Полевые испытания | ||
149. Эксплуатационные испытания | Коррозионные испытания машин, аппаратов, сооружений и т.п. в эксплуатационных условиях | |
150. Ускоренные испытания | Коррозионные испытания, проводимые в условиях, близких к эксплуатационным, но дающие результаты в более короткий срок | |
151. Водородный показатель коррозии | Объем выделившегося в процессе коррозии водорода, отнесенный к единице поверхности металла и единице времени | |
152. Кислородный показатель коррозии | Объем поглощенного в процессе коррозии кислорода, отнесенный к единице поверхности металла и единице времени | |
153. Шкала коррозионной стойкости | Шкала, предназначенная для качественной и количественной оценки коррозионной стойкости металла в определенных условиях | При оценке коррозии следует пользоваться десятибалльной шкалой коррозионной стойкости металлов (см. ГОСТ 9.908) |
154. Коррозионный балл | Единица шкалы коррозионной стойкости | |
154а. Визуальная оценка коррозионной стойкости | Оценка коррозионной стойкости, осуществляемая внешним осмотром | Визуальная оценка может осуществляться как вооруженным, так и невооруженным глазом |
Визуальная оценка | ||
А | ||
Активация | 94 | |
Активатор | 95 | |
Атмосфера защитная | 145 | |
Б | ||
Балл коррозионный | 154 | |
Биокоррозия | 24 | |
Бумага ингибитированная | 143 | |
В | ||
Вещество активирующее | 95 | |
Вещество пассивирующее | 93 | |
Влажность критическая | 13 | |
Г | ||
Графитизация чугуна | 43 | |
Грунт | 127 | |
Д | ||
Деаэрация | 146 | |
Депассивация Ндп | 94 | |
Деполяризация | 77 | |
Деполяризация водородная | 78 | |
Деполяризация кислородная | 80 | |
Деполяризация окислительная | 79 | |
Диаграмма поляризационная коррозионная | 70 | |
Дифференц-эффект Ндп | 81 | |
Ж | ||
Жаростойкость | 53 | |
З | ||
Защита анодная | 122 | |
Защита катодная | 120 | |
Защита противокоррозионная | 112 | |
Защита электрохимическая | 118 | |
И | ||
Ингибирование | 112а | |
Ингибитор анодный | 108 | |
Ингибитор анодно-катодный | 110 | |
Ингибитор атмосферной коррозии | 104 | |
Ингибитор катодный | 109 | |
Ингибитор кислотной коррозии | 101 | |
Ингибитор контактный | 105 | |
Ингибитор коррозии | 100 | |
Ингибитор коррозии в нейтральных средах | 103 | |
Ингибитор летучий | 106 | |
Ингибитор универсальный | 107 | |
Ингибитор щелочной коррозии | 102 | |
Испытания коррозионные | 146а | |
Испытания лабораторные | 147 | |
Испытания в природных условиях | 148 | |
Испытания полевые | 148 | |
Испытания ускоренные | 150 | |
Испытания эксплуатационные | 149 | |
К | ||
Контроль анодный | 66 | |
Контроль диффузионный | 69 | |
Контроль катодный | 67 | |
Контроль омический | 68 | |
Контроль поляризационный | 65 | |
Коррозия атмосферная | 17 | |
Коррозия блуждающим током | 26 | |
Коррозия внешним током | 25 | |
Коррозия газовая | 16 | |
Коррозия избирательная | 42 | |
Коррозия интеркристаллитная Ндп | 41 | |
Коррозия контактная | 27 | |
Коррозия межкристаллитная | 41 | |
Коррозия местная | 33 | |
Коррозия металлов | 1 | |
Коррозия неравномерная | 32 | |
Коррозия нитевидная | 39 | |
Коррозия ножевая | 46 | |
Коррозия подводная | 21 | |
Коррозия под напряжением | 49 | |
Коррозия подземная | 23 | |
Коррозия подповерхностная | 34 | |
Коррозия по ватерлинии | 19 | |
Коррозия при неполном погружении | 18 | |
Коррозия при переменном погружении | 22 | |
Коррозия при полном погружении | 20 | |
Коррозия при трении | 28 | |
Коррозия послойная | 38 | |
Коррозия пятнами | 36 | |
Коррозия равномерная | 31 | |
Коррозия селективная Ндп | 42 | |
Коррозия сквозная | 37 | |
Коррозия сплошная | 30 | |
Коррозия структурная | 40 | |
Коррозия точечная | 35 | |
Коррозия химическая | 15 | |
Коррозия электрохимическая | 14 | |
Коррозия щелевая | 45 | |
Кривая поляризационная | 74 | |
Кривая поляризационная идеальная | 75 | |
Кривая поляризационная реальная | 76 | |
М | ||
Макроэлемент коррозионный | 57 | |
Металл корродирующий | 3 | |
Металл коррозионностойкий | 9 | |
Микроэлемент коррозионный | 58 | |
О | ||
Обесцинкование | 44 | |
Окалина | 54 | |
Очаг коррозионный | 12 | |
Оценка визуальная | 154а | |
Оценка коррозионной стойкости визуальная | 154а | |
П | ||
Пассиватор | 93 | |
Пассивация | 84 | |
Пассивность | 85 | |
Пассивность анодная | 88 | |
Перепассивация | 96 | |
Питтинг | 35 | |
Пленка защитная | 114 | |
Пленка окисная | 116 | |
Плотность тока пассивации | 90 | |
Плотность тока полной пассивации | 92 | |
Показатель коррозии водородный | 151 | |
Показатель коррозии кислородный | 152 | |
Покрытие защитное | 117 | |
Покрытие защитное полимерное | 126а | |
Покрытие неметаллическое изолирующее | 126 | |
Поляризация | 63 | |
Потенциал активации | 97 | |
Потенциал защитный | 118а | |
Потенциал коррозии | 73 | |
Потенциал начала пассивации | 89 | |
Потенциал перепассивации | 98 | |
Потенциал питтингообразования | 97а | |
Потенциал полной пассивации | 91 | |
Потери коррозионные | 4 | |
Предел коррозионной усталости | 51 | |
Продукты коррозии | 5 | |
Протектор | 119 | |
Протектор анодный | 121 | |
Протектор катодный | 123 | |
Процесс коррозионный | 1* | |
Процесс контролирующий | 64 | |
Р | ||
Разрушение коррозионное | 1* | |
Растрескивание коррозионное | 48 | |
Ржавчина | 99 | |
С | ||
Скорость коррозии | 6 | |
Скорость проникновения коррозии | 7 | |
Слой адсорбционный | 115 | |
Слой покрытия внешний | 128 | |
Слой обезуглероженный | 55 | |
Смазка защитная | 144 | |
Состояние пассивное | 85 | |
Среда газовая инертная | 2г | |
Среда газовая окислительная | 2в | |
Среда коррозионная | 2 | |
Среда коррозионная газообразная | 2б | |
Среда коррозионная жидкая | 2а | |
Стимулятор коррозии | 111 | |
Стойкость коррозионная | 8 | |
Субмикроэлемент коррозионный | 59 | |
Степень защиты | 113 | |
Т | ||
Ток коррозионный | 71 | |
Ток максимальный коррозионный | 72 | |
Ток саморастворения Ндп | 71 | |
У | ||
Условия пассивации | 86 | |
Усталость коррозионная | 50 | |
Устойчивость пассивного состояния | 87 | |
Ф | ||
Факторы коррозии внешние | 11 | |
Факторы коррозии внутренние | 10 | |
Фреттинг-коррозия | 29 | |
Х | ||
Хрупкость коррозионная | 52 | |
Ш | ||
Шкала коррозионной стойкости | 153 | |
Э | ||
Элемент аэрационный | 62 | |
Элемент концентрационный | 61 | |
Элемент коррозионный | 56 | |
Элемент многоэлектродный | 60 | |
Эффект отрицательный разностный | 83 | |
Эффект положительный разностный | 82 | |
Эффект разностный | 81 | |
Эффект щелевой Ндп | 45 | |
Я | ||
Язва коррозионная | 47 | |
Электрохимическая коррозия и ее причины
Электрохимическая
коррозия является самым распространенным видом коррозии. Она возникает в
случаях контакта металла с электролитически проводящей окружающей
средой.
При данном процессе, восстановление окислительного компонента коррозионной среды проходит в отличительное от ионизации атомов металла время и электродный потенциал влияет на их скорость. Первопричина, по которой возникает электрохимическая коррозия металлов — термодинамическая неустойчивость металла в окружающей его среде. Ржавление обивки днища корабля, трубопровода, металлических конструкций в атмосфере — все это частные случаи электрохимической коррозии.
Для борьбы с электрохимической коррозией нужно знать механизм ее работы и причины возникновения. Протекание механизма коррозии может осуществляться по двум вариантам.
Гомогенный:
• Поверхностный слой металла рассматривается как однородный и гомогенный;
• Причина растворения металла заключается в термодинамической возможности протекания анодного или катодного актов;
• Анодные и катодные участки мигрируют по металлической поверхности;
• На скорость коррозии влияет кинетический фактор;
• Однородная поверхность может быть рассмотрена, как предельный случай, реализация которого возможна и в жидких металлах.
Гетерогенный:
• Из-за различных положений атомов в кристаллической решетке твердые металлы имеют негомогенную поверхность;
• Гетерогенность актуальна при наличии инородных включений в сплаве.
Электрохимическая коррозия металлов имеет ряд особенностей: делится на анодный и катодные процессы, кинетически зависящие друг от друга и протекающие одновременно; на некоторых металлических поверхностях коррозия принимает локальных характер; основной металл растворяется на анодах.
Поверхность металла представляет собой множество короткозамкнутых электродов. При контакте с коррозионной средой образуется гальванический элемент, способствующий электрохимическому разрушение.
Существует три основные причины возникновения местного гальванического элемента:
• Неоднородность металлического сплава: наличие микро- и макровключений, микро- и макропор, зерен кристаллов;
• Неоднородность среды: область с ограниченным доступом окислителя выступает анодом по отношению к участку со свободным доступом;
• Неоднородность физических условий: облучение, воздействие температуры и внешних токов.
На нашем заводе вы всегда сможете заказать теплообменники, а так же редуктор вертикальный цилиндрический одноступенчатый.
Производимые предприятием теплообменники и емкости:
Продажи трубопроводной арматуры:
- Задвижки
- Фланцы из нержавейки
- Фланцы сталь 20
- Фланцы стальные плоские
Интересные материалы сайта
Типы и причины коррозии, способы ее предотвращения Блоги по решениям для ходовых и управляющих систем
Предотвращение коррозии — важнейшая задача во многих отраслях промышленности. В отсутствие защитных мер коррозия может оказать пагубное влияние на инфраструктуру, а также безопасность и эффективность бизнеса. Риску подвержен и бюджет компаний: по результатам исследования, проведенного организацией NACE International, ежегодные затраты на борьбу с коррозией составляют 2,5 триллиона долл. США.
С другой стороны, современным инженерам-конструкторам доступно значительно больше инструментов, чем прежде. Более глубокое понимание типов и причин коррозии, усовершенствованные материалы и передовые подходы — все это помогает техническим специалистам предотвращать разрушение металлов и снижать его интенсивность.
В этой публикации представлено краткое содержание новой брошюры Parker о борьбе с коррозией.
Определение коррозии
Коррозия — это процесс, при котором инфраструктура, продукция и детали разрушаются вследствие химической либо электрохимической реакции с окружающей средой.
Основные типы коррозии
Сегодня в разных отраслях промышленности распространены шесть типов коррозии.
• Электрохимическая коррозия, возникающая при контакте двух материалов с разными электрохимическими свойствами (например, сталь и латунь) в агрессивной среде и приводящая к разрушению менее устойчивого материала.
• Точечная коррозия, при которой в металле быстро возникают глубокие и узкие отверстия, в то время как остальная поверхность остается неповрежденной. Обычно это происходит с самопассивирующимися материалами, такими как нержавеющая сталь или сплавы алюминия.
• Равномерная коррозия, которая развивается постепенно на открытой для воздействия поверхности металла, оставляя равномерный слой отложений.
• Щелевая коррозия, охватывающая те участки, где в небольших углублениях (выемках или углах) скапливается жидкость.
• Межкристаллитная коррозия, которая возникает внутри зернистой структуры сплава или рядом с ней и вызывает локальные повреждения.
• Коррозионное растрескивание под напряжением, когда материал подвергается непрерывной или меняющейся нагрузке в агрессивной среде, что приводит к появлению трещин.
Что вызывает коррозию?
Коррозия — результат воздействия ряда различных факторов, характерных для каждой конкретной отрасли. Ниже перечислены распространенные примеры для отдельных отраслей.
• В сфере строительства коррозия часто возникает в ситуациях, когда металлы подвергаются воздействию природных факторов и экстремальных температур.
• Подземные разработки обычно проводят в средах с кислой водой (нередко содержащей хлориды и сульфаты) в сочетании с высокой влажностью и температурой.
• В лесной промышленности коррозия обычно появляется при работе на удаленных участках, когда оборудование паркуют прямо на траве или земле. За ночь там накапливается большое количество воды, которая может вызывать коррозию встроенных механических систем и компонентов.
Условия окружающей среды также влияют на скорость развития и распространение коррозии. При повышенной влажности металлы реагируют друг с другом и разрушаются гораздо быстрее, чем в сухих условиях.
В агрессивных средах обычно присутствуют следующие факторы (отдельно или в различных сочетаниях):
• влажность;
• экстремальные температуры;
• сырые поверхности;
• взвешенные в воздухе частицы;
• соль;
• промышленные смазочные материалы.
Предотвращение коррозии и защита
Инженерам доступен целый ряд методов, которые помогают снизить интенсивность коррозии или предотвратить ее возникновение. Ниже перечислены методы, более подробно описанные в брошюре о борьбе с коррозией.
• Выбор материалов. Ключевую роль играет выбор подходящих материалов с учетом задачи и условий ее выполнения. В агрессивной среде разрушению подвержены все металлы, однако сплавы могут резко отличаться друг от друга по своим показателям. Решающее значение в этом случае имеет баланс между пределом прочности на разрыв и стойкостью к нагреву, воздействию химических веществ и коррозии.
• Совместимость материалов. При разработке продуктов инженеры должны учитывать вероятность соприкосновения потенциально несовместимых материалов. Так, сочетания меди и нержавеющей стали или бронзы и стали могут стать причиной электрохимической коррозии. Для решения этой проблемы следует выбирать совместимые материалы и сплавы либо применять изоляцию, которая позволяет предотвратить образование электрической цепи.
• Защитные покрытия. На некоторые металлы, такие как сталь, железо и алюминий, можно нанести защитное покрытие, устойчивое к коррозии. Чтобы выбрать оптимальную комбинацию металла и покрытия, требуется тщательно проанализировать требования к прочности, надежности, трению, моменту затяжки и коррозионной стойкости.
• Коррозионные испытания. В ходе контролируемых испытаний можно смоделировать различные агрессивные атмосферы, включая распыленную соленую воду, солевой туман, сухость и влажность. Такие испытания обычно проводят с соблюдением очень точных параметров, например моделируют сезонные циклы, чтобы воссоздать реальные погодные условия.
• Системы защиты от коррозии. Эффективная система защиты помогает предприятиям успешно справляться с коррозией. Мониторинг состояния и анализ журналов для учета инцидентов улучшают понимание практических аспектов, связанных с коррозией, а обмен информацией между подразделениями позволяет выявить потенциальную зависимость между капиталовложениями, методами обслуживания и сроком службы активов.
Борьба с коррозией: брошюра
Скачать брошюру
Автор статьи — доктор Филипп Вагенер (Philipp Wagener)
Связанные статьи:
Пыль гораздо вреднее, чем кажется
что это и как с ней бороться
Коррозия — процесс разрушения металла под воздействием влаги, агрессивных веществ, с которым контактирует покрытие или изделие в процессе эксплуатации. Это явление распространено, его можно увидеть дома, на улице и на работе. Когда металл оказывается в щелочной, кислой среде начинается окисление, которое со временем преобразуется в ржавчину. Другими словами, происходит химическая коррозия.
Сегодня поговорим о другом типе коррозии, которая образуется из-за «блуждающих токов». Именно она появляется на кранах, полотенцесушителях и прочем сантехническом оборудовании. Разрушение металла «блуждающими токами» называют электрохимической коррозией.
Этому коррозийному процессу подвержены многие металлы, включая надёжную и долговечную нержавеющую сталь. Под воздействием электромеханического влияния изделие быстро теряет привлекательность, происходит разрушение швов, соединений, стенок металла. В результате возникает угроза аварийных ситуаций, вплоть до серьезных протечек, грозящих соседям снизу затоплением и порчей имущества.
Как определить электрохимическую коррозию
Рассмотрим пример образования признаков электрохимкоррозии на полотенцесушителе.
Оборудование производят из всевозможного сырья. Лучшим вариантом считаются модели из нержавейки, так как эксплуатационный период такого изделия гораздо продолжительней, нежели срок использования аналогов из других металлов. Однако, нержавеющая сталь не всегда способна справиться с агрессивным воздействием электрохимической коррозии.
На начальный процесс разрушения указывают практически незаметные пятна ржавчины, которая образуется на поверхности изделия, далее они добавляют в размерах, а значит — процесс прогрессирует и становится глубже.
Если очистить ржавчину грубым абразивом, то под ней прячется черная точка, говорящая об активном развитии разрушения. Так, ржавчина «поедает» металл снаружи и изнутри, создавая небольшое отверстие. В подобных случаях повреждениям подвергаются все изделие, включая фитинги. Коррозия, как правило, начинает развиваться на слабых участках, которыми являются сварные швы.
Если ржавчина обнаружена на изделии, изготовленном из стали высокого класса, то наверняка проблема заключается в наличии в воде электричества.
Электрохимкоррозия работает при поддержке «помощников», например, хлора, который используется предприятиями для обеззараживания воды, окислителя кислорода, солей кальция, магния и прочие вещества. Ржавчина активно распространяется под воздействием горячей воды — если жидкость внутри трубы нагревается свыше 70°С, разрушающее действие ускоряется.
Почему появляется коррозия?
Чтобы понимать всю схему появления ржавчины на сантехническом оборудовании, стоит знать, откуда в воде появляется электричество.
Среди причин:
- Если дом относится к старым постройкам, в нем может быть нереализованным качественное заземление, которое обязательно, если в квартире установлено множество бытовых приборов и современная сантехника, например, ванна с гидромассажем, водонагреватели и пр. Заземление обеспечивает безопасность использования техники.
При эксплуатации оборудования, которое имеет те или иные дефекты, происходит утечка токов, которые отправляются в стояки и взаимодействуют с водой. Таким образом появляются точечные «пробои», которые провоцируют образование ржавчины.
Если заземление выполнено в соответствии с нормативами, подобные неприятности не появятся.
- Если в доме проживают любители сэкономить на оплате коммунальных счетов за электроэнергию, появляется проблема электрохимической коррозии. Так, недобросовестные жильцы используют стояк как нулевой провод или же применяют специальные приборы, чтобы «скрутить» показатели счетчика электроэнергии. В результате этих и других манипуляций высоки риски образования коррозийных процессов. Также ситуация небезопасна для жизни — при прикосновении к трубе существует риск удара током.
- Разница потенциалов между металлами провоцирует образование неприятности. Токи возникают, если два разных металла плотно контактируют друг с другом. Если проектирование дома выполнено с соблюдением норм и стандартов, подобной проблемы возникнуть не должно, ведь токопроводящие компоненты подвергаются заземлению. Защитные меры способствуют уравниванию потенциалов.
- Сегодня широко распространены новые материалы, используемые для изготовления труб и сантехнического оборудования: металлопластик, полиэтилен и пр. Вместе с этим появились и новые проблемы. Так, если при замене части трубы применяется пластиковый аналог, может образоваться разница потенциалов, способствующая появлению «блуждающих токов». Несмотря на то, что пластик относится к группе диэлектриков, он находится в водной среде, которая становится проводником — появление ржавчины в этом случае практически неизбежно.
- Образованию токов подвержены не только стояки, но и коммуникации, находящиеся под землей. Блуждающее электричество, находящееся в них, может попасть и в квартиру. На подземные системы оказывают воздействие электрический транспорт (трамвай, троллейбус, поезда метро). Появляются токи утечки, а устранить проблему смогут только эксплуатирующие компании, обязанные проводить тщательные проверки.
- Проблемы нередко возникают, если невдалеке от труб, отвечающих за подачу воды и отопление, присутствует электропроводка с некачественной изоляцией. Повреждения провоцируют появление токов, которые блуждают по трубам водоснабжения.
- Среди причин коррозии — статическое электричество, накапливающееся на металле при контакте с водой.
Произвести контроль над соответствием рекомендованных норм и соблюдением правил монтажа и использования оборудования в высотном доме не представляется возможным. Зачастую подобные работы выполняют мастера без опыта или с его минимальным наличием.
Как следствие — аварийные ситуации и неприятные последствия для жильцов дома. Если полотенцесушитель подвергается коррозии, вы можете не иметь к этому отношения, а также не приостановите процесс из-за разрушения инженерного оборудования по причинам, независящим от вас.
Как предотвратить электрохимическую коррозию
Существует несколько мер, которые помогут предотвратить разрушение металла:
- Приобретая полотенцесушитель, откажитесь от его установки. Работу стоит доверить опытным мастерам, которые имеют допуск к проведению подобных мероприятий.
- Конструкции в обязательном порядке нуждается в заземлении, что особенно актуально для тех, кто врезал пластиковые трубы, расположенные между общим стояком и полотенцесушителем.
Для заземления оборудования можно предпринять несколько вариантов:
- Если стояк и его элементы изготовлены из металла, необходимо соединить стояк, например, с помощью хомута и медного провода, сечение которого не меньше 4 мм2. Затем от стояка горячего водоснабжения подключаются проводом к PE-шине и электрическому щиту, находящемуся на этаже. Для обеспечения полной безопасности при эксплуатации полотенцесушителя проводят заземления других токопроводящих объектов, включая ванны, изготовленные из нержавеющей стали и чугуна.
- Когда стояк и его компоненты изготовлены из полимеров, необходимо установить металлическую вставку, отвечающую диаметру трубы. Деталь вставляют между соединением полотенцесушителя и шаровым краном. На вставку монтируют зажим заземления. Используя провод из меди, подключаются к электрощиту.
- В случае, когда стояк состоит из пластиковых и металлических элементов, устанавливают вставку из металла между монтируемым оборудованием и шаровым краном. На нее крепят зажим и посредством медного кабеля подключаются к щиту.
- Еще одно решение задачи — установка системы для уравнивания потенциалов. Монтаж выполняют непосредственно в ванной. Такой шаг позволит избежать коррозии, а также минимизирует риски, связанные с ударом тока. Если за систему водоснабжения отвечают трубы из полимеров, то к ближайшему электрощиту также выполняются подключение заземляющих повод.
- В продаже представлено множество моделей полотенцесушителей. Эксперты рекомендуют не приобретать слишком дешевые конструкции. Для безопасной и длительной эксплуатации стоит обратить внимание на оборудование, снабженное защитой от «блуждающих токов». Полотенцесушители работают на базе полимера, которым обрабатывают внутреннюю часть трубы. Он ликвидирует контакт воды с металлом.
- Полимер полностью безопасен, так как не содержит вредных веществ, способных навредить человеку. Он не боится чрезмерно высокой температуры, не подвержен разрушению. Стоимость подобной продукции немногим выше стандартных изделий, при этом срок службы превышает период работы аналогов в несколько раз.
- Электрическая коррозия устраняется также заменой оборудования на электрическое. В этом случае нагрев полотенцесушителя начинается при подключении устройства к розетке. Как правило, на корпусе присутствует кнопка, позволяющая включать или отключать его. Это хорошее решение для многих людей, ищущих безопасный и долговечный вариант. Прибор функционирует автономно, не зависит от работоспособности системы водоснабжения, а значит — вы сможет прогреть помещение и высушить вещи даже в том случае, если горячей воды в кране нет. Минус прибора — потребление электроэнергии, за которую придется платить.
Важно! Если выбор пал на электрическое оборудование, следует знать, что оно имеет невысокую мощность, поэтому может работать от стационарного источника питания — розетки. Однако, учитывайте, что прибор работает в ванной, где преобладает высокая влажность, а значит его подключение должно проводиться через УЗО и автомат.
Мы попытались рассказать все самое важное об электрохимической коррозии и методах ее предотвращения/устранения. Вероятно, вы не столкнетесь с подобной проблемой, но, если она уже обнаружена, лучше сразу заявить о неприятности инженеру управляющей компании.
Специалист должен рассказать, какие меры стоит предпринять, какое оборудование станет оптимальным вариантом для вашей ванной комнаты. После установки инженер выполнит проверку полотенцесушителя на предмет герметичности, а также подпишет акт ввода прибора в эксплуатации.
Монтаж полотенцесушителя желательно поручить опытному мастеру, ведь от корректности установки во многом зависит долговечность прибора, а также безопасность и комфорт пользователей.
16.8: Электрохимическая коррозия — Chemistry LibreTexts
Цели обучения
Убедитесь, что вы полностью понимаете следующие важные идеи. Особенно важно, чтобы вы знали точное значение всех выделенных терминов в контексте этой темы.
- Электрохимическая коррозия металлов происходит, когда электроны от атомов на поверхности металла переносятся на подходящий акцептор электронов или деполяризатор . Должна присутствовать вода, чтобы служить средой для переноса ионов.
- Наиболее распространенными деполяризаторами являются кислород, кислоты и катионы менее активных металлов.
- Поскольку электроны проходят через сам металлический объект, анодная и катодная области (две половины электрохимической ячейки) могут находиться на значительном расстоянии друг от друга.
- Анодные области имеют тенденцию развиваться в местах, где металл подвергается напряжению или защищен от кислорода.
- Контакт с другим металлом, прямой или косвенный, может привести к коррозии более активного металла.
- Коррозию стали можно предотвратить путем цинкования , то есть путем покрытия ее цинком, более активным металлом, растворение которого оставляет на металле отрицательный заряд, который препятствует дальнейшему растворению Fe 2+ .
- Катодная защита с использованием внешнего источника напряжения широко используется для защиты подземных сооружений, таких как резервуары, трубопроводы и опоры. Источником может быть расходуемый анод из цинка или алюминия, либо сетевой или фотоэлектрический источник питания.
Коррозию можно определить как разрушение материалов химическими процессами. Из них наиболее важной на сегодняшний день является электрохимическая коррозия металлов, в которой процесс окисления M → M + + e — облегчается наличием подходящего акцептора электронов, иногда называемого в коррозионной науке как . деполяризатор.
В некотором смысле коррозию можно рассматривать как самопроизвольное возвращение металлов в свои руды; Огромное количество энергии, затраченной на добычу, очистку и производство металлов в полезные объекты, рассеивается множеством различных маршрутов.Экономические аспекты коррозии намного важнее, чем думает большинство людей; ориентировочная стоимость коррозии только в США составила 276 миллиардов долларов в год. Из этой суммы около 121 миллиарда долларов было потрачено на борьбу с коррозией, а разница в 155 миллиардов долларов осталась чистой убытком для экономики. Коммунальные предприятия, особенно системы питьевого водоснабжения и канализации, несут наибольший экономический ущерб, за которыми следуют автомобили и транспорт.
Ячейки коррозии и реакции
Особенностью большинства процессов коррозии является то, что стадии окисления и восстановления происходят в разных местах металла. {-}} \ label {1.{-}} \ rightarrow \ ce {M (s)} \ label {1.7.2c} \]
где \ (\ ce {M} \) — металл.
Какие части металла служат анодами и катодами, может зависеть от многих факторов, как видно из обычно наблюдаемых нерегулярных структур коррозии. Атомы в областях, которые подверглись напряжению, которое может быть получено при формовании или механической обработке, часто имеют более высокую свободную энергию и, следовательно, имеют тенденцию становиться анодными.
Рисунок \ (\ PageIndex {2} \): Принципиальная схема ячеек коррозии железа.(CC BY-NSA-NC; анонимно по запросу)
Если одна часть металлического объекта защищена от атмосферы так, что \ (\ ce {O2} \) недостаточно для создания или поддержания оксидной пленки, это «защищает «регион часто будет местом, где коррозия наиболее активна. Тот факт, что такие участки обычно скрыты от глаз, во многом объясняет сложность обнаружения и контроля коррозии.
Рисунок \ (\ PageIndex {3} \): Точечная коррозия Большинство металлов покрыто тонкой оксидной пленкой, которая препятствует анодному растворению.Когда происходит коррозия, иногда в металле образовывается узкое отверстие или ямка. Дно этих ям, как правило, лишено кислорода, что способствует дальнейшему врастанию ямы в металл. (CC BY 3.0 Unported; Стивен Лоуэр)
В отличие от анодных участков, которые, как правило, локализуются в определенных областях поверхности, катодная часть процесса может происходить практически где угодно. Поскольку оксиды металлов обычно являются полупроводниками, большинство оксидных покрытий не препятствуют потоку электронов к поверхности, поэтому почти любая область, которая подвергается воздействию \ (\ ce {O2} \) или какого-либо другого акцептора электронов, может действовать как катод.Склонность участков, лишенных кислорода, становиться анодными, является причиной многих часто наблюдаемых видов коррозии.
Ржавые пятна от автомобилей и ванных комнат
Любой, кто владел старым автомобилем, видел коррозию на стыках между частями кузова и под пленкой краски. {-}}.\]
Метод защиты 1: Жертвенные покрытия
Один из способов обеспечения этого отрицательного заряда — нанесение покрытия из более активного металла. Таким образом, очень распространенный способ защиты стали от коррозии — покрытие ее тонким слоем цинка; Этот процесс известен как цинкование. Цинковое покрытие, которое менее благородно, чем железо, имеет тенденцию к избирательной коррозии. Растворение этого жертвенного покрытия оставляет после себя электроны, которые концентрируются в железе, делая его катодным и, таким образом, препятствуя его растворению.
Рисунок \ (\ PageIndex {5} \): Жертвенные покрытия (CC BY 3.0 Unported; Стивен Лоуэр)
Эффект покрытия железа менее активным металлом обеспечивает интересный контраст. Обычная луженая банка (справа) — хороший тому пример. Пока оловянное покрытие остается неповрежденным, все в порядке, но воздействие влажной атмосферы даже на крошечную часть лежащего под ним железа вызывает коррозию. Электроны, высвобождаемые из железа, перетекают в олово, делая его более анодным, поэтому теперь олово активно способствует коррозии железа! Вы, наверное, наблюдали, как жестяные банки очень быстро разрушаются, когда их оставляют на открытом воздухе.
Метод защиты 2: катодная защита
Более сложная стратегия заключается в поддержании постоянного отрицательного электрического заряда на металле, чтобы предотвратить его растворение в виде положительных ионов. Поскольку вся поверхность приводится в катодное состояние, этот метод известен как катодная защита . Источником электронов может быть внешний источник постоянного тока (обычно используемый для защиты нефтепроводов и других подземных сооружений), или это может быть коррозия другого, более активного металла, такого как кусок цинка или алюминия, закопанный в землю поблизости. , как показано на иллюстрации подземного резервуара для хранения пропана ниже.
Рисунок \ (\ PageIndex {6} \): Катодная защита (CC BY 3.0, без порта; Стивен Лоуэр)
Что такое коррозия?
Консервационная инфраструктура
Способность электрохимических процессов расщеплять соединения на элементы или создавать новые соединения может быть как разрушительной, так и продуктивной. Коррозия — это очень распространенный результат электрохимических реакций между материалами и веществами в окружающей их среде.
Коррозия — одно из самых разрушительных и дорогостоящих природных явлений, наблюдаемых сегодня.
Что такое коррозия?
Коррозия — опасная и чрезвычайно дорогостоящая проблема. Из-за этого могут обрушиться здания и мосты, прорвутся нефтепроводы, протечка химических заводов и затопление ванных комнат. Корродированные электрические контакты могут вызвать возгорание и другие проблемы, корродированные медицинские имплантаты могут привести к заражению крови, а загрязнение воздуха вызвало коррозию произведений искусства по всему миру. Коррозия угрожает безопасному удалению радиоактивных отходов, которые должны храниться в контейнерах в течение десятков тысяч лет.
Наиболее распространенные виды коррозии возникают в результате электрохимических реакций. Общая коррозия возникает, когда большинство или все атомы на одной и той же металлической поверхности окисляются, повреждая всю поверхность. Большинство металлов легко окисляются: они склонны терять электроны из-за кислорода (и других веществ) в воздухе или в воде. Когда кислород восстанавливается (приобретает электроны), он образует оксид с металлом.
Процесс восстановления и окисления различных металлов, контактирующих друг с другом, называется гальванической коррозией.При электролитической коррозии, которая чаще всего возникает в электронном оборудовании, вода или другая влага попадает в ловушку между двумя электрическими контактами, между которыми прикладывается электрическое напряжение. Результат — непредусмотренная электролитическая ячейка.
Возьмите металлическую конструкцию, такую как Статуя Свободы. Он выглядит прочным и стойким. Однако, как почти все металлические предметы, он может стать нестабильным, поскольку вступает в реакцию с веществами в окружающей среде и портится. Иногда эта коррозия безвредна или даже полезна: зеленоватая патина, покрывающая медную кожу статуи, защищает находящийся под ней металл от погодных повреждений.Однако внутри статуи коррозия за эти годы нанесла серьезный ущерб. Его железный каркас и медная обшивка действовали как электроды огромного гальванического элемента, так что почти половина каркаса заржавела к 1986 году, к столетнему юбилею статуи.
Естественная защита
Некоторые металлы приобретают естественную пассивность или устойчивость к коррозии. Это происходит, когда металл вступает в реакцию с кислородом воздуха или разъедает его. В результате получается тонкая оксидная пленка, которая блокирует склонность металла к дальнейшим реакциям.Примерами этого являются патина, образующаяся на меди, и выветривание некоторых скульптурных материалов. Защита не работает, если тонкая пленка повреждена или разрушена структурным напряжением — например, мостом — или царапинами или царапинами. В таких случаях материал может повторно пассивироваться, но если это невозможно, только части объекта подвергаются коррозии. Тогда ущерб часто еще больше, потому что он сосредоточен в этих местах.
Вредную коррозию можно предотвратить множеством способов. Электрические токи могут образовывать пассивные пленки на металлах, которые обычно не имеют их.Некоторые металлы более стабильны в определенных средах, чем другие, и ученые изобрели сплавы, такие как нержавеющая сталь, для улучшения характеристик в определенных условиях. Некоторые металлы можно обрабатывать лазером, чтобы придать им некристаллическую структуру, устойчивую к коррозии. При гальванике железо или сталь покрывают более активным цинком; это образует гальванический элемент, в котором коррозирует цинк, а не железо. Другие металлы защищены гальваническим покрытием инертным или пассивирующим металлом.Неметаллические покрытия — пластмассы, краски и масла — также могут предотвратить коррозию.
Chem1 Электрохимическая коррозия
Вероятно, нет электрохимического процесса, который был бы более широко распространенным, приводил бы к большим экономическим потерям и был бы более скрыт от глаз, чем коррозия металлов. И все же на вводных курсах химии о нем редко упоминается больше, чем вкратце. Этот урок пытается помочь преодолеть этот недостаток.
Коррозию можно определить как разрушение материалов химическими процессами.Из них наиболее важной на сегодняшний день является электрохимическая коррозия металлов, в которой процесс окисления M → M n + + n e n — облегчается наличием подходящего акцептора электронов, в коррозионной науке иногда называют деполяризатором .
В некотором смысле коррозию можно рассматривать как самопроизвольное возвращение металлов в свои руды; Огромное количество энергии, затраченной на добычу, очистку и производство металлов в полезные объекты, рассеивается множеством различных маршрутов.
Хороший справочник по этой теме: Corosion and Corrosion Control: An Introduction to Corrosion Science and Engineering (4 Ed), R.W. Revie and H.H. Uhlig. Ограниченные ее части можно увидеть на этом сайте Google Книг.
Экономические аспекты коррозии намного важнее, чем думает большинство людей; Согласно отчету 2001 года, стоимость коррозии только в США составила 276 миллиардов долларов в год. Из этой суммы около 121 миллиарда долларов было потрачено на борьбу с коррозией, а разница в 155 миллиардов долларов осталась чистой убытком для экономики.Коммунальные предприятия, особенно системы питьевого водоснабжения и канализации, несут наибольший экономический ущерб.
на втором месте — автомобили и транспорт.
На этом изображении показана внутренняя часть торгового центра Algo Center в Эллиот-Лейк, Онтарио после того, как в июне 2012 года часть парковочной площадки на крыше обрушилась на первый этаж, в результате чего погибли два человека. Основной причиной обрушения этого и очень большого количества других парковочных сооружений в холодном климате было попадание дорожной соли в настил, что привело к электрохимической коррозии стальных арматурных стержней, встроенных в бетон.Однако, настоящая причина была человеческая неудача ; Проблемы с утечкой через настил крыши возникали почти с момента постройки конструкции в 1970-х годах, но стоимость надлежащей обработки этих утечек (например, нанесение защитного покрытия на палубу) удерживала владельцев торговых центров от таких инвестиций. (Подробнее здесь)
1 Ячейки коррозии и реакции
Особенностью большинства процессов коррозии является то, что стадии окисления и восстановления происходят в разных местах металла.Это возможно, потому что металлы являются проводящими, поэтому электроны могут течь через металл от анодной области к катодной. Присутствие воды необходимо для переноса ионов к металлу и от него, но может быть достаточно тонкой пленки адсорбированной влаги.
Коррозионная система может рассматриваться как короткозамкнутый электрохимический элемент, в котором анодный процесс представляет собой что-то вроде
Fe (т.) → Fe 2+ (водн.) + 2 e —
, а катодные ступени могут быть любыми из
.
O 2 + 2 H 2 O + 4 e — → 4 OH —
H + + e — → ½ H 2 (г)
M 2+ + 2 e — → M (с)
где М — металл.
Коррозия часто начинается в месте ( 1 ), где металл находится под напряжением (на изгибе или сварке) или изолирован от воздуха (где два куска металла соединены или находятся под неплотно приставшей пленкой краски). ионы металлов растворяются в пленке влаги, а электроны мигрируют в другое место ( 2 ), где они захватываются деполяризатором . Кислород — самый распространенный деполяризатор; образующиеся гидроксид-ионы реагируют с Fe 2+ с образованием смеси водных оксидов железа, известной как ржавчина .
Какие части металла служат анодами и катодами, может зависеть от многих факторов, как видно из обычно наблюдаемых нерегулярных структур коррозии. Атомы в областях, которые подверглись напряжению, которое может быть получено при формовании или механической обработке, часто имеют более высокую свободную энергию и, следовательно, имеют тенденцию становиться анодными.
[ссылка]
Если одна часть металлического объекта защищена от атмосферы так, что O 2 недостаточно для создания или поддержания оксидной пленки, эта «защищенная» область часто будет местом, на котором коррозия наиболее активна.Тот факт, что такие участки обычно скрыты от глаз, во многом объясняет сложность обнаружения и контроля коррозии.
Большинство металлов покрыто тонкой оксидной пленкой, препятствующей анодному растворению. Когда происходит коррозия, иногда в металле появляется узкое отверстие или углубление или . Дно этих ям, как правило, лишено кислорода, что способствует дальнейшему врастанию ямы в металл.
Тенденция к анодированию мест, лишенных кислорода, является причиной многих часто наблюдаемых структур коррозии
В отличие от анодных участков, которые обычно локализуются в определенных областях поверхности, катодная часть процесса может происходить практически где угодно.Поскольку оксиды металлов обычно являются полупроводниками, большинство оксидных покрытий не препятствуют потоку электронов к поверхности, поэтому почти любая область, которая подвергается воздействию O 2 или какого-либо другого акцептора электронов, может действовать как катод.
Ржавые пятна от автомобилей и ванных комнат
Любой, кто владел старым автомобилем, видел коррозию на стыках между частями кузова и под пленкой краски. Вы также заметили, что как только начинается коррозия, она начинает питаться сама собой.Одна из причин этого заключается в том, что одним из продуктов реакции восстановления O 2 является ион гидроксида. Высокий pH, возникающий в этих катодных областях, имеет тенденцию разрушать защитную оксидную пленку и может даже смягчить или ослабить пленки краски, так что эти участки могут стать анодными. Большее количество электронов способствует более интенсивному катодному действию, которое порождает еще больше анодных участков и т. Д.
Очень распространенной причиной коррозии является контакт двух разнородных металлов, что может произойти рядом с крепежным элементом или в сварном шве.Влага собирается в точке соединения, действуя как электролит и образуя ячейку, в которой два металла служат электродами. Влага и проводящие соли на внешних поверхностях обеспечивают внешний токопроводящий путь, эффективно замыкая элемент накоротко и вызывая очень быструю коррозию; Вот почему автомобили так быстро ржавеют в местах, где на дорогах кладут соль для растапливания льда.
Коррозия разнородных металлов может произойти, даже если два металла изначально не находятся в прямом контакте.Например, в домах, где для водопровода используются медные трубы, в воде всегда присутствует небольшое количество растворенного Cu 2+ . Когда эта вода сталкивается со стальными трубами или сливом для раковины, покрытым хромом e-, благородная медь more- откладывается на другом металле, образуя новую коррозионную ячейку, контактирующую с металлами. В случае хромированной фурнитуры для раковины это приводит к образованию солей Cr 3+ , которые выпадают в осадок в виде зеленоватых пятен.
2 Контроль коррозии
Поскольку для возникновения коррозии должны иметь место как катодный, так и анодный этапы, предотвращение любого из них остановит коррозию. Наиболее очевидная стратегия — остановить оба процесса, нанеся на объект краску или другое защитное покрытие. Даже если это будет сделано, вероятно, останутся места, где покрытие сломано или не проникает, особенно если есть отверстия или резьба.
Более сложный подход состоит в том, чтобы приложить к металлу небольшой отрицательный заряд, тем самым затрудняя протекание реакции M → M 2+ + 2 e — .
Как защитные покрытия контролируют коррозию
Один из способов обеспечения этого отрицательного заряда — нанесение покрытия из более активного металла. Таким образом, очень распространенный способ защиты стали от коррозии — покрытие ее тонким слоем цинка; этот процесс известен как цинкование.Цинковое покрытие, менее благородное, чем железо, склонно к избирательной коррозии. Растворение этого жертвенного покрытия оставляет после себя электроны, которые концентрируются в железе, делая его катодным и, таким образом, препятствуя его растворению.
видео по электрохимической коррозии:
Химия ржавчины и коррозии (Джейсон Гуди, 12½ м)
Инфраструктурная коррозия и разложение (Геоканал, 43 м)
Эффект покрытия железа менее активным металлом обеспечивает интересный контраст.Обычная луженая банка (справа) — хороший тому пример. Пока оловянное покрытие остается неповрежденным, все в порядке, но воздействие влажной атмосферы даже на крошечную часть лежащего под ним железа вызывает коррозию. Электроны, высвобождаемые из железа, перетекают в олово, делая его более анодным, поэтому теперь олово активно способствует коррозии железа! Вы, наверное, наблюдали, как жестяные банки очень быстро разрушаются, когда их оставляют на открытом воздухе.
Катодная защита для контроля коррозии
Более изощренная стратегия — поддерживать постоянное отрицательное
электрический заряд на металле, так что его растворение в виде положительных ионов
заблокирован.Поскольку вся поверхность вдавливается в катодный
Состояние этот метод известен как катодная защита .
Источником электронов может быть внешний источник питания постоянного тока.
(обычно используется для защиты нефтепроводов и других подземных сооружений),
или это может быть коррозия другого, просто кусок более активного металла, такого как цинк или алюминий, закопанный в земле поблизости.
3 Галерея ужасов коррозии
Коррозия гвоздя
Ногти погружают в агар, который образует влажный твердый гель.Агар также содержит фенолфталеин и гексацианоирон (III).
Fe (CN6) — образует темно-синий цвет («берлинскую лазурь») в присутствии Fe2 +. Синие цвета явно связаны с теми частями ногтя, которые подверглись нагрузке, что способствует анодному высвобождению Fe2 + из металла. Розовым цветом показаны катодные области, которые стали щелочными в результате реакции.
O2 + 2 h3O + 4e– → 4 OH–
Это ясно показывает разделение анодного и катодного процессов при коррозии.
Внутренняя часть водопровода 4>
Если вы живете в старой части города, где возрасту 50-100 лет, вода, которую вы пьете, вполне могла пройти через трубу в таком состоянии! Подобная сильная коррозия чаще встречается в районах с кислой водой. Такая вода поступает из горных снеготаяний и сточных вод и обычно приобретает кислотность за счет растворенного в атмосфере углекислого газа.
Воды из рек, озер и особенно подземные воды из колодцев обычно достаточно долго находились в контакте с карбонатсодержащими отложениями, чтобы их нейтрализовать.Администраторы гидротехнических сооружений любят делать воду слегка щелочной и слегка перенасыщенной карбонатом кальция, чтобы поддерживать тонкий слой твердого карбоната на внутренней части трубы, который защищает ее от коррозии.
Стальные арматурные стержни в бетоне
Все большие бетонные конструкции содержат стальные арматурные стержни («арматуру»), которые помогают обеспечить структурную целостность при различных условиях нагрузки и особенно во время землетрясений.Попадание воды, даже в виде тумана или тумана, может привести к серьезным коррозионным повреждениям, как видно на этом снимке этой колонны, которая поддерживает путепровод на шоссе. \\
Коррозия металлических стыков
На рисунке показаны два стальных конструктивных элемента, соединенных чугунными фланцами, скрепленными вместе болтами. По какой-то причине одна из частей стала более анодной, чем другая, что привело к сильной коррозии верхней части.
Коррозия, вызванная почвенными бактериями
Эта газовая труба была похоронена в красной почве, содержащей железный колчедан (FeS). Бактерия thiobacillus ferrooxidans получает энергию, окисляя Fe2 + до более растворимого Fe3 +, передавая электроны O2. Он также окисляет серу, образуя серную кислоту. Образовавшийся химический коктейль прорезал трубу.
Эти оцинкованные болты использовались для соединения деревянных балок.Последующее перемещение балок из-за различных условий нагрузки привело к истиранию цинкового покрытия. Недостаток кислорода около центров болтов также, вероятно, способствовал коррозии, предотвращая образование защитной оксидной пленки.
Коррозия из-за недостатка кислорода
Эти оцинкованные болты использовались для соединения деревянных балок. Последующее перемещение балок из-за различных условий нагрузки привело к истиранию цинкового покрытия. Недостаток кислорода около центров болтов также, вероятно, способствовал коррозии, предотвращая образование защитной оксидной пленки.
Точечная коррозия поверхности
Точечная коррозия имеет тенденцию к образованию узких, но глубоких отверстий («ямок») на поверхности, которые трудно обнаружить, особенно когда они покрыты продуктами коррозии. Как только яма образуется, она имеет тенденцию копать глубже из-за более медленной диффузии кислорода в узкое дно ямы.
Нержавеющая сталь не полностью защищена от коррозии
Стальные сплавы, содержащие 13–26 мас.% Хрома, образуют тонкий, хорошо прилипающий поверхностный слой Cr 2 O 3 при контакте с воздухом, тем самым становясь пассивированным и устойчивым к коррозии.Но для того, чтобы сохранить это сопротивление, кислород должен оставаться доступным для поверхности.
Если это условие не соблюдается, пассивирующая пленка может разрушиться, как это произошло с этим фланцем, который подвергся сильной точечной коррозии. Хлорид-ионы также могут нарушить защитную пленку, хотя существуют специальные сорта нержавеющей стали, доступные для использования в морских условиях, которые более устойчивы к этому эффекту.
Следует проявлять особую осторожность при соединении нержавеющих сталей с другими конструкциями.Излишнее затягивание гаек на этом кронштейне могло повредить пленку Cr 2 O 3 ; использование крепежных винтов и гаек не из нержавеющей стали гарантирует обычную гальваническую коррозию.
Что вы должны уметь
Убедитесь, что вы полностью понимаете следующие основные концепции, представленные выше.
- Электрохимическая коррозия металлов происходит, когда электроны от атомов на поверхности металла переносятся на подходящий акцептор электронов или деполяризатор .Должна присутствовать вода, чтобы служить средой для переноса ионов.
- Наиболее распространенными деполяризаторами являются кислород, кислоты и катионы менее активных металлов.
- Поскольку электроны проходят через сам металлический объект, анодная и катодная области (две половины электрохимической ячейки) могут находиться на значительном расстоянии друг от друга.
- Анодные области имеют тенденцию развиваться в местах, где металл подвергается напряжению или защищен от кислорода.
- Контакт с другим металлом, прямой или косвенный, может привести к коррозии более активного металла.
- Коррозию стали можно предотвратить путем цинкования , то есть путем покрытия ее цинком, более активным металлом, растворение которого оставляет на металле отрицательный заряд, который препятствует дальнейшему растворению Fe 2+ .
- Катодная защита с использованием внешнего источника напряжения широко используется для защиты подземных сооружений, таких как резервуары, трубопроводы и опоры.Источником может быть расходуемый анод из цинка или алюминия, либо сетевой или фотоэлектрический источник питания.
Список литературы
Отличное иллюстрированное руководство по коррозии и катодной защите
Хорошие схематические иллюстрации различных причин коррозии
Обзор различных форм коррозии (с фотографиями)
Проблемы, связанные с коррозией железобетона
Почему нержавеющая сталь нержавеющая?
Концептуальная карта
Коррозия металлов
Теория коррозии металлов
Коррозия определяется как повреждение материала в результате
химическая, часто электрохимическая реакция с окружающей средой.Согласно этому определению термин «коррозия» может применяться ко всем
материалы, в том числе неметаллы. Но на практике слово коррозия в основном используется в
в сочетании с металлическими материалами.
Почему металлы корродируют? Помимо золота, платины и некоторых других,
в чистом виде металлы в природе не встречаются. Они обычно
химически связаны с другими веществами в рудах, такими как сульфиды, оксиды и т. д.Энергия должна быть затрачена (например, в доменной печи) для извлечения металлов из
сульфиды, оксиды и т. д. для получения чистых металлов.
Чистые металлы содержат больше связанной энергии, представляя собой
более высокое энергетическое состояние, чем в природе в виде сульфидов или оксидов.
Энергетическое состояние металла в различных формах
Поскольку весь материал во Вселенной стремится вернуться к своему низкому уровню
энергетическое состояние, чистые металлы также стремятся вернуться к своему самому низкому энергетическому состоянию
которые у них были в виде сульфидов или оксидов.Один из способов, которыми металлы могут
возврат к низкому уровню энергии происходит за счет коррозии. Продукты коррозии
металлы часто представляют собой сульфиды или оксиды.
Химическая и электрохимическая коррозия
Химическая коррозия может рассматриваться как окисление и происходит под действием
сухих газов, часто при высоких температурах. С другой стороны, имеет место электрохимическая коррозия.
электродными реакциями, часто во влажной среде, т.е.е. влажная коррозия.
Все металлы в сухом воздухе покрыты очень тонким слоем оксида,
мощностью около 100 (10 -2 м). Этот слой образован химическими веществами.
коррозия кислородом воздуха. При очень высоких температурах реакция
с кислородом в воздухе может продолжаться без ограничений, и металл быстро превратится в
оксид.
Окисление металла при разных температурах
При комнатной температуре реакция останавливается, когда слой становится тонким.Эти
тонкие слои оксида могут защитить металл от продолжительного воздействия, например в
водный раствор. На самом деле именно эти слои оксида
и / или продукты коррозии, образующиеся на поверхности металла, защищающие
металл от продолжающегося воздействия в гораздо большей степени, чем коррозия
сопротивление самого металла.
Эти слои оксида могут быть более или менее прочными в
вода, например.Мы знаем, что обычная углеродистая сталь быстрее корродирует в воде.
чем нержавеющая сталь. Разница зависит от состава и
проницаемость их соответственно оксидных слоев. Следующее описание
явление коррозии касается только электрохимической коррозии, т.е.
влажная коррозия.
Ячейки коррозии
Как металлы корродируют в жидкостях? Проиллюстрируем это,
используя явление коррозии, называемое биметаллической коррозией или гальванической коррозией.Биметаллическая коррозионная ячейка может, например, состоят из стальной пластины и медной пластины
в электрическом контакте друг с другом и погружены в водный раствор
(электролит).
Электролит содержит растворенный кислород из воздуха.
и растворенная соль. Если лампа подключена между стальной пластиной и
медная пластина, она загорится. Это указывает на то, что ток течет между
металлические пластины.Медь будет положительным электродом, а сталь —
быть отрицательным электродом.
Ток течет через лампу от медной пластины к стальной пластине
Движущей силой тока является разница в электрическом
потенциал между медью и сталью. Цепь должна быть замкнута и
следовательно, ток будет течь в жидкости (электролите) от стального листа.
к медной пластине.Ток протекает через положительно заряженный
атомы железа (ионы железа) покидают стальную пластину, и стальная пластина корродирует.
Корродирующая металлическая поверхность называется анодом. Кислород
и вода расходуются на поверхности медной пластины, а гидроксильные ионы
(ОН-), которые имеют отрицательный заряд, образуются. Отрицательные ионы гидроксила
«нейтрализовать» положительно заряженные атомы железа.Ионы железа и гидроксила образуют
гидроксид железа (ржавчина).
В описанной выше коррозионной ячейке металлическая медь
называется катодом. Обе металлические пластины называются электродами, а
определение анода и катода дано ниже.
Анод : Электрод, от которого течет положительный ток.
в электролит.
Катод : Электрод, через который проходит положительный электрический ток.
ток уходит из электролита.
Когда положительные атомы железа переходят в раствор из стальной пластины,
электроны остаются в металле и переносятся в обратном направлении, в сторону
положительный ток.
Предпосылки для
К формированию биметаллической ячейки относятся:
1.Электролит
2. Анод
3. Катод
4. Окислительная среда, например растворенный кислород (O 2 ) или ионы водорода.
(H + ).
Электродный потенциал — гальваническая серия
В приведенном выше примере
было показано, что движущая сила для протекания тока и, следовательно,
Коррозия — это разность электродных потенциалов.Электродный потенциал
металл — это показатель склонности металла к растворению и коррозии
в определенном электролите.
Также упоминается «благородство» металла. Более благородный
металла, чем выше потенциал, тем меньше у него тенденция к
раствориться в электролите.
Электродные потенциалы различных металлов могут быть указаны в
отношение друг к другу в гальваническом ряду для разных электролитов.В
гальванический ряд различных металлов в морской воде показан ниже.
Золото | +0,42 |
| Серебро | +0,19 |
Нержавеющая сталь (AISI 304), пассивное состояние | +0.09 |
| Медь | +0,02 |
| Олово | -0,26 |
Нержавеющая сталь (AISI 304), активное состояние | -0,29 |
| Свинец | -0,31 |
| Сталь | -0.46 |
| Кадмий | -0,49 |
| Алюминий | -0,51 |
| Оцинкованная сталь | -0,81 |
| цинк | -0,86 |
| Магний | -1,36 |
Учитывая сталь-медь
Например, из приведенной выше таблицы будет отмечено, что медь имеет более высокий потенциал (
благороднее), чем обычная углеродистая сталь.Сталь будет анодом и корродирует,
тогда как медь будет катодом и не подвергнется коррозии.
Коррозия в микроячейках
Сталь-медь
пример показал, как происходит коррозия, когда два разных материала
соединен в водном растворе. Как происходит коррозия на поверхности
из цельного металла? Когда поверхность металла исследуется под микроскопом,
будет видно, что это не один однородный металл.Различия в
структура и размер зерна возникают на поверхности. Химический состав может
варьируются, и могут присутствовать различные примеси.
Если потенциал электрода измеряется на очевидном
однородной поверхности, будет обнаружено, что она значительно варьируется в пределах только
доли квадратного миллиметра. Итак, катоды и аноды, возможно, маленькие, но
достаточно большой, чтобы вызвать коррозию, может быть сформирован на той же металлической поверхности.В результате анодной и катодной реакций образовалась коррозионная микроячейка.
описано ниже.
Анодная часть поверхности корродирована
В случае низкого pH катодная реакция будет: 2e — +
2H + → H 2 . Поверхность катода может быть
примеси, такие как оксидные включения, усиление графита или более благородная фаза.
| Коррозия |
| Коррозия возможна только до тех пор, пока некоторые металлы имеют примеси, кислород и влага. Коррозия металлов, таких как железо, электрохимический процесс. Очень чистые образцы железа, кажется, сопротивляются коррозия. Напротив, когда кусок железа, содержащий частички примесей, таких поскольку медь подвергается воздействию влажного воздуха, железо покрывается ржавчиной пятна. Железная ржавчина — это красновато-коричневое гидратированное соединение различного состава. имеют формула Fe (OH) 3 . x H 2 O. Следовательно, пятна ржавчины указывают на место, где было окисленный. Эти пятна ржавчины представляют собой анодные полуэлементы ан Электрохимическая ячейка . |
| Такие примеси, как медь, служат катодными полуячейками. и есть расположены на незатронутых участках рядом с пятнами ржавчины.В электроны проходят через железо от анода к катоду. Пленка влаги служит средой, через которую ионы перемещаются в полный схема. |
| Электрохимическая теория коррозии подтверждена. посредством наблюдение, что железо, подвергающееся воздействию совершенно сухого воздуха, не ржаветь. Три реакции полуэлементов, которые представят возможные реакции в это сложный механизм: |
| Анод Fe (ы) <====> Fe +2 + 2 e -1 Катод 1/2 O 2 (г) + H 2 O (л) + 2 e -1 <====> 2 ОН -1 (нейтральный раствор.) Катод 2 H +1 + 2 e -1 <=====> H 2 (г) (кислый раствор) |
| Общую клеточную реакцию можно получить, добавив уравнения. |
| Дальнейшее окисление Fe (OH) 2 дает Fe (OH) 3 . Исследование уравнения показывает, что на формирование коррозии. Это концентрация кислорода, кислотность, и наличие кислорода. На самом деле существует четвертый фактор: качество самого железного металла. |
| Для минимизации коррозии на предотвращать прямой контакт влаги и кислорода с металлом. Электрохимический принципы также могут применяться для предотвращения коррозии.Это известен в качестве катодной защиты. В катодной защите железо является катодная полуячейка, чтобы не терять электроны и раствориться. Этого можно добиться, прикрепив более активный металл, например магний к утюгу или подключив утюг к катоду внешнего мощность источник. Эти устройства часто используются для защиты подземных трубы и танки и даже корпуса кораблей. Стальные корпуса корабли особенно уязвимы к коррозии, потому что бронзовые пропеллер действует как катод, соленая вода как соляной мостик, а корпус как ан анод.Эта проблема решается периодическим прикреплением больших шт металлического магния на корпус корабля. Таким образом, металлический магний ржавчина и растворена, но стальной корпус, к которому он прикреплен, защищен. |
Коррозия | Безграничная химия
Коррозия
Коррозия возникает при разрушении металлов в результате химических процессов.
Цели обучения
Обсудить общие причины коррозии металлической поверхности
Основные выводы
Ключевые моменты
- Коррозия — это двухэтапный процесс, для которого требуются три вещи: металлическая поверхность, электролит и кислород.
- В процессе коррозии поверхностные атомы металла растворяются в водном растворе, оставляя металл с избытком отрицательного заряда. Образующиеся ионы удаляются подходящим акцептором электронов.
- Коррозия — это металлы, которые самопроизвольно возвращаются в форму своей руды в процессе окисления.
- Электропроводящие свойства металла позволяют окислению и восстановлению происходить на отдельных участках поверхности металла.
Ключевые термины
- коррозия : Химическая эрозия, особенно окисление.
Когда материалы портятся в результате химических процессов, они подвергаются коррозии. Коррозия обычно обсуждается применительно к металлам, которые корродируют электрохимически. Этот вид коррозии представляет собой двухэтапный процесс, для которого требуются три вещи: металлическая поверхность, электролит и кислород. В процессе коррозии атом металла на поверхности растворяется в водном растворе, оставляя металл с избыточными отрицательно заряженными ионами.Эти образующиеся ионы удаляются подходящим акцептором электронов. Коррозию можно рассматривать как самопроизвольное возвращение металлов в свои руды в процессе окисления.
Проводящие свойства металла позволяют этапам окисления и восстановления, которые происходят во время коррозии, происходить на отдельных участках поверхности металла. Проводимость позволяет электронам течь из анодной в катодную области металла. — [/ latex]
Коррозия — это неприятность : На этой фотографии железного моста через реку Нанду на Хайнане, Китай, показаны доказательства повреждений, вызванных коррозией.- \ rightarrow \ text {M} (\ text {s}) [/ latex]
На этой катодной ступени M — металл.
Насколько подвержен коррозии тот или иной металл, можно определить по его восстановительному потенциалу. Чем выше восстановительный потенциал металла, тем меньше вероятность его окисления.
Коррозия — обычная неприятность с реальными ударами. Мы видим его последствия в ржавых каркасах автомобилей, прорыве водопровода и разрушении мостов.
Предотвращение коррозии
Предотвращение коррозии снижает как экономический, так и связанный с безопасностью ущерб, связанный с технологическим процессом.
Цели обучения
Обсудите общие профилактические меры, которые можно предпринять против коррозии металлической поверхности
Основные выводы
Ключевые моменты
- Для возникновения коррозии необходимы три фактора: электролит, открытая металлическая поверхность и акцептор электронов.
- Коррозию можно предотвратить, сняв одно из этих условий.
- Покрытие металлической поверхности краской или эмалью создает барьер между металлом и влагой окружающей среды.
- Процесс покрытия металлической поверхности другим металлом, который с большей вероятностью окисляется, называется жертвенным покрытием.
Ключевые термины
- электролит : Вещество, которое в растворе или в расплавленном состоянии ионизирует и проводит электричество.
- жертвенное покрытие : Металлическое покрытие, которое подвержено окислению с большей вероятностью, чем металл, который оно защищает.
- гальваника : для покрытия тонким слоем металла электрохимическим способом; к гальванике.
Анализ коррозии
Мы узнали, что для анодной и катодной стадий коррозии необходимы три вещи: электролит, открытая металлическая поверхность и акцептор электронов. Отсюда следует, что мы можем предотвратить коррозию, удалив одно из этих важных условий. Самое простое условие для удаления — это оголенная металлическая поверхность.
Создание физического барьера
Покрытие металлической поверхности краской или эмалью создает барьер между металлом и влагой в окружающей среде, тем самым устраняя возможность контакта кислорода и влаги с металлом.
Жертвенные покрытия
Процесс покрытия металлической поверхности другим металлом, который с большей вероятностью окисляется, называется жертвенным покрытием. Сталь из сплава железа, подверженная коррозии, обычно покрывается цинком, более активным металлом, в процессе, известном как цинкование. Коррозия жертвенного цинка приводит к его окислению; железо восстанавливается, что делает его катодным и препятствует его коррозии.
Оцинкованная поверхность : Защита сплавов железа покрытием из более активного металла посредством процесса цинкования предотвращает коррозию сплавов.
Контраст с предыдущим сценарием можно увидеть, когда железо или железный сплав покрывают менее активным металлом, например оловом. Пока оловянное покрытие остается неповрежденным, коррозия невозможна. Однако, если оловянное покрытие ухудшится, обнажая лежащий под ним металл, произойдет коррозия. Это связано с тем, что обнаженное железо подвергается окислению и становится анодным. Олово принимает электроны от окисленного железа, и соблюдаются три критерия коррозии.
Катодная защита
Еще один способ защиты от коррозии — создание постоянного отрицательного электрического заряда на металле.Этот метод называется катодной защитой. Катодная защита воспроизводит эффект жертвенного покрытия, но с более активным металлом. Источником отрицательного заряда обычно является внешний источник постоянного тока. Катодная защита используется, в частности, для защиты подземных топливных баков и трубопроводов.
Пассивация
Пассивация — это процесс, при котором на металлической поверхности образуется тонкая пленка продуктов коррозии, служащая барьером против окисления.На формирование пассивирующего слоя влияют pH окружающей среды, температура и химические условия. Статуя Свободы, например, покрыта сине-зеленой патиной, вызванной несколькими химическими реакциями, которая защищает металлическую медь под ней.
Анодирование
Анодирование — это еще одна обработка поверхности, защищающая от коррозии. Защищаемый металл покрывается специальным веществом, а электрохимические условия регулируются таким образом, чтобы в оксидной пленке металла появлялись однородные поры шириной несколько нанометров.Эти поры позволяют образовываться оксидной пленке, более толстой, чем пассивирующий слой. Полученный защитный слой очень твердый и очень эластичный.
Жертвенная защита анода
По тому же принципу, что и временное пленочное покрытие, расходуемый анод, сделанный из металла, более активного, чем металл, который вы хотите защитить, можно использовать для предотвращения коррозии металлических конструкций, погруженных в воду или заглубленных в землю. Жертвенный анод подвергнется коррозии раньше, чем металл, который он защищает. Однако, как только расходуемый анод подвергнется коррозии, его необходимо заменить; в противном случае металл, который она защищает, тоже начнет разъедать.
Катодная защита предотвращает коррозию : Гальванический расходный анод, прикрепленный к корпусу судна; Здесь протекторный анод показывает коррозию, а металл, к которому он прикреплен, — нет. Анод, кусок более электрохимически «активного» металла, прикреплен к уязвимой поверхности металла, где он подвергается воздействию электролита; потенциал уязвимой поверхности поляризован, чтобы быть более отрицательным, пока поверхность не будет иметь однородный потенциал. На этом этапе устраняется движущая сила реакции коррозии с защищаемой поверхностью.Гальванический анод продолжает корродировать, расходуя материал анода, пока в конечном итоге его не нужно будет заменить, но катодный материал защищен.
Коррозия представляет реальную угрозу целостности личного имущества, а также мостов, дорог и другой общественной инфраструктуры. Понимание и реализация стратегий предотвращения коррозии снизит как экономический ущерб, так и ущерб, связанный с безопасностью, связанный с процессом.
Электрохимическое и термодинамическое исследование коррозионных характеристик стали API X120 в 3.5% раствор NaCl
Эрран, А., де ла Крус, Дж. М. и де Андрес, Б. Global Search Metaheuristics для планирования транспортировки нескольких нефтепродуктов в многотрубной системе. Компьютеры и химическая инженерия 37 , 248–261, https://doi.org/10.1016/j.compchemeng.2011.10.003 (2012).
CAS
Статья
Google Scholar
Карретеро Олалла, В. и др. . Анализ механизмов упрочнения трубопроводных сталей в зависимости от параметров горячей прокатки. Mater. Sci. Eng., A 604 , 46–56, https://doi.org/10.1016/j.msea.2014.02.066 (2014).
CAS
Статья
Google Scholar
Оконкво П. К., Шакур Р. А., Ахмед Э. и Мохамед А. М. Характеристики эрозионного износа трубопроводной стали API X42. Eng. Неудача. Анальный. 60 , 86–95, https://doi.org/10.1016/j.engfailanal.2015.11.046 (2016).
CAS
Статья
Google Scholar
Шакур, А. и др. . Коррозионное поведение высокопрочной низколегированной стали HSLA в растворе 35 мас.% NaCl, содержащем диэтилентриамин DETA в качестве ингибитора коррозии. 2018 , https://doi.org/10.5339/qfarc.2018.EEPD356 (2018).
Риос-Меркадо, Р. З. и Борраз-Санчес, К. Проблемы оптимизации в системах транспортировки природного газа: современный обзор. Заявл. Энергия 147 , 536–555, https://doi.org/10.1016/j.apenergy.2015.03.017 (2015).
Артикул
Google Scholar
Гуо, Й., Мэн, Т., Ван, Д., Тан, Х. и Хе, Р. Экспериментальные исследования коррозии сталей трубопроводов серии X при воздействии переменного тока. Eng. Неудача. Анальный. 78 , 87–98, https://doi.org/10.1016/j.engfailanal.2017.03.003 (2017).
CAS
Статья
Google Scholar
Мохтади-Бонаб, М. А. и Эскандари, М. Сосредоточение внимания на различных факторах, влияющих на вызванное водородом растрескивание в стали для трубопроводов нефти и природного газа. Eng. Неудача. Анальный. 79 , 351–360, https://doi.org/10.1016/j.engfailanal.2017.05.022 (2017).
CAS
Статья
Google Scholar
Педроса И. Р., Кастро Р. Сд, Ядава Ю. П. и Феррейра Р. А. Исследование фазовых превращений в стали API 5L X80 с целью повышения ее вязкости разрушения. Mater. Res. 16 , 489–496 (2013).
CAS
Статья
Google Scholar
Zhang, J.-m, Sun, W.-h & Sun, H. Механические свойства и микроструктура высокопрочной трубопроводной стали марки X120. J. Iron. Steel Res. Int. 17 , 63–67, https://doi.org/10.1016/S1006-706X(10)60185-9 (2010).
CAS
Статья
Google Scholar
Cao, R. et al . Влияние кремния и меди на микроструктуру, растяжение и свойства Шарпи металлов сварных швов с помощью очищенной проволоки X120. Mater. Sci. Eng., A 718 , 350–362, https://doi.org/10.1016/j.msea.2018.01.080 (2018).
CAS
Статья
Google Scholar
Yoo, J.-Y., Ahn, S.-S., Seo, D.-H., Song, W.-H. И Кан, К.-Б. Новая разработка трубопроводных сталей высокого качества от X80 до X120. Mater. Manuf. Процессы 26 , 154–160, https://doi.org/10.1080/10426910
2534 (2011).
CAS
Статья
Google Scholar
Линтер Б. Р., Бурштейн Г. Т. Реакции сталей трубопроводов в растворах диоксида углерода. Коррозия Науки. 41 , 117–139, https://doi.org/10.1016/S0010-938X(98)00104-8 (1999).
CAS
Статья
Google Scholar
Гао М., Панг X. и Гао К. Механизм роста пленок продуктов коррозии CO2. Коррозия Науки. 53 , 557–568, https://doi.org/10.1016/j.corsci.2010.09.060 (2011).
CAS
Статья
Google Scholar
Чжан Дж., Ван Дж., Чжу Ф. и Ду М. Исследование ингибирующих свойств софоролипидов для коррозии стали X65 в промысловой воде, насыщенной диоксидом углерода, на промысле. Ind. Eng. Chem. Res. 54 , 5197–5203, https://doi.org/10.1021/ie5044055 (2015).
CAS
Статья
Google Scholar
Mazumder, MAJ, Nazal, MK, Faiz, M. & Ali, SA Имидазолины, содержащие одно-, двух- и треххвостые гидрофобы и гидрофильные подвески (Ch3Ch3NH) nH в качестве ингибиторов коррозии мягкой стали в CO2– 0,5 М NaCl. RSC Adv. 6 , 12348–12362, https: // doi.org / 10.1039 / C5RA21276F (2016).
CAS
Статья
Google Scholar
Нешич, С. Ключевые вопросы, связанные с моделированием внутренней коррозии нефте- и газопроводов — обзор. Коррозия Науки. 49 , 4308–4338, https://doi.org/10.1016/j.corsci.2007.06.006 (2007).
CAS
Статья
Google Scholar
Кермани, М. Б. и Моршед, А.Углекислотная коррозия при добыче нефти и газа — конспект. Коррозия 59 , 659–683, https://doi.org/10.5006/1.3277596 (2003).
CAS
Статья
Google Scholar
Рен, К., Ван, В., Цзинь, X., Лю, Л. и Ши, Т. Физико-химические характеристики пленок FeCO3 под влиянием анионов. RSC Adv. 5 , 20302–20308, https://doi.org/10.1039/C4RA14313B (2015).
CAS
Статья
Google Scholar
Элиан Ф. и Альфантази А. Влияние температуры на коррозионное поведение трубопроводной стали API-X100 в растворах CO2-HCO3- при давлении 1 бар: электрохимическое исследование. Mater. Chem. Phys. 140 , 508–515, https://doi.org/10.1016/j.matchemphys.2013.03.061 (2013).
CAS
Статья
Google Scholar
Элиан Ф. Ф., Мохаммади Ф. и Альфантази А. Электрохимическое исследование влияния содержания хлоридов на коррозию стали API-X100 с помощью CO2. Коррозия Науки. 64 , 37–43, https://doi.org/10.1016/j.corsci.2012.06.032 (2012).
CAS
Статья
Google Scholar
Аль-Джаруди, С. С., Уль-Хамид, А. и Аль-Мумен, М. А. Преждевременный выход из строя насосно-компрессорных труб, используемых в добывающей скважине малосернистой нефти сорта Extra Arab Light. Eng. Неудача. Анальный. 47 , 178–198, https://doi.org/10.1016/j.engfailanal.2014.10.006 (2015).
CAS
Статья
Google Scholar
Эрнандес-Эспехель, А., Домингес-Креспо, М.А., Кабрера-Сьерра, Р., Родригес-Менесес, К. и Арсе-Эстрада, Э.М. Исследования коррозионных пленок, образовавшихся на стали трубопроводов API-X52 в кислых средах. Коррозия Науки. 52 , 2258–2267, https://doi.org/10.1016/j.corsci.2010.04.003 (2010).
CAS
Статья
Google Scholar
Мустафа А. Х., Ари-Вахджоеди Б. и Исмаил М. С. Ингибирование CO2-коррозии стали X52 ингибитором на основе имидазолина в среде CO2-вода под высоким давлением. J. Mater. Англ. Выполнять. 22 , 1748–1755, https://doi.org/10.1007/s11665-012-0443-5 (2013).
CAS
Статья
Google Scholar
Валькарсе, М. Б. и Васкес, М. Пассивность углеродистой стали, исследованная в растворах с низкой степенью карбонизации: влияние хлорид- и нитрит-ионов. Mater. Chem. Phys. 115 , 313–321, https://doi.org/10.1016/j.matchemphys.2008.12.007 (2009).
CAS
Статья
Google Scholar
Ван Б., Сюй Л., Лю Г. и Лу М. Коррозионное поведение и механизм стали 3Cr в среде CO2 с различной концентрацией Ca2 +. Коррозия Науки. 136 , 210–220, https://doi.org/10.1016/j.corsci.2018.03.013 (2018).
CAS
Статья
Google Scholar
Уморен, С., Эбенсо, Э., Окафор П. и Огбобе О. Водорастворимые полимеры как ингибиторы коррозии. Технология пигментов и смол 35 , 346–352, https://doi.org/10.1108/03699420610711353 (2006).
CAS
Статья
Google Scholar
Ingham, B., Ko, M., Laycock, N., Kirby, NM & Williams, DE. Первые стадии кристаллизации сидерита во время коррозии стали с помощью CO2 оценивались с использованием синхротрона in situ малого и широкого диапазона. угловое рассеяние рентгеновских лучей. Фарадей Обсудить. 180 , 171–190, https://doi.org/10.1039/C4FD00218K (2015).
ADS
CAS
Статья
PubMed
PubMed Central
Google Scholar
Чжэн, Л. Ф., Лэндон, Дж., Кёбке, Н. К., Чандан, П. и Лю, К. Л. Пригодность и стабильность 2-меркаптобензимидазола в качестве ингибитора коррозии в системе улавливания CO2 после сжигания. Коррозия 71 , 692–702, https: // doi.org / 10.5006 / 1524 (2015).
CAS
Статья
Google Scholar
Артур Д. Э., Джонатан А., Аме П. О. и Аня К. Обзор оценки полимерных материалов, используемых в качестве ингибиторов коррозии металлов и сплавов. Внутр. J. Ind. Chem. 4 , 2, https://doi.org/10.1186/2228-5547-4-2 (2013).
Артикул
Google Scholar
Кахраман Р. Подавление атмосферной коррозии мягкой стали обработкой бензоатом натрия. J. Mater. Англ. Выполнять. 11 , 46–50, https://doi.org/10.1007/s11665-002-0007-1 (2002).
CAS
Статья
Google Scholar
Финшгар М., Фассбендер С., Николини Ф. и Милошев И. Полиэтиленимин в качестве ингибитора коррозии нержавеющей стали ASTM 420 в почти нейтральной солевой среде. Коррозия Науки. 51 , 525–533, https://doi.org/10.1016/j.corsci.2008.12.006 (2009).
CAS
Статья
Google Scholar
Finšgar, M., Fassbender, S., Hirth, S. & Milošev, I. Электрохимическое и XPS исследование полиэтилениминов разного молекулярного размера в качестве ингибиторов коррозии для нержавеющей стали AISI 430 в почти нейтральной хлоридной среде. Mater. Chem. Phys. 116 , 198–206, https: // doi.org / 10.1016 / j.matchemphys.2009.03.010 (2009).
CAS
Статья
Google Scholar
Биглхол, Д., Вебстер, Б. и Вернер, С. Исследование эллипсометрии адсорбции молекул на границах раздела электролита с золотом и нержавеющей сталью. J. Colloid Interface Sci. 202 , 541–550, https://doi.org/10.1006/jcis.1998.5475 (1998).
ADS
CAS
Статья
Google Scholar
Казази М., Афшар А. и Саджаднежад М. Ингибирующее действие полиэтиленимина (PEI) на точечную коррозию аустенитной нержавеющей стали 304 в 3,5% растворе NaCl. Международный журнал Общества черной металлургии Ирана 10 , 14–22 (2013).
Google Scholar
Jianguo, Y., Lin, W., Otieno-Alego, V. & Schweinsberg, D. P. Поливинилпирролидон и полиэтиленимин как ингибиторы коррозии низкоуглеродистой стали в фосфорной кислоте. Коррозия Науки. 37 , 975–985, https://doi.org/10.1016/0010-938X(95)00008-8 (1995).
CAS
Статья
Google Scholar
Секин, I. Ингибирование коррозии мягкой стали катионными и анионными полимерами в системе охлаждающей воды. J. Electrochem. Soc. 139 , 3167, https://doi.org/10.1149/1.2069050 (1992).
CAS
Статья
Google Scholar
Чжан, Х. и др. . Антикоррозийное поведение четвертичного полиэтиленимина в кислой среде. Mater. Sci. Форум 610–613 , 136–141, https://doi.org/10.4028/www.scientific.net/msf.610-613.136 (2009).
Артикул
Google Scholar
Гао, Б., Чжан, X. и Шэн, Ю. Исследования по приготовлению и ингибированию коррозии кватернизованного полиэтиленимина для низкоуглеродистой стали в серной кислоте. Mater. Chem. Phys. 108 , 375–381, https://doi.org/10.1016/j.matchemphys.2007.10.033 (2008).
CAS
Статья
Google Scholar
Али, С. А. и Саид, М. Т. Синтез и изучение ингибирования коррозии некоторых солей N, N-диаллил четвертичного аммония на основе 1,6-гександиамина и их полимеров. Полимер 42 , 2785–2794, https://doi.org/10.1016/S0032-3861(00)00665-0 (2001).
CAS
Статья
Google Scholar
G1-90-e1, A. Стандартная практика подготовки, очистки и оценки образцов для испытаний на коррозию. (1999).
Singh, A. et al. . Предстоящий ингибитор, полезный для нефтегазодобывающей промышленности: потеря веса, электрохимические, поверхностные и квантово-химические расчеты. Научные отчеты 7 , 14904, https://doi.org/10.1038 / s41598-017-13877-0 (2017).
ADS
CAS
Статья
PubMed
PubMed Central
Google Scholar
Sliem, M. H. et al. . Поверхностно-активное вещество AEO7 как экологически чистый ингибитор коррозии углеродистой стали в растворе HCl. Scientific Reports 9 , 2319, https://doi.org/10.1038/s41598-018-37254-7 (2019).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Салах М., Лахсен Л., Омар А. и Яхия Х. Изучение ингибирования коррозии стали C38 в 1 M растворе HCl полиэтилениминметиленфосфоновой кислотой. Международный журнал промышленной химии 8 , 263–272, https://doi.org/10.1007/s40090-017-0123-2 (2017).
CAS
Статья
Google Scholar
Яко, Э. А., Анаи, Р. А., Абдулмаджид, М. Х., Томи, И. Х. Р. и Кадхим, М. М.Потенциодинамическая поляризация, анализ поверхности и компьютерные исследования 1,3,4-тиадиазольного соединения в качестве ингибитора коррозии для иракских керосиновых цистерн. J. Mol. Struct. 1202 , 127356, https://doi.org/10.1016/j.molstruc.2019.127356 (2020).
CAS
Статья
Google Scholar
Ортега-Толедо, Д.М., Гонсалес-Родригес, Дж. Г., Касалес, М., Мартинес, Л. и Мартинес-Виллафанье, А. Ингибирование коррозии трубопроводной стали Х-120 с помощью CO2 модифицированным имидазолином в условиях потока . Коррозия Науки. 53 , 3780–3787, https://doi.org/10.1016/j.corsci.2011.07.028 (2011).
CAS
Статья
Google Scholar
Zhao, J. & Chen, G. Синергетическое ингибирующее действие имидазолина на основе олеиновой кислоты и бензоата натрия на коррозию мягкой стали в насыщенном CO 2 солевом растворе. Электрохимы. Acta 69 , 247–255, https://doi.org/10.1016/j.electacta.2012.02.101 (2012).
CAS
Статья
Google Scholar
Schweinsberg, DP, Hope, GA, Trueman, A. & Otieno-Alego, V. Электрохимическое и SERS исследование действия поливинилпирролидона и полиэтиленимина в качестве ингибиторов меди в аэрированном H 2 SO 4 . Коррозия Науки. 38 , 587–599, https://doi.org/10.1016/0010-938X(95)00148-D (1996).
CAS
Статья
Google Scholar
Вашишт, Х. и др. . Синергетическое взаимодействие между гидроксидом тетрабутилфосфония и иодид-ионами на поверхности мягкой стали для ингибирования коррозии в кислой среде. J. Mol. Liq. 224 , 19–29, https://doi.org/10.1016/j.molliq.2016.09.056 (2016).
CAS
Статья
Google Scholar
Бахгат Радван, А., Слим, М. Х., Оконкво, П. К., Шибл, М. Ф. и Абдулла, А. М.Ингибирование коррозии стали API X120 в высокоагрессивной среде с использованием стеарамидопропилдиметиламина. J. Mol. Liq. 236 , 220–231, https://doi.org/10.1016/j.molliq.2017.03.116 (2017).
CAS
Статья
Google Scholar
Усман, Б. Дж., Уморен, С. А. и Гасем, З. М. Ингибирование коррозии стали API 5L X60 в насыщенном CO2 3,5% растворе NaCl дубильной кислотой и синергетический эффект добавки KI. J. Mol. Liq. 237 , 146–156, https://doi.org/10.1016/j.molliq.2017.04.064 (2017).
CAS
Статья
Google Scholar
Оконкво, П. К., Слим, М. Х., Шакур, Р. А., Мохамед, А. М. и Абдулла, А. М. Влияние температуры на коррозионное поведение трубопроводной стали API X120 в среде h3S. J. Mater. Англ. Выполнять. 26 , 3775–3783, https://doi.org/10.1007/s11665-017-2834-0 (2017).
CAS
Статья
Google Scholar
Джавиди, М. и Бехрад, С. Анализ отказов трубопровода влажного газа из-за локальной коррозии CO. 2 . Eng. Неудача. Анальный. 89 , 46–56, https://doi.org/10.1016/j.engfailanal.2018.03.006 (2018).
CAS
Статья
Google Scholar
Сингх А. и др. . Электрохимические и поверхностные исследования некоторых порфинов в качестве ингибитора коррозии для стали J55 в условиях слабой коррозии. Заявл. Прибой. Sci. 359 , 331–339, https://doi.org/10.1016/j.apsusc.2015.10.129 (2015).
ADS
CAS
Статья
Google Scholar
Джавиди М. и Ходапараст М. Ингибирующее действие моноэтиленгликоля на коррозию стали API 5L X52 с помощью CO2. J. Mater. Англ. Выполнять. 24 , 1417–1425, https://doi.org/10.1007/s11665-015-1415-3 (2015).
CAS
Статья
Google Scholar
Zhang, H.-h, Pang, X. & Gao, K. Локальная CO2-коррозия углеродистой стали с различной микроструктурой в солевых растворах с ингибитором на основе имидазолина. Заявл. Прибой. Sci. 442 , 446–460, https://doi.org/10.1016/j.apsusc.2018.02.115 (2018).
ADS
CAS
Статья
Google Scholar
Фенг, Л., Янг, Х., Цуй, X., Чен, Д. и Ли, Г. Экспериментальные и теоретические исследования антикоррозионных свойств стальной арматуры с использованием недавно разработанной формулы экологически чистого ингибитора. RSC Adv. 8 , 6507–6518, https://doi.org/10.1039/C7RA13045G (2018).
CAS
Статья
Google Scholar
Saha, SK, Dutta, A., Ghosh, P., Sukul, D. & Banerjee, P. Новые молекулы на основе Шиффа в качестве эффективных ингибиторов коррозии для поверхностей из мягкой стали в среде 1 M HCl: экспериментальные и теоретический подход. Phys. Chem. Chem. Phys 18 , 17898–17911, https: // doi.org / 10.1039 / C6CP01993E (2016).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Чжан Б. Р. и др. . Синергетическое ингибирование коррозии экологически чистыми ингибиторами коррозии углеродистой стали в мягкой воде. Коррозия Науки. 94 , 6–20, https://doi.org/10.1016/j.corsci.2014.11.035 (2015).
CAS
Статья
Google Scholar
Mansfeld, F. Использование спектроскопии электрохимического импеданса для изучения защиты от коррозии с помощью полимерных покрытий. J. Appl. Электрохим 25 , 187–202, https://doi.org/10.1007/BF00262955 (1995).
Артикул
Google Scholar
Абд-Элаал, А.А., Эльбасиони, Н.М., Шабан, С.М. и Заки, Е.Г. Изучение ингибирования коррозии некоторых приготовленных неионных поверхностно-активных веществ на основе 3- (4-гидроксифенил) пропановой кислоты и оценка влияния наночастиц серебра по параметрам поверхности. J. Mol. Liq. 249 , 304–317, https://doi.org/10.1016/j.molliq.2017.11.052 (2018).
CAS
Статья
Google Scholar
Гадала, И. М. и Альфантази, А. Электрохимическое поведение трубопроводной стали API-X100 в почвенных растворах, имитирующих почти нейтральный и слабощелочной pH. Коррозия Науки. 82 , 45–57, https://doi.org/10.1016/j.corsci.2013.12.020 (2014).
CAS
Статья
Google Scholar
Laidler, K. J. React. Kinet. (Pergamon Press, New York, 1963).
Луковиц И., Калман Э. и Зукки Ф. Ингибиторы коррозии — взаимосвязь между электронной структурой и эффективностью. Коррозия 57 , 3–8, https://doi.org/10.5006/1.32
(2001).
CAS
Статья
Google Scholar
Fouda, A. e., Abd El-Aal, A., Sliem, M. H., Abdullah, A. Каприламидопропилбетаин в качестве высокоэффективного экологически чистого ингибитора коррозии для стали API X120 в 1 M h3SO4. Египет. J. chem ., Https://doi.org/10.21608/ejchem.2019.13652.1844 (2019).
Ren, X., Xu, S., Chen, S., Chen, N. & Zhang, S. Экспериментальные и теоретические исследования триизопропаноламина в качестве ингибитора алюминиевого сплава в 3% растворе NaCl. RSC Adv. 5 , 101693–101700, https://doi.org/10.1039/C5RA21050J (2015).
CAS
Статья
Google Scholar
Эль-Хаддад, М.N. Гидроксиэтилцеллюлоза используется в качестве экологически чистого ингибитора коррозии стали 1018 c в 3,5% растворе NaCl. Carbohydr. Polym. 112 , 595–602, https://doi.org/10.1016/j.carbpol.2014.06.032 (2014).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Сурешкумар Сринивасан, А. В. А. А. Скрининг и оценка экологически чистых ингибиторов коррозии для процесса абсорбции CO2 на основе амина, ингибиторы коррозии, принципы и недавнее применение Махмуд Алиофхазраи.IntechOpen (4 апреля 2018 г.).
Эспиноза-Васкес, А. и Родригес-Гомес, Ф. Дж. Кофеин и никотин в 3% растворе NaCl с CO2 в качестве ингибиторов коррозии для низкоуглеродистой стали. RSC Adv. 6 , 70226–70236, https://doi.org/10.1039/c6ra07673d (2016).
CAS
Статья
Google Scholar
Мобин, М. и Хан, М. А. Адсорбционные и антикоррозионные свойства полиэтиленгликоля и поверхностно-активных добавок на низкоуглеродистой стали в h3SO4. J. Mater. Англ. Выполнять. 23 , 222–229, https://doi.org/10.1007/s11665-013-0767-9 (2014).
CAS
Статья
Google Scholar
Радван, А. Б., Слим, М. Х., Юсуф, Н. С., Альнуайми, Н. А. и Абдулла, А. М. Повышение коррозионной стойкости арматурной стали в агрессивных условиях эксплуатации с использованием хлорида бегентримония. Scientific Reports 9 , 18115, https: // doi.org / 10.1038 / s41598-019-54669-y (2019).
ADS
CAS
Статья
PubMed
PubMed Central
Google Scholar
Wang, Y. et al. . Влияние pH и хлоридов на микромеханизм питтинговой коррозии высокопрочной трубопроводной стали в аэрированных растворах NaCl. Заявл. Прибой. Sci. 349 , 746–756, https://doi.org/10.1016/j.apsusc.2015.05.053 (2015).
CAS
Статья
Google Scholar
Зейно А., Абдулазиз И., Халед М., Джавич М. В. и Обот И. Б. Механическое исследование полиаспарагиновой кислоты (PASP) в качестве экологически чистого ингибитора коррозии мягкой стали в 3% аэрированном растворе NaCl. J. Mol. Liq. 250 , 50–62, https://doi.org/10.1016/j.molliq.2017.11.160 (2018).
CAS
Статья
Google Scholar
Эль-Тайб Хеакал, Ф., Фауда, А. С. и Радван, М. С. Ингибирующее действие некоторых производных тиадиазола на коррозию углеродистой стали в нейтральном растворе хлорида натрия. Mater. Chem. Phys. 125 , 26–36, https://doi.org/10.1016/j.matchemphys.2010.08.067 (2011).
CAS
Статья
Google Scholar
Абдель Назир, А., Эль-Аббаси, Х. М. и Фауда, А. С. Адсорбция и ингибирование коррозии углеродистой стали цефоперазоном в качестве экологически чистого ингибитора в HCl. J. Mater. Англ. Выполнять. 22 , 2314–2322, https://doi.org/10.1007/s11665-013-0528-9 (2013).
CAS
Статья
Google Scholar
Хамди А. и Эль-Генди Н. С. Термодинамические, адсорбционные и электрохимические исследования для ингибирования коррозии углеродистой стали экстрактом хны в кислой среде. Египет. J. Pet. 22 , 17–25, https://doi.org/10.1016/j.ejpe.2012.06.002 (2013).
Артикул
Google Scholar
Каннан, П., Рао, Т. С. и Раджендран, Н. Повышение коррозионной стойкости углеродистой стали в кислых условиях с использованием ингибитора нафталин-2-илнафталин-2-карбоксаммида. J. Colloid Interface Sci. 512 , 618–628, https://doi.org/10.1016/j.jcis.2017.09.061 (2018).
ADS
CAS
Статья
PubMed
PubMed Central
Google Scholar
Фазаель, А.С., Хорасани, М. и Сараби, А.А. Эффект функционализированных поликарбоксилатных структур в качестве ингибиторов коррозии в моделированном пористом растворе бетона. Заявл. Прибой. Sci. 441 , 895–913, https://doi.org/10.1016/j.apsusc.2018.02.012 (2018).
ADS
CAS
Статья
Google Scholar
Choi, W. et al. . Эпоксидная функционализация полиэтиленимина для синтеза стабильного адсорбента диоксида углерода при адсорбции с переменным температурным режимом. Nat. Commun. 7 , 12640, https://doi.org/10.1038/ncomms12640 (2016).
ADS
CAS
Статья
PubMed
PubMed Central
Google Scholar
Xu, X., Pejcic, B., Heath, C. & Wood, C. D. Улавливание углерода с помощью шариков полиэтиленимин-гидрогеля (PEI HBs). J. Mater. Chem. A 6 , 21468–21474, https://doi.org/10.1039/C8TA07760F (2018).
CAS
Статья
Google Scholar
Шарма П., Чакрабарти С., Рой С. и Кумар Р. Молекулярный взгляд на захват CO2 полиэтиленимином: роль структурной и динамической неоднородности. Langmuir 34 , 5138–5148, https: // doi.org / 10.1021 / acs.langmuir.8b00204 (2018).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Чжан В., Лю, Х., Сан, К., Драге, Т. К. и Снейп, К. Э. Улавливание CO2 из окружающего воздуха с помощью адсорбента полиэтиленимин-диоксид кремния в псевдоожиженных слоях. Chem. Англ. Sci. 116 , 306–316, https://doi.org/10.1016/j.ces.2014.05.018 (2014).
CAS
Статья
Google Scholar
Шен, X., Ду, Х., Маллинс, Р. Х. и Коммалапати, Р. Р. Применение полиэтиленимина в улавливании и выделении диоксида углерода: от теоретического исследования к экспериментальной работе. Energy Technol. 5 , 822–833, https://doi.org/10.1002/ente.201600694 (2017).
CAS
Статья
Google Scholar
Wang, J. et al. . Улавливание углекислого газа с использованием мезопористых углеродов, содержащих полиэтиленимин. J. Environ. Sci. 25 , 124–132, https://doi.org/10.1016/S1001-0742(12)60011-4 (2013).
CAS
Статья
Google Scholar
 Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения.
Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения. Коррозия усиливается в том случае, если происходит облучение, в среде присутствуют блуждающие тока. Негативно влияет и температура, особенно при перепадах. В таком случае разница между холодными и теплыми местами становится причиной появления анода.
Коррозия усиливается в том случае, если происходит облучение, в среде присутствуют блуждающие тока. Негативно влияет и температура, особенно при перепадах. В таком случае разница между холодными и теплыми местами становится причиной появления анода. Это опасно, потому что может непредсказуемо менять потенциал катодных процессов, формирование окисных пленок. Также создается значительное перенапряжение реакции на электродах. Рекомендуется не допускать контакта металла со средами, у которых показатель рН высокий.
Это опасно, потому что может непредсказуемо менять потенциал катодных процессов, формирование окисных пленок. Также создается значительное перенапряжение реакции на электродах. Рекомендуется не допускать контакта металла со средами, у которых показатель рН высокий. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
 , в мае 1982 г. (ИУС 5-71, 8-82).
, в мае 1982 г. (ИУС 5-71, 8-82). Жидкая коррозионная среда
Жидкая коррозионная среда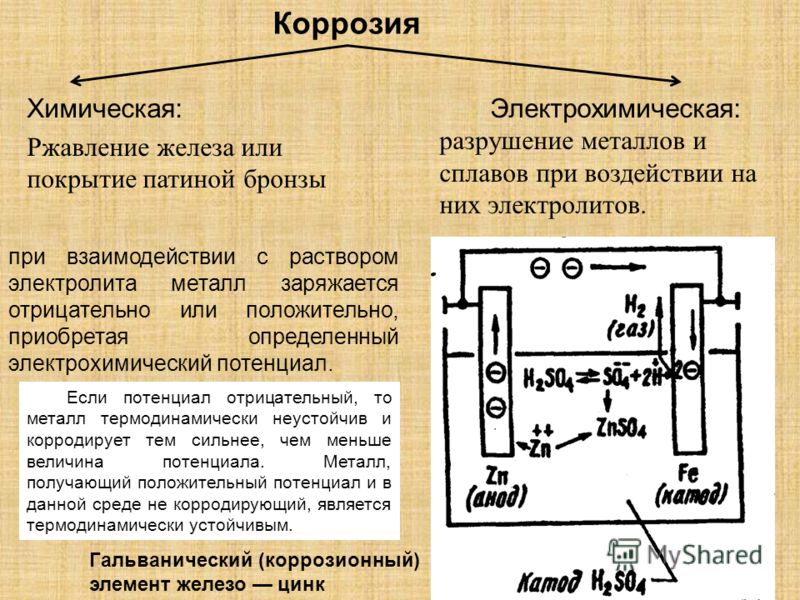 Коррозионная стойкость может быть оценена:
Коррозионная стойкость может быть оценена: Внешние факторы коррозии
Внешние факторы коррозии Коррозия при переменном погружении
Коррозия при переменном погружении Неравномерная коррозия
Неравномерная коррозия Структурная коррозия
Структурная коррозия Коррозионное растрескивание
Коррозионное растрескивание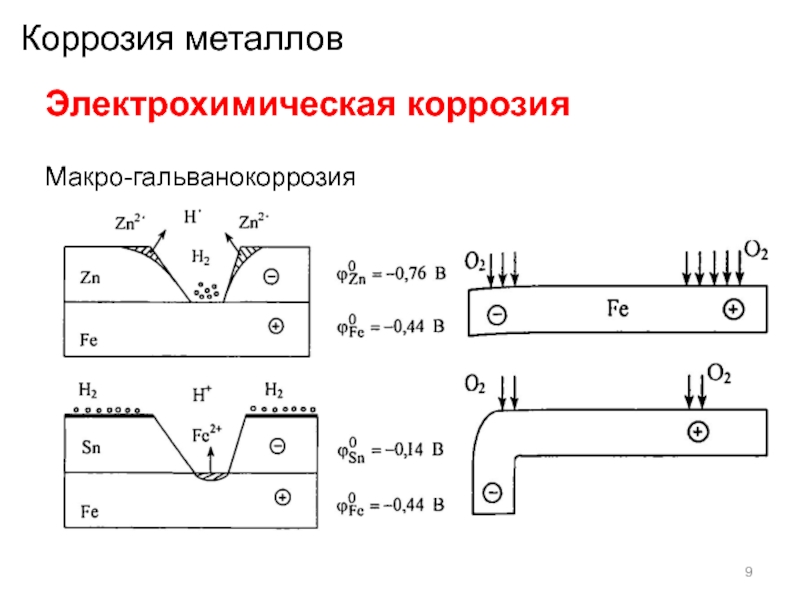 Коррозионный микроэлемент
Коррозионный микроэлемент Катодный контроль
Катодный контроль Реальная поляризационная кривая
Реальная поляризационная кривая Условия пассивации
Условия пассивации Активирующее вещество
Активирующее вещество Ингибитор кислотной коррозии
Ингибитор кислотной коррозии Стимулятор коррозии
Стимулятор коррозии Защитный потенциал
Защитный потенциал Полимерное защитное покрытие
Полимерное защитное покрытие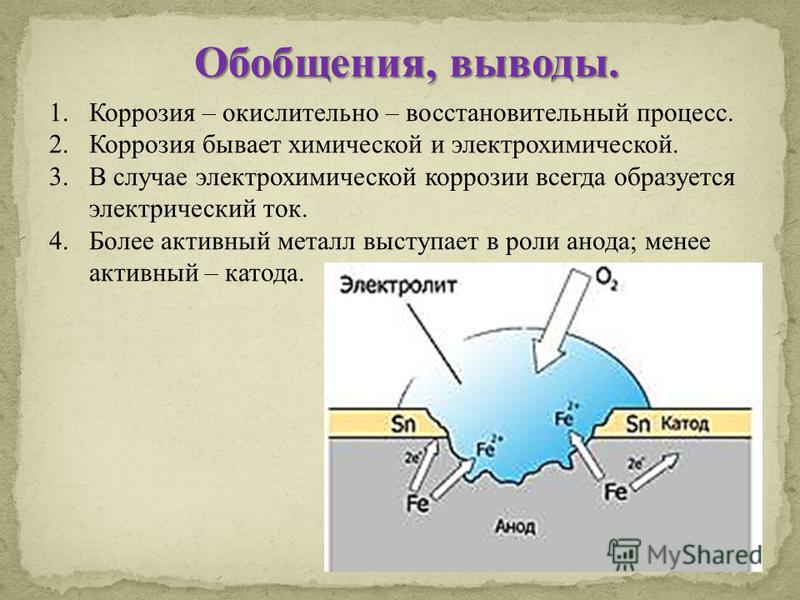 Испытания в природных условиях
Испытания в природных условиях N 1, 2).
N 1, 2). N 1, 2)
N 1, 2)