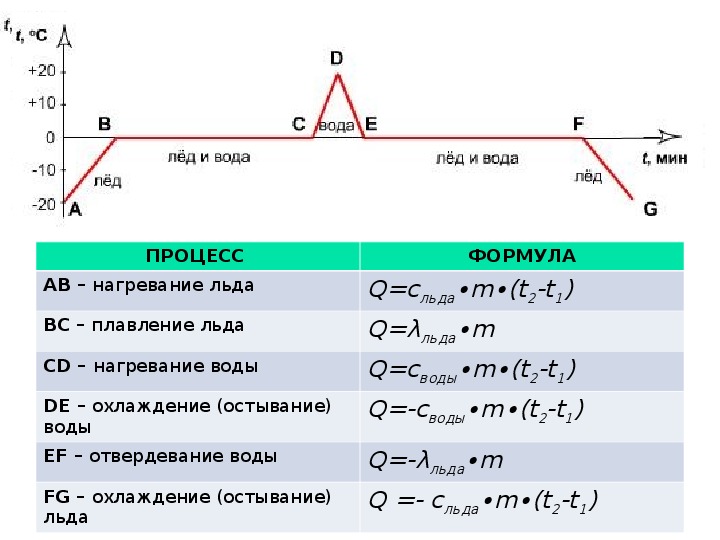
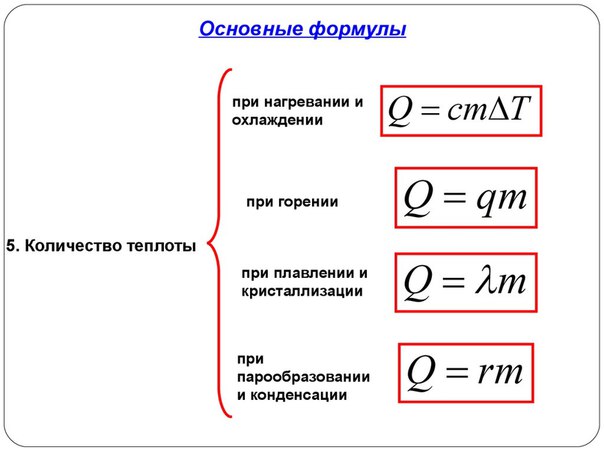
Количество теплоты: нагревание, охлаждение, плавление, кристаллизация, парообразование, конденсация, горение. Термодинамическая система
Тестирование онлайн
Количество теплоты. Основные понятия
Количество теплоты
Термодинамика
Раздел молекулярной физики, который изучает передачу энергии, закономерности превращения одних видов энергии в другие. В отличие от молекулярно-кинетической теории, в термодинамике не учитывается внутреннее строение веществ и микропараметры.
Термодинамическая система
Это совокупность тел, которые обмениваются энергией (в форме работы или теплоты) друг с другом или с окружающей средой. Например, вода в чайнике остывает, происходит обмен теплотой воды с чайником и чайника с окружающей средой. Цилиндр с газом под поршнем: поршень выполняет работу, в результате чего, газ получает энергию, и изменяются его макропараметры.
Количество теплоты
Это энергия, которую получает или отдает система в процессе теплообмена. Обозначается символом Q, измеряется, как любая энергия, в Джоулях.
В результате различных процессов теплообмена энергия, которая передается, определяется по-своему.
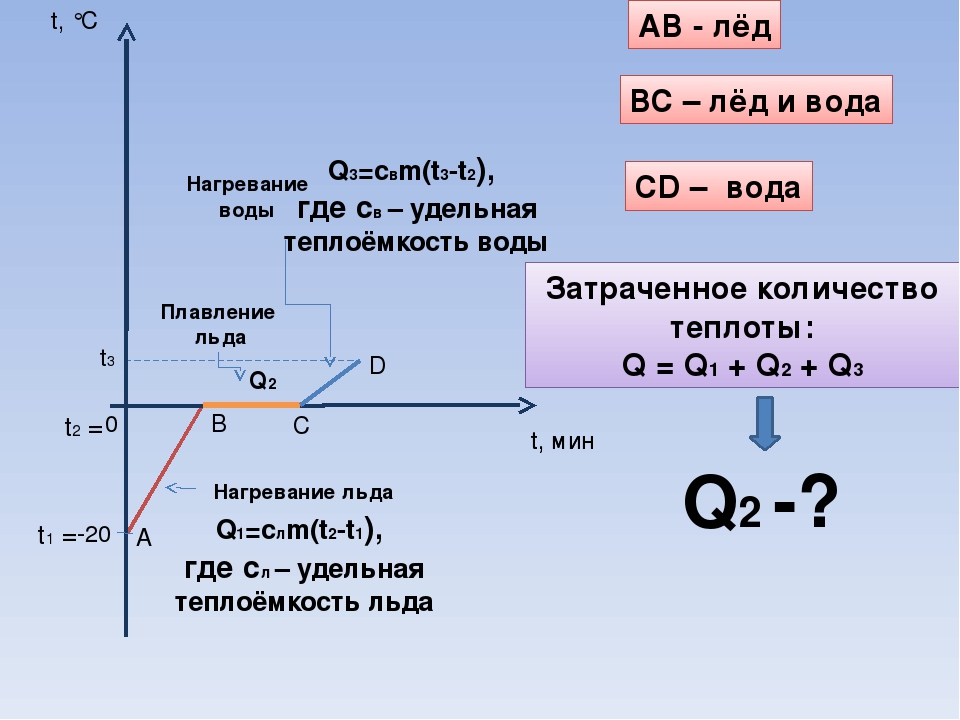
Нагревание и охлаждение
Этот процесс характеризуется изменением температуры системы. Количество теплоты определяется по формуле
Удельная теплоемкость вещества с измеряется количеством теплоты, которое необходимо для нагревания единицы массы данного вещества на 1К. Для нагревания 1кг стекла или 1кг воды требуется различное количество энергии. Удельная теплоемкость — известная, уже вычисленная для всех веществ величина, значение смотреть в физических таблицах.
Теплоемкость вещества С — это количество теплоты, которое необходимо для нагревания тела без учета его массы на 1К.
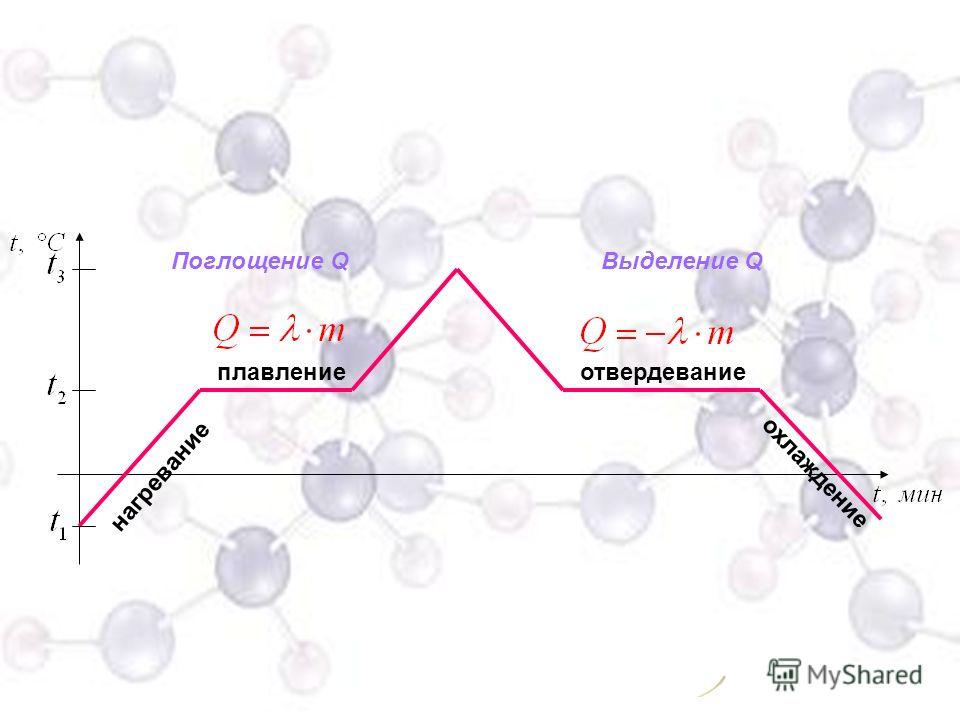
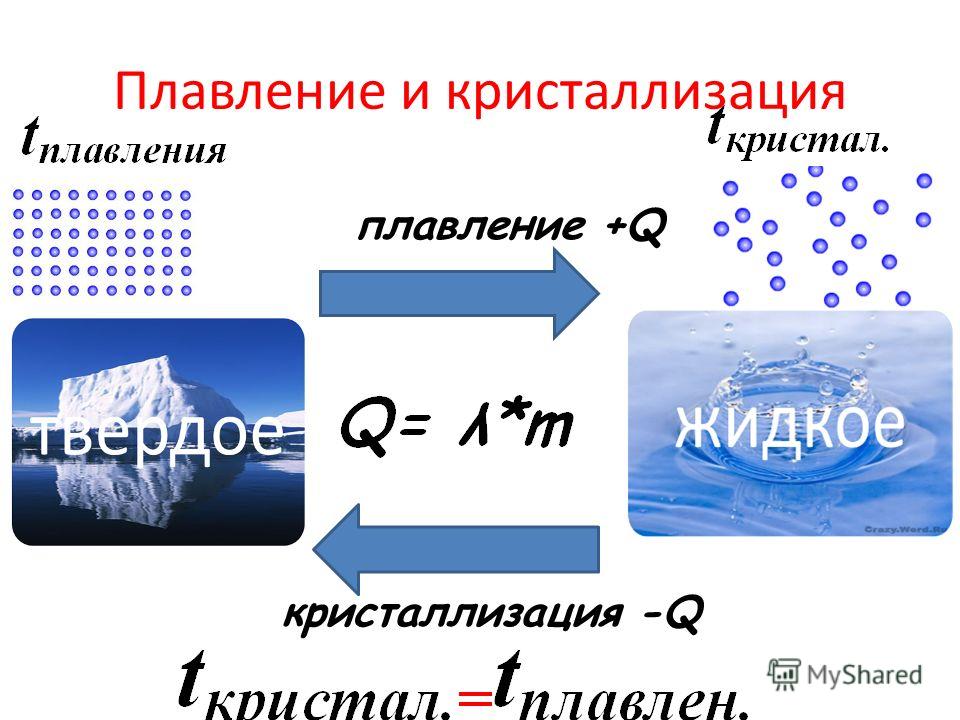
Плавление и кристаллизация
Плавление — переход вещества из твердого состояния в жидкое. Обратный переход называется кристаллизацией.
Энергия, которая тратится на разрушение кристаллической решетки вещества, определяется по формуле
Удельная теплота плавления известная для каждого вещества величина, значение смотреть в физических таблицах.
Парообразование (испарение или кипение) и конденсация
Парообразование — это переход вещества из жидкого (твердого) состояния в газообразное. Обратный процесс называется конденсацией.
Удельная теплота парообразования известная для каждого вещества величина, значение смотреть в физических таблицах.
Горение
Количество теплоты, которое выделяется при сгорании вещества
Удельная теплота сгорания известная для каждого вещества величина, значение смотреть в физических таблицах.
Для замкнутой и адиабатически изолированной системы тел выполняется уравнение теплового баланса. Алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующим в теплообмене, равна нулю:
Q1+Q2+…+Qn=0
Кристаллизация
★ Кристаллизация
Кристаллизация процесс образования кристаллов из газов, растворов, расплавов или стекол. также называют кристаллизации при образовании кристаллов со структурой кристаллов различной структуры или перехода из жидкого состояния в твердое кристаллическое состояние. из-за кристаллизации образование минералов и льда, зубной эмали и костей живых организмов. одновременного роста числа маленьких кристалликов, используемые в металлургии и в других отраслях. В кристаллизации химической промышленности используется для получения веществ в чистом виде.
1) процесс кристаллизации начинается только после охлаждения жидкости до определенной температуры. 2) при кристаллизации температура не изменяется. 3) температура кристаллизации равна температуре плавления.
В формирование кристаллов происходит фазовый переход, т. е. переход вещества из одной термодинамической фазы в другую. образования кристаллов из газов, растворов, расплавов или стекол является фазовым переходом Первого рода, и в кристаллизации полиморфных превращений может быть фазовым переходом второго рода.
е. переход вещества из одной термодинамической фазы в другую. образования кристаллов из газов, растворов, расплавов или стекол является фазовым переходом Первого рода, и в кристаллизации полиморфных превращений может быть фазовым переходом второго рода.
Кристаллизация начинается при достижении некоторого предельного условия, например, переохлаждения жидкости или пересыщения пара, когда практически мгновенно возникает множество мелких кристалликов центров кристаллизации. кристаллы растут путем добавления атомы или молекулы из жидкости или пара. рост граней кристалла происходит послойно, края незавершенных атомных слоев по мере роста путешествий по краю. зависимость скорости роста от условий кристаллизации приводит к разнообразию форм роста и структуры кристаллов. В процессе кристаллизации неизбежно возникают различные дефекты.
Число центров кристаллизации и скорость роста значительно влияет степень переохлаждения.
Степень гипотермии — охлаждения жидкого металла ниже температуры перехода его в кристаллическое вещество модификации. переохлаждение необходимо для компенсации энергии скрытой теплоты кристаллизации. называется первичной кристаллизацией образование кристаллов в металлах, сплавах и жидкостях при переходе из жидкого состояния в твердое.
| Публикации по эксперименту: | 1. Байдусь А.Н., Гребенко А.И., Жухлистова Н.Е., Кислицын Ю.А., Куранова И.П., Ляшенко А.В., Муравьева Т.И., Самыгина В.Р., Смирнова Е.А., Сосфенов Н.И., Степаненко В.Н., Чупова Л.А. Эксперименты по кристаллизации белков на Российском сегменте международной космической станции // Космонавтика и ракетостроение, 2007, № 4 (49), С.13–17.
|
Материаловеды из МГУ научились управлять кристаллизацией перовскитных солнечных батарей
Сотрудники лаборатории новых материалов для солнечной энергетики факультета наук о материалах МГУ изучили процессы формирования светопоглощающего слоя перовскитных солнечных батарей и открыли 4 новых соединения, которые образуются на начальном этапе его кристаллизации. Результаты работы опубликованы в престижном международном журнале Chemistry of Materials.
Результаты работы опубликованы в престижном международном журнале Chemistry of Materials.
Перовскитные солнечные батареи — новое поколение устройств, преобразующих энергию солнечного света в электричество. В настоящее время КПД таких устройств составляет более 25%, превышая рекордные значения наиболее распространённых сегодня солнечных батарей на основе поликристаллического кремния.
Кристаллы гибридного перовскита (оранжевые) и промежуточной фазы (прозрачные).
Основа перовскитного солнечного элемента — тонкий слой кристаллического светопоглощающего материала — гибридного перовскита. Этот материал имеет такую же структуру, как и одноимённый минерал «перовскит», однако совсем иной химический состав. В отличие от природного минерала, имеющего химическую формулу CaTiO3, гибридные перовскиты, синтезируемые в лаборатории и используемые для солнечных батарей, состоят из органических (метиламмоний, формамидиний) и неорганических (ионы свинца, брома, йода) ионов. Поскольку такие соединения сочетают органическую и неорганическую части, их называют гибридными, а их общая формула может быть представлена как APbX3 (A = MA, FA; X = I, Br).
Химический состав гибридного перовскита определяет его свойства. Например, насколько хорошо он будет поглощать свет и насколько устойчив будет к факторам окружающей среды. Последние исследования в области перовскитных элементов показали, что использовать катион формамидиния предпочтительнее, чем катион метиламмония: получаемые на его основе перовскитные солнечные батареи обладают большей стабильностью и эффективностью.
В отличие от других светопоглощающих материалов, гибридные перовскиты имеют важное преимущество: их можно получать кристаллизацией из растворов в органических растворителях (DMF или DMSO). Несмотря на то, что количество работ, посвящённых растворным методам получения гибридных перовскитов исчисляется уже тысячами, механизм кристаллизации, критически влияющий на свойства получаемого материала, по-прежнему оставался малоизученным.
Сотрудники лаборатории новых материалов для солнечной энергетики факультета наук о материалах МГУ ранее установили, что кристаллизацией гибридного перовскита MAPbI3 из DMF можно управлять, контролируя образование промежуточных фаз, а изучение взаимодействие перовскитов с растворителями позволило сотрудникам разработать
новую систему классификации растворителей.
В новой работе учёные рассмотрели все возможные составы кристаллизуемой системы — варьировали тип катиона, аниона, тип растворителя, а также соотношение исходных реагентов в растворе — и установили, какие соединения образуются в ходе кристаллизации данных систем. Отельное внимание было уделено системе с катионом формамидиния, которая в настоящее время считается наиболее перспективной для создания высокоэффективных перовскитных солнечных элементов. В ходе работы было обнаружено 4 новых промежуточных фазы с этим наиболее перспективным катионом и показаны существенные различия в пути кристаллизации в зависимости от состава раствора.
«Проведённая работа имеет важное фундаментальное значение, поскольку мы изучили пути кристаллизации для всех возможных случаев. Это позволило показать полную и завершённую картину того, какие промежуточные соединения могут образовываться при кристаллизации перовскитов с различным составом из различных растворителей. Полученные результаты имеют также и непосредственную практическую значимость. Как нами было показано ранее, путь кристаллизации напрямую обуславливает свойства получаемого материала. Благодаря нашей работе теперь стало известно, какие возможные продукты могут образоваться при получении гибридных перовскитов, и как следует выбирать состав, чтобы управлять кристаллизацией. Таким образом, рациональный выбор составов и контроль условий кристаллизации позволят получить более стабильные и более эффективные перовскитные солнечные батареи», — рассказал руководитель исследования Алексей Тарасов, кандидат химических наук, заведующий лабораторией новых материалов для солнечной энергетики факультета наук о материалах и старший научный сотрудник химического факультета МГУ. г: глгтптг/ттгггггг
г: глгтптг/ттгггггг
(78), 2015——————-
УДК 669.154 Поступила 21.01.2015
ДЕНДРИТНАЯ КРИСТАЛЛИЗАЦИЯ ЧУГУНА DENDRITIC CRYSTALLIZATION OF CAST IRON
В. Ю. СТЕЦЕНКО, ГНУ «Институт технологии металлов НАН Беларуси», г. Могилев, Беларусь V. STETSENKO, SSI «Institute of Technology of Metals of NAS of Belarus», Mogilev, Belarus
Показано, что кристаллизация основных фаз в чугуне происходит по дендритному механизму. Основными фазами при затвердевании чугуна являются дендриты аустенита, графита и цементита. Термодинамически установлено, что шаровидный графит представляет собой сильно разветвленный компактный дендрит со секторально-слоистым строением.
It is shown that crystallization of the main phases in cast iron happens on the dendritic mechanism. The main phases when hardening cast iron are dendrites of austenite, graphite and a cementite. Thermodynamic it is established that spherical graphite represents strongly branched compact dendrite with a sectorial and layered structure.
Ключевые слова. Дендрит, кристаллизация, чугун, аустенит, графит, цементит, нанокристаллы.
Keywords. Dendrite, crystallization, cast iron, austenite, graphite, cementite, nanocrystals.
При кристаллизации чугуна происходят сложные явления, связанные со структурной перестройкой фаз, переносами масс и энергии. В результате образуются кристаллы аустенита, графита и цементита. Термодинамически процесс кристаллизации для каждой фазы чугуна можно описать известным уравнением:
G = -Vg + So, (1)
где G и g — соответственно полная и удельная объемные энергии Гиббса при кристаллизации фазы; V — объем фазы; S — площадь поверхности твердой фазы; о — удельная межфазная поверхностная энергия.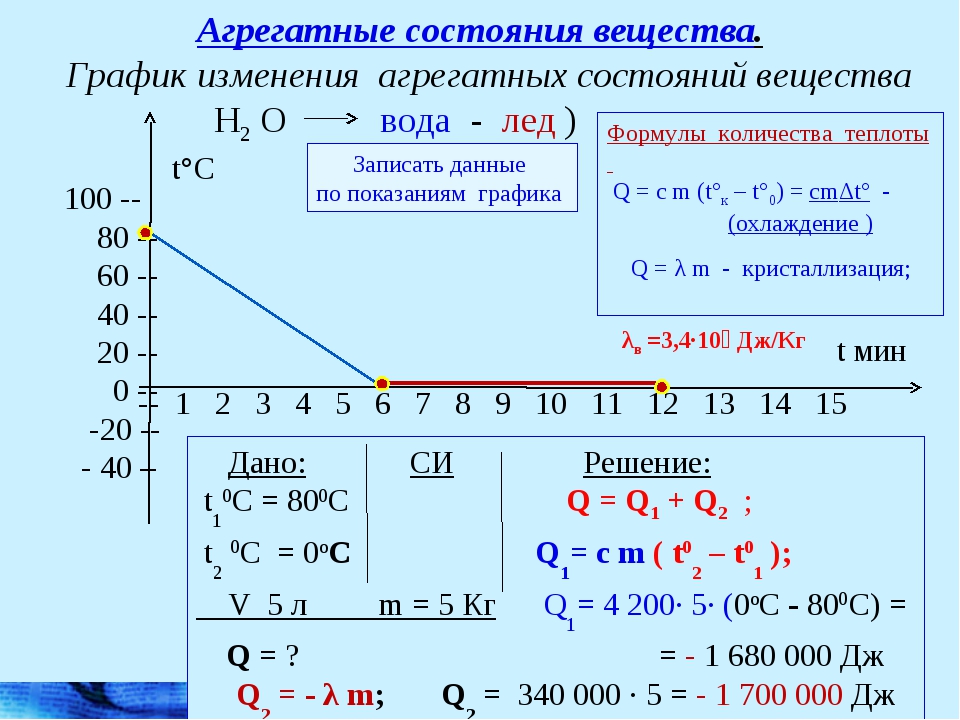 Величина g определяется по уравнению:
Величина g определяется по уравнению:
LAT р TM ’
(2)
где L — молярная теплота кристаллизации фазы; р и M — соответственно плотность и молярная масса фазы; T — температура плавления чугуна; AT — уменьшение равновесной температуры (переохлаждение) при затвердевании чугуна [1]. Подставляя (2) в (1), получаем:
G =-VLATp + sо. (3)
TM
Термодинамические доказано, что процесс кристаллизации фаз при литье заготовок в основном является равновесным [1]. Снижение равновесной температуры на величину AT относительно температуры плавления происходит вследствие высокой дисперсности кристаллизующихся фаз, поскольку расплав является наноструктурной системой [2]. При эвтектическом превращении в чугуне величина переохлаждения процесса определяется как разность температуры плавления эвтектики и средней температуры ее затвердевания. Обычно при литье заготовок из чугуна это «площадки» на температурно-временной кривой охлаждения расплава. Неравновесность при литье заготовки малой массы может проявляться только кратковременно, в начальный момент процесса затвердевания, в виде пикового провала площадки на графике «температура-время». При равновесной кристаллизации фазы G = 0. Тогда из уравнения (3) получим:
лпттгг= г: кт ггтгптгг
‘ 1 (78), 2015
/ 59
5 _ LATр F _ TM с ‘
Величина S /F является коэффициентом формы (к) кристалла фазы. Считается, что центром кристаллизации (ЦК) служит сферический кристалл. Для него коэффициент формы (кс ) можно рассчитать по уравнению:
kc J ,
а„
(5)
где d0 — диаметр сферического кристалла. Причем кс не зависит от количества кристаллов, а определяется только значением dc. По нему можно судить о кристаллизационной обстановке в сплаве в начальной стадии его затвердевания. Коэффициент формы пластинчатого кристалла кп определяется по уравнению:
Причем кс не зависит от количества кристаллов, а определяется только значением dc. По нему можно судить о кристаллизационной обстановке в сплаве в начальной стадии его затвердевания. Коэффициент формы пластинчатого кристалла кп определяется по уравнению:
К =
(6)
где dп — толщина пластинчатого кристалла. Величина кп также не зависит от количества пластин в сплаве. Поэтому по толщине пластины можно по формуле (4), зная AT, определить с и прогнозировать кристаллизационную обстановку в сплаве при его затвердевании. Коэффициент формы цилиндрического кристалла (кц) рассчитываем по уравнению:
(7)
где dц — диаметр цилиндрического кристалла. Причем кц не зависит от количества кристаллов, а определяется только значением d4. Поэтому в соответствии с формулой (4) можно определить с и прогнозировать кристаллизационную обстановку в сплаве в зависимости от величины AT .
Если к > кс, то кристалл увеличивает межфазную поверхность, т. е. разветвляется. В результате образуется дендритный кристалл (дендрит). Разветвление сферического кристалла может происходить цилиндрами (ветвями), пластинами (лепестками) и смешанными (комбинированными) формами (отростками). Если кп > кц, то наиболее сильное разветвление дендрита осуществляется лепестками.
Формулы (4) — (7) позволяют исследовать процесс кристаллизации графита при эвтектическом превращении в чугуне. Для этого используем следующие исходные литературные данные: L _ 71340 Дж моль-1; M _ 0,012 кг; р _ 2200 кг м-3; T _ 1426 К; переохлаждение при кристаллизации пластинчатого графита (ПГ) АТПГ = 16,5 К; переохлаждение при кристаллизации шаровидного графита (ШГ) АТШГ = 46,5 К; удельная межфазная поверхностная энергия системы «расплав- ПГ» Опг = 1,0 Дж-м-2; удельная межфазная поверхностная энергия системы «расплав — ШГ» оШГ = 1,6 Дж-м-2; средний размер (диаметр) ЦК ПГ в отливке чугуна — 12 • 10-6 м; средний размер (диаметр) ЦК ШГ в отливке чугуна — 6 • 10-6 м [3-5]. c: г: гсшг /7/7гггггг:гг
c: г: гсшг /7/7гггггг:гг
/ 1 (78), 2015——————————————————————————-
в тангенциальном направлении. В результате ШГ имеет секторально-слоистое строение [3-5]. В отличие от ПГ ШГ ферромагнитен, поскольку содержит в 10 раз больше железа, которое располагается между слоями ШГ. Таким образом, ШГ представляет собой компактный сильно разветвленный дендритный кристалл. По сравнению с ШГ дендрит ПГ имеет более грубое строение, поскольку менее компактен и слабее разветвлен графитными лепестками. В ПГ они имеют большую толщину, чем в ШГ. При эвтектической кристаллизации чугуна каждый дендрит ПГ образует графитную колонию, растущую из одного ЦК. Количество дендритов ПГ значительно меньше, чем дендритов ШГ, поскольку образование последних происходит при относительно большом переохлаждении.
Формулы (4) — (7) позволяют исследовать процесс кристаллизации аустенита при эвтектическом превращении в чугуне. Для этого используем следующие исходные литературные данные: L = 6730 Дж-моль-1; M = 0,055 кг; р = 7740 кгм-3; T = 1426 К; AT = 16,5 К; удельная межфазная поверхностная энергия системы «расплав-аустенит» с A = 0,2 Дж-м-2 [3,6,7]. Подставляя исходные данные в формулу (4), получаем, что коэффициент формы для кристалла аустенита kA = 5,5 -107 м-1. Это достаточно большое значение, но при одинаковом переохлаждении kA значительно больше кпг (в 2,7 раза). Поэтому кристаллы аустенита формируются в виде дендрита с цилиндрическими отростками (ветвями). Из приведенного выше значения kA и формулы (7) находим, что средний диаметр цилиндрического отростка дендрита аустенита составляет 73 нм. Реально этот диаметр значительно больше. Это свидетельствует о том, что величина с A для нанокристаллов будет намного меньше, чем для макрокристаллов, и определяться радиусом кривизны торца цилиндрического отростка дендрита [1]. Мелкие нанокристаллы аустенита в расплаве имеют удельную межфазную поверхностную энергию, близкую к нулю, что обеспечивает им стабильность выше температуры ликвидус [1]. При повышении степени переохлаждения разветвленность дендрита аустенита увеличивается.
Мелкие нанокристаллы аустенита в расплаве имеют удельную межфазную поверхностную энергию, близкую к нулю, что обеспечивает им стабильность выше температуры ликвидус [1]. При повышении степени переохлаждения разветвленность дендрита аустенита увеличивается.
Формулы (4) — (7) позволяют исследовать процесс кристаллизации цементита при эвтектическом превращении в чугуне. Для этого используем следующие исходные литературные данные: L = 60300 Дж-моль-1; M = 180 кг; р = 7670 кг м-3; T = 1420 К; AT = 50 К; средняя удельная межфазная поверхностная энергия системы «расплав-цементит» Опц = 0,9 Дж-м-2 [3-7]. Подставляя исходные данные в формулу (4), получаем, что коэффициент формы для пластинчатого кристалла цементита кпц = 1-108 м-1. Это достаточно большое значение, но кпц немного меньше кпг- Поэтому кристаллы цементита по сравнению с ПГ формируются в виде менее разветвленного дендрита с более грубыми пластинами. Из приведенного выше значения кпц и формулы (6) находим, что средняя толщина цементитной пластины составляет 10 нм. Реально толщина пластины цементита значительно больше. Это свидетельствует о том, что величина Опц для нанокристаллов будет намного меньше, чем для макрокристаллов, и определяться радиусом кривизны торца пластины. Мелкие нанокристаллы цементита в расплаве имеют удельную межфазную поверхностную энергию, близкую к нулю, что обеспечивает им стабильность выше температуры ликвидус [1].
Таким образом, при затвердевании отливок из чугуна аустенитно-графитная эвтектика представляет собой смесь дендритов аустенита и графита, а аустенитно-цементитная эвтектика — смесь дендритов аустенита и цементита. Шаровидный графит является сильно разветвленным компактным дендритом со секторально-слоистым строением.
Литература
1. М а р у к о в и ч Е. И., С т е ц е н к о В. ГГГГГГ /G1
ГГГГГГ /G1
——————————————————————————————————1 (78), 2015 / и I
3. Z a h a г c h e n k o Je. V, L e v c h e n k o Ju. N., G o r e n k o V G., V a r e n i k P. A. Otlivki iz chuguna s sharovidnym i vermikuljarnymgrafitom [Cast iron with nodular and vermicular graphite]. Kiev. Naukova dumka Publ., 1986.
4. N e i z h k o I. G. Grafitizacija i svojstvachuguna [Graphitization and properties of cast iron]. Kiev, Naukova dumka Publ., 1989.
5. S h e b a t i n o v M. P., A b r a m e n k o Ju. E., B e h N. I. Vysokopro chnyjchugun v avtomobilestroenii [Ductile iron in the automotive industry]. Moskov, Mashinostroenie Publ., 1988.
6. S a l l i I. V Kristallizacija stali [Crystallization steel]. Kiev, Naukova dumka Publ., 1974.
7. S a m s o n o v G. V, V i n i c k i j I. M. Tugoplavkie soedinenija (spravochnik) [Refractory compounds (reference)]. Moskov, Metallurgija Publ., 1976.
Сведения об авторе
Стеценко Владимир Юзефович, канд. техн. наук, ГНУ «Институт технологии металлов НАН Беларуси, Беларусь, г. Могилев, ул. Бялыницкого-Бирули, 11. Тел. (+375-17) 222-28-85-97. E-mail. [email protected]
Information about the authors
Stetsenko Vladimir, Candidatе of Technical Sciences, SSI «Institute of Technology of Metals of NAS of Belarus», Mogilev, Bialynitskogo-Biruli, 11, Belarus. Tel.(+375-17) 222-28-85-97. E-mail. [email protected]
9.6. Кристаллизация веществ из растворов
Кристаллизация вещества из раствора — это процесс перехода растворенного вещества из жидкой фазы в кристаллическую. Обычно он сопровождается появлением множества мелких монокристаллов, поэтому носит название массовой кристаллизации.
Обычно он сопровождается появлением множества мелких монокристаллов, поэтому носит название массовой кристаллизации.
Массовая кристаллизация вызвана одновременным возникновением в пересыщенном растворе многих центров кристаллизации, что может происходить при охлаждении раствора (кривая 1, рис. 208) либо при его нагревании (кривая 2) в зависимости от знака изменения энтальпии АН растворения вещества конкретном растворителе.
Массовую кристаллизацию можно вызвать не только изменением температуры раствора, но и удалением части растворителя при выпаривании раствор или введением другого растворителя (высаливание).
рис 208. Кривые растворимости веществ:1- растворимость увеличивается с ростом температуры; 2 — уменьшается; 3 — мало изменяется (ΔW — изменение энтальпии процесса растворения)
При массовой кристаллизации вещества из раствора происходит перераспределение примесей между остающейся жидкой фазой (фильтратом, маточным раствором) и кристаллами. Примеси либо накапливаются в маточном распоре, либо в кристаллах (кристализанте). Встречаются случаи, когда они почти равномерно распределяются между твердой и жидкой фазами и очистки кристаллов не происходит.
Распределение примеси В между фазами зависит (если кристаллы — твердый раствор) от значения концентрационной константы равновесия:
(9.11)
где Db — константа равновесия; хт(В) и Хт(А) — молярные доли примеси В и кристаллизующегося вещества А в твердом растворе; ст(В) и ст(А) — моляльности тех же компонентов в жидкой фазе .
Когда DB « 1, происходит накопление примеси В в жидкой фазе, при Or > 1 примесь В переходит преимущественно в кристаллы. Если же Dв = 1, то кристаллизация вещества из раствора с целью его очистки от примеси В бесполезна, примесь не будет накапливаться ни в одной из равновесных фаз. Поэтому перед применением кристаллизации вещества из раствора для очистки его от той или иной примеси следует знать значение DB, табличное или установленное экспериментально.
Кристаллизация вещества приводит к существенному понижению концентрации только той примеси в кристаллах, которая не образует с выделяющейся твердой фазой твердых растворов и обладает большей растворимостью по сравнению с основным веществом. Удаляемые примеси при кристаллизации не должны образовывать насыщенных растворов .
Если кристаллизация вещества вызвана понижением температуры раствора, то ее называют изогидрической, поскольку в этом процессе количество растворителя не изменяется. Если же массовую кристаллизацию проводить за счет частичного удаления растворителя путем выпаривания раствора, то это будет изотермическая кристаллизация, так как выпаривание насыщенного раствора происходит при постоянной температуре кипеня. Наконец, кристаллизация малорастворимого вещества может происходить при химическом взаимодействии двух или более растворенных веществ. Тогда ее называют химической кристаллизацией, или осаждением вещества.
Известно много конструкций лабораторных кристаллизаторов. Ниже приведены только наиболее простые и часто применяемые.
Рис. 209. Кристаллизаторы: с мешалкой (а, б), барботажный (в), Чернова -Ковзуна (г) и Стёпина — Гойхраха (д)
Изoдидрическую кристаллизацию осуществляют в лабораториях самым простым способом — в химических стаканах с меткой после предварительного упаривания раствора до появления на поверхности жидкости небольшой корки мелких кристаллов. Обычно стакан 3, снабженный термометром / и мешалкой 2, с насыщенным раствором погружают либо в ванну (рис. 209, о) с охлаждающей смесью, либо в сосуд 4 (рис. 209, б) с проточной водопроводной водой. Для контроля за конечной температурой кристаллизации, если это необходимо, в стакан помещают термометр 1. По окончании кристаллизации стакан извлекают из ванны и кристаллы 5 отфильтровывают от маточного раствора на воронке Бюхнера (см. рис. 200, а) или другом фильтрующем устройстве.
Чтобы избежать образования мелких кристаллов, мешалку 2 или циркуляцию охлаждающей жидкости включают спустя некоторое время после помещения стакана с нагретым раствором в охлаждающую среду.
Инкрустации на стенках стакана в большинстве случаев не образуются. Появившаяся корочка кристаллов, приставших к стенке стакана, легко снимается стеклянной палочкой после временной остановки мешалки.
Кристаллы, растущие при перемешивании раствора во взвешенном состоянии, захватывают меньшее количество маточного раствора и получаются более чистыми, чем при кристаллизации без перемешивания.
Для получения более или менее однородных по размеру кристаллов применяют барботажный кристаллизатор непрерывно или периодического действия (рис. 209, в).
Он состоит из стеклянного или полимерного сосуда 4 и циркуляционной трубки, закрепленной в пробке сосуда. Для перемешивания и охлаждения нагретого раствора, поступающего в кристаллизатор
без трубку 3, снизу через трубку 8 подают азот из баллона.
от проходит стеклянный пористый фильтр 7 и разбивается на
мельчайшие пузырьки, попадающие через направляющую трубку циркуляционную трубку 5. Нагретый раствор, соприкасается с азотом, охлаждается и выделяет кристаллы. Частично кристаллизация происходит и за счет некоторого испарения растворителя, пар которого уносится вместе с азотом через трубку 2. Крупные кристаллы осаждаются и выводятся в виде суспензии через клапан 9 на фильтр. Мелкие же кристаллы захватываются циркулирующим раствором снова в трубку 5, где продолжают расти и, достигнув определенного размера, опускаются на дно кристаллизатора. В растворе, находящемся между корпусом сосуда 4 и циркуляционной трубкой, кристаллизация практически не происходит, так как сюда поступает предварительно нагретый раствор. Иногда в верхней части трубы 5 делают отверстия для слива суспензии в кольцевое пространство между корпусом и трубой. Кристаллизатор сообщается с атмосферой через трубку 1.
Изотермическую кристаллизацию проводят в установках, позволяющих упаривать растворы. В частности, в лабораторном кристаллизаторе Чернова — Ковзуна (рис. 209, г) растворитель многократно испаряется и конденсируется. Кристаллизация вещества в этой установке происходит следующим образом. В стеклянную колонку 7 помещают стеклянный перфорированный стакан 8 с веществом, требующим перекристаллизации, а в стеклянную колонку 3 заливают растворитель до середины расширенной части при открытом кране 6, соединяющем две колонки. Растворитель должен заполнить две колонки до одного уровня. Затем, вставив пальчиковый холодильник 9 и фторопластовую пробку 1, включают трубчатый электронагреватель 2. Пар кипящего растворителя конденсируется на стенках холодильника и стекает в стакан с веществом, растворяя его. Раствор перетекает в колонку испарения и подвергается там кристаллизации. Образующиеся кристаллы 4 оседают на фильтрующей пластинке 5. Обогащенный примесями раствор периодически выпускают через кран 6. После того как по
Кристаллизация вещества в этой установке происходит следующим образом. В стеклянную колонку 7 помещают стеклянный перфорированный стакан 8 с веществом, требующим перекристаллизации, а в стеклянную колонку 3 заливают растворитель до середины расширенной части при открытом кране 6, соединяющем две колонки. Растворитель должен заполнить две колонки до одного уровня. Затем, вставив пальчиковый холодильник 9 и фторопластовую пробку 1, включают трубчатый электронагреватель 2. Пар кипящего растворителя конденсируется на стенках холодильника и стекает в стакан с веществом, растворяя его. Раствор перетекает в колонку испарения и подвергается там кристаллизации. Образующиеся кристаллы 4 оседают на фильтрующей пластинке 5. Обогащенный примесями раствор периодически выпускают через кран 6. После того как по
чти все вещество перейдет из колонки 7 на фильтр 5, весь раствор спускают и 3 Мают с колонки 3 нижнюю часть с фильтром и кристаллами.
Эту часть установки готовят из полипропилена.
Портативный кристаллизатор Стёпина — Гойхраха (рис. 209 служит для непрерывной кристаллизации с испарением растворителя. Он состоит из корпуса 5, внутри которого размещен ленточный шнек 1, вращающийся во фторопластовых подшипниках, установленных в торцевых стенках корпуса. Шнек вращается от приводного механизма (на рисунке не показан) с числом оборотов от 1 до 10 в минуту. Корпус и шнек готовят из нержавеющей стали или титана, а приемник кристаллов 4 из органического стекла.
Нагревание раствора проводят при помощи ИК-излучателей Р(см. рис. 115). Камера, в которой они находятся, имеет рубашку 8 с проточной водой, подаваемой в таком количестве, чтобы на выходе из нее температура была равной 60 — 80 °С. Нагретую воду направляют в рубашку 6, расположенную в нижней части корпуса. Здесь она отдает теплоту на нагревание нижних слоев раствора. В кристаллизаторе поддерживают постоянный уровень раствора при помощи сосуда Мариотта 11 соединенного с кристаллизатором резиновой трубкой 10. Пар растворителя отсасывается водоструйным насосом (см. рис. 258) через трубку 7. Воздух в корпус поступает через трубку 2, снабженную фильтром Петрянова . Кристаллы, образующиеся при выпаривании раствора, переносятся шнеком в верх корпуса 5 и через трубку 3 сбрасываются в приемник 4, откуда периодически направляются на сушку.
Пар растворителя отсасывается водоструйным насосом (см. рис. 258) через трубку 7. Воздух в корпус поступает через трубку 2, снабженную фильтром Петрянова . Кристаллы, образующиеся при выпаривании раствора, переносятся шнеком в верх корпуса 5 и через трубку 3 сбрасываются в приемник 4, откуда периодически направляются на сушку.
Режим работы кристаллизатора можно регулировать в большом диапазоне за счет изменения скорости вращения шнека и температуры ИК-излучателей.
Такие вакуум-кристаллизаторы полезны для кристаллизации веществ, растворимость которых мало изменяется с температурой или возрастает с уменьшением температуры.
При изотермической кристаллизации процессы выпаривания и кристаллизации объединены в одну операцию. Отсутствие теплопередающих поверхностей у кристаллизаторов, в которых происходит образование кристаллов, позволяет изготавливать их из коррозионно-устойчивых полимерных материалов, обладающих малой теплопроводностью. Надежная герметичность и высокая химическая инертность полимерных материалов позволяют в таких аппаратах проводить кристаллизацию особо чистых веществ.
К числу таких вакуум-кристаллизаторов принадлежит простой аппарат Стёпина с фторопластовым цилиндрическим корпусом 4 (рис. 210, а), соединенным с фторопластовым дном крышкой при помощи резьбы (возможно и фланцевое соединение. Через штуцер 3 кристаллизатор связан с водоструйным насосом (см. рис. 258).
Рис. 210. Вакуум-аппараты Стёпина для изотермической кристаллизации (а) и фторогшастово-стеклянный (б)
Другие части:
9.6. Кристаллизация веществ из растворов. Часть 1
9.6. Кристаллизация веществ из растворов. Часть 2
9.6. Кристаллизация веществ из растворов. Часть 3
К оглавлению
ПЭТ (полиэтилентерефталат) :: ЯрПЭТ
Полиэтилентерефталат (ПЭТФ, ПЭТ) — это термопластик, который также именуется как полиэфир, лавсан и т. д. В СССР полиэтилентерфталат и получаемое из него волокно называли лавсаном, в честь места разработки — Лаборатории Высокомолекулярных Соединений Академии Наук. Аналогичные волоконные материалы, изготавливаемые в других странах, получили другие названия: терилен, дакрон, тергал, тревира, теторон, полиэстер, мелинекс, милар (майлар) и т. д.
д. В СССР полиэтилентерфталат и получаемое из него волокно называли лавсаном, в честь места разработки — Лаборатории Высокомолекулярных Соединений Академии Наук. Аналогичные волоконные материалы, изготавливаемые в других странах, получили другие названия: терилен, дакрон, тергал, тревира, теторон, полиэстер, мелинекс, милар (майлар) и т. д.
В настоящее время употребляются оба сокращения, однако когда речь идет о полимере, чаще используется название ПЭТФ, а когда об изделиях из него — ПЭТ. Продукт поликонденсации этиленгликоля с терефталевой кислотой (или ее диметиловым эфиром) — это твердое, бесцветное, прозрачное вещество в аморфном состоянии и белое, непрозрачное в кристаллическом состоянии. При нагреве до температуры стеклования переходит в прозрачное состояние и остается в нем при резком охлаждении и быстром проходе через так называемую «зону кристаллизации».
Важным параметром ПЭТ (ПЭТФ — полиэтилентерефталат) является вязкость, которая определяется длиной молекулы полимера. С увеличением параметра присущей вязкости скорость кристаллизации снижается. ПЭТ, ПЭТФ (полиэтилентерефталат) обладает такими качествами как: прочность, износостойкость. ПЭТ, ПЭТФ является хорошим диэлектриком.
Полиэтилентерефталат обладает высокой механической прочностью и ударостойкостью, устойчивостью к истиранию и многократным деформациям при растяжении и изгибе и сохраняет свои высокие ударостойкие и прочностные характеристики в рабочем диапазоне температур от -40 °С до +60 °С.
ПЭТ отличается низким коэффициентом трения и низкой гигроскопичностью. Общий диапазон рабочих температур изделий из полиэтилентерефталата от -60 до 170 °C.
По внешнему виду и по светопропусканию (90%) листы из ПЭТ аналогичны прозрачному оргстеклу (акрилу) и поликарбонату. Однако по сравнению с оргстеклом у полиэтилентерефталата ударная прочность в 10 раз больше.
Огромное значение по использованию ПЭТ (ПЭТФ — полиэтилентерефталат) приобрело и в промышленном производстве: пленки, канаты, упаковочные ленты, шпагаты, производство различных преформ для изготовления бутылки.
Основные характеристики полиэтилентерефталата
- Теплопроводность: 0,14 Вт/(м·К).
- Сжимаемость (расплав): 99·106 Мпа.
- Относительное удлинение при разрыве:12-55%.
- Температура стеклования аморфного полиэтилентерефталата: 67 °С.
- Температура стеклования кристаллического полиэтилентерефталата: 81 °С.
- Температура плавления: 250-265 °С.
- Температура разложения: 350 °С.
- Показатель преломления (линия Na) аморфного полиэтилентерефталата: 1,576.
- Показатель преломления (линия Na) кристаллического полиэтилентерефталата: 1,640.
- Предел прочности при растяжении: 172 МПа.
- Модуль упругости при растяжении: 1,41·104 МПа.
- Влагопоглощение: 0,3%.
- Допустимая остаточная влага: 0,02%.
- Морозостойкость: до -60 °С.
ВОДА РАСЧЕТА КРИСТАЛЛИЗАЦИИ гидратированные и безводные соли Док Заметили ошибку по неосторожности? | См. Также 14.1 % чистоты продукта и аналитические расчеты 14,2a % выход реакции и расчет теоретического выхода 14.2b расчеты атомной экономики 14,5 как
См. Также 14.1 % чистоты продукта и аналитические расчеты 14,2a % выход реакции и расчет теоретического выхода 14.2b расчеты атомной экономики 14,5 как
НАЧАЛО СТРАНИЦЫ Выше представлена типичная таблица Менделеева, используемая в спецификациях по науке и химии GCSE и я «обычно» использовал эти значения в своих расчетах на примере, чтобы охватить большинство НАЧАЛО СТРАНИЦЫ ДРУГИЕ РАСЧЕТНЫЕ СТРАНИЦЫ
кристаллизационная вода НАЧАЛО СТРАНИЦЫ |
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Определение кристаллизации
Кристаллизация — это затвердевание атомов или молекул в высокоструктурированную форму, называемую кристаллом.Обычно это относится к медленному осаждению кристаллов из раствора вещества. Однако кристаллы могут образовываться из чистого расплава или непосредственно в результате осаждения из газовой фазы. Кристаллизация может также относиться к технологии разделения твердой и жидкой фаз и очистки, при которой происходит перенос массы из жидкого раствора в чистую твердую кристаллическую фазу.
Хотя кристаллизация может происходить во время осаждения, эти два термина не являются взаимозаменяемыми. Осаждение просто относится к образованию нерастворимого (твердого) вещества в результате химической реакции.Осадок может быть аморфным или кристаллическим.
Процесс кристаллизации
Чтобы произошла кристаллизация, должны произойти два события. Во-первых, атомы или молекулы группируются вместе в микроскопическом масштабе в процессе, называемом зародышеобразованием . Затем, если кластеры станут стабильными и достаточно большими, может произойти рост кристалла .
Атомы и соединения обычно могут образовывать более одной кристаллической структуры (полиморфизм). Расположение частиц определяется на стадии зародышеобразования кристаллизации. На это может влиять множество факторов, включая температуру, концентрацию частиц, давление и чистоту материала.
На это может влиять множество факторов, включая температуру, концентрацию частиц, давление и чистоту материала.
В растворе в фазе роста кристаллов устанавливается равновесие, при котором частицы растворенного вещества растворяются обратно в раствор и выпадают в осадок в виде твердого вещества. Если раствор перенасыщен, это вызывает кристаллизацию, потому что растворитель не может поддерживать дальнейшее растворение. Иногда перенасыщенного раствора недостаточно, чтобы вызвать кристаллизацию.Может потребоваться затравочный кристалл или шероховатая поверхность для начала зародышеобразования и роста.
Примеры кристаллизации
Материал может кристаллизоваться естественным или искусственным путем, быстро или в течение геологического времени. Примеры естественной кристаллизации включают:
- Образование снежинки
- Кристаллизация меда в банке
- Образование сталактитов и сталагмитов
- Осаждение кристаллов драгоценных камней
Примеры искусственной кристаллизации включают:
Методы кристаллизации
Есть много методов, используемых для кристаллизации вещества.В значительной степени они зависят от того, является ли исходный материал ионным соединением (например, солью), ковалентным соединением (например, сахаром или ментолом) или металлом (например, серебром или сталью). Способы выращивания кристаллов включают:
- Охлаждение раствора или расплава
- Испарение растворителя
- Добавление второго растворителя для снижения растворимости растворенного вещества
- Сублимация
- Наслоение растворителем
- Добавление катиона или аниона
Наиболее распространенный процесс кристаллизации заключается в растворении растворенного вещества в растворителе, в котором оно, по крайней мере, частично растворимо.Часто температура раствора повышается для увеличения растворимости, поэтому максимальное количество растворенного вещества переходит в раствор. Затем теплую или горячую смесь фильтруют, чтобы удалить нерастворенный материал или примеси. Оставшемуся раствору (фильтрату) дают медленно остыть, чтобы вызвать кристаллизацию. Кристаллы можно удалить из раствора и дать им высохнуть, или их можно промыть, используя растворитель, в котором они нерастворимы. Если процесс повторяется для повышения чистоты образца, это называется перекристаллизацией.
Скорость охлаждения раствора и количество испарения растворителя могут сильно повлиять на размер и форму образующихся кристаллов. Как правило, более медленное испарение приводит к минимальному испарению.
Кристаллизация из перенасыщенного раствора
Краткое описание:
Экзотермическая кристаллизация из перенасыщенного раствора демонстрируется путем выливания раствора тригидрата ацетата натрия на кристаллы в химическом стакане, в результате чего образуется столбик твердого вещества, который может достигать нескольких дюймов в высоту.
Назначение / цель:
Усиливает представления о том, из чего состоит раствор, о пересыщении и кристаллизации. Иллюстрирует концепцию экзотермичности во время кристаллизации.
Объяснение эксперимента:
При температурах ниже 58 ° C растворы, насыщенные по отношению к безводному ацетату натрия, являются перенасыщенными по отношению к тригидрату. Состав приготовленного раствора соответствует 88 г NaC 2 H 3 O 2 на 100 г воды.100 г воды включают добавленную воду и воду для гидратации. Когда этот раствор охлаждают до 20 ° C, он является ненасыщенным по отношению к NaC 2 H 3 O 2 , но перенасыщенным по отношению к NaC 2 H 3 O 2 .3H 2 O. Таким образом, «затравка» раствора тригидратом вызывает образование кристаллов гидратированного ацетата натрия. Кристаллизация является экзотермической, и образующееся твердое вещество на ощупь является теплым.
Подготовка материалов:
Необходимые материалы:
- 175 г тригидрата ацетата натрия, NaC 2 H 3 O 2 .3H 2 O
- 50 мл дистиллированной воды
- Стакан на 2 л
- Конфорка
- Колба Эрленмейера 500 мл
- Стакан 100 мл
- Стакан 250 мл
- Лопатка
Приготовьте кипящую водяную баню, наполнив химический стакан 2 л примерно 1,5 л воды и нагрея на горячей плите. Перенасыщенный раствор готовят, помещая 175 г тригидрата ацетата натрия и 50 мл дистиллированной воды (3.5 г NaC 2 H 3 O 2 .3H 2 O на мл H 2 O) в колбе Эрленмейера на 500 мл, нагревая смесь на водяной бане и периодически перемешивая до получения прозрачного гомогенного раствора получается. Снимите колбу с водяной бани, поместите перевернутый стакан на 100 мл на горлышко колбы и дайте раствору спокойно остыть, пока он не достигнет комнатной температуры (примерно 1-3 часа).
После демонстрации твердое вещество можно разрезать лопаткой и вернуть в колбу Эрленмейера для повторного использования.Перенасыщенный раствор восстанавливается путем нагревания на кипящей водяной бане — его можно использовать повторно, если он не загрязнен. После нескольких циклов использования может потребоваться добавление небольшого количества воды, чтобы компенсировать потери при испарении.
Перенасыщенный раствор иногда трудно приготовить. Вся посуда должна быть чистой и без царапин. Если после нескольких попыток раствор не может быть охлажден до комнатной температуры без кристаллизации, его следует выбросить. Очистите или замените стеклянную посуду и начните с другого образца.
Поскольку даже небольшой выступ может вызвать кристаллизацию, следует приготовить более одного образца перенасыщенного раствора.
Представительство:
Чтобы продемонстрировать кристаллизацию, поместите несколько кристаллов тригидрата ацетата натрия в стакан объемом 250 мл и вылейте раствор на кристаллы. Не делайте это слишком медленно, так как твердое вещество может начать образовываться в горлышке колбы и в конечном итоге забить ее. Кристаллизация начинается немедленно, образуя холмик из белого твердого ацетата натрия — химический стакан используется для предотвращения слишком большого распространения твердого вещества.Вся вода задерживается внутри твердого вещества, не оставляя видимых следов жидкости. Твердое вещество на ощупь кажется теплым. Форма насыпи будет зависеть от способа заливки раствора — столбы могут быть разных форм и размеров.
Опасности:
Растворы достаточно горячие, чтобы вызвать ожоги. Если кристаллизованный ацетат натрия коснется кожи, промойте его водой.
Выбытие:
Материалы подлежат вторичной переработке.Если требуется утилизация, твердое вещество следует смыть водой в канализацию.
Видео:
Общая концепция:
- Основные понятия
- Растворы и соли
Тип реакции:
Первичная ссылка:
- Шахашири, Б.З. 1983, Химические демонстрации — Справочник для учителей химии, т. 1 с. 27-30.
Теги:
Упрощенный подход к балансам масс кристаллизации — Химическая инженерия
При непрерывной кристаллизации часто бывает сложно точно измерить массовый расход, но описанный здесь метод обеспечивает более простой путь к сбалансированному процессу кристаллизации
Очевидно, что для получения оптимальной выгоды от промышленных процессов кристаллизации важно понимание конкретных свойств кристаллов [ 1 ], но также важно иметь точное представление о массовых балансах системы.На практике точное измерение массового расхода в процессах кристаллизации может быть довольно обременительным, особенно на крупных производственных предприятиях, на которых может быть установлено меньше измерительной аппаратуры по сравнению с меньшими экспериментальными установками, ориентированными на исследования. В этой статье представлена простая модель баланса массы, которая обеспечивает базовое понимание испарительной кристаллизации с использованием шести независимых уравнений и семи неизвестных массовых расходов. Используя эту модель, оценка только одного массового расхода напрямую обеспечивает массовый баланс всего процесса кристаллизации.
Обзор кристаллизации
На рисунке 1 показана простая модель процесса непрерывной кристаллизации, состоящего из одного испарителя, как в установке механической рекомпрессии пара (MVR), или состоящего из нескольких последовательно соединенных испарителей, как в установке многоэффектного испарения (MEE). Соответствующие параметры процесса и номенклатура для этого примера приведены в таблице 1. В модели различие между сатуратором и испарителями является чисто концептуальным, поскольку на практике оба этапа процесса объединены.Поток исходного материала ( F ) обычно немного ненасыщен по отношению к растворенному веществу в условиях (таких как температура, давление и состав) в последнем испарителе. Обратите внимание, что подача может происходить случайным образом в один или несколько испарителей. Последний испаритель — это тот, из которого (объединенная) суспензия поступает в центрифугу, которая отделяет кристаллы от маточного раствора. В сатураторе испаряется только вода ( W1 ) до тех пор, пока сырье не станет насыщенным ( SF ).Следовательно, в сатураторе не происходит кристаллизации.
РИСУНОК 1. Эта простая модель непрерывного процесса кристаллизации показывает массовые потоки, причем часть каждого потока представляет воду (выделено синим цветом) и технологическое растворенное вещество (выделено желтым цветом). Массовый расход кристаллов указывает на ту часть растворенного вещества, которая превратилась в твердые кристаллы
В испарителе вода ( W2 ) испаряется, что приводит к кристаллизации твердых частиц (кристалл ) и одновременному образованию потока насыщенного маточного раствора ( ML ).Общий расход воды ( W ) складывается из W1 и W2 . Концентрация растворенного вещества ( C , мас.%) В сырье и его растворимость ( S , мас.%) В маточном растворе последнего испарителя обычно легко определяются аналитически и считаются известными. Также известен коэффициент концентрации ( CF ), который представляет собой отношение массового расхода сырья и массового расхода маточного раствора. В общем, CF почти всегда можно определить по примеси в сырье, которая остается растворенной в маточном растворе при кристаллизации, так называемом маркере.Таким образом, CF равно отношению концентрации маркера в маточном растворе и его концентрации в сырье. Обратите внимание, что единицей измерения концентрации маркера должна быть масса / кг, тогда как масса / л является стандартной для аналитических данных. Следовательно, требуется деление по плотностям исходного материала и маточного раствора, если эти плотности не равны. На практике включением маркера в отдельные кристаллы можно пренебречь с точки зрения баланса массы. Теперь можно составить следующий набор уравнений, в котором все символы, кроме C , S и CF , отражают массовый расход:
Общий весовой баланс:
F = ML + кристалл + W ( 1 )
Уравнение концентрации:
F = CF × ML ( 2 )
Баланс насыщенности:
F = SF + W1 ( 3 )
Уравнение субнасыщенности:
SF = C / S × F ( 4 )
Водный баланс:
W = W1 + W2 ( 5 )
Уравнение растворимости:
W2 = (100 — S ) / S × кристалл ( 6 )
Остаток кристаллизатора:
SF = W2 + кристалл + ML ( 7 )
Уравнения (1), (3), (5) и (7) представляют собой простые массовые балансы.Уравнения (2), (4) и (6) основаны на концентрации. Поскольку уравнение (7) может быть получено из уравнений (1), (3) и (5), это уравнение не является независимым и может использоваться в качестве проверки. Математическая стабильность требует, чтобы S ≠ 0.
Приведенный выше набор уравнений состоит из шести независимых уравнений и семи неизвестных массовых расходов ( F , SF , W1 , W2 , W , кристалл и ML ). Следовательно, можно свободно выбирать только один массовый расход, который фиксирует производительность процесса кристаллизации.Это фундаментально, поскольку, в конце концов, приведенная выше система уравнений действительна независимо от единицы измерения, выбранной для массовых потоков (это означает, что тонна / с так же оправдана, как и мг / год).
Если, например, выбран расход подачи 100 условных единиц (а.е.), как на рисунке 1, все другие массовые потоки фиксированы, предполагая, что известны C , S и CF . Конечно, при желании можно свободно выбрать один из других массовых расходов, но тогда скорость подачи будет фиксированной.
Следовательно, необходимо измерить только один массовый расход, чтобы получить доступ ко всем остальным массовым расходам, что может быть весьма удобно, особенно на крупных производственных предприятиях. Наиболее подходящими массовыми расходами для измерения являются конденсат ( W ) или сырье ( F ).
Измерение массового расхода кристалла или массового расхода ML сложнее, поскольку в точке разделения некоторое количество маточного раствора остается прикрепленным к кристаллам, а крошечные кристаллы могут оставаться в другом растворе.
Очевидно, что массовый расход насыщенного сырья ( SF ) технически недоступен для измерения.
Дополнительной особенностью этого подхода является то, что измерение двух массовых расходов (например, W и F ) обеспечивает удобный метод проверки рабочих характеристик двух задействованных расходомеров. Кроме того, обратите внимание, что C потенциально может быть больше S , что приводит к отрицательному значению W1 .
Плотность естественного раствора
Плотность естественного раствора ( НСД ; мас.%) процесса кристаллизации приведено в уравнении (8) ниже:
NSD = 100 × кристалл / ( кристалл + ML ) ( 8 )
Замена и перегруппировка с использованием уравнений (1) — (8) показывает, что это уравнение NSD может быть преобразовано в уравнение (9):
NSD = 100 × (C x CF — S) / (C ✕ CF — S + 100) ( 9 )
Уравнение (9) показывает, что естественная плотность суспензии не зависит от массового расхода и может быть легко рассчитана из C , S и CF .Кроме того, можно построить простой график, который дает NSD как функцию от CF , как показано на рисунке 2, где C = S.
Рис. 2. Естественная плотность пульпы зависит от коэффициента концентрации, но не зависит от массового расхода.
Физическая причина прямой причинно-следственной связи между NSD и CF связана с испарением воды, как показано на рисунке 3. Если вода испаряется из насыщенного раствора, оба CF и NSD увеличиваются.
Рис. 3. Испарение воды является движущей силой
связи между естественной плотностью пульпы и коэффициентом концентрации (CF)
Стекло и весовой процент
В таблице 1 NSD представлен один раз как процентное содержание по массе (мас.%) И один раз как процентное содержание стекла (г%). NSD сначала определяется как мас.% В уравнении (8), что удобно для расчетов баланса массы.
Рис. 4. Для определения естественной плотности суспензии в процентах по стеклу (г%) суспензию кристаллов наливают в мерный цилиндр и дают ей возможность свободно осесть.После осаждения высота суспензии кристаллов и маточного раствора используется для определения процентного содержания стекла
.
Однако на практике плотность суспензии обычно определяется в г% с использованием стеклянного (или пластикового) измерительного цилиндра, как показано на рисунке 4. Для определения плотности суспензии в г% суспензию кристаллов наливают в цилиндр и затем разрешают. свободно осесть, что обычно длится всего несколько секунд. Затем рассчитывают г% как высоту осевшей суспензии кристаллов, деленную на высоту маточного раствора (оба измеряются от дна цилиндра), умноженные на 100.Уравнения (10) и (11), приведенные ниже, дают конверсию между г% и масс.% Единиц.
В уравнениях (10) и (11) ρ s — это плотность кристаллов, а ρ b — плотность маточного раствора. Насыпная плотность во влажном состоянии (ρ wb ) отражает массу только кристаллов при плотности суспензии 100 г%, в зависимости от конкретной формы кристаллов, среди других параметров. Для простых кубических кристаллов одинакового размера при плотности плотнейшей упаковки ρ wb равно π / 6 ≈ 0.5236 × ρ s [ 2 ].
Однако на практике определение ρ wb важно, потому что кристаллизация почти всегда приводит к определенному гранулометрическому составу (PSD) кристаллов и не достигается плотнейшая упаковка. Значение ρ wb при 100 г% фактически отражает насыпную насыпную плотность — как если бы маточный раствор не окружал погруженные кристаллы.
Изменение плотности раствора
Обычно эксплуатационные соображения (например, засорение) требуют, чтобы плотность суспензии не превышала примерно 30–40 г%, за исключением отстойных или промывных ножек или выходов гидроциклонов непосредственно перед центрифугами.
Чрезмерно низкая плотность суспензии может привести к образованию мелких кристаллов, затрудняющих центрифугирование. Это показывает, что плотность суспензии оказывает сильное влияние на кристаллизацию, поскольку плотность суспензии определяет поверхность кристалла, доступную для роста (при условии постоянной PSD). Если для роста доступна недостаточная площадь поверхности кристалла, пересыщение увеличивается (поскольку испарение воздействует на кристаллизаторы) до тех пор, пока не произойдет зародышеобразование.
Влияние плотности суспензии на кристаллизацию зависит от температуры, потому что кинетика намного быстрее при более высоких температурах.Следовательно, при более высоких температурах можно допустить более низкую плотность суспензии без вредного снижения PSD из-за чрезмерного зародышеобразования. Ясно, что контроль плотности суспензии важен для любого процесса кристаллизации. В принципе, есть два основных метода уменьшения плотности навозной жижи:
- Удаление кристаллов (например, через ножку для мытья)
- Рецикл маточного раствора (например, маточный раствор, рециркулируемый из циклона или центрифуги)
И наоборот, есть также два основных метода увеличения плотности навозной жижи:
- Рециркуляция кристаллов (например, более концентрированная суспензия кристаллов, рециркулируемая из сгустителя или сепаратора)
- Удаление маточного раствора через кольцевую зону
Плотность жидкого навоза еще раз
По определению фактическая плотность пульпы ( SD , мас.%), включая удаление маточного раствора (или рециркуляцию) или рециркуляцию (или удаление) кристаллов в процессе кристаллизации, приведено в уравнении (12):
SD = 100 × ( кристалл + cR ) / ( кристалл + cR + ML — MLR ) ( 12 )
В этом уравнении и рецикл кристаллов ( cR ), и удаление маточного раствора ( MLR ) определены как положительные массовые расходы, аналогично кристаллу и ML в таблице 1.И наоборот, удаление кристаллов определяется как отрицательный массовый расход рециркулированных кристаллов, тогда как рециркуляция маточного раствора определяется как отрицательный массовый расход MLR.
Уравнение SD , приведенное выше, может быть математически преобразовано путем подстановки с использованием набора из семи приведенных выше уравнений и перегруппировки, давая Уравнение (13):
Где:
cR # = фракция рецикла кристаллов ( кристалл cR / )
MLR # = фракция удаления маточного раствора ( MLR / ML )
Это последнее уравнение показывает, что фактическая плотность суспензии не зависит от массового расхода и может быть просто рассчитана на основе легко доступных параметров, таких как C, S, CF, cR # и MLR #.Используя значения, приведенные в таблице 1, мы видим, что cR # = 0,2 (зарегистрировано как 20%) и MLR # = 0,3 (зарегистрировано как 30%).
Рециркуляция кристаллов обычно более эффективна по сравнению с удалением маточного раствора, поскольку соотношение кристаллов / ML чаще всего меньше 1. Плотность суспензии может быть увеличена, поддерживая тот же уровень производства, поскольку этот уровень производства определяется испарение воды. Плотность суспензии просто отражает задержку кристаллов в испарителе, поэтому увеличение плотности суспензии увеличивает среднее время пребывания кристаллов.Наконец, доля рециркуляции кристаллов больше 1 (где рециркуляция кристаллов больше 100%) не является исключительным условием.
Другие процессы кристаллизации
Методология, описанная в этой статье, представлена для непрерывного процесса испарительной кристаллизации, но она в равной степени применима и для периодического процесса испарительной кристаллизации с использованием массы вместо массового расхода. Кроме того, этот метод может применяться для процессов охлаждения, антирастворителя и реакционной кристаллизации.Поскольку в этих трех методах кристаллизации растворитель не удаляется ( W = 0), CF больше не является свободной переменной и теперь равно (100- S ) / (100- C ) при условии, что следующие утверждения верны:
- При кристаллизации антирастворителя концентрация C в сырье должна быть основана на общей массе (или расходах), поэтому должна быть включена добавленная масса антирастворителя (или скорости потока).
- При реакционной кристаллизации концентрация в сырье, C, представляет собой расчетную концентрацию кристаллизующегося компонента, основанную на общей массе (или расходах) всех реагентов после полного превращения в результате реакции
Теперь формулы для NSD и SD можно сократить до формул (14) и (15) соответственно:
На основе этого простого подхода к массовому балансу оценка только одного массового расхода может разблокировать массовый баланс для всего процесса кристаллизации.Кроме того, этот подход поясняет, что естественная плотность суспензии определяется коэффициентом концентрации, растворимостью в маточном растворе и концентрацией растворенного вещества в сырье, а не массовым расходом. Точно так же плотность суспензии определяется коэффициентом концентрации, растворимостью в маточном растворе и концентрацией растворенного вещества в сырье, а также рециклом кристаллов и удалением ML, а не массовым расходом. Помимо испарительной кристаллизации, представленная здесь методология также применима для процессов охлаждения, антирастворителя и реакционной кристаллизации.
Под редакцией Мэри Пейдж Бейли
Список литературы
1. Льюис, А.Е., Секлер, М.М., Крамер, Х.Дж.М., ван Росмален, Г.М., «Промышленная кристаллизация: основы и приложения», глава 2, Cambridge University Press, 2015.
2. Упаковка сфер, Wolfram MathWorld, https://mathworld.wolfram.com/spherepacking.html
Автор
Йоханнес (Ян) Альбертус Мария Мейер (джем[email protected]; Шальхаар, Нидерланды) — старший эксперт по кристаллизации и химическому технологу. Выйдя на пенсию, он проработал 32 года в AkzoNobel Industrial Chemicals B.V. и руководил группой исследований и разработок в области соли и кристаллизации в течение последних 26 лет своей карьеры. Он имеет степень магистра наук. с отличием в области химической технологии и кандидатом технических наук. Кандидат технических наук, оба из Технологического университета Делфта. Мейер разработал 12 основных процессов кристаллизации и имеет восемь патентов. Он является автором или соавтором 27 публикаций по солевой технологии и кристаллизации.
Определение кристаллизации
Что такое кристаллизация?
Кристаллизация — это продажа ценной бумаги с целью вызвать прирост капитала или убыток. В случае прироста или убытка капитала к выручке применяется инвестиционный налог.
Как работает кристаллизация
Когда инвестор покупает капитальный актив, увеличение (или уменьшение) стоимости ценной бумаги не приводит к прибыли (или убытку). Инвестор может претендовать на прибыль (или убыток) только после того, как он продал ценную бумагу.Продажа ценной бумаги с прибылью называется кристаллизацией прироста капитала.
Рассмотрим инвестора Смита, который 13 октября 2016 г. приобрел 100 акций Nvidia Corporation (Nasdaq: NVDA) за 65,35 доллара. Акция стабильно росла с тех пор, как он ее купил, и по состоянию на 18 сентября 2017 года составляла 187,55 доллара. Пока Смит не продаст акции, он не может кристаллизовать прибыль от увеличения или заявить, что он получил прибыль. Если он решит продать акции за 187,55 долларов, его прирост капитала составит 187 долларов.55 — 65,35 доллара) x 100 акций = 12 220 долларов. В этом случае он кристаллизовал прирост капитала в размере 12 220 долларов.
Смит, возможно, не сможет долго наслаждаться своей удачей, поскольку прирост капитала облагается налогом. Налог на прирост капитала по краткосрочным инвестициям равен обычной ставке подоходного налога инвестора. Ставка налога на прирост капитала в долгосрочной перспективе, в зависимости от того, в какую предельную налоговую категорию попадает инвестор, составляет от 0% до 20%. Предполагая, что годовой доход Смита за 2017 год составляет 120000 долларов, это означает, что он попадает в категорию предельного налога на прибыль 28% , И, следовательно, налог на прирост капитала от его прибыли NVDA составит 15%.В конце налогового года он заплатит 15% x 12 220 долларов США = 1833 доллара США.
Капитальные убытки могут использоваться для компенсации части или всей прироста капитала. Если Смит владел 700 акциями Transocean Ltd. (NYSE: RIG), которые он купил по 15,80 долларов за акцию год назад, но теперь торгуется на рынках капитала по 7,30 долларов за акцию, он может кристаллизовать убытки от капиталовложений, чтобы компенсировать капитал. прибыль от NVDA, чтобы уменьшить счет по налогу на прирост капитала.Если он продаст RIG, он будет кристаллизовать убытки в размере ($ 15.80 — 7,30 доллара) x 700 = 5950 долларов. Вместо того, чтобы сообщать о приросте капитала в размере 12 220 долларов США, Смит может вместо этого сообщить о приросте в размере 12 220 долларов США — 5950 долларов США = 6270 долларов США. Поскольку он использовал кристаллизованные потери капитала для компенсации своей прибыли, его налог на прирост капитала составит 15% x 6270 долларов = 940,50 долларов.
Стратегии кристаллизации
Кристаллизацию можно использовать как стратегию продажи и покупки акций почти мгновенно для увеличения или уменьшения балансовой стоимости. Пример этого происходит, когда инвестору необходимо принять убыток от капитала по определенной акции, но он все еще считает, что цена акции вырастет.Таким образом, он / она кристаллизовал бы бумажные убытки, продав акции и сразу же выкупив их. В приведенном выше примере Смит продал свои акции RIG за убыток капитала, чтобы уменьшить свои налоговые обязательства по приросту капитала. Если Смит считает, что акции все еще могут вырасти в цене, он может выкупить их для своего портфеля.
Кристаллизация налогового убытка — не проблема. Однако то, что вы делаете после кристаллизации, может быть проблемой. В большинстве налоговых агентств есть правила (например, правило продажи-стирки), чтобы предотвратить возникновение капитальных убытков в какой-то сомнительной манере.В США и Канаде, например, инвестор не может требовать налоговых убытков, если он выкупает акции в течение 30 дней после кристаллизации убытка от тех же акций. Следуя примеру выше, Смиту придется выкупить Transocean. акции по прошествии 30 дней.
Кристаллизовавшиеся капитальные убытки могут переноситься на неопределенный срок. Убыток капитала можно использовать для компенсации реализованной прибыли и уменьшения обычного дохода (до 3000 долларов в год) в последующие годы.Например, инвестор, который выкристаллизовал капитальные убытки в размере 20 000 долларов, может применить это к своей кристаллизованной приросте капитала в 5000 долларов.
 В., Слуцкая Э.С., Филимоненков А.А., Бойко К.М., Клейменов С.Ю., Конарев П.В., Поляков К.М., Свергун Д.И., Трофимов А.А., Хоменков В.Г., Звягильская Р.А., Попов В.О. Выделение и олигомерный состав цитохром с нитритредуктазы из галоалкалофильной бактерии Thioalkalivibrio nitratireducens // Биохимия. – 2008. – Т.73. – N2. – С.202-209.
В., Слуцкая Э.С., Филимоненков А.А., Бойко К.М., Клейменов С.Ю., Конарев П.В., Поляков К.М., Свергун Д.И., Трофимов А.А., Хоменков В.Г., Звягильская Р.А., Попов В.О. Выделение и олигомерный состав цитохром с нитритредуктазы из галоалкалофильной бактерии Thioalkalivibrio nitratireducens // Биохимия. – 2008. – Т.73. – N2. – С.202-209.
 П. Получение, кристаллизация и предварительное рентгеновское исследование мутанта карбоксипептидазы Т с карманом первичной специфичности карбоксипептидазы В // Кристаллография, 2010, 55, № 5, С. 851–854.
П. Получение, кристаллизация и предварительное рентгеновское исследование мутанта карбоксипептидазы Т с карманом первичной специфичности карбоксипептидазы В // Кристаллография, 2010, 55, № 5, С. 851–854.
 Куранова И.П., Смирнова Е.А., Абрамчик Ю.А., Чупова Л. А., Есипов Р.С., Акпаров В.Х., Тимофеев В.И., Ковальчук М.В. Выращивание кристаллов фосфопантетеин аденилилтрансферазы, карбоксипептидазы Т и тимидинфосфорилазы на международной космической станции методом встречной диффузии в капилляре// Кристаллография, 2011, Т. 56, № 5, С. 944–951.
Куранова И.П., Смирнова Е.А., Абрамчик Ю.А., Чупова Л. А., Есипов Р.С., Акпаров В.Х., Тимофеев В.И., Ковальчук М.В. Выращивание кристаллов фосфопантетеин аденилилтрансферазы, карбоксипептидазы Т и тимидинфосфорилазы на международной космической станции методом встречной диффузии в капилляре// Кристаллография, 2011, Т. 56, № 5, С. 944–951.
 2012 1;68 (Pt 11):1387-1389.
2012 1;68 (Pt 11):1387-1389.
 В. Липкин, В. О. Попов, М. В. Ковальчук От гена к структуре. Белковая фабрика нбик-центра курчатовского института. 2013, Кристаллография, т. 58, №3, 431-437
В. Липкин, В. О. Попов, М. В. Ковальчук От гена к структуре. Белковая фабрика нбик-центра курчатовского института. 2013, Кристаллография, т. 58, №3, 431-437
 12-21
12-21
 1134/S1063774515050181
1134/S1063774515050181
 Николаева, В. И. Тимофеев, К. М. Бойко, Д. А. Корженевский, Т. В. Ракитина, П. В. Дороватовский, А. В. Липкин. Выделение, очистка, кристаллизация и предварительное рентгеновское исследование кристаллов HU-белка из M. Gallisepticum // Кристаллография, 2015, 60(6), 922-925.
Николаева, В. И. Тимофеев, К. М. Бойко, Д. А. Корженевский, Т. В. Ракитина, П. В. Дороватовский, А. В. Липкин. Выделение, очистка, кристаллизация и предварительное рентгеновское исследование кристаллов HU-белка из M. Gallisepticum // Кристаллография, 2015, 60(6), 922-925.
 И. Тимофеев, В. Р. Самыгина, И. П. Куранова, В.О. Попов, М.В. Ковальчук. Кристаллизация белков в условиях микрогравитации. Анализ результатов российских экспериментов на МКС В 2005–2015 гг., Кристаллография, 2016, том 61, № 5, с. 691–702
И. Тимофеев, В. Р. Самыгина, И. П. Куранова, В.О. Попов, М.В. Ковальчук. Кристаллизация белков в условиях микрогравитации. Анализ результатов российских экспериментов на МКС В 2005–2015 гг., Кристаллография, 2016, том 61, № 5, с. 691–702
 Oksana M. Subach,, Natalia V. Barykina, Kiryl D. Piatkevich, Vladimir P. Sotskov, Marina A. Roshchina, Tatiana A. Kunitsyna, Aleksey Y. Malyshev, Anna M. Varizhuk, Galina E. Pozmogova, Konstantin V. Anokhin, Grigori N. Enikolopov and Fedor V. Subach. Enhanced variant of genetically-encoded green calcium sensor NTnC. 2017. Scientific Reports, подготовлена к печати.
Oksana M. Subach,, Natalia V. Barykina, Kiryl D. Piatkevich, Vladimir P. Sotskov, Marina A. Roshchina, Tatiana A. Kunitsyna, Aleksey Y. Malyshev, Anna M. Varizhuk, Galina E. Pozmogova, Konstantin V. Anokhin, Grigori N. Enikolopov and Fedor V. Subach. Enhanced variant of genetically-encoded green calcium sensor NTnC. 2017. Scientific Reports, подготовлена к печати.
 61 I. 6 p. 974-978
61 I. 6 p. 974-978
 7868/S0023476117060054.
7868/S0023476117060054.
 2017.1304242.
2017.1304242.

 Эти примечания к редакции
Эти примечания к редакции 4.2 Как рассчитать
4.2 Как рассчитать xH 2 O, (x
xH 2 O, (x Q30)
Q30)