Метафосфорная кислота — Справочник химика 21
Качественные реакции на метафосфорную кислоту и ее соли. 4. Раствор, полученный в тесте 3, наливают в две пробирки (по 1—2 мл в каждую). В одну из них добавляют 1 мл водного раствора белка. Наблюдают его свертывание. В другую пробирку добавляют [c.175]
При нагревании ортофосфорная кислота превращается в метафосфорную кислоту. Напишите уравнение реакции. [c.95]
Какие из перечисленных реакций могут быть использованы для получения метафосфорной кислоты [c.235]
Получение метафосфорной кислоты. 1. Взаимодействие фосфорного ангидрида с водой. В фарфоровую чашку поместите 1 микрошпатель фосфорного ангидрида и растворите его в дистиллированной воде. Вначале раствор становится [c.181]
При понижении температуры метафосфорная кислота через полифосфорные кислоты превращается в фосфорную (ортофос-форную) кислоту [c.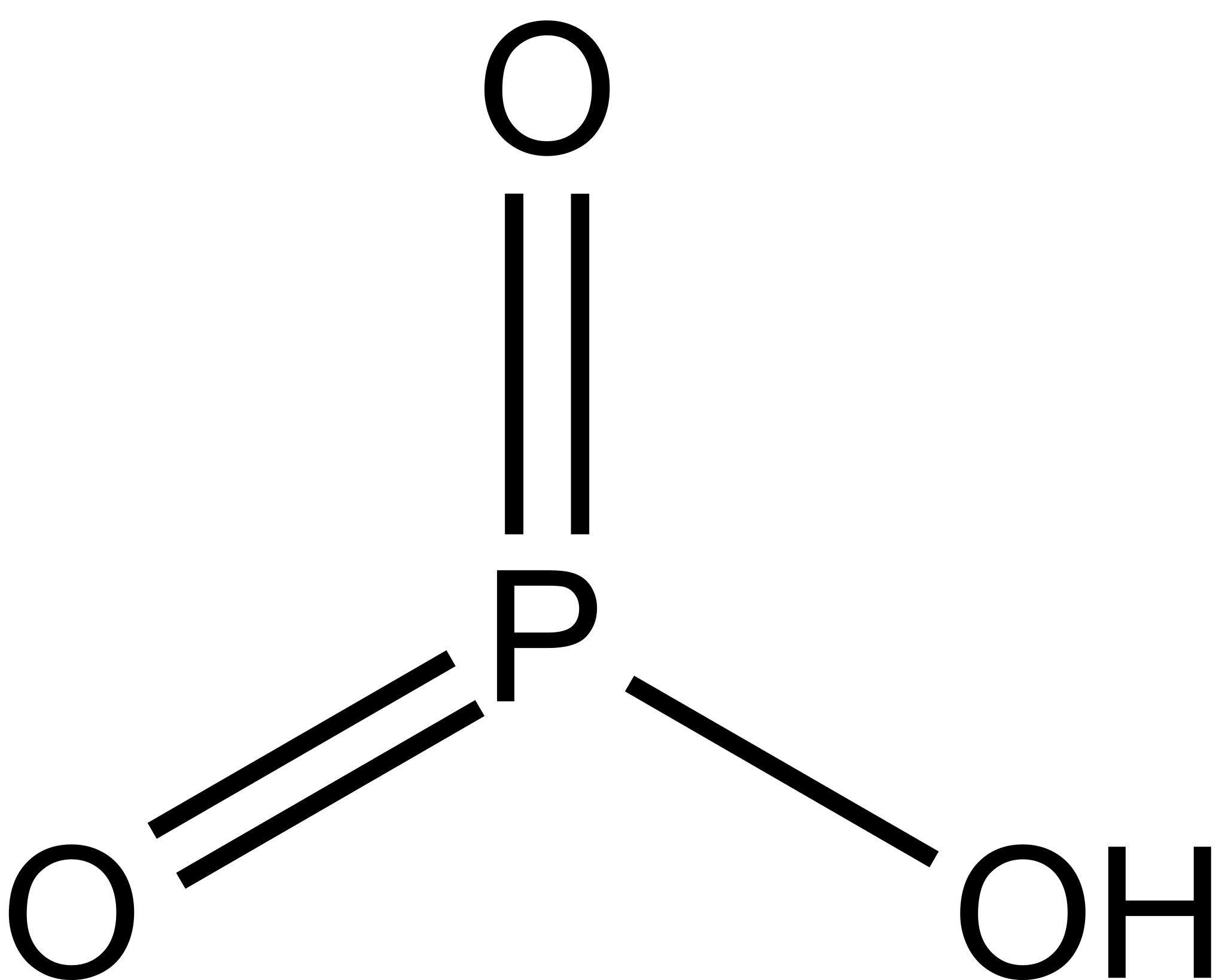 289]
289]
Является ли превращение метафосфорной кислоты в ортофосфорную кислоту окислительно-восстановительной реакцией Ответ мотивируйте. [c.95]
Какова степень окисления фосфора а) в ортофосфорной б) в метафосфорной кислоте [c.95]
Рассчитайте процентную концентрацию водного раствора метафосфорной кислоты, если известно, что при нагревании такого раствора (объем его поддерживается постоянным) можно получить 24,5%-ный раствор ортофос-форной кислоты. [c.26]
Катализатор нужно восстанавливать после пропускания 100-кратного количества полимера (примерно через 60 рабочих дней). Регенерация осуш ествляется посредством контролируемого окисления смесью воздуха с отработанным газом при 480—540 °С и последующей гидратацией образовавшейся метафосфорной кислоты при 285 °С. Менять катализатор необходимо после пропускания 700- максимум 1300-кратного объема продукта полимеризации [14, 151. [c.243]
В анионе фосфорной кислоты каждый атом фосфора окружен четырьмя атомами кислорода, расположенными в вершинах тетраэдра. Ортофосфорная кислота построена из изолированных тетраэдров Р04 , в концентрированных фосфорных кислотах тетраэдры Р04 через общие кислородные вершины объединены в фосфатные комплексы, содержащие от 2 до 10 атомов фосфора. В метафосфорных кислотах тетраэдры Р04 образуют замкнутые кольца. [c.22]
Ортофосфорная кислота построена из изолированных тетраэдров Р04 , в концентрированных фосфорных кислотах тетраэдры Р04 через общие кислородные вершины объединены в фосфатные комплексы, содержащие от 2 до 10 атомов фосфора. В метафосфорных кислотах тетраэдры Р04 образуют замкнутые кольца. [c.22]
Гидратация оксида фосфора (V) протекает через ряд стадий. На первой стадии процесса, вследствие высокой температуры в системе, взаимодействие паров оксида фосфора с водой дает метафосфорную кислоту [c.288]
Значит, исходная концентрация раствора метафосфорной кислоты была 20%, так как по условию задачи масса раствора не изменялась, а при решении исходили из 100 г раствора. [c.129]
Все другие фосфорные кпслоты представляют собой продукты соединения тетраэдров РО4. В большинстве своем эти кислоты пе выделены в свободном состоянии, а и шестны в виде смесей, в водных растворах илн в виде солей. В зависимости от способа соединения групп РО4 в фосфатные комплексы эти кислоты разделяются на полифосфорные и метафосфорные кислоты. Полифос-форные кислоты и их соли — пол н фосфа ты — построены из цепочек —РО3—О—РО3—. В метафосфорпых кислотах и их солях— мета фосфатах — тетраэдры РО4 образуют кольца. [c.422]
Полифос-форные кислоты и их соли — пол н фосфа ты — построены из цепочек —РО3—О—РО3—. В метафосфорпых кислотах и их солях— мета фосфатах — тетраэдры РО4 образуют кольца. [c.422]
При получении этилена в качестве дегидратирующего средства может быть использована метафосфорная кислота. Дегидратация третичных спиртов происходит при кипячении их с безводной щавелевой кислотой или бисульфатом калия. Все третичные спирты и некоторые вторичные легко дегидратируются при перегонке в присутствии иода, взятого в количестве примерно 0,2% от веса спирта. Таким образом, наиболее легко подвергаются дегидратации третичные спирты, затем вторичные и труднее всего превращаются в олефины. первичные спирты. [c.162]
Ответ для получения 20 г метафосфорной кислоты необход[гмо [c.21]
Оксид фосфора (V) жадно соединяется с водой и потому применяется как очень сильное водоотнимающее средство. На воздухе оксид фосфора (V), притягивая влагу, быстро превращается в расплывающуюся массу метафосфорной кислоты. [c.444]
[c.444]
При полимеризации с жидкой фосфорной кислотой (полугидрат-метафосфорной кислоты) при 160—170 °С и под давлением 50— 60 кгс/см2 Террес [83] получил следующие продукты [c.247]
Четафосфорные кислоты имеют общую формулу Н Р Оз , где и может принимать значения от 3 дпростейшей формулой НРО3. Эти кислоты представляют собою стеклообразные вещества. В раствор они переходят в виде полимеров, имеющих кольцевую структуру. С течением времени кольца расщепляются и образуются цепные полифосфор-ние кислоты. Метафосфорные кислоты ядовиты. Известны соли [c.422]
Упаренная фосфорная кислота с концентрацией 108 -116 по Н3РО4 имеет довольно сложный состав. Например, по данным [34], кислота с концентрацией 109% состоит на 20.5 -ич орто-, на 46.2 /(1 ич пиро-, на 20.6 Уп ич Триполи-, на 8.8″ > из тетраполи-, на 3.4% из пентаполи- и на 0.5% из гексаполп фосфорных кислот. При больших концентрациях кислоты в ei составе появляются и превалируют голько метафосфорны- кислоты циклической структуры с общей формулой , [c.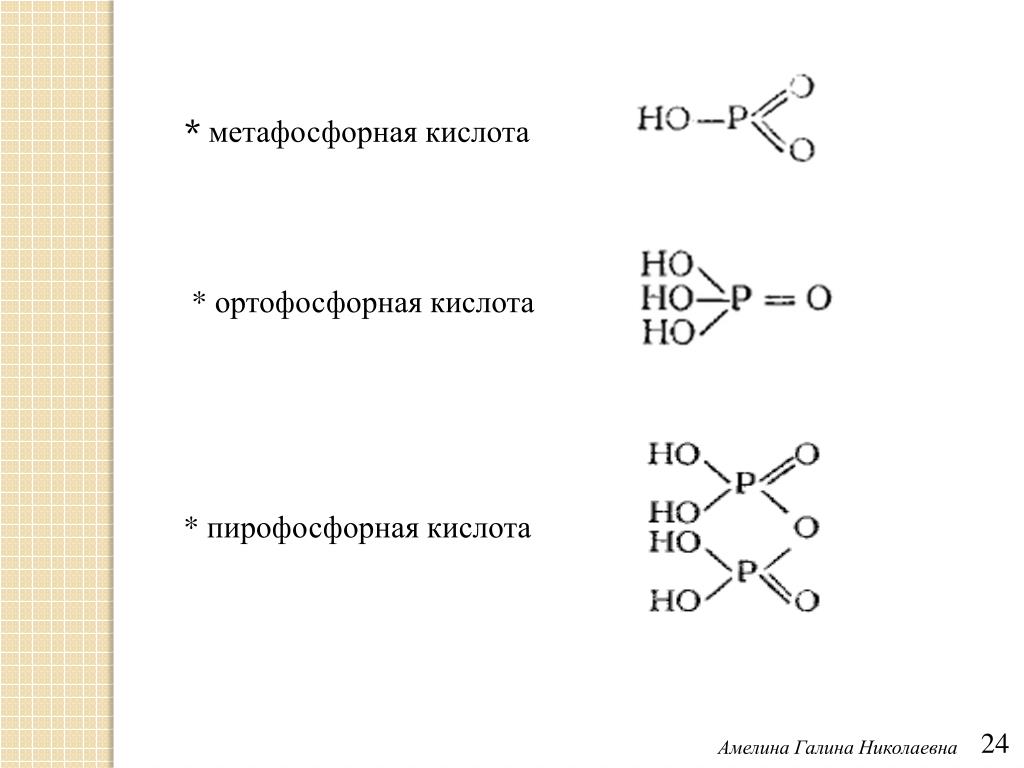 33]
33]
Конденсированные фосфаты. Олигомеры циклофосфатов можно разделить хроматографически вплоть до октаметафосфата. Один из гексаметафосфатов был выделен в препаративных количествах. Полимерные метафосфорные кислоты — это сильные или средней силы кислоты. Например,, для тетраметафосфорной кислоты (НРОз)4 рЯ1 = 2,6 р/(2=6,4,, р/(з =8,8,. р/С4=И,4- Соли этих кислот хорошо растворимы в воде. Осаждение происходит лишь после их гидролиза до монофосфатов, который, ускоряется в присутствии разбавленных кислот и при нагревании. При образовании перлов фосфорных солей связь Р—О—Р разрывается благодаря протеканию реакций с оксидами металлов. В предельном случае процесс приводит к образованию монофосфатов, причем получающиеся смешанные соли имеют характерную окраску. Считавшаяся ранее специфичной для метафосфатов реакция свертывания яичного белка идет лишь в присутствии растворов изополифосфатов с большим размером цепи. Олиго-фосфатами с п 15 раствор яичного белка не сворачивается. [c.550]
[c.550]
Пример 2. Из какого количества фосфора может быть получено 20 г метафосфорной кислоты НРО3 [c.21]
Получение метафосфорной кислоты. Полученный в тесте 2 фосфорный ангидрид с помощью струи воды из промывалки смывают со стенок воронки небольшим количеством воды (5—10 мл) в стакан, подставленный под воронку. Образуется раствор метафосфор-пой кислоты. Отмечают окраску раствора. [c.175]
Образование промежуточных соединений в ходе каталитических реакций в ряде случаев может быть подтверждено экспериментально методами ЭПР, спектрального анализа и др. В реакции окисления метафосфорной кислоты персульфатом калия, катализируемой иодистоводородной кислотой [c.343]
Взаимодействием негашеной извести с парами метафосфорной кислоты можио получить ксицеитрированное удсбр. иие. Составьте уравнение реакции н рассчитайте содержание РРз в этом удобрении. [c.100]
[c.100]
Соли метафосфорной кислоты — мета( юсфаты ЫазРзОд, Na,P40,2. Саз(Р..А)2. [c.317]
Необходимо отметить, что метафосфорные кислоты могут 1гметь состав, отличный от (НРОз)4, н формулу нх в обн ем виде можно записать (НРОз) , [c.217]
При дальнейшем действии HF образуется дифторофосфорная кис-лота. Можно полностью заменить атомы кислорода в ортофосфорной кислоте на фтор, при этом получается Н (РРб) — аналог метафосфорной кислоты НРОз. Для этого в безводном HF растворяют пентахлорид фосфора P Ij, прн этом происходит соль-волиз [c.304]
Учебник общей химии (1981) — [
c.276
]
Неорганическая химия (1981) — [
c.329
]
Пособие по химии для поступающих в вузы 1972 (1972) — [
c.249
]
Общая химия (1987) — [
c. 160
160
]
Приготовление растворов для химико-аналитических работ (1964) — [
c.40
]
Справочник Химия изд.2 (2000) — [
c.352
]
Химия справочное руководство (1975) — [
c.86
]
Общая химия (1964) — [
c.315
,
c.367
]
Курс неорганической химии (1963) — [
c.677
,
c.689
]
Ионообменные разделения в аналитической химии (1966) — [
c.231
]
Общая химия и неорганическая химия издание 5 (1952) — [
c.120
,
c.253
]
Общая органическая химия Т5 (1983) — [
c.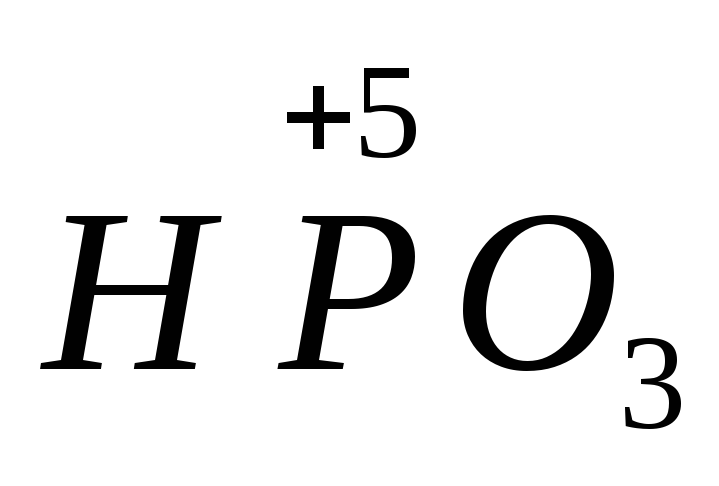 66
66
]
Курс общей химии (1964) — [
c.361
]
Неорганическая химия (1950) — [
c.182
]
Общая и неорганическая химия (1981) — [
c.419
]
общая органическая химия Том 5 (1983) — [
c.66
]
Учебник общей химии 1963 (0) — [
c.260
]
Неорганическая химия (1981) — [
c.329
]
Качественный анализ (1964) — [
c.228
]
Неорганическая химия (1987) — [
c.652
]
Справочник по общей и неорганической химии (1997) — [
c.91
]
Технология минеральных удобрений и солей (1956) — [
c.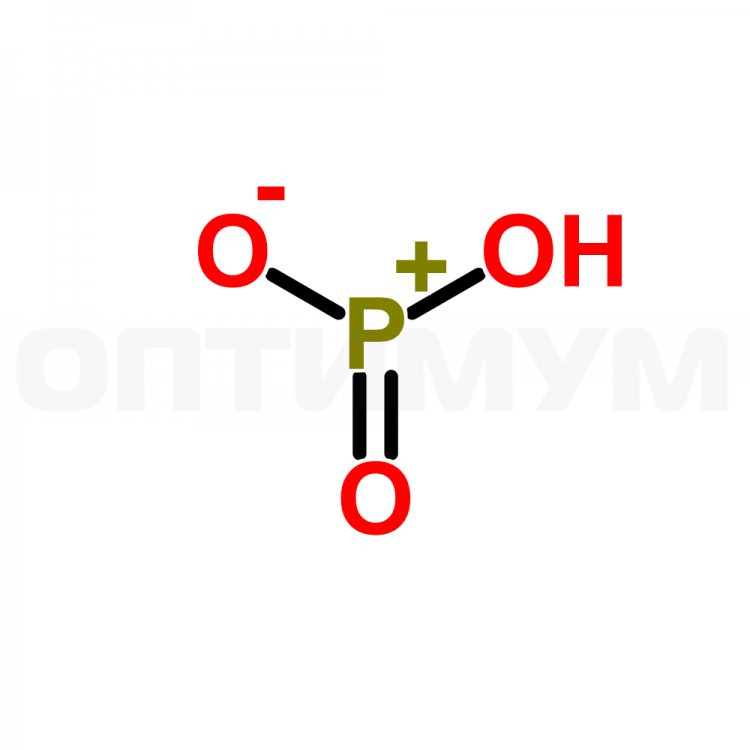 98
98
]
Химия органических соединений фосфора (1972) — [
c.491
,
c.492
]
Технология минеральных удобрений (1966) — [
c.146
,
c.173
,
c.176
]
Общая химическая технология Том 2 (1959) — [
c.53
,
c.54
]
Качественный химический полумикроанализ (1949) — [
c.210
]
Руководство по неорганическому синтезу (1953) — [
c.214
]
Основы общей химии Т 1 (1965) — [
c.430
,
c.441
]
Курс неорганической химии (1972) — [
c.607
,
c. 617
617
]
Коррозия металлов Книга 1,2 (1952) — [
c.819
]
Биохимия Издание 2 (1962) — [
c.216
]
Методы концентрирования микроэлементов в неорганическом анализе (1986) — [
c.65
]
Основы общей химии том №1 (1965) — [
c.430
,
c.441
]
Коррозия металлов Книга 2 (1952) — [
c.0
]
Метафосфорная кислота
Метафосфорная кислота
ГОСТ 841-76
(HPO3)n, n ≥ 3
Метафосфорная кислота — одноосновная кислота, простейшая формула которой HPO3; действительный же состав её молекул выражается формулой (HPO3)n, где n = 3,4,5 и т.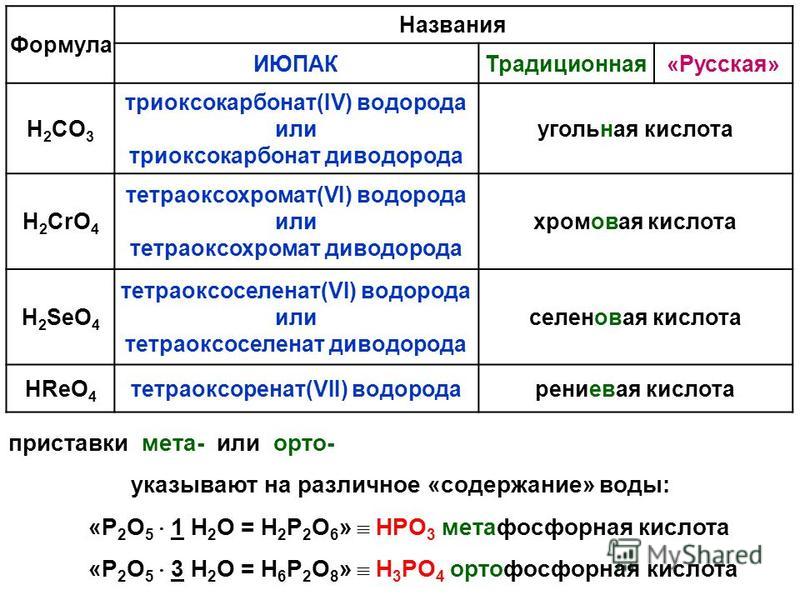 д. В чистом виде представляет собой стекловидную массу, легко растворимую в воде.
д. В чистом виде представляет собой стекловидную массу, легко растворимую в воде.
Метафосфорная кислота — одноосновная кислота, простейшая формула которой HPO3; действительный же состав её молекул выражается формулой (HPO3)n, где n = 3,4,5 и т. д. В чистом виде представляет собой стекловидную массу, легко растворимую в воде.
Источник: http://kursak.net/hpo3-metafosfornaya-kislota/
© kursak.net
Метафосфорная кислота — одноосновная кислота, простейшая формула которой HPO3; действительный же состав её молекул выражается формулой (HPO3)n, где n = 3,4,5 и т. д. В чистом виде представляет собой стекловидную массу, легко растворимую в воде.
Источник: http://kursak.net/hpo3-metafosfornaya-kislota/
© kursak.net
Метафосфорная кислота — одноосновная кислота, простейшая формула которой HPO3; действительный же состав её молекул выражается формулой (HPO3)n, где n = 3,4,5 и т. д. В чистом виде представляет собой стекловидную массу, легко растворимую в воде.
Источник: http://kursak. net/hpo3-metafosfornaya-kislota/
net/hpo3-metafosfornaya-kislota/
© kursak.net
Метафосфорная кислота — одноосновная кислота, простейшая формула которой HPO3; действительный же состав её молекул выражается формулой (HPO3)n, где n = 3,4,5 и т. д. В чистом виде представляет собой стекловидную массу, легко растворимую в воде.
Источник: http://kursak.net/hpo3-metafosfornaya-kislota/
© kursak.net
Физико-химические свойства метафосфорной кислоты
Метафосфорная кислота представляет собой белое стеклообразное вещество, хорошо растворимое в воде и, присоединяя её, постепенно переходит в ортофосфорную кислоту:
- H P O 3 + H 2 O → t H 3 P O 4 {\displaystyle {\mathsf {HPO_{3}+H_{2}O\ {\xrightarrow {t}}\ H_{3}PO_{4}}}}
ПОМОГИТЕ!!!
НУЖНО СОСТАВИТЬ СТРУКТУРНУЮ ФОРМУЛУ МЕТАФОСФОРНОЙ КИСЛОТЫ)))
Виберіть із переліку речовини, розчини яких забарвлюють метиловий оранжевий у жовтий колір:1) h3SO4;2) Н2СO3;3) NaCl;4) Ва(ОН)2.2. Установіть відповід
Установіть відповід
…
ність:А) безоксигенова кислота 1) Сu(ОН)2Б) оксигеновмісна кислота 2) НСlВ) сіль 3) Na2SO4Г) основа 4) Н3РO43. Виберіть ряд, у якому всі оксиди внаслідок розчинення у воді утворюють луг:1) Na2O, ВаО, К2O;2) Na2O, Cu2O, N2O;3) CO, ВаО, CaO.4. Виберіть речовину, що не буде взаємодіяти із сульфатною кислотою:A) SO2;Б) Ag;В) Аl;Г) Аl(ОН)3.5. Допишіть рівняння можливих реакцій:1) Cu(ОН)2 + NaOH Проміжне оцінювання з теми Основні класи неорганічних сполук2) Fe + CuSO4 Проміжне оцінювання з теми Основні класи неорганічних сполук3) ВаО + КОН Проміжне оцінювання з теми Основні класи неорганічних сполук4) Zn + НСl Проміжне оцінювання з теми Основні класи неорганічних сполук6. Для нейтралізації сульфатної кислоти кількістю речовини 1 моль необхідно взяти натрій гідроксид кількістю речовини:А) 1 моль;Б) 2 моль;В) 0,5 моль;Г) 4 моль.7. Здійсніть перетворення: Проміжне оцінювання з теми Основні класи неорганічних сполук8. Обчисліть масу міді, що виділиться в результаті дії цинкової пластинки на розчин купрум(ІІ) хлориду масою 13,5 г. 9. Обчисліть масу сульфітної кислоти, що утвориться в результаті проведення таких перетворень: сірка Проміжне оцінювання з теми Основні класи неорганічних сполук сульфур(ІV) оксид Проміжне оцінювання з теми Основні класи неорганічних сполук сульфітна кислота, якщо для реакції взяли сірку масою 3,2 г.10. Дано ряд речовин:КОН, SO3, KNO3, HNO3, К, FeO, Cu, Na2SO4, Al(OH)3.Випишіть речовини, що утворюють генетичний ряд; складіть схему цього зв’язку, напишіть рівняння реакцій, з допомогою яких можна його здійснити.
9. Обчисліть масу сульфітної кислоти, що утвориться в результаті проведення таких перетворень: сірка Проміжне оцінювання з теми Основні класи неорганічних сполук сульфур(ІV) оксид Проміжне оцінювання з теми Основні класи неорганічних сполук сульфітна кислота, якщо для реакції взяли сірку масою 3,2 г.10. Дано ряд речовин:КОН, SO3, KNO3, HNO3, К, FeO, Cu, Na2SO4, Al(OH)3.Випишіть речовини, що утворюють генетичний ряд; складіть схему цього зв’язку, напишіть рівняння реакцій, з допомогою яких можна його здійснити.
Речовина А
газ, алкен (DN,(Е) = 1). Він реагує з гідроген хлоридом, утво-
рюючи речовину В. Взаємодією речовини в зі спиртовим розчином лугу (Кон)
оде
…
ржують речовину с безбарвну рідину з характерним запахом, яку вико-
ристовують у медицині для приготування настоянок та як антисептик. Відомо,
що до складу речовини с входить характеристична група -ОН. Під час часткового
окиснення речовини сутворюється речовина D — безбарвна рідина, яку засто-
совують у харчовій промисловості як харчову добавку й консервант. У розчині
У розчині
речовини D лакмус змінює свій колір на червоний. Під час повного окиснення
(горіння) речовини с утворюються газ Е та вода.
укажіть речовини з якими може реагувати хлоридна кислота
Рассчитайте массу грамм 4% раствора, в котором содержится 20 г веществаПОМОГИТЕ ПОЖАЛУЙСТА)
10. Составьте уравнения возможных реакций между хлоридной кислотой итакими веществами: вода, цинк, калий оксид, барий гидроксид.14. Осуществите превра
…
щение: A) — А1,03 AICI: Al(OH), — А1,0 —— NaAIO,13. Задача. Серу массой 8 г сожгли. Образовавшийся газ пропустили черезраствор кальций гидроксида. Вычислите массу образовавшегося осадка.ПОМОГИТЕ ПЖ
5. Здійснити перетворення:KCIO, O, CO, HCO3СРОЧНОООО!!!!!
помогите пожалуйста химия 8 класс
Помогите пожалуйста умоляюю пожаалууйййстаа срочно нужно сделать
Помогите пожалуйста умоляюю пожаалууйййстаа срочно нужно сделать
химия несложные задачи 35 Баллов
Формула гидроксида фосфора в химии
Определение и формула гидроксида фосфора
Существует несколько кислот, в которых фосфор проявляет различные степени окисления.
Фосфорноватистая кислота
Химическая формула –
Молярная масса равна г/моль.
Сильный восстановитель, и соответственно слабый окислитель.
Физические свойства – белое или бесцветное кристаллическое вещество.
Хорошо растворяется в воде.
Химические свойства
- Как типичная кислота реагирует с щелочами с образованием солей:
- Вступает в окислительно-восстановительное взаимодействие с оксидом мышьяка:
- При нагревании распадается на ортофосфорную кислоту и фосфин:
Получение
Данную кислоту можно получить при взаимодействии фосфина с водой и иодом:
Фосфористая кислота
Формула –
Молярная масса равна г/моль.
Физические свойства – белые или бесцветные кристаллы.
Разлагается при нагревании.
Очень хорошо растворяется в воде.
Химические свойства
- При температуре разлагается на ортофосфорную кислоту и фосфин:
- Вступает в реакции окисления-восстановления:
- Вступает в реакции обмена с гидроксидом натрия:
Получение
Один из способов получения фосфористой кислоты основан на взаимодействии фосфина с концентрированной серной кислотой:
Метафосфорная кислота
Формула –
Молярная масса равна г/моль.
Физические свойства – аморфное (стекловидное) вещество белого цвета, гигроскопичная.
Сублимируется при сильном нагревании.
Слабая одноосновная кислота.
Хорошо растворяется в воде.
Химические свойства
- Метафосфорная кислота растворяется в воде с образованием ортофосфорной кислоты:
- Взаимодействует с с образованием солей различного состава в зависимости от условий:
Ортофосфорная кислота
Формула –
Молярная масса равна г/моль.
Физические свойства – бесцветное гигроскопичное кристаллическое вещество.
Кислота средней силы.
Хорошо растворяется в воде.
Химические свойства
- Реагирует с щелочами, проявляя кислотные свойства:
- При взаимодействии с металлом он вытесняет водород из фосфорной кислоты:
- Вступает в реакции обмена с солями:
Получение
Один из способов получения фосфорной кислоты основан взаимодействии пентахлорида фосфора с водой:
Примеры решения задач
Фосфор, подготовка к ЕГЭ по химии
Фосфор (греч.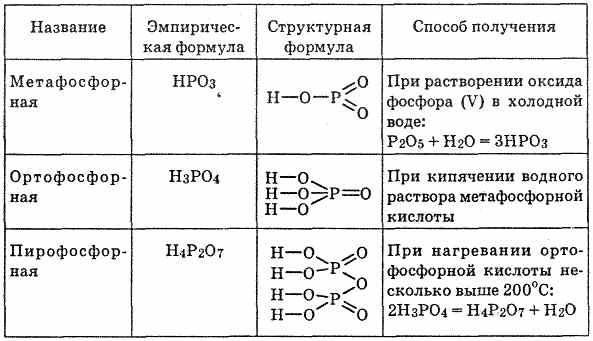 phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество,
phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество,
легко воспламеняющееся и светящееся.
Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*Ca(OH,F)2 — фосфорит
- Ca10(PO4)6(F,Cl,OH)2 — апатит
Получение
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Ca3(PO4)2 + SiO2 + C → (t) CaSiO3 + P + CO
Химические свойства
Химическая активность фосфора значительно выше, чем у азота.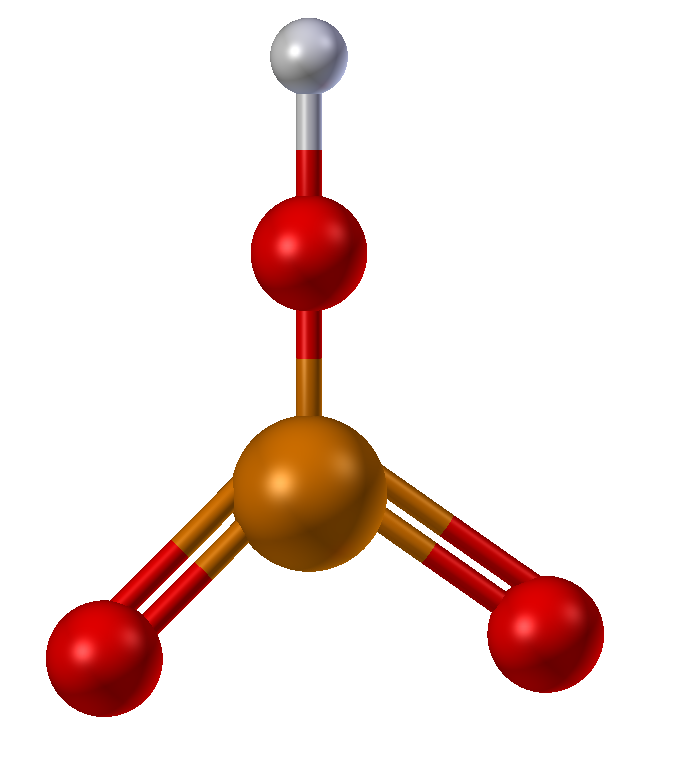 Активность также определяется аллотропной модификацией: наиболее активен белый
Активность также определяется аллотропной модификацией: наиболее активен белый
фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до
P2.
- Реакции с неметаллами
- Реакции с металлами
- Реакция с водой
- Реакция с щелочами
- Восстановительные свойства
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
4P + 3O2 → 2P2O3 (недостаток кислорода)
4P+ 5O2 → 2P2O5 (избыток кислорода)
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
P + S → P2S3
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое
Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое
отравляющее вещество.
Ca3P2 + H2O → Ca(OH)2 + PH3↑
2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество
является и окислителем, и восстановителем).
P + H2O → (t) PH3 + H3PO4
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
P + LiOH + H2O → LiH2PO2 + PH3↑ (LiH2PO2 — гипофосфит лития)
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.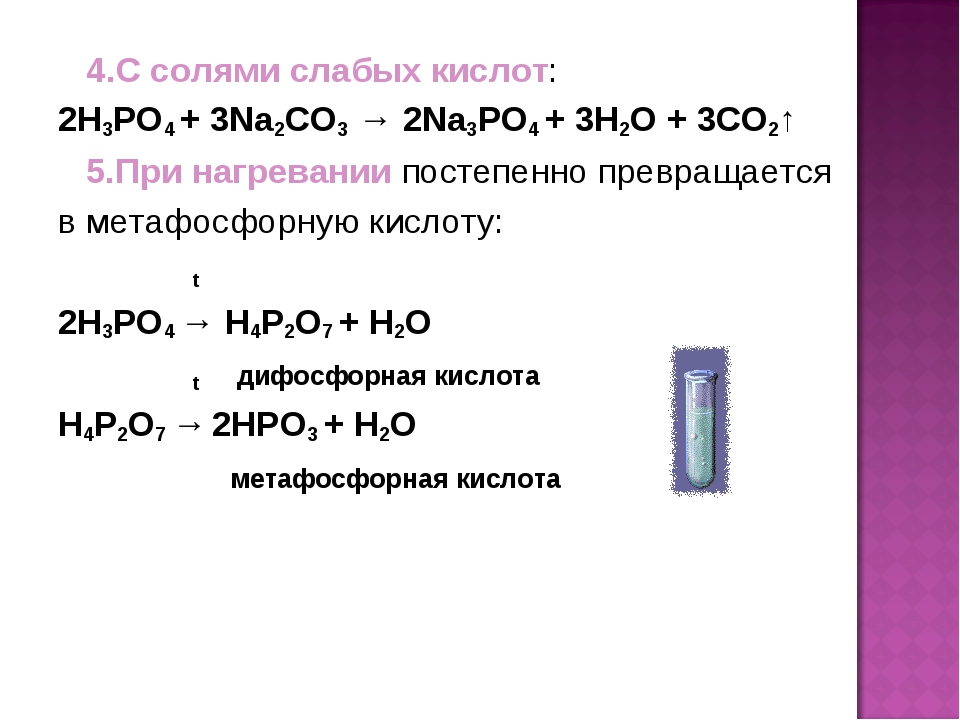
KClO3 + P → KCl + P2O5
Оксид фосфора V — P
2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Получение
P + O2 → P2O5
Химические свойства
- Кислотные свойства
- Дегидратационные свойства
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
P2O5 + 3H2O = 2H3PO4
P2O5 + H2O = HPO3 (при недостатке воды)
Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль — определяет соотношение основного
Какая именно получится соль — определяет соотношение основного
оксида/основания и кислотного оксида.
P2O5 + Na2O → Na3PO4
6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида — соотношение 4:1)
2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида — соотношение 2:1)
Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
HClO4 + P2O5 → HPO3 + Cl2O7 (HPO3 — метафосфорная кислота)
HNO3 + P2O5 → HPO3 + N2O5
Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота — H3PO4 (трехосновная кислота, соли — фосфаты PO43-)
- Метафосфорная кислота — HPO3 (одноосновная кислота, соли — метафосфаты PO3—)
- Фосфористая — H3PO3 (двухосновная кислота, соли — фосфиты HPO32-)
- Фосфорноватистая — H3PO2 (одноосновная кислота, соли гипофосфиты — H2PO2— )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.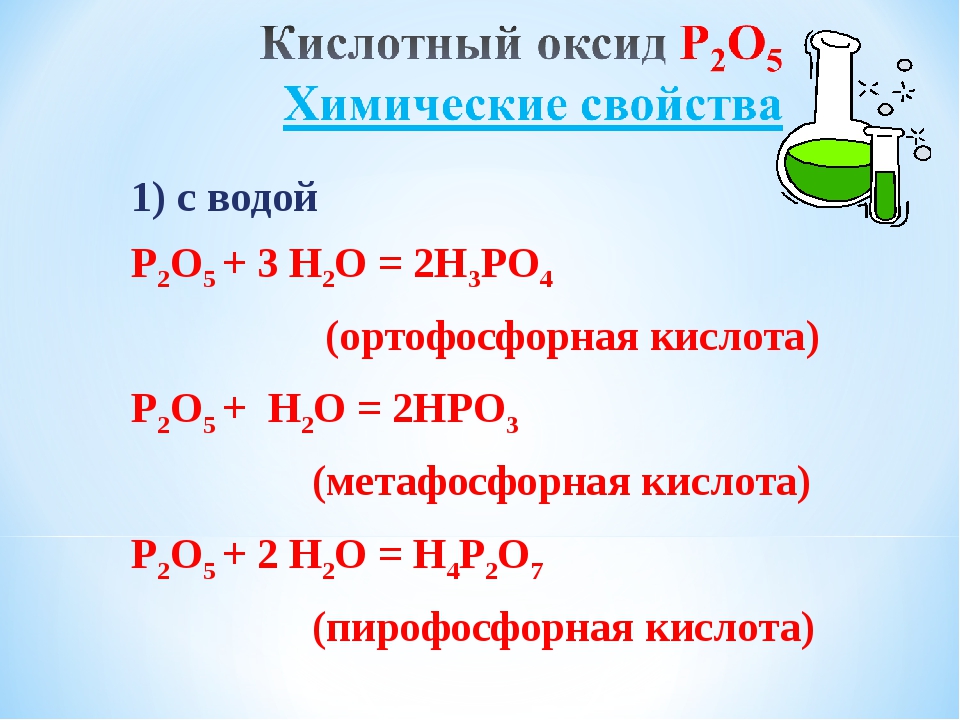
CuSO4 + H3PO2 + H2O → Cu + H2SO4 + H3PO4
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора,
взаимодействия оксида фосфора V с водой.
Ca3(PO4)2 + H2SO4 → CaSO4 + H3PO4
P2O5 + H2O → H3PO4
PCl5 + H2O → H3PO4 + HCl
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
P + HNO3 + H2O → H3PO4 + NO
Химические свойства
- Кислотные свойства
- Реакции с солями
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями.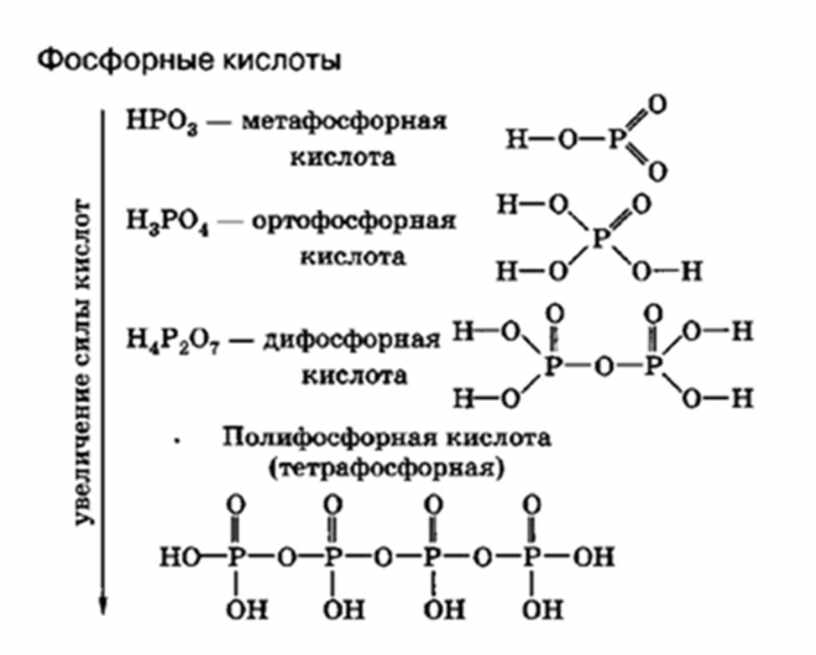 При различных соотношениях кислоты и основания получаются различные
При различных соотношениях кислоты и основания получаются различные
соли (фосфаты, гидрофосфаты и дигидрофосфаты).
3K2O + H3PO4 = 2K3PO4 + 3H2O
3KOH + H3PO4 = K3PO4 + 3H2O
2KOH + H3PO4 = K2HPO4 + H2O
KOH + H3PO4 = KH2PO4 + H2O
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок
желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
AgNO3 + H3PO4 → Ag3PO4 + HNO3
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
K2CO3 + H3PO4 → K3PO4 + H2O + CO2
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg + H3PO4 → Mg3(PO4)2 + H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 + H2O
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
Фосфаты являются хорошими удобрениями, которые повышают урожайность.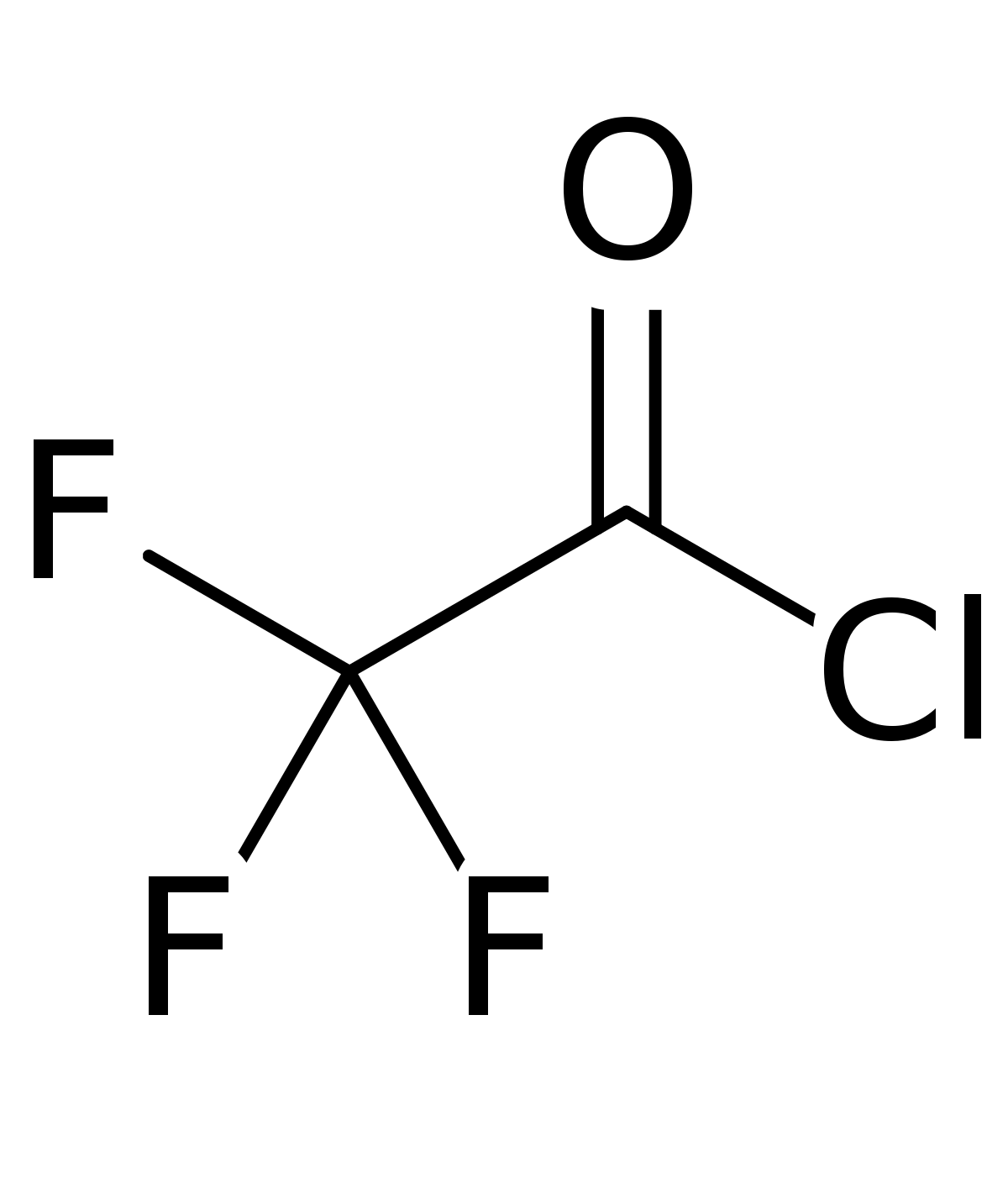 Перечислим наиболее значимые:
Перечислим наиболее значимые:
- Фосфоритная мука — Ca3(PO4)2
- Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат — Ca(H2PO4)2*H2O
- Преципитат — CaHPO4*2H2O
- Костная мука — продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Страница не найдена |
Страница не найдена |
404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
12
24252627282930
31
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Фосфорноватая кислота — неорганическое соединение, четырёхосновная кислота с формулой H 4 P 2 O 6, бесцветные кристаллы, растворяется в холодной воде с медленны
Пользователи также искали:
фосфористая кислота,
фосфорноватистая кислота,
метафосфорная кислота,
кислота,
фосфорноватая,
фосфорноватая кислота,
фосфористая,
google,
советская,
большая,
кислоту,
метафосфорная,
кислоты,
кислот,
фосфорноватистая кислота,
метафосфорная кислота,
фосфористая кислота,
фосфорноватистая,
wikiinfo,
фосфорноватая кислота большая советская google — wiki. info,
info,
фосфорноватая кислота большая советская google — wikiinfo,
wiki.info,
cтатьи о неорганических веществах. фосфорноватая кислота,
|
прак.. ФОСФОРНОВАТАЯ КИСЛОТА: статья из Химической энциклопедии.. .. ФОСФОРНОВАТАЯ КИСЛОТА. гипофосфорная, четырехосновная кислота средней силы. Безводная h5P2O6 бесцветные кристаллы, плавятся при температуре 70 ° с. .. Изучение старшеклассниками низших кислот и соединений. ФОСФОРНАЯ ФОСФОРНОВАТАЯ ФОСФОРНОВАТИСТАЯ КИСЛОТА ФОСФОРНОЙ КИСЛОТЫ ГЕКСАМЕТИЛТРИАМИД. .. Энциклопедии, словари, справочники поиск Химическая.  Соли фосфорноватой кислоты гипофосфаты по своим химическим свойствам являются промежуточными между солями фосфористой и фосфорной. .. Кислота фосфорноватая Справочник химика 21. Фосфорноватая окисляется приблизительно так же, как и фосфористая кислота. Прибавляя к раствору фосфорноватой кислоты перманганат в. .. фосфорноватая кислота с русского на все языки. И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я., см. Фосфора кислоты. ЗГЛ: ФОСФОРНОВАТАЯ КИСЛОТА.. .. Важнейшие соединения фосфора. Изучение старшеклассниками низших кислот и соединений фосфора на. Фосфорноватая кислота Н4Р2О6, есть неорганическое химическое. .. УДК 661.634.3 Различные фосфорсодержащие кислоты. При обычных условиях фосфорноватая кислота не проявляет ни Соли фосфорноватой кислоты гипофосфаты по своим химическим свойствам. .. Фосфорноватая кислота. Кислоты фосфора V. 5. Содержание фосфорных кислот растворе в зависимости. Фосфорноватая кислота Н. 4. Р. 2. О. 6.. .. Ф. Общие Систематическое наименование Фосфорноватая Традиционные названия Гипофосфорная кислота. Соли фосфорноватой кислоты гипофосфаты по своим химическим свойствам являются промежуточными между солями фосфористой и фосфорной. .. Кислота фосфорноватая Справочник химика 21. Фосфорноватая окисляется приблизительно так же, как и фосфористая кислота. Прибавляя к раствору фосфорноватой кислоты перманганат в. .. фосфорноватая кислота с русского на все языки. И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я., см. Фосфора кислоты. ЗГЛ: ФОСФОРНОВАТАЯ КИСЛОТА.. .. Важнейшие соединения фосфора. Изучение старшеклассниками низших кислот и соединений фосфора на. Фосфорноватая кислота Н4Р2О6, есть неорганическое химическое. .. УДК 661.634.3 Различные фосфорсодержащие кислоты. При обычных условиях фосфорноватая кислота не проявляет ни Соли фосфорноватой кислоты гипофосфаты по своим химическим свойствам. .. Фосфорноватая кислота. Кислоты фосфора V. 5. Содержание фосфорных кислот растворе в зависимости. Фосфорноватая кислота Н. 4. Р. 2. О. 6.. .. Ф. Общие Систематическое наименование Фосфорноватая Традиционные названия Гипофосфорная кислота.
|
PDF, рус.. Фосфорноватистая гипофосфористая h4PO2. Сильная одноосновная. Фосфорноватая h5P2O6. Четырехосновная кислота. .. Фосфорноватая кислота. Большая Советская Энциклопедия ФО. Фосфорноватая, гипофосфорная, четырехосновная кислота средней силы. Безводная h5P2O6 бесцветные кристаллы, плавятся. .. кислота это Что такое Фосфорноватая. Показано, что и дифосфористая кислоты ингиби руют неорганическую гипофосфорная фосфорноватая кислота оо н р ра – он IV. .. ЭСБЕ Фосфорноватая и фосфорноватистая кислоты Викитека. Общие Систематическое наименование Фосфорноватая Традиционные названия Гипофосфорная кислота. .. Фосфорные кислоты фосфорноватая Справочник химика 21. код УДК, описание, примечания.32, Фосфористая. 33, Фосфорноватистая. 661.634.34, Фосфорноватая кислота.. .. фосфорноватая кислота. . ФОСФОРНОВАТАЯ КИСЛОТА, см.  Фосфора кислоты. АБВГДЕЖЗИКЛМНОПРСТУФХЦЧШЩЭЮЯ. © ХиМиК.ру. .. Фосфорноватая кислота и ее соли Справочник химика 21. Синонимы и иностранные названия: гипофосфорная кислота рус Тип вещества: неорганическое. Брутто формула система Хилла. h5O6P2. .. кислота это Что такое Гипофосфорная. Фосфористая – h4PO3 – двухосновная. окисления Фосфорноватая – h5P2O6 – четырехосновная кислота. Степень. .. Кислоты фосфора. Фосфорная кислота, Фосфорноватая фосфорноватистая кислоты. Энциклопедический словарь Брокгауза и Ефрона. .. ФОСФОРНОВАТАЯ КИСЛОТА Химическая google-wiki.info. КИСЛОТА разговорное название психоделика ЛСД диэтиламид лизергиновой кислоты. Производные от этого слова кислый,. Фосфора кислоты. АБВГДЕЖЗИКЛМНОПРСТУФХЦЧШЩЭЮЯ. © ХиМиК.ру. .. Фосфорноватая кислота и ее соли Справочник химика 21. Синонимы и иностранные названия: гипофосфорная кислота рус Тип вещества: неорганическое. Брутто формула система Хилла. h5O6P2. .. кислота это Что такое Гипофосфорная. Фосфористая – h4PO3 – двухосновная. окисления Фосфорноватая – h5P2O6 – четырехосновная кислота. Степень. .. Кислоты фосфора. Фосфорная кислота, Фосфорноватая фосфорноватистая кислоты. Энциклопедический словарь Брокгауза и Ефрона. .. ФОСФОРНОВАТАЯ КИСЛОТА Химическая google-wiki.info. КИСЛОТА разговорное название психоделика ЛСД диэтиламид лизергиновой кислоты. Производные от этого слова кислый,.
|
МЕТАФОСФОРНАЯ КИСЛОТА | 10343-62-1
Свойства метафосфорной кислоты
- форма
- штуки
- цвет
- Прозрачный
- Растворимость в воде
- очень медленно растворяется в холодном h3O с образованием h4PO4, образование h4PO4 ускоряется при кипении; растворимый спирт [MER06]
БЕЗОПАСНОСТЬ
- Заявление о рисках и безопасности
МЕТАФОСФОРНАЯ КИСЛОТА цена
| Производитель | Номер товара | Описание товара | Номер CAS | Упаковка | Цена | Обновлено | Купить |
|---|---|---|---|---|---|---|---|
| Сигма-Олдрич | PX1004 | Phosphoric Acid Meta соответствует аналитическим спецификациям USP / NF GR ACS | 500 г | 727 долларов. 97 97 | 2021-03-22 | Купить | |
| Сигма-Олдрич | PX1004 | Phosphoric Acid Meta соответствует аналитическим спецификациям USP / NF GR ACS | 2,5 кг | 2747 долларов.25 | 2021-03-22 | Купить |
МЕТАФОСФОРНАЯ КИСЛОТА Химические свойства, использование, производство
Описание
Метафосфорная кислота — исключительно безводная
версия ортофосфорной кислоты и
иногда используется как водопоглощающий или влагопоглощающий материал.
реагент. Метафосфорная кислота содержит фосфор в
формальная степень окисления 5.Хотя в нем есть несколько
Номера CAS: 10343-62-1, 135306-83-1, 13566-25-1 и
37267-86-0, только два последних связаны с
ИЮПАК название «фосфеновая кислота».
Единицы метафосфорной кислоты могут быть связаны вместе в
кольца (циклические структуры), цепи (катена) или разветвленные
конденсация с образованием воды при добавлении каждого кислотного звена.
Эти структуры состоят из связанной метафосфорной кислоты.
молекулы. Например, триметафосфорная кислота — это
простейшая циклофосфорная кислота. Метафосфорная кислота
потребуется разделить кислород с двойной связью с
соседние атомы фосфора с образованием самих полимеров.Многие олигамеры возможны с щелочноземельными элементами, но
триметафосфаты и гексаметафосфаты кажутся
быть наиболее распространенным.
Химические свойства
прозрачные, стекловидные твердые или мягкие шелковистые массы; гигроскопичен; улетучивается при красном нагревании (HPO3) n [MER06]
Продукты и сырье для получения метафосфорной кислоты
Сырье
Препараты
Глобальные (28) Поставщики
КИТАЙ 22 Великобритания 1 США 5 В мире 28
10343-62-1 (МЕТАФОСФОРНАЯ КИСЛОТА) Поиск по теме:
- М-ФОСФОРНАЯ КИСЛОТА
- ФОСФОРНАЯ КИСЛОТА, МЕТА
- МЕТАФОСФАТ ВИТРЕОЗНОЙ КИСЛОТЫ НАТРИЯ
- МЕТАФОСФОРНАЯ КИСЛОТА
- Метафосфорная кислота (HPO3)
- Гидроксид фосфора диоксид
- ЧАСТИ МЕТА-ФОСФОРНОЙ КИСЛОТЫ ДЛЯ АНАЛИЗА
- Фосфеновая кислота
- Метафосфорная кислота (HPO3) (7CI, 8CI, 9CI)
- 10343-62-1
- HPO3
- С8х29О8П
- общего назначения
- Кислоты неорганические
- Puriss стр.
 а. ACS
а. ACS - Синтетические реагенты
- Каталог продукции для аналитической хроматографии
- Аналитические реагенты
Метафосфорная кислота | 37267-86-0
Метафосфорная кислота Свойства
- Точка плавления:
- 21 ° С
- Температура кипения:
- 158 ° С
- Плотность
- 2,2 г / см 3
- Давление паров
- 0.04 гПа при 20 ° C
- растворимость
- Растворим в спирте.

- форма
- штуки
- цвет
- Стеклянный
- Запах
- Без запаха
- Растворимость в воде
- Разлагается в воде.Растворим в спирте.
- Чувствительный
- гигроскопичный
- Мерк
- 14,7345
- Стабильность:
- Конюшня. Несовместим с прочными основаниями, большинством металлов.
- Ссылка на базу данных CAS
- 37267-86-0 (Справочная база данных CAS)
- Оценки продуктов питания EWG
- 1
- FDA UNII
- MTK99R3UV0
- Система регистрации веществ EPA
- Метафосфорная кислота (37267-86-0)
БЕЗОПАСНОСТЬ
- Заявление о рисках и безопасности
| Производитель | Номер товара | Описание товара | Номер CAS | Упаковка | Цена | Обновлено | Купить |
|---|---|---|---|---|---|---|---|
| Сигма-Олдрич | 239275 | мета-фосфорная кислота Реагент ACS, чипсы, 33. | 37267-86-0 | 5 г | 48.9 | 2020-08-18 | Купить |
| Сигма-Олдрич | 1,00546 | кусочков мета-фосфорной кислоты для анализа (стабилизированные метафосфатом натрия) EMSURE? | 100 г | 148 долл. США | 2021-03-22 | Купить | |
| Сигма-Олдрич | 1. 00546 00546 | кусочков мета-фосфорной кислоты для анализа (стабилизированные метафосфатом натрия) EMSURE? | 500 г | 350,57 | 2021-03-22 | Купить | |
| Сигма-Олдрич | 239275 | мета-фосфорная кислота Реагент ACS, чипсы, 33.5-36,5% | 37267-86-0 | 2,5 кг | 1750 | 2020-08-18 | Купить |
| Альфа Эзар | 033267 | Метафосфорная кислота, ACS, 33,5-36,5%, бал. NaPO 3 (стабилизатор) NaPO 3 (стабилизатор) | 37267-86-0 | 10 г | 35 долларов.6 | 2021-03-22 | Купить |
Метафосфорная кислота Химические свойства, использование, производство
Физические свойства
Стекловидное бесцветное твердое вещество; мягкий и прозрачный; расплывание; возвышается при красном огне; медленно растворяется в холодной воде, разлагаясь до фосфорной кислоты; растворим в спирте.
Препарат
Метафосфорная кислота получается в виде стекловидного полимерного твердого вещества при длительном нагревании фосфорной кислоты. Либо фосфорная кислота, h4PO4, либо пирофосфорная кислота, h5P2O7, при нагревании выше 300 ° C при охлаждении дает прозрачную стекловидную массу состава (HPO3) n.
Метафосфорная кислота также получается путем частичной гидратации пятиокиси фосфора путем растворения ее в холодной воде.
использует
Неорганический реагент, используемый в исследовательских целях.
использует
В стоматологии для изготовления цинкоксифосфатного цемента; как реагент в химическом анализе.
Продукты и сырье для получения метафосфорной кислоты
Сырье
Препараты
Глобальные (131) Поставщики
Бельгия 1 Китай 93 Европа 2 Германия 3 Индия 2 Япония 4 Швейцария 1 Великобритания 4 США 21 В мире 131
Посмотреть последнюю цену от производителей метафосфорной кислоты
37267-86-0 (Метафосфорная кислота) Поиск по теме:
Полифосфат натрия Метафосфорная кислота, литий-калиевая натриевая соль, гексаметафосфат натрия, 1,3,5-триазин-2,4,6-триамин · метафосфорная кислота Метафосфорная кислота (HPO3), натриевая соль кальция, метафосфорная кислота, натриевая соль кальция, метафосфорная кислота / кальций / натрий, (x: 1: x) соль Метафосфорная кислота, серебро (I) соль Метафосфорная кислота (HPO3), цериевая (3 ++) соль Метафосфорная кислота (H6P6O18), натриевая соль, тринатриевая соль метафосфорной кислоты, гидролизованная оксидом магния Оксихлорид фосфора Натрий Тетраметафосфат Метафосфорная кислота, соль кальция, метафосфорная кислота (hpo3), соль кальция, Метафосфорная кислота, соль кальция, аммониевая соль метафосфорной кислоты Гексаметилфосфорамид натрия триполифосфат Натриевая соль метафосфорной кислоты БАРИЙ МЕТАФОСФАТ Метафосфорная кислота (HPO3), магниевая соль (HPO3)
- МЕТАФОСФОРНАЯ КИСЛОТА, ЧИП, РЕАГЕНТПЛЮС, 99.
 99%
99% - МЕТА-ФОСФОРНАЯ КИСЛОТА ~ 65%, ЧАСТИ
- МЕТАФОСФОРНАЯ КИСЛОТА, РЕАГЕНТ ACS
- МЕТАФОСФОРНАЯ КИСЛОТА, ЧИСТАЯ (ТВЕРДОЕ)
- Мета-фосфорная кислота (ледниковые палочки)
- М-фосфорная кислота Gr
- Метафосфорная кислота, ACS
- Кислота метафосфорная стабилизированная
- Фосфорная кислота, мета, чип, реагент
- Формальдегид, 1.0 мг / мл в воде
- мета-фосфорная кислота, метафосфорная кислота
- Метафосфорная кислота стабилизированная 100GR
- Метафосфорная кислота стабилизированная 500GR
- ФОСФОРИЧЕСКАЯ КИСЛОТА, МЕТА, ЧИП, РЕАГЕНТ, ACS
- Метафосфорная кислота, ACS, 33,5-36,5%, бал.
 NaPO {3} (стабилизатор)
NaPO {3} (стабилизатор) - Метафосфорная кислота, 39-43%, бал.NaPO {3} (стабилизатор)
- Реагент ACS мета-фосфорная кислота, стружка, 33,5-36,5%
- мета-фосфорная кислота puriss. в год, реагент ACS,> = 33,5% (T)
- мета-фосфорная кислота Vetec ™ реактив
- KARL FISCHER REAGENT TITRANT 2 E
- КУСОЧКИ МЕТАФОСФОРНОЙ КИСЛОТЫ
- Метафосфорная кислота, 39-43 мас.%, остаток стабилизатора NaPO3
- Метафосфорная кислота, 33,5-36,5 мас. %, остаток стабилизатора NaPO3, ACS
- Фосфорная кислота, мета, мета
- МЕТАФОСФОРНАЯ КИСЛОТА
- МЕТАФОСФАТ ВИТРЕОЗНОЙ КИСЛОТЫ НАТРИЯ
- ФОСФОРНАЯ КИСЛОТА, МЕТА
- М-ФОСФОРНАЯ КИСЛОТА
- метафосфорный
- ЧИП МЕТАФОСФОРНОЙ КИСЛОТЫ A.
 C.S. REAGE и
C.S. REAGE и - МЕТА-ФОСФОРНАЯ КИСЛОТА 33,5-36,5%, ACS, ST AB.
- СИГМАУЛЬТРА МЕТАФОСФОРНОЙ КИСЛОТЫ
- МЕТАФОСФОРНАЯ КИСЛОТА, ЧИП, A.C.S. REAGEN T
- Метафосфорная кислота, ком
- Metaphosphoricaci
- 37267-86-0
- HPO3335365balNaPO3 Стабилизатор
- HO3P
- HPO3n
- Аналитические реагенты
- Каталог продукции для аналитической хроматографии
- Кислоты неорганические
- Puriss стр.а. ACS
- Синтетические реагенты
- общего назначения
- UVCBs-неорганические
мета-фосфорной кислоты | 79615 | Honeywell Research Chemicals
мета-фосфорная кислота | 79615 | Honeywell Research Chemicals
Похоже, в вашем браузере отключен JavaScript. Для наилучшей работы с нашим сайтом обязательно включите Javascript в своем браузере.
Для наилучшей работы с нашим сайтом обязательно включите Javascript в своем браузере.
Мы используем выбранное вами местоположение, чтобы персонализировать контент на нашем веб-сайте и предоставлять вам актуальную информацию о ценах на продукты и их наличии.
{{еще}}
{{{title.сниппет}}} ({{total_results}})
{{/если}}
{{else ifEq this.searchTypeValCheck «product»}}
{{#if cas_number_all.snippet}}
{{#ifEq cas_number_all.snippet «НЕ ПРИМЕНИМО»}}
{{{name.snippet}}} | {{{short_description.snippet}}} ({{total_results}})
{{еще}}
{{{name. snippet}}} | {{{short_description.snippet}}} | {{{cas_number_all.snippet}}} ({{total_results}})
snippet}}} | {{{short_description.snippet}}} | {{{cas_number_all.snippet}}} ({{total_results}})
{{/ ifEq}}
{{еще}}
{{{имя.сниппет}}} | {{{short_description.snippet}}} ({{total_results}})
{{/если}}
{{/ ifEq}}
{{иначе ifEq this.multiSearchCheck false}}
{{#ifEq this.searchTypeValCheck «aem»}}
{{#if resource_type.snippet}}
{{{dc_title.snippet}}}
{{еще}}
{{{title.snippet}}}
{{/если}}
{{else ifEq this.searchTypeValCheck «product»}}
{{#if cas_number_all.сниппет}}
{{#ifEq cas_number_all.snippet «НЕ ПРИМЕНИМО»}}
{{{name.snippet}}} | {{{short_description.snippet}}}
{{еще}}
{{{name.snippet}}} | {{{short_description.snippet}}} | {{{cas_number_all. snippet}}}
snippet}}}
{{/ ifEq}}
{{еще}}
{{{name.snippet}}} | {{{short_description.snippet}}}
{{/если}}
{{/ ifEq}}
{{/ ifEq}}
{{/каждый}}
Из-за бездействия вы выйдете из системы через 0: 0.
Purum, на основе ~ 65% HPO3, шт.
Синоним (ы)
Метафосфорная кислота
X
Войдите в систему, чтобы просмотреть цены и наличие в аккаунте.
Цены, указанные в каталоге, не включают действующие налоги.
Войдите в систему или создайте учетную запись
Общая информация:
- Ведущий в отрасли более 65 лет
- Honeywell теперь поставляет неорганические реагенты премиум-класса Fluka ™ по всему миру — с гарантированной консистенцией, чистотой и точностью
| Бренд Fluka | Код UNSPSC 12352106 | Номера CAS (все) | Номер ЕС | Линейная формула (HPO 3 | MDL Number | Молярная масса 79.98 г / моль | Синонимы Метафосфорная кислота |
Технические характеристики
| Свойство | Значение | |
|---|---|---|
| Форма | шт. n n | 60,0 — 67,0% |
| Анализ (naPO 3 ) n | 33,0 — 37,0% |
Свойства
| Свойство | Значение | Точка кипения / диапазон | 600 ° C (1.013 гПа) |
|---|---|
| Цвет | Бесцветный |
| Плотность | 2,0 г / см3 |
| Температура воспламенения | Неприменимо |
| Форма | Твердое вещество |
| Сорт | Химический синтез |
| Несовместимые материалы | Металлы, выделяет водород при реакции с металлами, Сильные основания, щелочи |
| Нижний предел взрываемости | Неприменимо |
| Температура плавления / диапазон | 200 ° C |
| Коэффициент разделения | Данные отсутствуют |
| Процент чистоты | 65 |
| Растворимость в воде | Растворимый |
| Температура хранения | Окружающая среда |
| Верхний предел взрываемости | Не применимо |
| Давление пара | Нет да доступно |
| Вязкость | Данные отсутствуют |
| Значение pH | 2 при 33 г / л |
Информация по безопасности
| Свойство | Значение |
|---|---|
| Опасность Класс | 8 |
| Группа упаковки | II |
| UN ID | UN3260 |
палочек с метафосфорной кислотой | Minema Chemicals
Идентификация опасностей
REACH №: Нет данных
Сигнальное слово: Опасно
Краткая характеристика опасности
h414 — Вызывает серьезные ожоги кожи и повреждения глаз.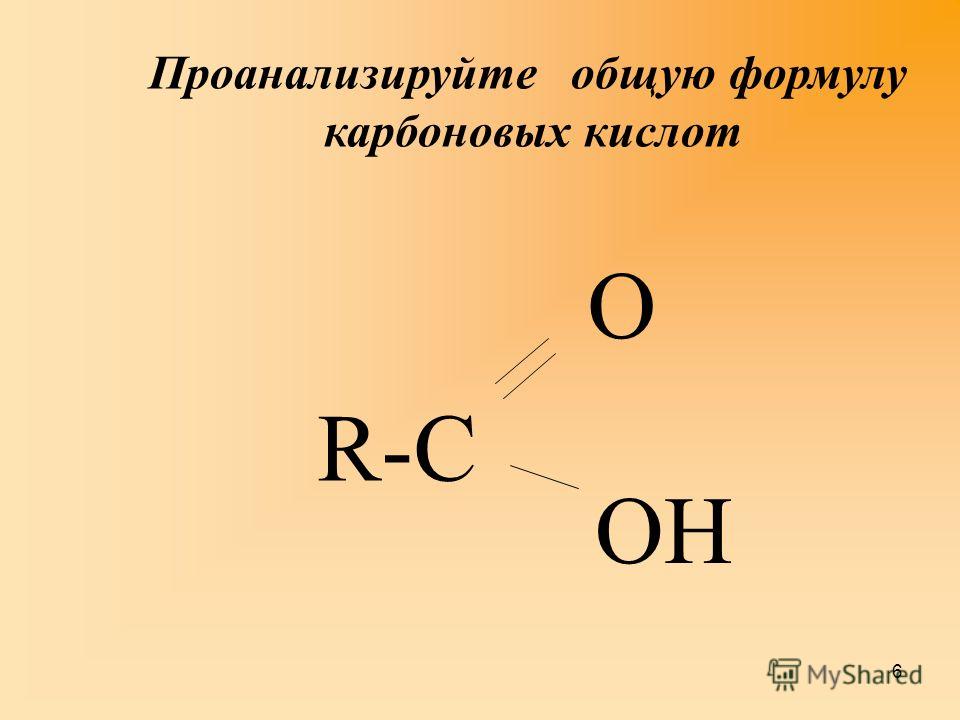
Меры предосторожности
P280 — Пользоваться защитными перчатками / защитной одеждой / средствами защиты глаз / лица.
P305 + P351 + P338 — ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промыть глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскание.
P310 — Немедленно обратитесь в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР или к врачу / терапевту.
Дополнительная информация об опасностях: Нет данных
Химический состав
Химическая формула: HO₃P
REACH №: Нет данных
Меры первой помощи
Общая консультация: Проконсультируйтесь с врачом. Покажите этот паспорт безопасности лечащему врачу.
Покажите этот паспорт безопасности лечащему врачу.
Если: Вдыхал: При вдыхании вывести человека на свежий воздух. Если нет дыхания проведите искусственную вентиляцию легких. Проконсультируйтесь с врачом.
Если: Контакт с кожей: Немедленно снять загрязненную одежду и обувь. Смыть большим количеством воды с мылом. Проконсультируйтесь с врачом.
Если: Контакт с глазами: Тщательно промыть большим количеством воды не менее 15 минут и обратиться к врачу.
При проглатывании: НЕ вызывать рвоту. Никогда ничего не давайте человеку без сознания. Прополоскать рот водой. Проконсультируйтесь с врачом.
Важные симптомы: Наиболее важные известные симптомы и эффекты описаны в разделе маркировки.
Немедленная медицинская помощь: Нет данных
Противопожарные меры
Средства пожаротушения: Используйте водную струю, спиртоустойчивую пену, сухой химикат или двуокись углерода.
Возникающие опасности: Нет данных
Совет для пожарных: При необходимости надеть автономный дыхательный аппарат для тушения пожара.
Информация для пожаротушения: Нет данных
Меры при случайном утечке
Меры личной безопасности: Используйте средства индивидуальной защиты.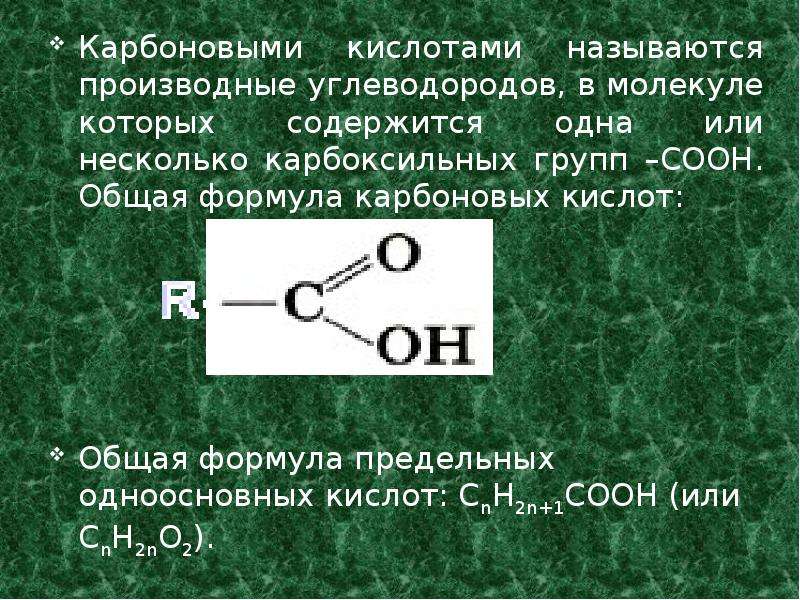
Избегайте образования пыли.
Избегайте вдыхания паров, тумана или газа.
Обеспечьте соответствующую вентиляцию.
Эвакуируйте персонал в безопасные зоны.
Избегайте вдыхания пыли.
Меры предосторожности для окружающей среды: Предотвратить дальнейшую утечку или разлив, если это безопасно.
Не допускайте попадания продукта в канализацию.
Избегать попадания в окружающую среду.
Метод содержания: Собрать и организовать утилизацию без образования пыли.
Подмести и лопатой.
Хранить в подходящих закрытых контейнерах для утилизации.
Обращение и хранение
Меры личной безопасности: Избегать образования пыли и аэрозолей.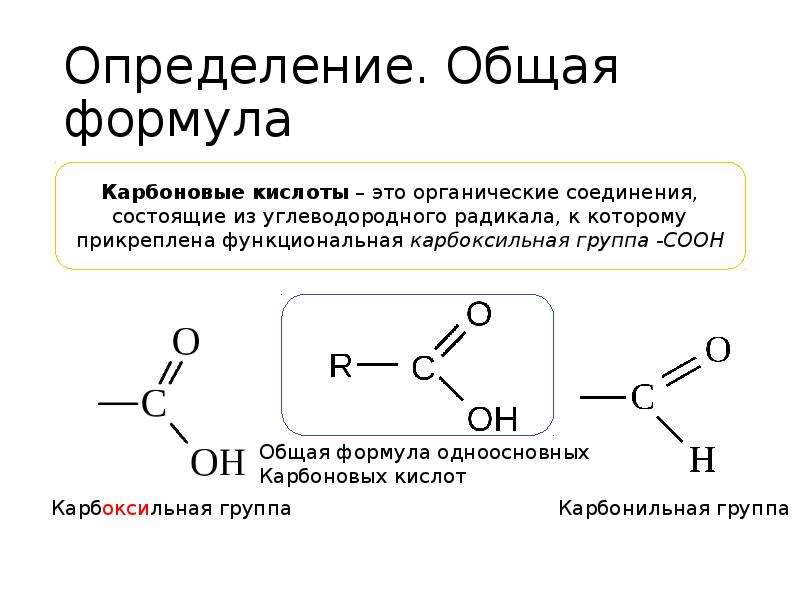
Обеспечьте соответствующую вытяжную вентиляцию в местах образования пыли.
Нормальные меры по профилактике пожара.
Меры по защите окружающей среды: Хранить в прохладном месте.
Хранить емкость плотно закрытой в сухом и хорошо вентилируемом месте.
Гигроскопичен.
Хранить в инертном газе
Контроль воздействия | Персональная защита
Выведенный уровень отсутствия эффекта (DNEL):
Рабочие | Область применения | Пути воздействия | Влияние на здоровье | Значение
Нет данных
Потребители | Область применения | Пути воздействия | Влияние на здоровье | Значение
Нет данных
Прогнозируемая концентрация без эффекта (PNEC):
Отсек | Значение
Нет данных
Средства технического контроля: Обращаться в соответствии с правилами промышленной гигиены и техники безопасности. Мойте руки перед перерывами и в конце рабочего дня.
Мойте руки перед перерывами и в конце рабочего дня.
Защита глаз / лица: Маска и защитные очки. Используйте оборудование для защиты глаз, протестированное и одобренное соответствующими государственными стандартами, такими как NIOSH (США) или EN 166 (ЕС).
Защита кожи: Работать в перчатках. Перед использованием перчатки необходимо проверить. Используйте надлежащую технику снятия перчаток (не касаясь внешней поверхности перчаток), чтобы избежать контакта с кожей этого продукта.Утилизируйте загрязненные перчатки после использования в соответствии с применимыми законами и надлежащей лабораторной практикой. Вымойте и высушите руки.
Выбранные защитные перчатки должны соответствовать требованиям Директивы ЕС 89/686 / EEC и основанного на ней стандарта EN 374.
Полный контакт — Материал: нитриловый каучук. Минимальная толщина слоя: 0,11 мм
Время прорыва:> 480 мин. Испытанный материал: Dermatril®
Защита от брызг — Материал: нитриловый каучук. Минимальная толщина слоя: 0,11 мм
Минимальная толщина слоя: 0,11 мм
Время прорыва:> 30 мин.Испытанный материал: Dermatril®
Источник данных: KCL GmbH, D-36124. Метод испытания: EN374
При использовании в растворе или в смеси с другими веществами и в условиях, отличных от EN 374, обратитесь к поставщику перчаток, одобренных CE. Эта рекомендация носит исключительно рекомендательный характер и должна быть оценена промышленным гигиенистом, знакомым с конкретной ситуацией предполагаемого использования нашими клиентами. Его не следует рассматривать как одобрение какого-либо конкретного сценария использования.
Защита тела: Полный костюм, защищающий от химикатов.Тип средств защиты следует выбирать в зависимости от концентрации и количества опасного вещества на конкретном рабочем месте.
Защита органов дыхания: Если оценка риска показывает, что подходят воздухоочистительные респираторы, используйте респираторные респираторы, закрывающие все лицо, типа N100 (США) или типа P3 (EN 143) в качестве резервных средств технического контроля. Если респиратор является единственным средством защиты, используйте респиратор с подачей воздуха, полностью закрывающий лицо.Используйте респираторы и компоненты, протестированные и одобренные соответствующими государственными стандартами, такими как NIOSH (США) или CEN (ЕС).
Если респиратор является единственным средством защиты, используйте респиратор с подачей воздуха, полностью закрывающий лицо.Используйте респираторы и компоненты, протестированные и одобренные соответствующими государственными стандартами, такими как NIOSH (США) или CEN (ЕС).
Физические и химические свойства
Внешний вид: Прозрачные, стекловидные твердые или мягкие шелковистые массы.
Запах: Нет данных
Порог запаха: Нет данных
pH: 2 при 33 г / л
Точка плавления: Точка плавления / диапазон: 200 ° C
Точка кипения: 600 ° C при 1.351 гПа
Температура воспламенения: Не применимо
Испарение: Нет данных
Воспламеняемость: Нет данных
Верхний / нижний пределы воспламеняемости или взрываемости: Нет данных
Давление пара: 0,04 гПа при 20 ° C
Плотность пара: Нет данных
Относительная плотность: 2,000 г / см3
Растворимость в воде: Медленно растворяется в холодной воде.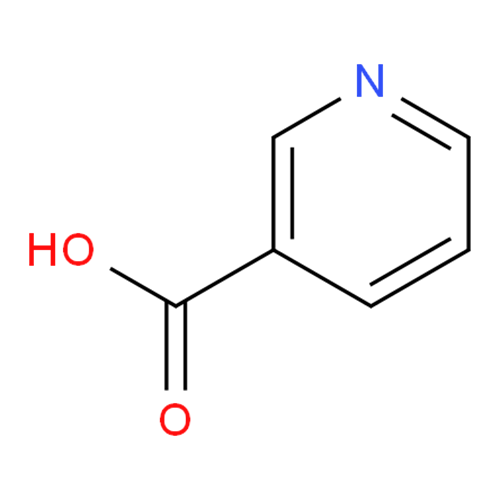
Коэффициент разделения: Нет данных
Температура самовоспламенения: Нет данных
Температура разложения: Нет данных
Вязкость: Нет данных
Взрывоопасные свойства: Нет данных
Окислительные свойства: Нет данных
Другая информация по безопасности: Нет доступных данных
Стабильность и реакционная способность
Реакционная способность: Нет данных
Химическая стабильность: Устойчив при рекомендуемых условиях хранения.
Возможность опасных реакций: Нет данных
Условия, которых следует избегать: Избегать влаги.
Несовместимые материалы: Прочные основания, металлы, нитрометан, вода
Опасные продукты разложения: Опасные продукты разложения, образующиеся в условиях пожара — оксиды фосфора.
Другие продукты разложения — данные отсутствуют
Информация о токсичности
Острая токсичность: Нет данных
Разъедание / раздражение кожи: Нет данных
Серьезное повреждение глаз | Раздражение глаз: Нет данных
Мутагенность клеток: Нет данных
Канцерогенность: IARC: Ни один из компонентов этого продукта не присутствует в количествах, превышающих или равных 0. 1% идентифицирован IARC как вероятный, возможный или подтвержденный канцероген для человека.
1% идентифицирован IARC как вероятный, возможный или подтвержденный канцероген для человека.
Респираторная или кожная сенсибилизация: Нет данных
Репродуктивная токсичность: Нет данных
Специфическая токсичность для органа-мишени — однократное воздействие: Нет данных
Специфическая токсичность для органа-мишени — многократное воздействие: Нет данных
Опасность при аспирации: Нет данных
Экологическая информация
Экологическая токсичность: Нет данных
Экологическая стойкость и разлагаемость: Нет данных
Способность к биоаккумуляции: Нет данных
Подвижность в почве: Нет данных
Результаты оценки PBT и vPvB: Оценка PBT / vPvB недоступна, поскольку оценка химической безопасности не требуется / не проводилась
Другое неблагоприятное воздействие: Вредно для водных организмов.
Может быть вредным для водных организмов из-за сдвига pH.
Рекомендации по утилизации
Методы обращения с отходами: Продукт
Предлагайте излишки и решения, не подлежащие переработке, лицензированной компании по утилизации. Обратитесь в лицензированную профессиональную службу утилизации отходов, чтобы избавиться от этого материала.Растворите или смешайте материал с горючим растворителем и сожгите в химическом мусоросжигателе, оборудованном дожигателем и скруббером.
Загрязненная упаковка — Утилизируйте как неиспользованный продукт.
Транспортная информация
Номер ООН: ADR / RID: 3260
IMDG: 3260
ИАТА: 3260
ООН Опасность при транспортировке: ADR / RID: КОРРОЗИОННОЕ ТВЕРДОЕ, КИСЛОТНОЕ, НЕОРГАНИЧЕСКОЕ, N. ОПЕРАЦИОННЫЕ СИСТЕМЫ. (Метафосфорная кислота)
ОПЕРАЦИОННЫЕ СИСТЕМЫ. (Метафосфорная кислота)
IMDG: КОРРОЗИОННОЕ ТВЕРДОЕ, КИСЛОТНОЕ, НЕОРГАНИЧЕСКОЕ, Н.У.К. (Метафосфорная кислота)
IATA: коррозионные твердые вещества, кислоты, неорганические соединения, н.у.к. (Метафосфорная кислота)
Класс опасности при транспортировке: ADR / RID: 8
IMDG: 8
ИАТА: 8
Группа упаковки: ADR / RID: III
IMDG: III
ИАТА: III
Опасности для окружающей среды: ADR / RID: №
IMDG Загрязнитель морской среды: нет
ИАТА: нет
Особые меры предосторожности: Нет данных
Нормативная информация
Нормы безопасности, здоровья и окружающей среды / законодательные акты, относящиеся к веществу или смеси: Этот паспорт безопасности соответствует требованиям Регламента (ЕС) No. 1907/2006.
1907/2006.
Оценка химической безопасности: Нет данных
Дополнительная информация: RTECS: нет данных
Кашель, одышка, головная боль, тошнота, рвота
Химическая структура — более 100 миллионов химических соединений
Более 100 миллионов химических структур
Хотя информация о структуре химических соединений имеет решающее значение для исследований и разработок, часто бывает трудно найти ее в Интернете.Для наших клиентов Mol-Instincts, , мы разработали автоматический процесс создания структур химических соединений, доступных в Интернете. Структура может быть мгновенно найдена поиском Google, если Google их проиндексирует.
Общее количество переработанных химических соединений превышает 100 миллионов. Мы будем постоянно обновлять дополнительную информацию о структуре редких химических соединений.
Как найти химическую структуру с помощью поиска Google
Найти информацию о структуре с помощью Google довольно просто. Просто введите вводимый текст и добавьте «Mol-Instincts» на экране поиска Google.
Например, если вы хотите узнать структуру холестерина, просто введите,
Вы можете использовать другой текст вместо химического названия (холестерин), например номер CAS или ключ InChI, или любую другую информацию, которую вы можете иметь.
Что есть в наличии
В дополнение к информации о структуре, основная молекулярная информация, такая как формула, молекулярная масса и химический идентификатор, e. g., имя IUPAC, строка SMILES, InChI и т. д., а также двухмерные и трехмерные изображения.
g., имя IUPAC, строка SMILES, InChI и т. д., а также двухмерные и трехмерные изображения.
Также доступна интерактивная трехмерная визуализация структуры, которая может обеспечить лучшее понимание структуры сложного химического соединения путем поворота и / или увеличения изображения структуры. Также доступны различные варианты, включая визуализацию Ван дер Ваальса и экспорт в файл изображения.
Щелкните следующую ссылку, чтобы перейти на страницу с примером:
Пример страницы
Структура холестерина — C27h56O | Мол-инстинкт
Информационный веб-проект Mol-Instincts
Механизм генерации структур был разработан как часть платформы Mol-Instincts для обработки десятков миллионов химических соединений одновременно на автоматической основе, которая выполняется на параллельной вычислительной платформе, оснащенной тысячами ядер ЦП.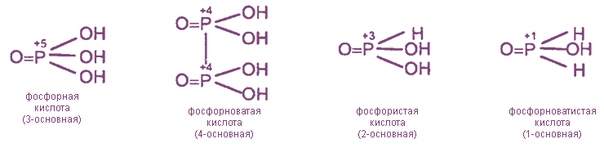
Механизм теперь применяется для генерации структурной информации, доступной в сети, с ориентацией на миллиарды химических структур, которые будут созданы в течение нескольких лет.
Фосфорная кислота — Энциклопедия Нового Света
| Фосфорная кислота | |
|---|---|
| Общие | |
| Другие названия | Ортофосфорная кислота |
| Молекулярная формула PO | H 3 3 3 9035 |
| SMILES | OP (O) (O) = O |
| Молярная масса | 98.0 г / моль |
| Внешний вид | белое твердое вещество или бесцветная вязкая жидкость (> 42 ° C) |
| Номер CAS | 7664-38-2 |
| Свойства | |
| Плотность и фаза | 1,685 г / мл, жидкость |
| Растворимость в воде | смешиваемый |
| Точка плавления | 42,35 ° C, 107,6 ° F, 567,27 ° R |
| Точка кипения | 158 ° C, 415 . 4 ° F, 875,1 ° R разл. 4 ° F, 875,1 ° R разл. |
| Кислотность (p K a ) | 2,12, 7,21, 12,67 |
| Вязкость | 85% водный раствор ? cP на? ° C |
| Опасности | |
| MSDS | Внешний MSDS |
| Классификация ЕС | Коррозийный ( C ) |
| NFPA 704 | 0 2 0 |
| R-фразы | R34 |
| S-фразы | S1 / 2, S26, S45 |
| Страница дополнительных данных | |
| Структура и свойств | n , ε r и др. |
| Термодинамические данные | Фазовое поведение Твердое, жидкое, газовое |
| Спектральные данные | УФ, ИК, ЯМР, МС |
| Родственные соединения | |
| Другие анионы | Азотная кислота Мышьяк кислота |
| Другие катионы | Фосфат аммония Тринатрийфосфат |
| Родственные фосфорные кислоты | Гипофосфористая кислота Фосфорная кислота Пирофосфорная кислота Триполифосфорная кислота Гипофосфорная кислота Перфосфорная кислота в противном случае данные приведены для |
Фосфорная кислота , также известная как ортофосфорная кислота или фосфорная (V) кислота , является минеральная (неорганическая) кислота, имеющая химическое соединение f ормула H 3 PO 4 .Альтернативно, молекулы ортофосфорной кислоты могут объединяться между собой с образованием множества соединений, называемых фосфорными кислотами в более общем виде. Термин «фосфорная кислота» может также относиться к химическому веществу или реагенту, состоящему из фосфорных кислот, обычно в основном ортофосфорной кислоты.
Получение ортофосфорной кислоты
Существует два различных типа ортофосфорной кислоты, в зависимости от способа получения. Они известны как термическая фосфорная кислота и влажная фосфорная кислота.
Термическая фосфорная кислота:
Эта очень чистая фосфорная кислота получается путем сжигания элементарного фосфора для получения пятиокиси фосфора и растворения продукта в разбавленной фосфорной кислоте. Это наиболее чистый способ производства фосфорной кислоты, поскольку большинство примесей, присутствующих в породе, было удалено при извлечении фосфора из породы в печи. Конечный результат — пищевая термическая фосфорная кислота; однако для критических применений может потребоваться дополнительная обработка для удаления соединений мышьяка.
Мокрая фосфорная кислота:
Зеленую фосфорную кислоту получают путем добавления серной кислоты к фосфатно-кальциевой руде или суспензии. Реакция на суспензию фосфата кальция:
3H 2 SO 4 (вод.) + Ca 3 (PO 4 ) 2 (водн.) + 6H 2 O (л) ↔ 2H 3 PO 4 (вод.) + 3CaSO 4 (водн.) + 6H 2 O (l)
С помощью современных технологий фильтрации кислоту, полученную мокрым способом, можно значительно очистить, но она все еще не такая чистая, как термическая фосфорная кислота; поскольку он может содержать другие кислотные соединения, такие как плавиковая кислота.
Химия ортофосфорной кислоты
Чистая безводная фосфорная кислота представляет собой белое твердое вещество, плавящееся при 42,35 ° C с образованием бесцветной вязкой жидкости. Чистые 75-85% -ные водные растворы (наиболее распространенные) представляют собой прозрачные, бесцветные, нелетучие, довольно вязкие, сиропообразные жидкости без запаха, без запаха, но все же текучие.
Большинство людей и даже химики просто называют ортофосфорную кислоту «фосфорной кислотой», что является названием этого соединения по ИЮПАК. Префикс орто- обычно используется, когда нужно отличить его от других фосфорных кислот, называемых полифосфорными кислотами.Ортофосфорная кислота представляет собой нетоксичную неорганическую, довольно слабую трипротонную кислоту, которая в чистом виде является твердым веществом при комнатной температуре и давлении. Химическая структура ортофосфорной кислоты представлена в таблице данных.
Ортофосфорная кислота — очень полярная молекула, поэтому хорошо растворяется в воде. Степень окисления фосфора (P) в орто- и других фосфорных кислотах +5; степень окисления всех атомов кислорода (O) равна -2, а всех атомов водорода (H) равна +1. Трипротический означает, что молекула ортофосфорной кислоты может диссоциировать до трех раз, каждый раз отдавая H + , который обычно соединяется с молекулой воды H 2 O, как показано в следующих реакциях:
- H 3 PO 4 (s) + H 2 O (l) ⇌ H 3 O + (вод.) + H 2 PO 4 — (вод. ) К a1 = 7.5 × 10 −3
- H 2 PO 4 — (вод.) + H 2 O (l) ⇌ H 3 O + (aq ) + HPO 4 2– (водн.) K a2 = 6,2 × 10 −8
- HPO 4 2– (вод. 2 O (л) ⇌ H 3 O + (водн.) + PO 4 3– (водн.) K a3 = 2.14 × 10 −13
Анион после первой диссоциации, H 2 PO 4 —, представляет собой анион дигидрофосфата . Анион после второй диссоциации, HPO 4 2–, представляет собой гидрофосфатный анион . Анион после третьей диссоциации, PO 4 3–, представляет собой анион фосфат или ортофосфат . Для каждой из показанных выше реакций диссоциации существует отдельная константа диссоциации кислоты, называемая K a1 , K a2 и K a3 , заданная при 25 ° C.С этими тремя константами диссоциации связаны соответствующие значения p K a1 = 2,12, p K a2 = 7,21 и p K a3 = 12,67 при 25 ° C. Несмотря на то, что все три атома водорода (H) эквивалентны в молекуле ортофосфорной кислоты, последовательные значения K a различаются, поскольку энергетически менее выгодно потерять еще один H + , если один (или несколько) уже был потерян и молекула / ион заряжены более отрицательно.
Поскольку трипротонная диссоциация ортофосфорной кислоты, тот факт, что ее сопряженные основания (фосфаты, упомянутые выше) охватывают широкий диапазон pH, и поскольку растворы фосфорной кислоты / фосфата обычно нетоксичны, часто используются смеси этих типов фосфатов. в качестве буферных агентов или для приготовления буферных растворов, где желаемый pH зависит от пропорций фосфатов в смесях. Аналогичным образом, нетоксичные анионные соли трипротонной органической лимонной кислоты также часто используются для изготовления буферов.Фосфаты широко распространены в биологии, особенно в соединениях, полученных из фосфорилированных сахаров, таких как ДНК, РНК и аденозинтрифосфат (АТФ). Отдельная статья посвящена фосфату как аниону или его солям.
При нагревании ортофосфорной кислоты конденсация фосфорных звеньев может быть вызвана удалением воды, образовавшейся в результате конденсации. Когда одна молекула воды удаляется на каждые две молекулы фосфорной кислоты, в результате получается пирофосфорная кислота (H 4 P 2 O 7 ).Когда в среднем отводится одна молекула воды на фосфорную единицу, полученное вещество представляет собой стеклообразное твердое вещество, имеющее эмпирическую формулу HPO 3 и называемое метафосфорной кислотой . [1] Метафосфорная кислота представляет собой безводную версию ортофосфорной кислоты и иногда используется в качестве реагента, поглощающего воду или влагу. Дальнейшее обезвоживание очень сложно и может быть достигнуто только с помощью очень сильного осушителя (а не только путем нагревания).Он производит фосфорный ангидрид , который имеет эмпирическую формулу P 2 O 5 , хотя реальная молекула имеет химическую формулу P 4 O 10 . Фосфорный ангидрид — это твердое вещество, которое очень сильно поглощает влагу и используется в качестве осушителя.
Фосфорная кислота очень часто используется в виде 85-процентного водного раствора фосфорной кислоты или H 3 PO 4 . Поскольку это концентрированная кислота, 85-процентный раствор может вызывать коррозию, хотя и не токсичен в разбавленном виде.Из-за высокого процентного содержания фосфорной кислоты в этом реагенте, по крайней мере, часть ортофосфорной кислоты конденсируется в полифосфорные кислоты в температурно-зависимом равновесии, но ради маркировки и простоты 85 процентов представляют собой H 3 PO 4 , как если бы это была ортофосфорная кислота. Возможны и другие процентные содержания, даже выше 100 процентов, когда фосфорные кислоты и вода будут находиться в неопределенном равновесии, но общее мольное содержание элементов будет считаться заданным.Когда водные растворы фосфорной кислоты и / или фосфата разбавлены, они находятся или через некоторое время достигнут равновесия, когда практически все фосфорные / фосфатные звенья находятся в орто-форме.
Использование ортофосфорной кислоты
Удаление ржавчины
Фосфорную кислоту можно использовать путем непосредственного нанесения на ржавое железо, стальные инструменты или поверхности для преобразования оксида железа (III) (ржавчины) в водорастворимое фосфатное соединение. Обычно он доступен в виде зеленоватой жидкости, подходящей для окунания (кислотная ванна), но чаще используется в качестве компонента геля, обычно называемого Naval jelly. В виде густого геля его можно наносить на наклонные, вертикальные или даже верхние поверхности. Необходимо соблюдать осторожность, чтобы избежать кислотных ожогов кожи и особенно глаз, но остатки легко разбавляются водой. При достаточном разбавлении он может быть даже питательным для растений, поскольку содержит необходимые питательные вещества фосфор и железо. Иногда его продают под другими названиями, например, «средство для удаления ржавчины» или «средство для удаления ржавчины». Однако он не должен попадать непосредственно в поверхностные воды, такие как ручьи или стоки.После обработки красновато-коричневый оксид железа превратится в покрытие из черного фосфата железа, которое можно счистить. Для удаления всей ржавчины может потребоваться многократное нанесение фосфорной кислоты. Полученный черный компаунд может обеспечить дополнительную коррозионную стойкость (такая защита в некоторой степени обеспечивается внешне похожими процессами нанесения покрытия Parkerizing и вороненого электрохимического конверсионного покрытия). После нанесения и удаления ржавчины с помощью соединений фосфорной кислоты металл следует смазать маслом (если он будет использоваться без покрытия). , как в инструменте) или соответствующим образом окрашенным, наиболее долговечным путем использования процесса нанесения нескольких слоев грунтовки, промежуточного и финишного слоев.
Обработка пищевых продуктов
Он также используется для подкисления пищевых продуктов и напитков, таких как кола, но не без разногласий относительно его воздействия на здоровье. Он обеспечивает пикантный вкус, и, будучи химическим веществом массового производства, доступен дешево и в больших количествах. Низкая стоимость и объемная доступность не похожи на более дорогие натуральные приправы, которые придают сравнимые вкусы, такие как имбирь для остроты или лимонная кислота для кислинки, получаемые из лимонов и лаймов. (Однако большая часть лимонной кислоты в пищевой промышленности извлекается не из цитрусовых, а ферментируется плесенью Aspergillus niger из лома мелассы, отработанных гидролизатов крахмала и фосфорной кислоты.) Он обозначен как E номер E338 .
Применение в медицине
Фосфорная кислота используется в стоматологии и ортодонтии в качестве протравливающего раствора для очистки и придания шероховатости поверхностям зубов, на которые будут помещены стоматологические приспособления или пломбы.
Фосфорная кислота также является ингредиентом безрецептурных лекарств от тошноты, которые также содержат высокий уровень сахара (глюкозы и фруктозы). Его нельзя использовать диабетикам без консультации с врачом. Фосфорная кислота также используется в качестве катализатора при синтезе аспирина, поскольку она обеспечивает большее количество ионов водорода с меньшим загрязнением по сравнению с соляной кислотой и серной кислотой. [2]
Получение галогенидов водорода
Фосфорная кислота реагирует с галогенидами с образованием соответствующего газообразного галогенида водорода
(при нагревании реакционной смеси наблюдаются пары с паром).
Это обычная практика для лабораторного получения галогенидов водорода.
3NaCl (s) + H 3 PO 4 (l) -> NaH 2 PO 4 (s) + HCl (g)
3NaBr (s) + H 3 PO 4 ( l) -> NaH 2 PO 4 (s) + HBr (g)
3NaI (s) + H 3 PO 4 (l) -> NaH 2 PO 4 (s) + HI (g)
Другие области применения
- Ортофосфорная кислота используется в качестве электролита в фосфорно-кислотных топливных элементах.
- Используется как внешний стандарт для ЯМР фосфора-31.
- Используется в строительстве в качестве очистителя для удаления минеральных отложений, цементных пятен и пятен от жесткой воды. Он также используется в качестве ингредиента в некоторых бытовых чистящих средствах, предназначенных для аналогичных задач по уборке.
- Горячая фосфорная кислота используется в микротравлении нитрида кремния (Si 3 N 4 ). Он очень селективен при травлении Si 3 N 4 вместо SiO 2 , диоксида кремния.
- Фосфорная кислота используется любителями (например, моделями железнодорожников) в качестве флюса для пайки.
- Фосфорная кислота также используется в гидропонике для снижения pH питательных растворов. Хотя можно использовать другие типы кислот, фосфор является питательным веществом, используемым растениями, особенно во время цветения, что делает фосфорную кислоту особенно желательной. Жидкий раствор General Hydroponics pH Down содержит фосфорную кислоту в дополнение к лимонной кислоте и бисульфату аммония с буферами для поддержания стабильного pH в резервуаре с питательными веществами.
- Фосфорная кислота используется в качестве регулятора pH в косметике и средствах по уходу за кожей. [3]
Биологическое воздействие на кальций костей
Фосфорная кислота, используемая во многих безалкогольных напитках (в первую очередь кола), в эпидемиологических исследованиях была связана с более низкой плотностью костей. Например, исследование [5] с использованием двухэнергетической рентгеновской абсорбциометрии, а не вопросника о поломке, предоставляет разумные доказательства в поддержку теории о том, что употребление колы приводит к снижению плотности костей.Это исследование было опубликовано в Американском журнале клинического питания. В период с 1996 по 2001 год было обследовано в общей сложности 1672 женщины и 1148 мужчин. Диетическая информация была собрана с использованием опросника по частоте приема пищи, в котором были конкретные вопросы о количестве порций колы и других газированных напитков, а также было проведено различие между обычными напитками с кофеином. бесплатные и диетические напитки. В статье приводятся статистически значимые доказательства того, что женщины, которые ежедневно потребляют колу, имеют более низкую плотность костей.Исследование также предполагает, что для подтверждения результатов необходимы дальнейшие исследования.
С другой стороны, исследование, финансируемое Pepsi, предполагает, что низкое потребление фосфора приводит к снижению плотности костей. В исследовании не исследуется влияние фосфорной кислоты, которая связывается с магнием и кальцием в пищеварительном тракте с образованием солей, которые не всасываются, а скорее изучается общее потребление фосфора. [6]
Однако контролируемое клиническое исследование Хини и Рафферти с использованием методов кальциевого баланса не обнаружило влияния газированных безалкогольных напитков, содержащих фосфорную кислоту, на выведение кальция. [7] В исследовании сравнивалось влияние воды, молока и различных безалкогольных напитков (два с кофеином и два без; два с фосфорной кислотой и два с лимонной кислотой) на баланс кальция у женщин от 20 до 40 лет. которые обычно употребляли ~ 3 или более стаканов (680 мл) газированных безалкогольных напитков в день. Они обнаружили, что по сравнению с водой только молоко и два кофеинсодержащих безалкогольных напитка увеличивали содержание кальция в моче, и что потеря кальция, связанная с потреблением безалкогольных напитков с кофеином, была примерно равна тому, что ранее было обнаружено для одного кофеина.Фосфорная кислота без кофеина не влияла на содержание кальция в моче и не увеличивала потерю кальция с мочой, связанную с кофеином. Поскольку исследования показали, что эффект кофеина компенсируется снижением потерь кальция позже в день [8] , Хини и Рафферти пришли к выводу, что чистый эффект газированных напитков, включая напитки с кофеином и фосфорной кислотой, незначителен и что скелетные эффекты от потребления газированных безалкогольных напитков, вероятно, связаны в первую очередь с вытеснением молока.
Другие химические вещества, такие как кофеин (также значительный компонент популярных напитков с колой), также подозревались как возможные факторы низкой плотности костей из-за известного эффекта кофеина на кальциурию. Другое исследование, в котором участвовали 30 женщин в течение недели, предполагает, что фосфорная кислота в коле не имеет такого эффекта, и постулирует, что кофеин имеет только временный эффект, который позже отменяется. Авторы этого исследования пришли к выводу, что влияние потребления газированных напитков на скелет, вероятно, связано в первую очередь с вытеснением молока. [9] (Другим возможным смешивающим фактором может быть связь между высоким потреблением безалкогольных напитков и малоподвижным образом жизни.)
Полифосфорные кислоты и другие родственные соединения
Ортофосфорная кислота — это простейшее соединение из группы, известной как «фосфорные кислоты». Две или более молекулы ортофосфорной кислоты могут быть соединены так называемой «реакцией конденсации», включающей отщепление молекул воды. Продукты называются полифосфорными кислотами .
Когда две молекулы ортофосфорной кислоты конденсируются в одну молекулу, пирофосфорная кислота (H 4 P 2 O 7 ) получается следующим образом:
- 2 H 3 PO 4 → H 4 P 2 O 7 + H 2 O
Аналогично, три молекулы ортофосфорной кислоты подряд для получения триполифосфорной кислоты (H 5 P 3 O 10 ).Этот процесс конденсации может продолжаться с дополнительными звеньями ортофосфорной кислоты для получения тетраполифосфорной кислоты (H 6 P 4 O 13 , изображено) и так далее. Молекулы полифосфорной кислоты могут иметь десятки таких фосфорных звеньев, связанных в ряд. Химические структуры первых нескольких из этих соединений показаны на иллюстрации выше.
Обратите внимание, что каждая дополнительная фосфорная единица добавляет 1 дополнительный атом H (водорода), 1 дополнительный атом P (фосфора) и 3 дополнительных атома O (кислорода).«Основная» цепь этих типов молекул состоит из чередующихся атомов P и O, ковалентно связанных вместе. Общая формула таких поликислотных соединений: HO (PO 2 OH) x H, где x = количество фосфорных звеньев в молекуле. Четыре атома кислорода, связанные с каждым атомом фосфора, находятся в тетраэдрической конфигурации с фосфором в центре тетраэдра и атомами кислорода в каждом из четырех углов.
Примечания
- ↑ фосфорная кислота. Колумбийская энциклопедия, шестое издание. 2001-05. Bartleby.com . Проверено 18 января 2008 г.
- ↑ Abdullah Rathur
- ↑ Cosmeticcop [1]. Проверено 18 января 2008 г.
- ↑ C. Toles, S. Rimmera и J. C. Hower. Производство активированного угля из лигнита вашингтон с использованием активации фосфорной кислотой. Carbon 34 (11) (1996): 1419-1426 [2]. Проверено 18 января 2008 г..
- ↑ Tucker et al. Am. J Clin. Орех. Октябрь 2006 г.Кола, но не другие газированные напитки, связаны с низкой минеральной плотностью костей у пожилых женщин: The Framingham Osteoporosis Study .. Проверено 18 января 2008 г.
- ↑ S. Elmståhl, B. Gullberg, L. Janzon, et al. Повышенная частота переломов у мужчин среднего и пожилого возраста с низким потреблением фосфора и цинка. Osteoporos Int (1998) 8: 333–340.
- ↑ Роберт П. Хини и Карен Рафферти, Газированные напитки и экскреция кальция с мочой, Американский журнал клинического питания 74 (3) (сентябрь 2001 г.): 343-347
- ↑ М.Дж. Баргер-Люкс, Р. П. Хини, М. Р. Стегман [3], Влияние умеренного потребления кофеина на экономию кальция у женщин в пременопаузе. Американский журнал клинического питания 52: 722–725
- ↑ Роберт П. Хини и Карен Рафферти, Газированные напитки и экскреция кальция с мочой, Американский журнал клинического питания 74 (3): 343-347, (сентябрь 2001 г.)
Ссылки
- Chang, Raymond. 2006. Химия, 9 изд. Нью-Йорк: McGraw-Hill Science / Engineering / Math.ISBN 0073221031
- Коттон, Ф. Альберт и Джеффри Уилкинсон. 1980. Advanced Inorganic Chemistry, 4-е изд. Нью-Йорк: Вили. ISBN 0471027758.
- McMurry, J., and R.C. Фэй. 2004. Химия, 4-е изд. Река Аппер Сэдл, штат Нью-Джерси: Prentice Hall. ISBN 0131402080.
Внешние ссылки
Все ссылки получены 25 марта 2019 г.
Источники
Энциклопедия Нового Света писателей и редакторов переписали и завершили статью Википедия
в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. могут применяться ограничения на использование отдельных изображений, на которые распространяется отдельная лицензия.
Формула фосфорной кислоты — применение, свойства, структура и формула фосфорной кислоты
Формула и структура: Химическая формула фосфорной кислоты: H 3 PO 4 . Его молекулярная формула записывается как H 3 O 4 P, а его молярная масса составляет 97,99 г / моль.
Центральный атом фосфора соединен с атомом кислорода двойной связью и с тремя гидроксильными (-ОН) группами одинарными связями. Таким образом, H 3 PO 4 может выделять до трех ионов H + .
Приготовление: Фосфорная кислота производится в промышленных масштабах мокрым способом, при котором серная кислота реагирует с апатитом (трикальцийфосфатная порода).
Ca 5 (PO 4 ) 3 Cl + 5 H 2 SO 4 + 10 H 2 O → 3 H 3 PO 4 + 5 CaSO 4 · 2 H 2 O + HCl
Полученный раствор фосфорной кислоты содержит только около 32-46% H 3 PO 4 , поэтому он затем концентрируется (выпариванием воды) для получения фосфорной кислоты более высоких концентраций.
Физические свойства: Чистая фосфорная кислота представляет собой белое кристаллическое твердое вещество с температурой плавления 42,35 ° C. В менее концентрированном виде это бесцветная вязкая жидкость без запаха с плотностью 1,885 г / мл. Он нетоксичен и нелетуч. Чаще всего концентрация фосфорной кислоты в воде составляет 85%.
Химические свойства: фосфорная кислота имеет три кислых замещаемых атома водорода. Таким образом, он реагирует иначе, чем другие минеральные кислоты. Он может реагировать с основаниями с образованием трех классов солей путем замены одного, двух или трех атомов H, таких как NaH 2 PO 4 , Na 2 HPO 4 и Na 3 PO 4 соответственно.
При высоких температурах молекулы фосфорной кислоты могут реагировать вместе и объединяться (с потерей молекулы воды) с образованием димеров, тримеров и даже длинных полимерных цепей, таких как полифосфорные кислоты и метафосфорные кислоты.
2 H 3 PO 4 → H 4 P 2 O 7 (- H 2 O)
Использование: Фосфорная кислота имеет множество применений. Благодаря своей нетоксичной и умеренно кислой природе, он используется в пищевых ароматизаторах, напитках, стоматологических продуктах, косметике и средствах по уходу за кожей.В промышленности он используется в основном при производстве фосфорных удобрений. Он также широко используется в качестве электролита, травителя, средства для удаления ржавчины, модификатора pH, бытового чистящего средства, диспергирующего средства и дезинфицирующего средства.
Опасность для здоровья / воздействие на здоровье: Фосфорная кислота не считается токсичной или опасной.
 а. ACS
а. ACS
 5-36,5%
5-36,5% 99%
99% NaPO {3} (стабилизатор)
NaPO {3} (стабилизатор)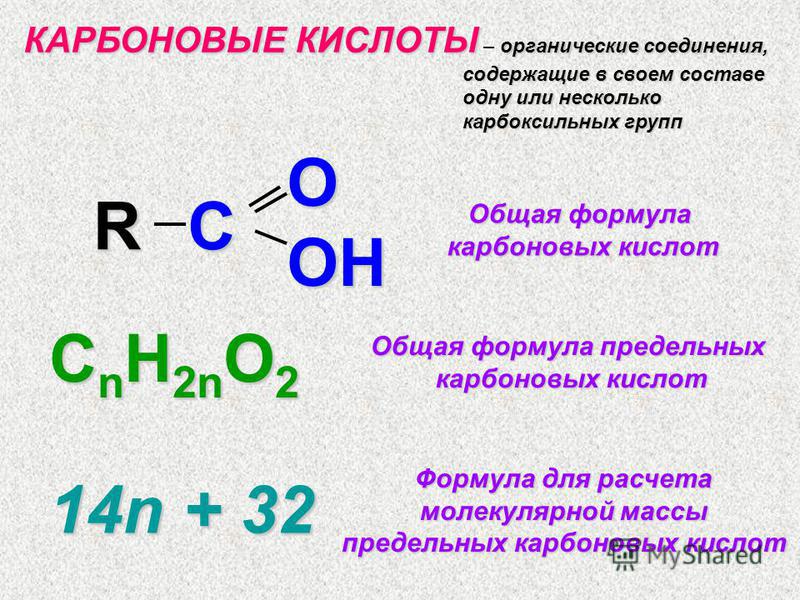 C.S. REAGE и
C.S. REAGE и