Металлы и неметаллы — Химия
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr
4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra
а также вне определённых групп бериллий и магний
38 в группе переходных металлов:
— Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn;
— Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd;
— La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg;
7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi
7 в группе полуметаллов: B, Si, Ge, As, Sb, Te, Po
14 в группе лантаноиды + лантан (La):
Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac):
Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
Таким образом, к металлам, возможно, относится 94 элемента из всех открытых; все остальные являются неметаллами.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).
Кроме того, в физике металлам [как проводникам] противоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника)).
Происхождение слова «металл»:
Слово «металл» заимствовано из немецкого языка. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и серебро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М. В. Ломоносова.
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» — «рудник, металл». Латинское, в свою очередь, заимствовано из греческого языка (μεταλλον — «рудник, копь»).
Нахождение в природе:
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Свойства металлов:
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью.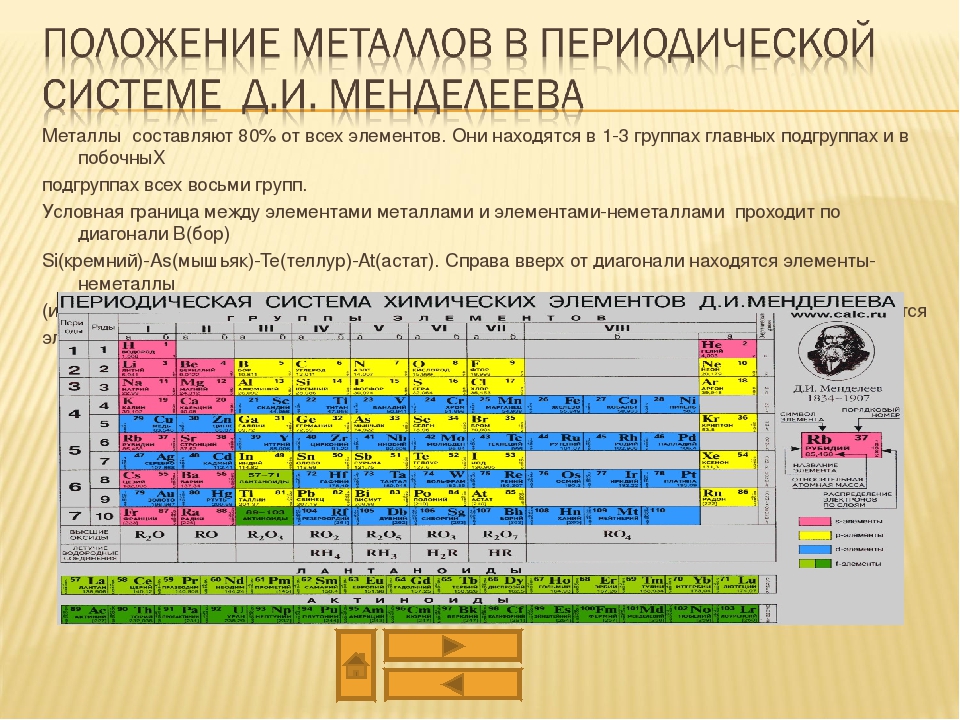 Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
Твёрдость некоторых металлов по шкале Мооса:
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например, олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается.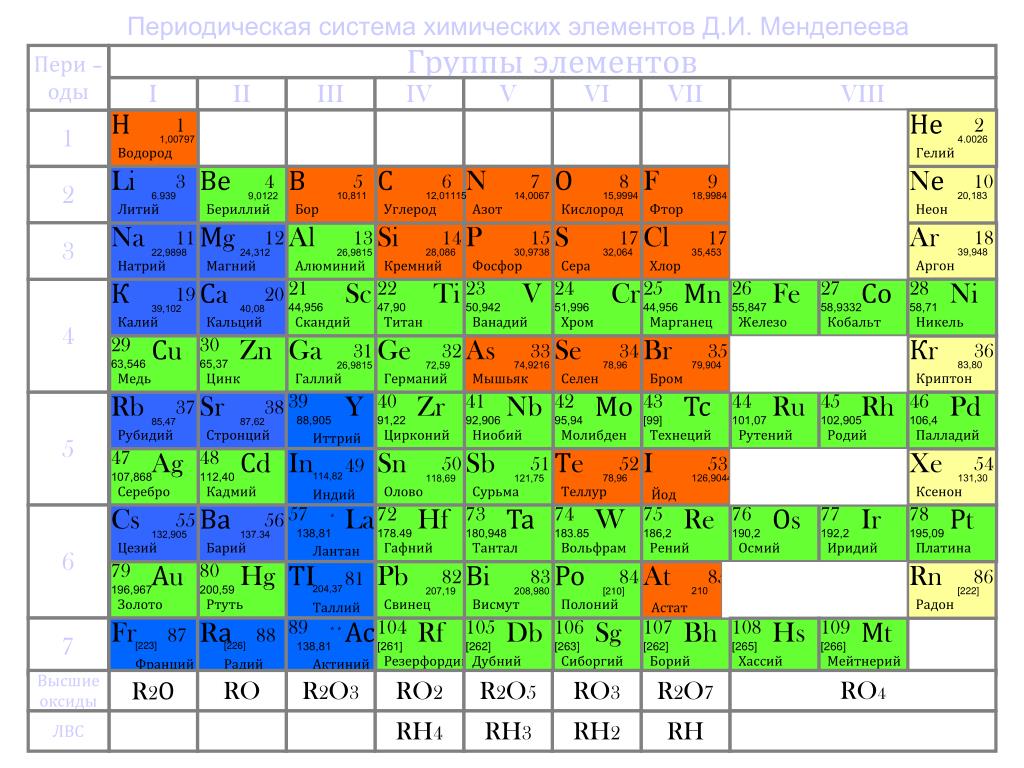 Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
оксид лития пероксид натрия надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Со средними и малоактивными металлами реакция происходит при нагревании:
С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
При нагревании:
С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп, кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
С углеродом реагируют только наиболее активные металлы.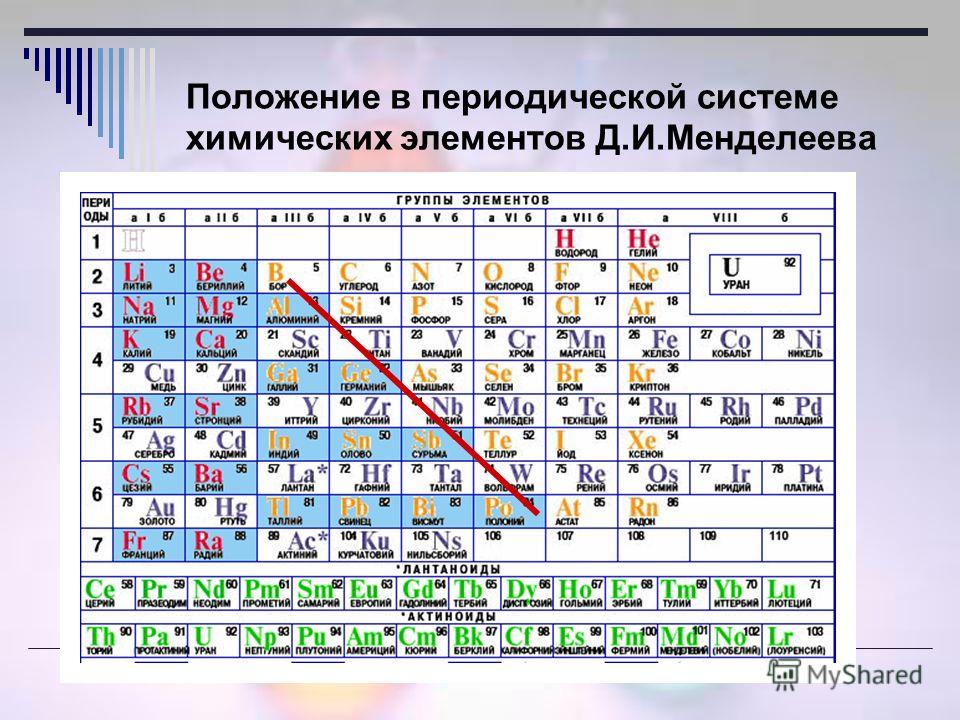 При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
Взаимодействие кислот с металлами:
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
2. Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
Урок 11. обзор металлических элементов а- и в-групп — Химия — 11 класс
Химия, 11 класс
Урок № 11. Обзор металлических элементов А- и B-групп
Перечень вопросов, рассматриваемых в теме: урок посвящён характеристике металлов А- и B-групп периодической системы химических элементов Д. И. Менделеева. Учащиеся получат представление о химических свойствах металлов в связи со строением их атомов
Глоссарий
d-элементы – элементы, в атомах которых заполняется d-подуровень.
p-элементы – элементы, в атомах которых заполняется p-подуровень.
s-элементы – элементы, в атомах которых заполняется s-подуровень.
Интерметаллид (интерметаллическое соединение) – химическое соединение двух или более металлов.
Полупроводники – материалы, по своей удельной проводимости занимающие промежуточное место между проводниками и диэлектриками.
«Провал» электрона – переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций.
Сверхпроводники – материалы, электрическое сопротивление которых при понижении температуры до некоторой величины становится равным нулю.
Щелочноземельные металлы – химические элементы 2А группы периодической таблицы элементов.
Щелочные металлы – элементы 1А группы периодической таблицы химических элементов.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Обзор металлических элементов А- и B-групп
- Химические свойства металлических элементов А-групп
Атомы металлических s- и p-элементов, обладая гораздо большим радиусом по сравнению с атомами неметаллов, способны только отдавать валентные электроны, проявляя восстановительные свойства.
Металлы вступают в реакции как с простыми, так и со сложными веществами.
Взаимодействие металлов с простыми веществами
Реакции металлов с галогенами и кислородом протекают очень энергично.
0 0 t +1 -1
2 Na + Cl2 = 2NaCl
0 0 t +3 -1
2Al + 3Cl2 = 2AlCl3
0 0 t +2 -2
2Mg + O2 = 2MgO
0 0 t +3 -2
4Al + 3O2 = 2Al2O3
Не так энергично идет реакция с серой.
0 0 t +1 -2
2Na + S = Na2S
0 0 t +3 -2
2Al + 3S = Al2S3
Гораздо труднее идет взаимодействие с азотом и фосфором.
0 0 t +2 -3
3Mg + N2 = Mg3N2
0 0 t +2 -3
3Ca + 2P = Ca3P2
При определенных условиях возможно также восстановление металлами водорода с образованием гидридов.
0 0 t +2 -1
Ca + H2 = CaH2
Металлы способны также взаимодействовать с другими металлами, образуя интерметаллические соединения. Многие интерметаллиды используются в технике как сильные магниты, полупроводники, сверхпроводники.
Взаимодействие металлов со сложными веществами
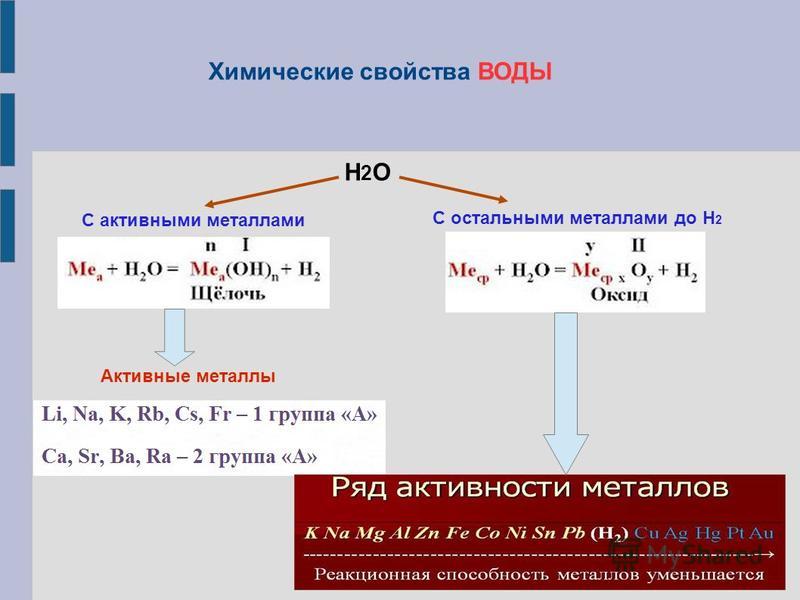
С водой при комнатной температуре взаимодействуют щелочные и щелочноземельные металлы (от Cs до Ca), а при нагревании – менее активные (от Mg до Sn). В обоих случаях выделяется водород, но в первом образуются гидроксиды, а во втором оксиды металлов.
0 +1 +2 0
Ca + 2HOH = Ca(OH)2 + H2↑
0 +1 t +2 0
Mg + 2H2O = MgO + H2↑
Металлы, расположенные в ряду напряжений до водорода, восстанавливают ионы водорода из разбавленных кислот (кроме азотной).
0 +1 +2 0
Mg + H2SO4 = MgSO4 + H2↑
Одни металлы восстанавливают другие из водных растворов солей, если первые расположены левее вторых в ряду стандартных электродных потенциалов.
0 +2 +3 0
2Al + 3Pb(NO3)2 = 2Al(NO3)3 + 3Pb
Не нужно забывать, что такие сильные восстановители как Li, Na, K, Ca будут восстанавливать не металл из соли, а водород из воды.
- Химические свойства металлических элементов B-групп
Металлические элементы B-групп принадлежат к d-элементам. В их атомах заполняются d-орбитали предвнешнего энергетического уровня. Поскольку структура внешнего уровня d-элементов одного периода одинакова (1-2 s-электрона), а радиусы атомов имеют близкие значения, то и свойства атомов d-элементов изменяются в периоде слева направо более медленно по сравнению с s- и p-элементами. У атомов некоторых элементов (например, Cr, Cu) в результате «провала» наружных электронов на внешнем уровне остается по одному электрону, что и определяет их свойства.
В B-группах радиусы атомов в направлении сверху вниз изменяются неравномерно, и восстановительные свойства (за некоторыми исключениями) уменьшаются.
В то же время у металлических элементов B-групп прослеживаются и некоторые общие закономерности, такие как:
- совпадение максимальной положительной степени окисления у p-элементов 3-7 B-групп с номером группы;
- образование некоторыми d-элементами (Ru, Os) соединений, в которых их максимальная степень окисления +8 совпадает с номером группы;
- ослабление основных и усиление кислотных свойств с увеличением степени окисления атомов металлов B-групп.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на расчеты по уравнению реакции
Условие задачи: При взаимодействии 3,12 г одновалентного металла с водой выделилось 0,896 л водорода. Определите этот металл. Ответ дайте в виде химического символа.
Шаг первый: Запишем уравнение реакции металла с водой, зная, что металл одновалентен
2Me + 2H2O = 2MeOH + H2↑
Шаг второй: Найдем количество вещества металла.
По уравнению реакции
n(Me) = 2n(h3)
n(h3) = 0,896/22.4=0.4 моль
n(Me) = 2 х 0.04 = 0,08 моль
Шаг третий: Вычислим молярную массу металла
M(Me) = m/n(Me) = 3,12/0,08 = 39 г/моль
Шаг четвёртый: С помощью таблицы Менделеева найдем металл с соответствующей относительной атомной массой, численно совпадающей с молярной. Этот металл – калий.
Ответ: K
2. Решение задачи на химические свойства металла.
Условие задачи: В лаборатории химика имеется порошок желто-коричневого цвета, который при попадании в воду издает сильный чесночный запах. Какое вещество представляет собой порошок, если он получен в результате реакции между алюминием и селеном, протекающей аналогично реакции алюминия с серой или кислородом? Укажите формулу данного вещества.
Шаг первый: Запишем уравнения реакций алюминия с серой и кислородом
2Al + 3S = Al2S3
4Al + 3O2 = 2Al2O3
Шаг второй: аналогичным образом запишем уравнение реакции алюминия с селеном.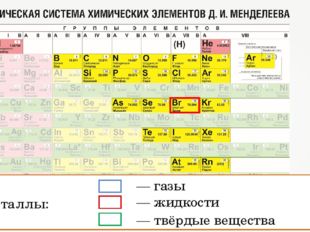
2Al + 3Se = Al2Se3
Это селенид алюминия.
Ответ: Al2Se3
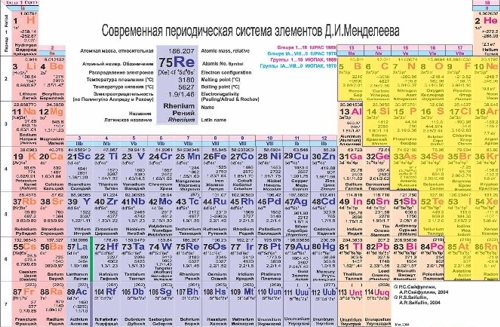
Химические элементы, названные в честь российских ученых и топонимов. Досье — Биографии и справки
ТАСС-ДОСЬЕ. 30 ноября Международный союз теоретической и прикладной химии (The International Union of Pure and Applied Chemistry, IUPAC) объявил об утверждении названий новооткрытых элементов периодической таблицы Менделеева.
113-й элемент получил имя нихониум (символ — Ni, в честь Японии), 115-й — московием (Mc, в честь Московской обл.), 117 — теннесином (Ts, в честь штата Теннеси) и 118-й — оганессоном (Og, в честь российского ученого Юрия Оганесяна).
Редакция ТАСС-ДОСЬЕ подготовила список других химических элементов, названных в честь российских ученых и топонимов.
Рутений
Рутений (Ruthenium, символ — Ru) — химический элемент с атомным номером 44. Представляет собой переходный металл платиновой группы серебристого цвета. Используется в электронике, химии, для создания износостойких электрических контактов, резисторах. Добывается из платиновой руды.
Используется в электронике, химии, для создания износостойких электрических контактов, резисторах. Добывается из платиновой руды.
Был открыт в 1844 г. профессором Казанского университета Карлосом Клаусом, который решил назвать элемент в честь России (Ruthenia — один из вариантов средневекового латинского названия Руси).
Самарий
Самарий (Samarium, Sm) — химический элемент с атомным номером 62. Представляет собой редкоземельный металл из группы лантаноидов. Широко используется для изготовления магнитов, в медицине (для борьбы с раком), для изготовления аварийных регулирующих кассет в ядерных реакторах.
Был открыт в 1878-1880 гг. французским и швейцарским химиками Полем Лекоком де Буабодраном и Жаном Галиссар де Мариньяком. Они обнаружили новый элемент в найденном в Ильменских горах минерале самарските и назвали его самарием (как производное от минерала).
Однако сам минерал, в свою очередь, был назван по имени русского горного инженера, начальника штаба Корпуса горных инженеров Василия Самарского-Быховца, который передал его иностранным химикам для изучения.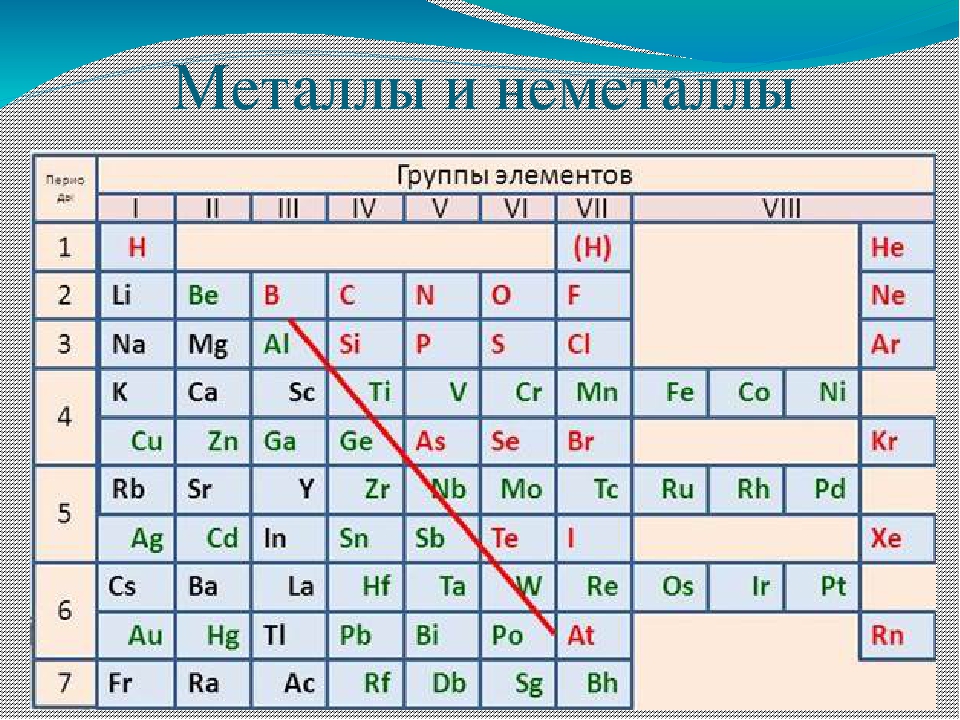
Менделевий
Менделевий (Mendelevium, Md) — синтезированный химический элемент с атомным номером 101. Представляет собой высокорадиоактивный металл.
На эту тему
Наиболее из стабильных изотопов элемента имеет период полураспада 51,5 суток. Может быть получен в лабораторных условиях при бомбардировке атомов эйнштейния ионами гелия. Был открыт в 1955 г. американскими учеными из Национальной лаборатории имени Лоуренса в Беркли (США).
Несмотря на то, что в это время США и СССР находились в состоянии холодной войны, первооткрыватели элемента, среди которых был один из основателей ядерной химии, Гленн Сиборг, предложили назвать его в честь создателя периодической таблицы — русского ученого Дмитрия Менделеева. Правительство США согласилось с этим, в том же году IUPAC присвоил элементу название Менделевий.
Дубний
Дубний (Dubnium, Db) — синтезированный химический элемент с атомным номером 105, радиоактивный металл. Наиболее стабильный из изотопов имеет период полураспада около 1 часа. Получается при бомбардировке ядер амереция ионами неона. Был открыт в 1970 г. в ходе независимых экспериментов физиками Лаборатории ядерных реакций Объединенного института ядерных исследований в Дубне и лаборатории в Беркли.
Получается при бомбардировке ядер амереция ионами неона. Был открыт в 1970 г. в ходе независимых экспериментов физиками Лаборатории ядерных реакций Объединенного института ядерных исследований в Дубне и лаборатории в Беркли.
После более чем 20-летнего спора о первенстве в открытии, IUPAC в 1993 г. принял решение признать оба коллектива первооткрывателями элемента и назвать его в честь Дубны (при этом в Советском Союзе предлагали назвать его нильсборием в честь датского физика — Нильса Бора).
Флеровий
Флеровий (Flerovium, Fl) — синтезированный химический элемент с атомным номером 114. Сильнорадиоактивное вещество с периодом полураспада не более 2,7 секунд. Впервые был получен группой физиков Объединенного института ядерных исследований в Дубне под руководством Юрия Оганесяна с участием ученых из Ливермоской национальной лаборатории США) путем слияния ядер кальция и плутония.
Назван по предложению российских ученых в честь одного из основателей института в Дубне, Георгия Флерова.
Московий и оганессон
8 июня комитет Международного союза теоретической и прикладной химии рекомендовал назвать 115-й элемент таблицы Менделеева московием в честь Московской области, где находится Объединенный институт ядерных исследований (город Дубна).
На эту тему
118-й элемент организация предложила называть оганессоном в честь его первооткрывателя, академика РАН Юрия Оганесяна.
Оба химических элементов являются синтезированными с периодом полураспада, не превышающим несколько долей секунд. Были открыты в Лаборатории ядерных реакций Объединенного института ядерных исследований в Дубне в ходе экспериментов в 2002-2005 гг. Предложенные IUPAC названия прошли публичное обсуждение и были утверждены им же 28 ноября 2016 г.
Также до 1997 г. в СССР и России синтезированный элемент с атомным номером 104 носил название курчатовий, в честь физика Игоря Курчатова, однако IUPAC принял решение назвать его в честь британского физика Эрнеста Резерфорда — резерфордием.
Названия химических элементов
Названия химических элементов
Названия химических элементов
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113* | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115* | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117* | Ts | Tennessine | Тенессин |
| 118* | Og | Oganesson | Оганессон |
Символы и названия элементов даны по материалам 2009
г.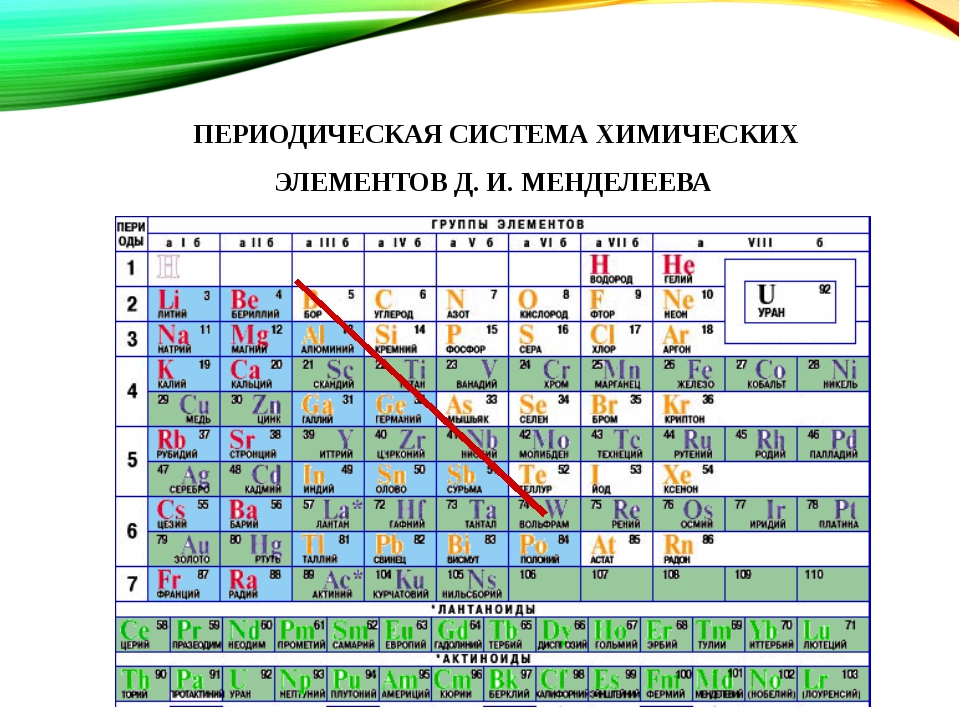 IUPAC (International Union of Pure and Applied
IUPAC (International Union of Pure and Applied
Chemistry) (см.
Pure Appl. Chem., 2011, 83,
359-396).
ATOMIC WEIGHTS OF THE
ELEMENTS 2009
Имена flerovium (Fl) для 114-го элемента и livermorium (Lv) для 116-го элемента
были одобрены (см.
Pure Appl. Chem., 2012, 84,
1669-1672)
* После утверждения открытия этих элементов, первооткрывателям было
предложено дать им имена. Отдел неорганической химии IUPAC рассмотрел эти
предложения и рекомендует их для принятия. До официального утверждения имен
советом IUPAC, проходит пятимесячного публичное обсуждение, которое закончится 8
ноября 2016 года.(см.
http://iupac.org/elements.html)
Неметаллы: простые вещества — свойства неметаллов, история открытия — химия 9 класс
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д. И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Химия. Базовый уровень. 10 класс. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Простота и доступность изложения курса органической химии , большое количество иллюстраций , а также разнообразные вопросы упражнения и задачи способствуют успешному усвоению учебного материала. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
Физические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.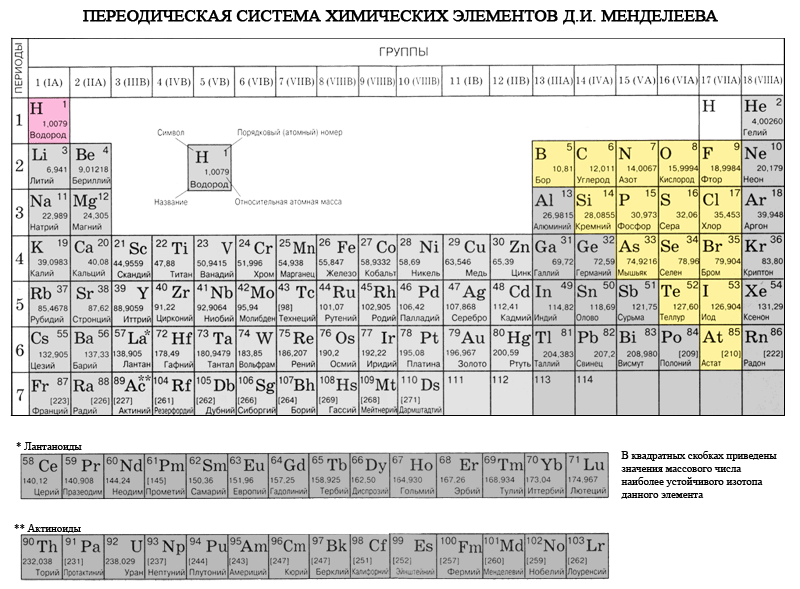
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
- Реакции с металлами.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Са + Сl2 = СаСl2
Са + O2 = СаO2
Na + Сl2 = Na+Сl2
- Реакции с водородом
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
Cl2 + H2 = 2HCl
С + 2Н2 = СН4
- Реакции с кислородом.
Неметаллы образуют кислотные или несолеобразующие оксиды.
S + O2 = SO2
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
Что ещё почитать?
ОГЭ по химии — 2019: расписание, критерии оценивания, типы заданий
Биография Д.И. Менделеева. Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
- они проводят тепло и электрический ток;
- для них характерен металлический блеск;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.

В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
Попытки открытия фтора стоили исследователям не только здоровья, но и жизни. Деви, братья Кнокс, Гей-Люссак — это неполный список жертв науки, что потеряли здоровье в попытках выделить фтор из плавикового шпата. Лишь в 1886 году Муассан решил сложную задачу способом электролиза. И получил первый галоген, а ещё – ядовитый хлор. Во времена Первой мировой войны его использовали как оружие массового поражения.
В настоящее время открыто 22 неметаллических элемента.
#ADVERTISING_INSERT#
история открытия, интересные факты и байки – Москва 24, 24.
 10.2012
10.2012
Фото: ИТАР-ТАСС
Открытие таблицы периодических химических элементов стало одной из важных вех в истории развития химии как науки. Первооткрывателем таблицы стал российский ученый Дмитрий Менделеев. Неординарный ученый с широчайшим научным кругозором сумел объединить все представления о природе химических элементов в единую стройную концепцию.
Об истории открытия таблицы периодических элементов, интересных фактах, связанных с открытием новых элементов, и народных байках, которые окружали Менделеева и созданную им таблицу химических элементов, М24.RU расскажет в этой статье.
История открытия таблицы
К середине XIX века было открыто 63 химических элемента, и ученые всего мира не раз предпринимали попытки объединить все существовавшие элементы в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию предложил химик и музыкант Джон Александр Ньюленд, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.
В 1869 году Менделеев опубликовал свою схему периодической таблицы в журнале Русского химического общества и разослал извещение об открытии ведущим ученым мира. В дальнейшем химик не раз дорабатывал и улучшал схему, пока она не приобрела привычный вид.
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов, свойства начинают повторяться. Так, калий похож на натрий, фтор — на хлор, а золото схоже с серебром и медью.
В 1871 году Менделеев окончательно объединил идеи в периодический закон. Ученые предсказал открытие нескольких новых химических элементов и описал их химические свойства. В дальнейшем расчеты химика полностью подтвердились — галлий, скандий и германий полностью соответствовали тем свойствам, которые им приписал Менделеев.
Байки о Менделееве
Гравюра, на которой изображен Менделеев. Фото: ИТАР-ТАСС
Об известном ученом и его открытиях ходило немало баек. Люди в то время слабо представляли себе химию и считали, что занятия химией — это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Люди в то время слабо представляли себе химию и считали, что занятия химией — это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Одна из легенд гласит, что Менделеев открыл таблицу химических элементов во сне. Случай не единственный, точно также говорил о своем открытии Август Кекуле, которому приснилась формула бензольного кольца. Однако Менделеев только смеялся над критиками. «Я над ней, может быть, двадцать лет думал, а вы говорите: сидел и вдруг … готово!», — как-то сказал ученый о своем открытии.
Другая байка приписывает Менделееву открытие водки. В 1865 году великий ученый защитил диссертацию на тему «Рассуждение о соединении спирта с водою», и это сразу дало повод для новой легенды. Современники химика посмеивались, мол ученый «неплохо творит под действием спирта, соединенного с водой», а следующие поколения уже называли Менделеева первооткрывателем водки.
Посмеивались и над образом жизни ученого, а особенно над тем, что Менделеев оборудовал свою лабораторию в дупле огромного дуба.
Также современники подтрунивали над страстью Менделеева к чемоданам. Ученый в пору своего невольного бездействия в Симферополе вынужден был коротать время за плетением чемоданов. В дальнейшем он самостоятельно мастерил для нужд лаборатории картонные контейнеры. Несмотря на явно «любительский» характер этого увлечения, Менделеева часто называли «чемоданных дел мастером».
Открытие радия
Одна из наиболее трагичных и в то же время известных страниц в истории химии и появления новых элементов в таблице Менделеева связана с открытием радия. Новый химический элемент был открыт супругами Марией и Пьером Кюри, которые обнаружили, что отходы, остающиеся после выделения урана из урановой руды, более радиоактивны, чем чистый уран.
Поскольку о том, что такое радиоактивность, тогда еще никто не знал, то новому элементу молва быстро приписала целебные свойства и способность излечивать чуть ли не от всех известных науке болезней. Радий включили в состав пищевых продуктов, зубной пасты, кремов для лица.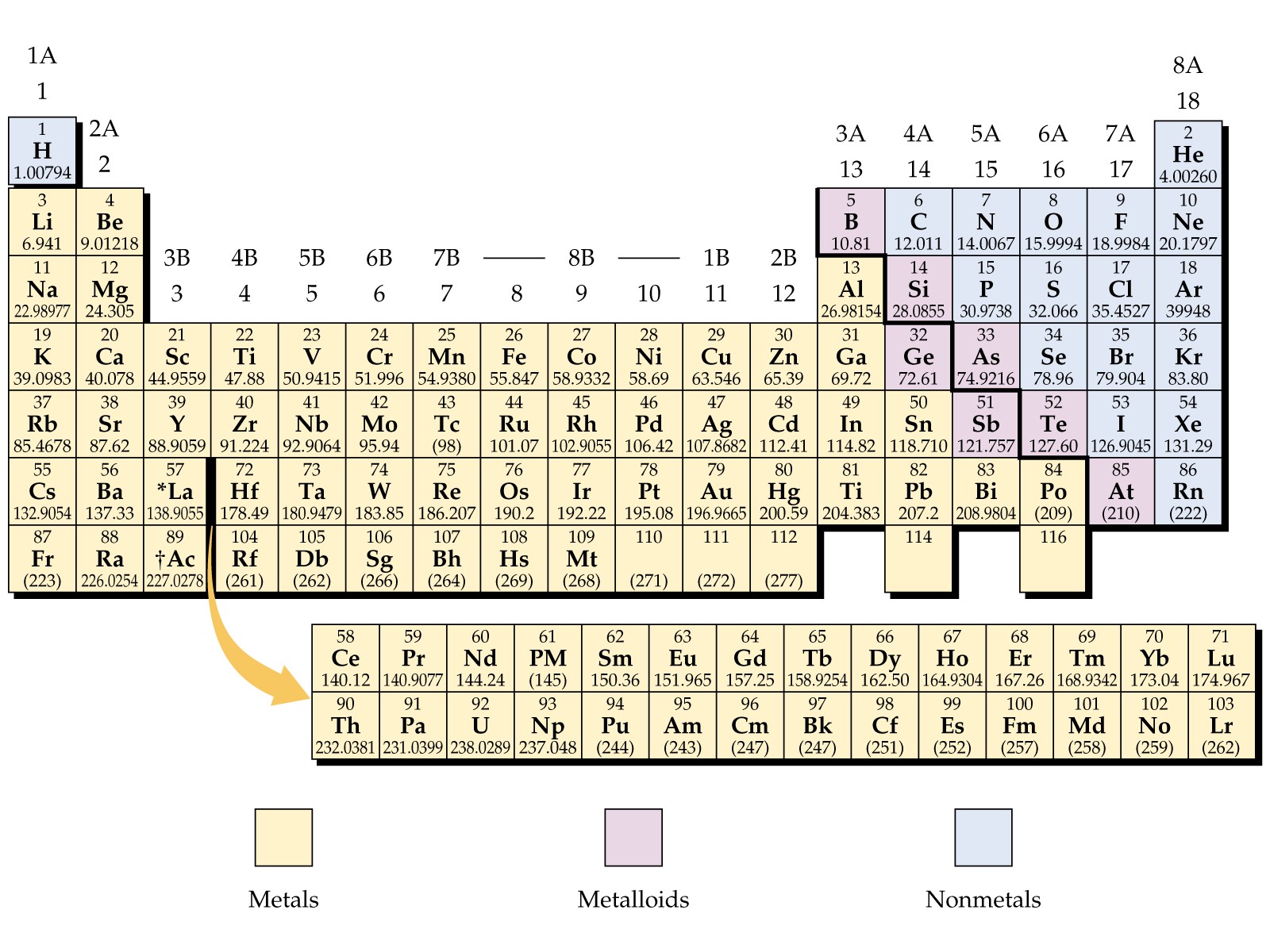 Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Подобное «производство» продолжалось целых двадцать лет — до 30-х годов двадцатого века, когда ученые открыли истинные свойства радиоактивности и выяснили насколько губительно влияние радиации на человеческий организм.
Мария Кюри умерла в 1934 году от лучевой болезни, вызванной долговременным воздействием радия на организм.
Небулий и короний
Фото: ИТАР-ТАСС
Таблица Менделеева не только упорядочила химические элементы в единую стройную систему, но и позволила предсказать многие открытия новых элементов. В то же время некоторые химические «элементы» были признаны несуществующими на основании того, что они не укладывались в концепцию периодического закона. Наиболее известна история с «открытием» новых элементов небулия и корония.
При исследовании солнечной атмосферы астрономы обнаружили спектральные линии, которые им не удалось отождествить ни с одним из известных на земле химических элементов.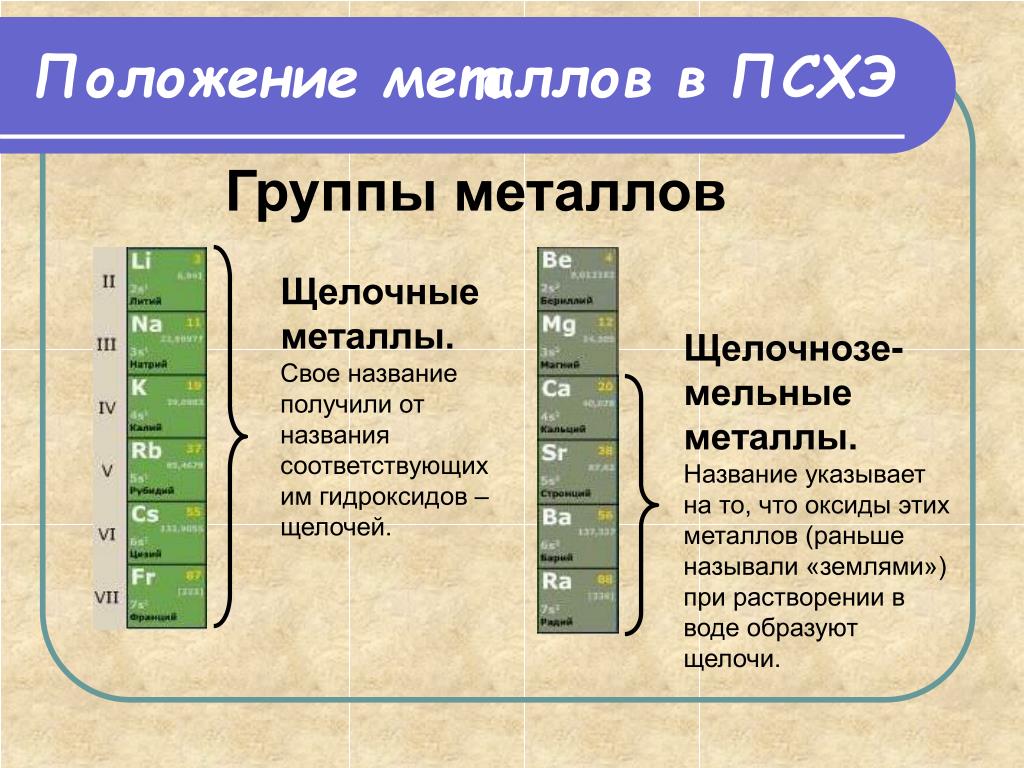 Ученые предположили, что эти линии принадлежат новому элементу, который получил название короний (потому что линии были обнаружены при исследовании «короны» Солнца — внешнего слоя атмосферы звезды).
Ученые предположили, что эти линии принадлежат новому элементу, который получил название короний (потому что линии были обнаружены при исследовании «короны» Солнца — внешнего слоя атмосферы звезды).
Спустя несколько лет астрономы сделали еще одно открытие, изучая спектры газовых туманностей. Обнаруженные линии, которые снова не удалось отождествить ни с чем земным, приписали другому химическому элементу — небулию.
Открытия подверглись критике, поскольку в периодической таблице Менделеева уже не оставалось места для элементов, обладающих свойствами небулия и корония. После проверки обнаружилось, что небулий является обычным земным кислородом, а короний — сильно ионизированное железо.
Отметим, что сегодня в московском Центральном доме ученых РАН торжественно присвоят имена двум химическим элементам, открытым учеными из подмосковной Дубны.
Материал создан на основе информации из открытых источников. Подготовил Василий Макагонов @vmakagonov
Металлы и различные неметаллы в периодической таблице Менделеева: признаки и свойства
Природа имеет некую цикличность и повторяемость в своих проявлениях. На это обращали внимание и древнегреческие ученые, когда пытались разложить природу вещей на составляющие: стихии, геометрические фигуры и даже атомы. На признаки повторяемости также обращают внимание и ученые современности. Например, Карл Линней на основе фенотипичного сходства смог выстроить систему живых существ.
На это обращали внимание и древнегреческие ученые, когда пытались разложить природу вещей на составляющие: стихии, геометрические фигуры и даже атомы. На признаки повторяемости также обращают внимание и ученые современности. Например, Карл Линней на основе фенотипичного сходства смог выстроить систему живых существ.
…
Вконтакте
Google+
Мой мир
Долгое время химия как наука оставалась без системы, которая могла бы упорядочить великое множество открытых веществ. Знания древних алхимиков дали богатейший материал для построения такой системы. Многие учёные предпринимали попытки выстроить гармоничную схему, но все попытки оказались тщетными. Так было вплоть до 1869 года, когда великий русский химик Дмитрий Иванович Менделеев представил миру своё детище — периодическую таблицу химических элементов. Говорят, что таблица приснилась учёному. Во сне он увидел, как таблица выстроилась в виде змеи и обвилась вокруг его ног. Достоверность этого факта сомнительна, но как бы то ни было, это был настоящий прорыв в науке.
Менделеев расположил элементы по мере возрастания их атомной массы. Этот принцип актуален и сейчас, правда, сейчас в основе лежит количество протонов и нейтронов в ядре.
Это интересно: анионы и катионы в химии, таблица растворимости.
Металлы и их отличительные свойства
Все химические элементы можно довольно условно поделить на металлы и неметаллы. Что же их отличает друг от друга? Как отличить металл от неметалла?
Из 118 открытых веществ 94 относят к группе металлов. Группа представлена разнообразными подгруппами:
- Щелочные
- Щелочноземельные
- Переходные металлы
- Легкие
- Полуметаллы
- Лантаноиды
- Актиноиды
- Неопределенные — Бериллий и Магний.
Какие же признаки являются общими для всех металлов?
- Все металлы при комнатной температуре являют твёрдыми веществами. Это справедливо для всех элементов, кроме ртути, которая тверда до минус 39 градусов Цельсия.
 В комнатных условиях ртуть — это жидкость.
В комнатных условиях ртуть — это жидкость. - Большинство из элементов этой группы имеют довольно высокую температуру плавления. Например, Вольфрам плавится при температуре 3410 градусов Цельсия. По этой причине его используют для изготовления нити в лампах накаливания.
- Все металлы пластичны. Это проявляется в том, что кристаллическая решетка металла позволяет атомам смещаться. В результате металлы могут гнуться без физической деформации, поддаются ковке. Особой пластичностью обладают медь, золото и серебро. Именно поэтому исторически они были первыми металлами, которые обрабатывал человек. Далее он научился обрабатывать железо.
- Все металлы очень хорошо проводят электричество, что опять же связано со строением металлической кристаллической решетки, имеющей подвижные электроны. Кроме всего прочего, эти элементы очень легко проводят тепло.
- Ну и, наконец, все металлы имеют характерный, ни с чем не сравнимый металлический блеск. Цвет чаще всего сероватой с голубым отливом.
 Au, Cu или Cs имеют желтый и красный оттенки.
Au, Cu или Cs имеют желтый и красный оттенки.
Не пропустите: механизм образования металлической связи, конкретные примеры.
Неметаллы
Все неметаллы расположены в правом верхнем углу периодической таблицы по диагонали, которую можно провести от водорода до астата и радона. Кстати говоря, водород при определенных условиях также может проявлять металлические свойства.
Основное отличие от металлов заключается в строении кристаллической решетки. Если у металлов кристаллическая решетка металлическая, то у неметаллов она может быть атомной или молекулярной. Молекулярной решеткой обладают некоторые газы — кислород, хлор, сера, азот. Вещества с атомной решеткой имеют твёрдое агрегатное состояние, относительно высокую температуру плавления.
Это интересно: водородная связь — примеры, механизм образования.
Физические свойства неметаллов довольно разнообразны, неметаллы могут быть твердыми (йод, углерод, сера, фосфор), жидкими (только бром), газообразными (фтор, хлор, азот, кислород, водород) веществами с абсолютно разнообразным цветом. Агрегатное состояние может меняться под действием температуры.
Агрегатное состояние может меняться под действием температуры.
С химической точки зрения, неметаллы могут выступать в роли окислителей и восстановителей. Неметаллы могут взаимодействовать между собой и с металлами. Кислород, к примеру, со всеми веществами выступает в роли окислителя, а вот с фтором выступает в роли восстановителя.
Аллотропия
Еще одно удивительное свойство неметаллов заключается в явлении, которое назвали аллотропией — видоизменение веществ, приводящее к различным аллотропным модификациям одного и того же химического элемента. С греческого можно перевести слово «аллотропия» как «другое свойство». Так оно и есть.
Это интересно: типы кристаллических решеток — таблица различных материалов.
Рассмотрим более подробно на примере списка некоторых простых веществ:
- Водород — при различной температуре это вещество может быть в виде орто-водорода и пара-водорода.
- Углерод имеет огромное множество аллотропных модификаций — алмаз, графит, графен, карбин.
 Строение кристаллических решеток этих веществ различается.
Строение кристаллических решеток этих веществ различается. - Фосфор — встречается более 11 модификаций этого вещества. Интересен тот факт, что при модификации цвет вещества также меняется. Наиболее известны белый, черный и красный фосфор. Белый фосфор наиболее реакционный — он может самовоспламеняться, светится в темноте. Необходимо помнить, что белый фосфор очень ядовит для человеческого организма. В связи с этим не рекомендуется держать в доме различные предметы с фосфором. В советские годы очень популярны были статуэтки оленей или птиц, выполненные с применением белого фосфора. Они, конечно, очень красивы, но при этом ядовиты.
- Кислород может существовать в виде формы О2 — это стандартный кислород, которым мы дышим, и О3 — озон. Озон — это не очень устойчивая форма. В стратосфере озон формирует озоновый экран, защищающий атмосферу от проникновения вредного солнечного ультрафиолета. Озон имеет особый запах, который мы ассоциируем с запахом свежести после грозы. По этому запаху можно определить озон.
 Дело в том, что под действием электрический разрядов в атмосфере образуются молекулы озона.
Дело в том, что под действием электрический разрядов в атмосфере образуются молекулы озона.
Это интересно: как определить валентность по таблице Менделеева?
Модификации имеют и другие вещества — сера, селен, бор, мышьяк, бор, кремний, сурьма. При различных температурах многие металлы также обладают этими свойствами.
Конечно, деление всех простых веществ на группы металлов и неметаллов довольно условно. Это деление облегчает понимание свойств химических веществ, создает иллюзию их разделения на обособленные вещества. Как и все в мире, это деление относительное и зависит от внешних факторов окружающей среды — давления, температуры, света и т.д.
Металлы, металлоиды и неметаллы — группы классификации элементов
Элементы периодической таблицы можно разбить на три различные группы: металлы, металлоиды и неметаллы.
В этой периодической таблице показаны три разные группы элементов. Металлоидная группа отделяет металлы от неметаллов. Элементы слева — это металлы, а неметаллы — справа. Исключение составляет элемент водород. Водород обладает свойствами неметалла при нормальных температурах и давлениях и щелочного металла при чрезвычайно высоком давлении.
Некоторые периодические таблицы включают зигзагообразную линию, чтобы различать металлы и металлоиды. Линия начинается ниже бора (B) и проходит между висмутом (Bi) и полонием (Po) или вниз между ливерморием (Lv) и теннессином (Ts). На самом деле металлы вблизи линии часто проявляют неметаллические свойства, а неметаллы имеют какой-то металлический характер.
Свойства металлов
Большинство элементов — металлы. Металлы включают группы щелочных металлов, щелочноземельных металлов, переходных металлов, основных металлов, лантаноидов и актинидов.Металлы обладают следующими свойствами:
- Твердое тело при комнатной температуре (за исключением ртути)
- Обычно блестящее, с металлическим блеском
- Высокая температура плавления
- Хороший проводник тепла
- Хороший проводник электричества
- Податливый — способный для измельчения в листы
- Пластичный — можно натянуть на проволоку
- Высокая плотность (исключения: литий, калий и натрий)
- Коррозия на воздухе или в морской воде
- Терять электроны в реакциях
Свойства металлоидов или полуметаллов
Металлоиды или полуметаллы обладают некоторыми свойствами металлов и некоторыми неметаллами. Металлоиды обычно имеют несколько форм или аллотропов с очень разными свойствами. Характеристики металлоидов включают:
Металлоиды обычно имеют несколько форм или аллотропов с очень разными свойствами. Характеристики металлоидов включают:
- Может быть тусклым или блестящим
- Проводить тепло и электричество, но не так хорошо, как металлы
- Хорошие полупроводники
- Обычно пластичные
- Обычно пластичные
- Могут как приобретать, так и терять электроны в реакциях
Свойства неметаллов
Неметаллы включают группу неметаллов, а также галогены и благородные газы.Свойства неметаллов включают:
- Тусклый, не блестящий
- Плохой проводник тепла
- Плохой проводник электричества
- Не ковкий или пластичный, обычно хрупкий
- Более низкая плотность (по сравнению с металлами)
- Более низкая температура плавления и кипения баллов (по сравнению с металлами)
- Получение электронов в реакциях
Список неметаллов
Выделенные элементы являются неметаллами.
Неметаллические элементы занимают верхний правый угол периодической таблицы.Неметаллы включают неметаллическую группу, галогены и благородные газы. Эти элементы имеют схожие химические свойства друг с другом, что отличает их от элементов, которые считаются металлами.
Группы неметаллов
Группа неметаллических элементов является подмножеством неметаллов. Группа неметаллических элементов состоит из водорода, углерода, азота, кислорода, фосфора, серы и селена. Водород действует как неметалл при нормальных температурах и давлении и обычно считается частью группы неметаллов.
Галогены — неметаллы 7 группы Периодической таблицы Менделеева. Атомы этих элементов имеют степень окисления -1. Элементы в верхней части группы — это газы, но они становятся жидкостями и твердыми телами, движущимися вниз по группе. Галогены — это фтор, хлор, бром, йод и астат. Свойства теннессина малоизвестны. Теннессин может быть галогеном или металлоидом.
Благородные газы — это относительно инертные газы, находящиеся в группе 8 (последний столбец) таблицы периодов. Благородные газы — гелий, неон, аргон, криптон, ксенон, радон и оганессон. Скорее всего, оганессон не является газом при комнатной температуре.
Благородные газы — гелий, неон, аргон, криптон, ксенон, радон и оганессон. Скорее всего, оганессон не является газом при комнатной температуре.
Список неметаллов
Это список неметаллических элементов в порядке возрастания атомного номера.
Свойства неметаллов
Свойства неметаллов включают:
- тусклый, не блестящий
- плохой проводник тепла
- плохой проводник электричества
- высокая энергия ионизации
- высокая электроотрицательность
- не податливый или пластичный, обычно хрупкий
- более низкая плотность (по сравнению с металлами)
- более низкая температура плавления и кипения (по сравнению с металлами)
- приобретение электронов в реакциях (отрицательная степень окисления)
- часто красочный в твердом состоянии
Список применений неметаллов
В отличие от металлов, неметаллы не имеют универсального применения.Но в некоторых приложениях они встречаются вместе:
- Незаменимые для жизни (углерод, водород, азот, кислород, сера, хлор, фосфор)
- Удобрения (водород, азот, фосфор, сера, хлор, селен)
- Хладагенты и криогенная техника (водород, гелий, азот, кислород, фтор, неон)
- Промышленные кислоты (углерод, азот, фтор, фосфор, сера, хлор)
- Лазеры и лампы
- Медицина и фармацевтика
Неметаллы образуют множество соединений. Фактически, большинство соединений, с которыми вы сталкиваетесь, содержат неметаллы. Они встречаются в воде, продуктах питания, тканях, пластмассах и других предметах повседневного обихода.
Фактически, большинство соединений, с которыми вы сталкиваетесь, содержат неметаллы. Они встречаются в воде, продуктах питания, тканях, пластмассах и других предметах повседневного обихода.
Ссылки
- Аддисон У. Э. (1964) Аллотропия элементов . Oldbourne Press: Лондон.
- Bettelheim, F.A .; Brown, W.H .; Кэмпбелл, М.К .; Farrell, S.O .; Торрес, О. (2016). Введение в общую, органическую и биохимию (11-е изд.). Cengage Learning: Бостон. ISBN 978-1-285-86975-9.
- Эмсли, Дж.(1971). Неорганическая химия неметаллов . Methuen Educational: Лондон. ISBN 0423861204.
- Steudel, R. (1977). Химия неметаллов: введение в атомную структуру и химические связи . Английское издание F.C. Наход и Дж. Дж. Цукерман. Берлин: Вальтер де Грюйтер. ISBN 3110048825.
Список металлов — Периодическая таблица
Список металлов — сплавов
Список металлов — открытие и история металлов Алфавитный список металлов Алфавитный список металлов ABC Список металлов * Элемент 113: Унунтриум, Элемент 114: Унунквадиум, Элемент 115: Унунпентиум и Элемент 116: Унунгексий, вероятно, будет основным металлом. Примеры элементов |
Список всех элементов, которые считаются металлами
Большинство элементов — металлы. В эту группу входят щелочные металлы, щелочноземельные металлы, переходные металлы, основные металлы, лантаноиды (редкоземельные элементы) и актиниды. Хотя лантаноиды и актиниды разделены в периодической таблице, на самом деле это особые типы переходных металлов.
Вот список всех элементов периодической таблицы, являющихся металлами.
Щелочные металлы
Щелочные металлы находятся в группе IA в крайней левой части таблицы Менделеева.Это элементы с высокой реакционной способностью, отличающиеся степенью окисления +1 и, как правило, низкой плотностью по сравнению с другими металлами. Поскольку они обладают такой реакционной способностью, эти элементы находятся в соединениях. В природе свободен только водород в виде чистого элемента, то есть в виде двухатомного водородного газа.
В природе свободен только водород в виде чистого элемента, то есть в виде двухатомного водородного газа.
- Водород в металлическом состоянии (обычно считается неметаллом)
- Литий
- Натрий
- Калий
- Рубидий
- Цезий
- Франций
Щелочноземельные металлы
Щелочноземельные металлы находятся в группе IIA периодической таблицы, которая является вторым столбцом элементов.Все атомы щелочноземельных металлов имеют степень окисления +2. Как и щелочные металлы, эти элементы находятся в соединениях, а не в чистом виде. Щелочноземельные металлы обладают меньшей реакционной способностью, чем щелочные металлы. Металлы группы IIA твердые и блестящие, обычно ковкие и пластичные.
- Бериллий
- Магний
- Кальций
- Стронций
- Барий
- Радий
Основные металлы
Основные металлы обладают характеристиками, которые люди обычно ассоциируют с термином «металл». «Они проводят тепло и электричество, имеют металлический блеск и имеют тенденцию быть плотными, пластичными и пластичными. Однако некоторые из этих элементов обладают неметаллическими характеристиками. Например, один аллотроп олова ведет себя больше как неметалл. твердые, свинец и галлий являются примерами мягких элементов. Эти элементы, как правило, имеют более низкие температуры плавления и кипения, чем переходные металлы (за некоторыми исключениями).
«Они проводят тепло и электричество, имеют металлический блеск и имеют тенденцию быть плотными, пластичными и пластичными. Однако некоторые из этих элементов обладают неметаллическими характеристиками. Например, один аллотроп олова ведет себя больше как неметалл. твердые, свинец и галлий являются примерами мягких элементов. Эти элементы, как правило, имеют более низкие температуры плавления и кипения, чем переходные металлы (за некоторыми исключениями).
- Алюминий
- Галлий
- Индий
- Олово
- Таллий
- Свинец
- Висмут
- Нихоний: вероятно, основной металл
- Флеровий: вероятно, основной металл
- Московий: вероятно, основной металл
- Ливерморий: вероятно, основной металл
- Теннессин: относится к группе галогенов, но может вести себя больше как металлоид или металл
Переходные металлы
Переходные металлы характеризуются наличием частично заполненных электронных подоболочек d или f.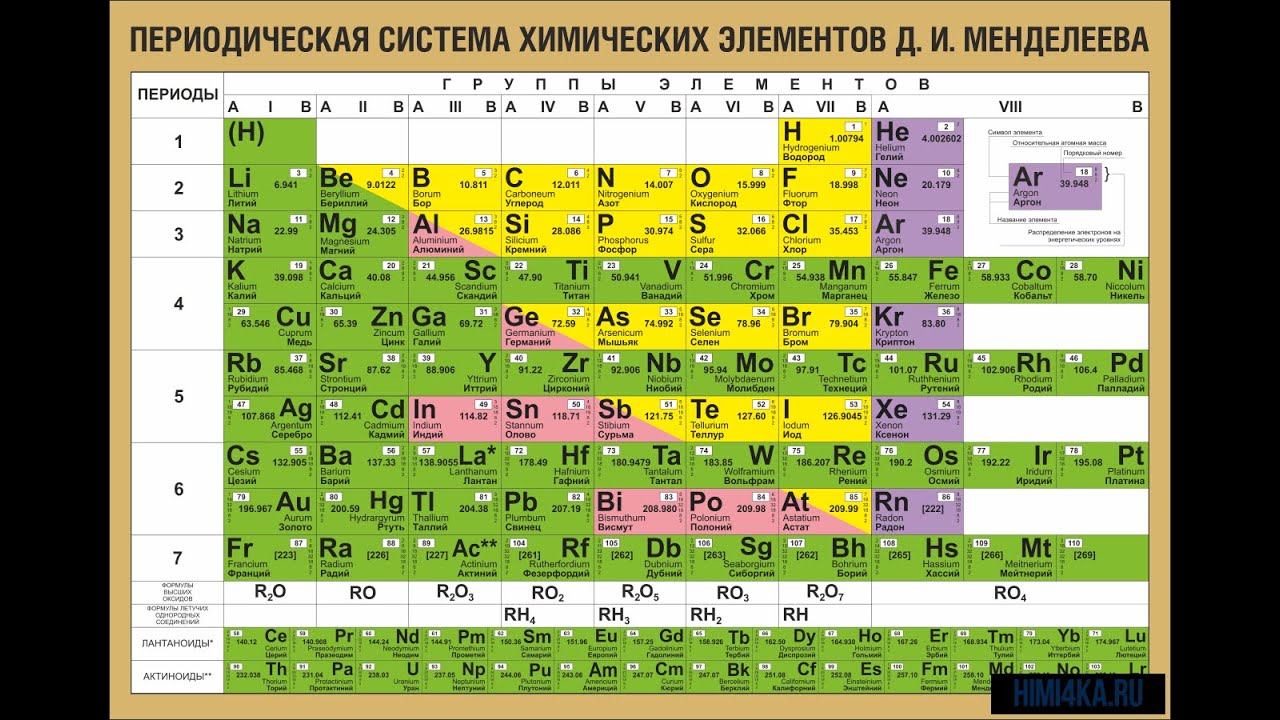 Поскольку оболочка заполнена не полностью, эти элементы проявляют несколько степеней окисления и часто образуют окрашенные комплексы. Некоторые переходные металлы встречаются в чистом или самородном виде, включая золото, медь и серебро. Лантаноиды и актиниды встречаются только в природных соединениях.
Поскольку оболочка заполнена не полностью, эти элементы проявляют несколько степеней окисления и часто образуют окрашенные комплексы. Некоторые переходные металлы встречаются в чистом или самородном виде, включая золото, медь и серебро. Лантаноиды и актиниды встречаются только в природных соединениях.
- Скандий
- Титан
- Ванадий
- Хром
- Марганец
- Утюг
- Кобальт
- Никель
- Медь
- Цинк
- Иттрий
- Цирконий
- Ниобий
- Молибден
- Технеций
- Рутений
- Родий
- Палладий
- Серебро
- Кадмий
- Лантан
- Гафний
- Тантал
- Вольфрам
- Рений
- Осмий
- Иридий
- Платина
- Золото
- Меркурий
- Актиний
- Резерфордий
- Дубний
- Сиборгий
- Бориум
- Калий
- Мейтнерий
- Дармштадтиум
- Рентгений
- Коперниций
- Церий
- Празеодим
- Неодим
- Прометий
- Самарий
- Европий
- Гадолиний
- Тербий
- Диспрозий
- Гольмий
- Эрбий
- Тулий
- Иттербий
- Лютеций
- Торий
- Протактиний
- Уран
- Нептуний
- Плутоний
- Америций
- Кюрий
- Берклий
- Калифорний
- Эйнштейний
- Фермий
- Менделевий
- Нобелий
- Лоуренсий
Подробнее о металлах
В общем, металлы расположены в левой части таблицы Менделеева, и их металлический характер уменьшается при движении вверх и вправо.
В зависимости от условий элементы, принадлежащие к группе металлоидов, могут вести себя как металлы. Кроме того, металлами могут быть даже неметаллы. Например, в определенных ситуациях вы можете найти металлический кислород или металлический углерод.
Список металлов и неметаллов
Список металлов , составляющий периодическую таблицу, включает железо, свинец, золото, алюминий, платину, уран, цинк, литий, натрий, олово, серебро и т. Д.
Неметаллы lis t, из которого состоит таблица Менделеева, включает водород, гелий, углерод, серу, азот, кислород, радон, неон, другие галогены, благородные газы и т. д.
Когда мы изучаем элементы, важно знать, какие элементы являются металлами, а какие — нет. Если вы пытаетесь научиться различать металлы и неметаллы, список и их использование — хороший способ разбить их и помочь запомнить разницу между ними. Хорошая новость в том, что большинство элементов — это металлы. Полезный способ подойти к изучению элементов — различать, металлические они или неметаллические. У металлов есть некоторые общие свойства. Итак, знание того, что это за свойства, — хороший способ начать наше исследование.
У металлов есть некоторые общие свойства. Итак, знание того, что это за свойства, — хороший способ начать наше исследование.
Что такое металл?
Как указано во введении, большинство элементов являются металлами или, по крайней мере, могут считаться таковыми. Знание того, какие из них есть, а какие нет, поможет нам правильно их сгруппировать. Прежде чем перейти к полному списку металлов, важно определить, что такое металл. Есть пять различных видов металлов:
Все металлические элементы помещены вместе в периодической таблице.
Нам нужно меньше запоминания — я никогда не запоминал периодическую таблицу элементов — я никогда не использовал ее, и я физик! Я могу это посмотреть.- Мичио Каку
Есть несколько свойств, которые делают большинство элементов металлами. Чтобы элемент считался металлом, он должен обладать несколькими из этих свойств. Важно ознакомиться с этими различными свойствами.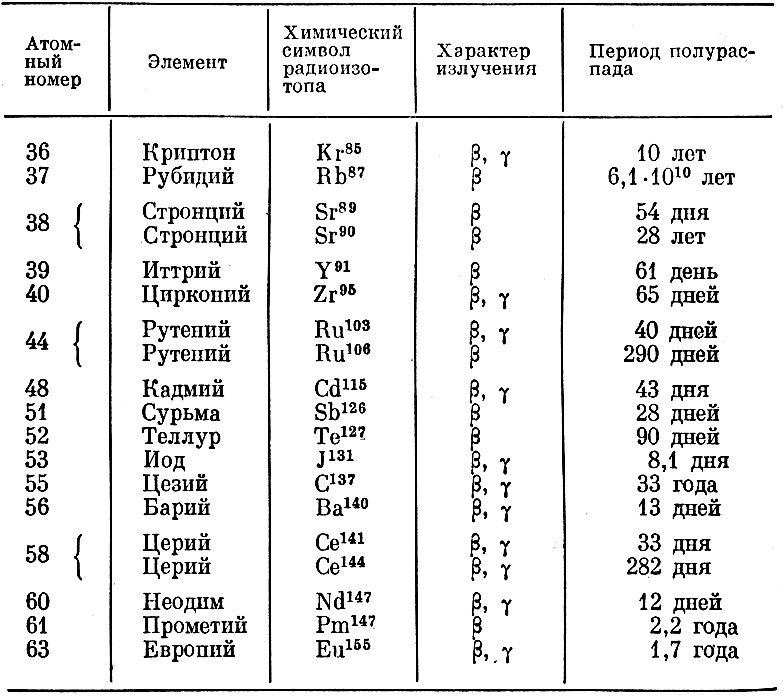 Не все свойства присущи всем металлам, но все элементы, которые обладают некоторыми из этих свойств, могут считаться металлами.
Не все свойства присущи всем металлам, но все элементы, которые обладают некоторыми из этих свойств, могут считаться металлами.
«Периодическая таблица блоков spdf (32 столбца)» от DePiep через Wikimedia Commons под лицензией CC-BY-SA 3.0
Каковы общие свойства металлов?
Большинство металлов имеют твердое состояние, когда они находятся при комнатной температуре. Фактически, единственным исключением из этого свойства является ртуть. Ртуть — единственный металл, который всегда находится в жидком состоянии независимо от температуры. Таким образом, он остается жидким даже при комнатной температуре. Как правило, температура плавления металлов высокая.
- Еще один способ распознать металл — это его сияние.
- Металлы также хорошо проводят тепло и электричество.Но имеют низкую энергию ионизации и низкую электроотрицательность. Еще одно важное свойство, которым обладают многие металлические элементы, — это их пластичность. Это означает, что металлы относительно легко разбить на листы.

- Кроме того, из большинства металлов можно производить проволоку. Это то, что мы называем пластичностью.
- За исключением калия, лития и натрия, большинство металлов имеют высокую плотность.
- Одним из общих и, пожалуй, наиболее заметных свойств, присущих большинству металлических элементов, является то, что они подвержены коррозии при воздействии морской воды или воздуха.
- Наконец, большинство металлических элементов теряют электроны во время реакций.
Есть один неметаллический элемент, который иногда может действовать как металл. Это водород, который при воздействии чрезвычайно высоких или чрезвычайно низких температур может проявлять некоторые из этих общих свойств.
Полный список металлов
Теперь, когда мы установили свойства, которые превращают большинство элементов периодической таблицы в металлы, мы можем теперь представить полный список металлических элементов:
 В комнатных условиях ртуть — это жидкость.
В комнатных условиях ртуть — это жидкость. Au, Cu или Cs имеют желтый и красный оттенки.
Au, Cu или Cs имеют желтый и красный оттенки. Строение кристаллических решеток этих веществ различается.
Строение кристаллических решеток этих веществ различается. Дело в том, что под действием электрический разрядов в атмосфере образуются молекулы озона.
Дело в том, что под действием электрический разрядов в атмосфере образуются молекулы озона. Примеры металлов: золото, алюминий, медь, железо, свинец, серебро, платина, уран и цинк. В Периодической таблице металлы разделены на группы, представленные в следующем списке:
Примеры металлов: золото, алюминий, медь, железо, свинец, серебро, платина, уран и цинк. В Периодической таблице металлы разделены на группы, представленные в следующем списке: Некоторые металлы были доступны и использовались некоторыми из старейших цивилизаций, включая древних египтян, древних греков и древних римлян. Вплоть до средневековья считалось, что металлов всего семь. Эти особые металлы называют «металлами древности». Древние «Металлы древности» вместе с приблизительными датами открытия: золото (6000 г. до н.э.), медь (9000 г. до н.э.), серебро (4000 г. до н.э.), свинец (6400 г. до н.э.), олово (3000 г. до н.э.), железо (1500 г. до н.э.) и ртуть (1500 г. до н.э.). Термин «металл» происходит от греческого слова «Metallon», означающего «раскапывать», например, в шахтах и ямах.Материалы, добытые на различных рудниках, Платон назвал металлеями.
Некоторые металлы были доступны и использовались некоторыми из старейших цивилизаций, включая древних египтян, древних греков и древних римлян. Вплоть до средневековья считалось, что металлов всего семь. Эти особые металлы называют «металлами древности». Древние «Металлы древности» вместе с приблизительными датами открытия: золото (6000 г. до н.э.), медь (9000 г. до н.э.), серебро (4000 г. до н.э.), свинец (6400 г. до н.э.), олово (3000 г. до н.э.), железо (1500 г. до н.э.) и ртуть (1500 г. до н.э.). Термин «металл» происходит от греческого слова «Metallon», означающего «раскапывать», например, в шахтах и ямах.Материалы, добытые на различных рудниках, Платон назвал металлеями.

 Например, они не податливы, у них относительно низкая плотность, они тусклые, плохо проводят тепло и электричество и т. Д.
Например, они не податливы, у них относительно низкая плотность, они тусклые, плохо проводят тепло и электричество и т. Д. Дайте нам знать в комментариях ниже, какой именно вы искали.
Дайте нам знать в комментариях ниже, какой именно вы искали. Это мягкие металлы, которые обладают высокой реакционной способностью и имеют один электрон на внешней оболочке.
Это мягкие металлы, которые обладают высокой реакционной способностью и имеют один электрон на внешней оболочке. Однако на самом деле они вписываются в середину Периодической таблицы. Есть два типа редкоземельных металлов: лантаноидов и актинидов .
Однако на самом деле они вписываются в середину Периодической таблицы. Есть два типа редкоземельных металлов: лантаноидов и актинидов . Обычно они мягче других металлов и имеют более низкие температуры плавления.
Обычно они мягче других металлов и имеют более низкие температуры плавления.
 Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и проводки.
Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и проводки. В эту группу входят кальций, магний и барий.
В эту группу входят кальций, магний и барий. (Добавьте хром, и вы получите нержавеющую сталь.Проверьте свои кухонные кастрюли и сковороды, чтобы узнать, сколько из них сделано из нержавеющей стали!)
(Добавьте хром, и вы получите нержавеющую сталь.Проверьте свои кухонные кастрюли и сковороды, чтобы узнать, сколько из них сделано из нержавеющей стали!) Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, которое популярно в ювелирных изделиях, представляет собой сплав золота и платины или палладия.
Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, которое популярно в ювелирных изделиях, представляет собой сплав золота и платины или палладия.