Свинец
|
Свинец | |
|---|---|
|
Атомный номер |
82 |
|
Внешний вид простого вещества | |
|
Свойства атома | |
|
Атомная масса (молярная масса) |
207,2 а. е. м. (г/моль) |
|
Радиус атома |
175 пм |
|
Энергия ионизации (первый электрон) |
715,2 (7,41) кДж/моль (эВ) |
|
Электронная конфигурация |
[Xe] 4f14 5d10 6s2 6p2 |
|
Химические свойства | |
|
Ковалентный радиус |
147 пм |
|
Радиус иона |
(+4e) 84 (+2e) 120 пм |
|
Электроотрицательность (по Полингу) |
1,8 |
|
Электродный потенциал |
Pb←Pb2+ -0,126 В Pb←Pb4+ 0,80 В |
|
Степени окисления |
4, 2 |
|
Термодинамические свойства простого вещества | |
|
Плотность |
11,3415 г/см³ |
|
Молярная теплоёмкость |
26,65[1]Дж/(K·моль) |
|
Теплопроводность |
35,3 Вт/(м·K) |
|
Температура плавления |
600,65 K |
|
Теплота плавления |
4,77 кДж/моль |
|
Температура кипения |
2 013 K |
|
Теплота испарения |
177,8 кДж/моль |
|
Молярный объём |
18,3 см³/моль |
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
кубическая гранецентрированая |
|
Параметры решётки |
4,950 Å |
|
Отношение c/a |
n/a |
|
Температура Дебая |
88,00 K |
|
Pb |
82 |
|
207,2 | |
|
[Xe]4f145d106s26p2 | |
|
Свинец | |
Свинец — элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы: švinas (литовский), svins (латышский).
Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Нахождение свинца в природе
Содержание в земной коре 1,6·10-3% по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В основном встречается в виде сульфидов.
Получение свинца
Страны — крупнейшие производители свинца (включая вторичный свинец) на 2004 год (по данным ILZSG), в тыс. тонн:
|
ЕС |
2200 |
|
США |
1498 |
|
Китай |
1256 |
|
Корея |
219 |
Физические свойства свинца
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К) при температуре 0°C. Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Плотность — 11,3415 г/см³ (при 20 °C)
Температура плавления — 327,4 °C
Температура кипения — 1740 °C
Химические свойства свинца
Электронная формула: KLMN5s25p65d106s26p2, в соответствии с чем он имеет степени окисления +2 и +4. Свинец не очень активен химически. На металлическом разрезе свинца виден металлический блеск, постепенно исчезающий из-за образования тонкой плёнки РbО.
С кислородом образует ряд соединений Рb2О, РbО, РbО2, Рb2О3, Рb3О4. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре получают оксида свинца и водород при взаимодействии свинца и горячего водяного пара.
Оксидам РbО и РbО2 соответствуют амфотерные гидрооксиды Рb(ОН)2 и Рb(ОН)4.
При реакции Mg2Pb и разбавленной HCl получается небольшое количество РbН4. Pbh5 — газозообразное вещество без запаха, которое очень легко разлагается на свинец и и водород. При большой температуре галогены образовывают со свинцом соединения вида РbХ2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа РbХ4. Свинец с азотом прямо не реагирует. Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Рb (II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb (II). В ряду напряжений Pb стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и h3SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки трудно-растворимых хлорида РbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа h3SO4 и НCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[РbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Рb(II). По растворимости в воде соли свинца делятся на нерастворимые (напрммер, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (вроде, хлорид и фторид) и растворимые (к примеру,ацетат, нитрат и хлорат свинца). Соли Pb (IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Рb (II). Соли Pb (IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (РbО3)2- и (РbО4)4-, хлороплюмбатов (РbCl6)2-, гидроксоплюмбатов [Рb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4]. Еион (Ме=>Ме++e)=7,42 эВ.
Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Рb(II). По растворимости в воде соли свинца делятся на нерастворимые (напрммер, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (вроде, хлорид и фторид) и растворимые (к примеру,ацетат, нитрат и хлорат свинца). Соли Pb (IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Рb (II). Соли Pb (IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (РbО3)2- и (РbО4)4-, хлороплюмбатов (РbCl6)2-, гидроксоплюмбатов [Рb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4]. Еион (Ме=>Ме++e)=7,42 эВ.
Основные соединения свинца
Оксиды свинца
Оксиды свинца имеют преимущественно основный или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
Галогениды свинца
Халькогениды свинца
Халькогениды свинца — сульфид свинца, селенид свинца и теллурид свинца — представляют собой кристаллы чёрного цвета, которые являются узкозонными полупроводниками.
Соли свинца
Сульфат свинца
Нитрат свинца
Ацетат свинца — свинцовый сахар, относится к очень ядовитым веществам. Ацетат свинца, или свинцовый сахар, Pb(CH3COO)2·3H2O существует в виде бесцветных кристаллов или белого порошка, медленно выветривающегося с потерей гидратной воды. Соединение хорошо растворимо в воде. Оно обладает вяжущим действием, но так как содержит ионы ядовитого свинца, то применяется как наружное в ветеринарии. Ацетат применяют также в аналитической химии, крашении, ситценабивном деле, как наполнитель шёлка и для получения других соединений свинца. Основной ацетат свинца Pb(CH3COO)2·Pb(OH)2 — менее растворимый в воде белый порошок — используется для обесцвечивания органических растворов и очистки растворов сахара перед анализом.
Основной ацетат свинца Pb(CH3COO)2·Pb(OH)2 — менее растворимый в воде белый порошок — используется для обесцвечивания органических растворов и очистки растворов сахара перед анализом.
Применение свинца
Свинец в народном хозяйстве
Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ. Азид свинца применяется как наиболее широкоупотребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжелой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а так же совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока. Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода h3S. Свинцовые белила применяют также для производства шпатлевки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика). Борат свинца Pb(BO2)2·h3O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора. Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония Nh5Cl. Его применяют для приготовления мазей при обработке опухолей.
Борат свинца Pb(BO2)2·h3O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора. Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония Nh5Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый желтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве желтых пигментов. Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке. Сульфат свинца Pb(SO4)2, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей.
Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца.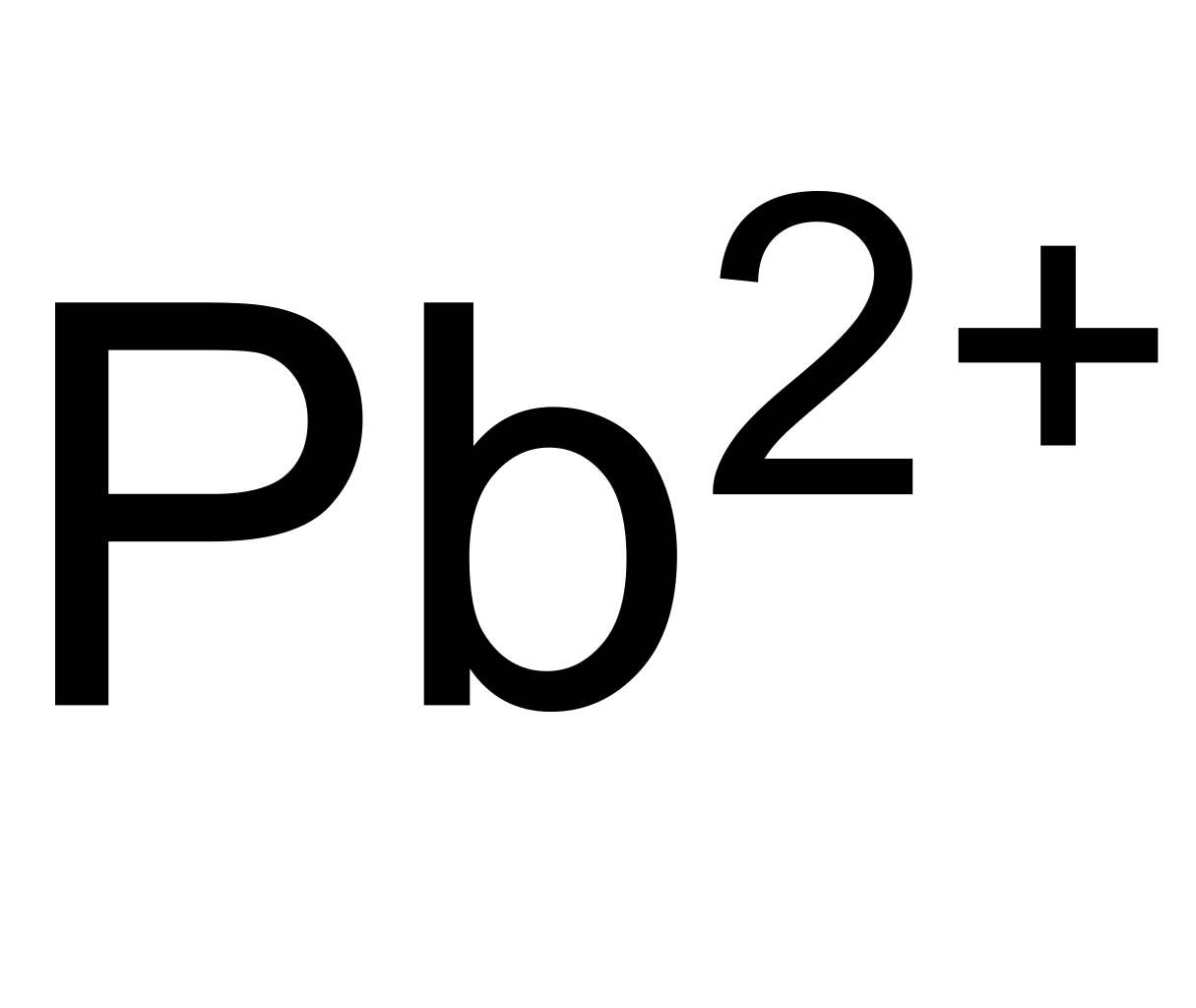
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85-90 % Sn и 15-10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары к-рой в малых концентрациях имеют сладковатый фруктовый запах, в больших-неприятный запах; Тпл = 130 °C, Ткип = 80°С/13 мм рт. ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Свинец в медицине
Экономические показатели
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл/кг.
Страны, крупнейшие потребители свинца в 2004 году, в тыс. тонн (по данным ILZSG):
|
Китай |
1770 |
|
ЕС |
1553 |
|
США |
1273 |
|
Корея |
286 |
Физиологическое действие
Свинец и его соединения токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение. ПДК в атмосферном воздухе соединений свинца 0,003 мг/м³, в воде 0,03 мг/л, почве 20,0 мг/кг. Выброс свинца в Мировой океан 430—650 тысяч т/год.
Выброс свинца в Мировой океан 430—650 тысяч т/год.
СВИНЕЦ | Энциклопедия Кругосвет
Содержание статьи
СВИНЕЦ – химический элемент IV группы периодической таблицы. Относительная атомная масса (Ar = 207,2) является усредненной из масс нескольких изотопов: 204Pb (1,4%), 206Pb (24,1%), 207Pb (22,1%) и 208Pb (52,4%). Последние три нуклида – конечные продукты естественных радиоактивных превращений урана, актиния и тория. Известно также более 20 радиоактивных изотопов свинца, из которых наиболее долгоживущие – 202Pb и 205Pb (с периодами полураспада 300 тысяч и 15 млн. лет). В природе образуются также и короткоживущие изотопы свинца с массовыми числами 209, 210, 212 и 214 с периодами полураспада соответственно 3,25 ч, 27,1 года, 10,64 ч и 26,8 мин. Соотношение различных изотопов в разных образцах свинцовых руд может несколько различаться, что не дает возможности определить для свинца значение Ar с большей точностью.
В земной коре свинца немного – 0,0016% по массе, но этот один из самых тяжелых металлов распространен гораздо больше, чем его ближайшие соседи – золото, ртуть и висмут. Это связано с тем, что разные изотопы свинца являются конечными продуктами распада урана и тория, так что содержание свинца в земной коре медленно увеличивалось в течение миллиардов лет.
Известно много рудных месторождений, богатых свинцом, причем металл легко выделяется из минералов. Всего известно более ста свинцовых минералов. Из них основные – галенит (свинцовый блеск) PbS и продукты его химических превращений – англезит (свинцовый купорос) PbSO4 и церуссит («белая свинцовая руда») PbCO3. Реже встречаются пироморфит («зеленая свинцовая руда») PbCl2·3Pb3(PO4)2, миметит PbCl2·3Pb3(AsO4)2, крокоит («красная свинцовая руда») PbCrO4, вульфенит («желтая свинцовая руда») PbMoO4, штольцит PbWO4. В свинцовых рудах часто находятся также другие металлы – медь, цинк, кадмий, серебро, золото, висмут и др. В месте залегания свинцовых руд этим элементом обогащена почва (до 1% Pb), растения и воды.
В свинцовых рудах часто находятся также другие металлы – медь, цинк, кадмий, серебро, золото, висмут и др. В месте залегания свинцовых руд этим элементом обогащена почва (до 1% Pb), растения и воды.
В сильноокислительной щелочной среде степей и пустынь возможно образование диоксида свинца – минерала платтнерита. И исключительно редко встречается самородный металлический свинец. См. также СВИНЦОВАЯ ПРОМЫШЛЕННОСТЬ.
История.
Происхождение слова «свинец» неясно. В старину свинец не всегда четко отличали от олова. В большинстве славянских языков (болгарском, сербскохорватском, чешском, польском) свинец и называется оловом. Наш же «свинец» встречается только в языках балтийской группы: svinas (литовский), svin (латышский). У некоторых горе-переводчиков это приводило к забавным недоразумениям, например, к «оловянным аккумуляторам» в автомобилях. Английское название свинца lead и голландское lood, возможно, связаны с нашим «лудить». Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber – водопроводчик (когда-то трубы зачеканивали мягким свинцом. И еще одна путаница, связанная со свинцом. Древние греки называли свинец «молибдос» (название сохранилось и в новогреческом языке). Отсюда – латинское molibdaena: так в средние века называли и свинцовый блеск PbS, и более редкий молибденовый блеск (MoS2), и другие похожие минералы, оставлявшие черный след на светлой поверхности. Такой же след оставляли графит и сам свинец. Тонкими свинцовыми стержнями можно было писать на пергаменте; недаром по-немецки карандаш – Bleistift, т.е. свинцовый стержень.
Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber – водопроводчик (когда-то трубы зачеканивали мягким свинцом. И еще одна путаница, связанная со свинцом. Древние греки называли свинец «молибдос» (название сохранилось и в новогреческом языке). Отсюда – латинское molibdaena: так в средние века называли и свинцовый блеск PbS, и более редкий молибденовый блеск (MoS2), и другие похожие минералы, оставлявшие черный след на светлой поверхности. Такой же след оставляли графит и сам свинец. Тонкими свинцовыми стержнями можно было писать на пергаменте; недаром по-немецки карандаш – Bleistift, т.е. свинцовый стержень.
Свинец вместе с золотом, серебром, медью, оловом, железом и ртутью входит в семерку металлов, известных с глубокой древности. Эти металлы сопоставлялись с известными тогда планетами (свинцу соответствовал Сатурн). Считается, что впервые люди выплавили свинец из руд 8 тысяч лет назад. Раскопки в Древнем Египте обнаружили изделия из серебра и свинца в захоронениях до династического периода. К этому же времени относятся аналогичные находки, сделанные в Месопотамии. Совместные находки серебряных и свинцовых изделий не удивительны. Еще в доисторические времена внимание людей привлекли красивые тяжелые кристаллы свинцового блеска. Залежи этого минерала находили в горах Армении, в центральных районах Малой Азии. А минерал галенит часто содержит значительные примеси серебра. Если положить куски этого минерала в костер, то сера выгорит и потечет расплавленный свинец (древесный уголь препятствует окислению свинца). Уже за много тысячелетий до новой эры в Месопотамии, Египте из него отливали статуи.
К этому же времени относятся аналогичные находки, сделанные в Месопотамии. Совместные находки серебряных и свинцовых изделий не удивительны. Еще в доисторические времена внимание людей привлекли красивые тяжелые кристаллы свинцового блеска. Залежи этого минерала находили в горах Армении, в центральных районах Малой Азии. А минерал галенит часто содержит значительные примеси серебра. Если положить куски этого минерала в костер, то сера выгорит и потечет расплавленный свинец (древесный уголь препятствует окислению свинца). Уже за много тысячелетий до новой эры в Месопотамии, Египте из него отливали статуи.
В VI в. до н.э. богатые залежи галенита были обнаружены в Лаврионе – гористой местности недалеко от Афин. Во времена пунических войн (264–146 до н.э.) на территории современной Испании работали многочисленные свинцовые шахты, которые были заложены греками и финикийцами. Позднее они разрабатывались римлянами; римские инженеры использовали свинец для изготовления труб древнего водопровода. Древнегреческий историк Геродот (V в. до н.э.) писал о методе укрепления железных и бронзовых скоб в каменных плитах путем заливки отверстий легкоплавким свинцом. Позднее при раскопках Микен нашли свинцовые скобы в каменных стенах.
Древнегреческий историк Геродот (V в. до н.э.) писал о методе укрепления железных и бронзовых скоб в каменных плитах путем заливки отверстий легкоплавким свинцом. Позднее при раскопках Микен нашли свинцовые скобы в каменных стенах.
При получении свинца античные металлурги сначала прокаливали руду, при этом шли реакции
2PbS + 3O2 ® 2PbO + 2SO2 и PbS + 2O2 ® PbSO4. Затем температуру повышали, что приводило к выплавке свинца:
PbS + 2PbO ® 3Pb + SO2; PbS + PbSO4 ® 2Pb + 2SO2. Первые плавильные печи, сделанные из глины и камней, были весьма примитивны. Их старались установить на склонах холмов, где дуют ветры, помогающие обжигу. Выплавленный свинец, как правило, содержал серебро – иногда до 0,5% и более. При медленном охлаждении такого расплава сначала кристаллизуется чистый свинец, а жидкость обогащается серебром – примерно до 2%. Для выделения серебра использовали метод купелирования: окисляли расплавленный свинец в пористом глиняном сосуде – купели, а его оксид затем снова восстанавливали до металла. Механизм этого процесса был изучен только в 1833.
Механизм этого процесса был изучен только в 1833.
Использовали свинец и для очистки золота и серебра методом купелирования. Для этого подлежащий очистке драгоценный металл сплавляли со свинцом. Свинец и другие примеси легко окислялись при высокой температуре; образующиеся оксиды сдувались струей воздуха, а частично впитывались в поры купели, а на дне оставался слиток чистого серебра или золота. Оксид свинца затем снова могли превратить в металл, нагревая его с древесным углем. Археологические находки в Уре и Трое свидетельствуют, что купелирование было известно на северо-западе Малой Азии уже в первой половине III тыс. до н.э. А греческим умельцам из добытого в Лаврионе свинца удавалось извлечь почти все серебро: по современным анализам его оставалось в свинце всего 0,02%! Искусство древних металлургов достойно удивления: ведь у них не было ни возможности контролировать температуру на разных стадиях процесса, ни проводить химических анализов. И все же в отвалах рудников оставалось много неизвлеченного свинца.-chemical-elements---vector-stencils-library.png--diagram-flowchart-example.png) Еще лучших результатов добились римские металлурги, вдвое снизив остаточное количество серебра. Конечно, их беспокоила не чистота свинца, а полнота извлечения из него драгоценного металла. Более того, как свидетельствует греческий историк Страбон, перерабатывая старые отвалы в Лаврионе, римляне смогли извлечь довольно много и свинца, и серебра, оставив около двух миллионов тонн отработанной руды в отвалах. После этого рудники были заброшены почти на два тысячелетия, но в 1864 отвалы снова начали перерабатывать – теперь уже ради только серебра (его в них оставалось около 0,01%). На современных металлургических предприятиях в свинце оставляют еще в сотни раз меньше серебра.
Еще лучших результатов добились римские металлурги, вдвое снизив остаточное количество серебра. Конечно, их беспокоила не чистота свинца, а полнота извлечения из него драгоценного металла. Более того, как свидетельствует греческий историк Страбон, перерабатывая старые отвалы в Лаврионе, римляне смогли извлечь довольно много и свинца, и серебра, оставив около двух миллионов тонн отработанной руды в отвалах. После этого рудники были заброшены почти на два тысячелетия, но в 1864 отвалы снова начали перерабатывать – теперь уже ради только серебра (его в них оставалось около 0,01%). На современных металлургических предприятиях в свинце оставляют еще в сотни раз меньше серебра.
Древние гончары, размалывая свинцовый блеск с глиной и водой, обливали этой смесью подлежащие обжигу глиняные сосуды. При высокой температуре поверхность сосуда покрывалась легкоплавким свинцовым стеклом. В 1673 английский стекольный мастер Джордж Равенскрофт, добавив в состав стекла оксид свинца, изобрел хрустальное стекло, которое легко плавится, прекрасно поддается обработке и обладает особым блеском, приближающим его к настоящему горному хрусталю. Позднее, сплавив чистый белый песок, поташ и оксид свинца, получили страз (от имени жившего в конце 18 в. ювелира Страсса) – сорт стекла с таким сильным блеском, что оно хорошо имитировало алмаз, а с примесью разных пигментов – другие драгоценные камни.
Позднее, сплавив чистый белый песок, поташ и оксид свинца, получили страз (от имени жившего в конце 18 в. ювелира Страсса) – сорт стекла с таким сильным блеском, что оно хорошо имитировало алмаз, а с примесью разных пигментов – другие драгоценные камни.
Тонкими свинцовыми пластинами обшивали деревянные корпуса древних кораблей. Один такой греческий корабль, построенный в III в. до н.э., был найден в 1954 на дне Средиземного моря недалеко от Марселя. Римляне изготовляли также из свинца трубы длиной 3 метра и разного, но строго определенного диаметра (всего было 15 вариантов). Это первый в истории пример стандартизированного промышленного производства. Сначала из свинца отливали пластину, оборачивали ее вокруг деревянного стержня и запаивали шов оловянно-свинцовым припоем (его состав с тех пор практически не изменился). В трубах нередко обнаруживались течи, и их надо было ремонтировать. До сих пор во время раскопок в Италии и в Англии находят такие трубы в очень хорошем состоянии. Римский зодчий и инженер Марк Витрувий Поллион рекомендовал заменить свинцовые трубы керамическими – из обожженной глины. Он обратил внимание на болезненность рабочих, занятых выплавкой свинца и считал, что свинец «лишает кровь ее силы». Однако не все разделяли это мнение. Так, римский государственный деятель, ученый и писатель Плиний, автор знаменитой «Естественной истории», писал о пользе свинцовых препаратов, о том, что свинцовая мазь помогает выводить шрамы, излечивать язвы и глазные болезни.
Римский зодчий и инженер Марк Витрувий Поллион рекомендовал заменить свинцовые трубы керамическими – из обожженной глины. Он обратил внимание на болезненность рабочих, занятых выплавкой свинца и считал, что свинец «лишает кровь ее силы». Однако не все разделяли это мнение. Так, римский государственный деятель, ученый и писатель Плиний, автор знаменитой «Естественной истории», писал о пользе свинцовых препаратов, о том, что свинцовая мазь помогает выводить шрамы, излечивать язвы и глазные болезни.
В средние века крыши церквей и дворцов нередко покрывали свинцовыми пластинами, устойчивыми к атмосферным влияниям. Еще в 669 свинцом покрыли крышу монастырской церкви в Йорке, а в 688 епископ в Нортумберленде приказал обшить свинцовыми пластинами крышу и стены церкви. Знаменитые витражи в соборах собирали с помощью свинцовых рамок с желобками, в которых укрепляли пластинки цветного стекла. Делали из свинца, по примеру римлян, и водопроводные, а также дренажные трубы. Так, в 1532 в Вестминстерском дворце установили свинцовые водосточные трубы квадратного сечения. Все эти изделия в те времена не прокатывали, а отливали в формах, на дно которых насыпали тонко просеянный песок. Со временем на свинцовых изделиях появлялся прочный защитный слой – патина. Некоторые облицованные свинцом средневековые шпили сохранились в течение почти семисот лет. К сожалению, пожар 1561 в Лондоне уничтожил такой шпиль величайшего собора святого Петра.
Все эти изделия в те времена не прокатывали, а отливали в формах, на дно которых насыпали тонко просеянный песок. Со временем на свинцовых изделиях появлялся прочный защитный слой – патина. Некоторые облицованные свинцом средневековые шпили сохранились в течение почти семисот лет. К сожалению, пожар 1561 в Лондоне уничтожил такой шпиль величайшего собора святого Петра.
Когда появилось огнестрельное оружие, большие количества свинца пошли для изготовления пуль и дроби, и свинец начал ассоциироваться также со смертельной опасностью: «Засвищет вокруг меня губительный свинец» (А.Пушкин), «За твой окоп другой боец подставил грудь под злой свинец» (К.Симонов). Сначала дробь отливали в разъемных формах. В 1650 английский принц Руперт изобрел более быстрый и удобный способ. Он обнаружил, что если к свинцу добавить немного мышьяка и лить этот сплав через своего рода большой дуршлаг в бак с водой, то получаются шарики дроби правильной сферической формы. А после того, как в 1436 Иоганн Гутенберг изобрел способ печатать книги с использованием подвижных металлических литер, печатники в течение сотен лет отливали буквы из так называемого типографского сплава на основе свинца (с примесью олова и сурьмы).
Из соединений свинца с древних времен использовали свинцовый сурик Pb3O4 и основной карбонат свинца (свинцовые белила) в качестве красной и белой краски. Почти все картины старых мастеров писаны красками, приготовленными на основе свинцовых белил. Оригинальным был старинный способ их получения: горшки с крепким уксусом ставили в навоз, а над ними подвешивали скрученные в спираль тонкие свинцовые пластины. Разлагаясь, навоз давал тепло (оно необходимо для усиленного испарения уксусной кислоты) и углекислый газ. Совместное действие на свинец этих веществ, а также кислорода воздуха и давало белила. Помимо ядовитости, эти белила темнеют со временем, так как реагируют со следами сероводорода, который всегда присутствует в воздухе: 2PbCO3·Pb(OH)2 + 3H2S ® 3PbS + 2CO2 + 4H2O. При реставрации таких картин потемневшие участки осторожно обрабатывают раствором Н2О2, что переводит черный сульфид в белый сульфат: PbS + 4H2O2 ® PbSO4 + 4H2O.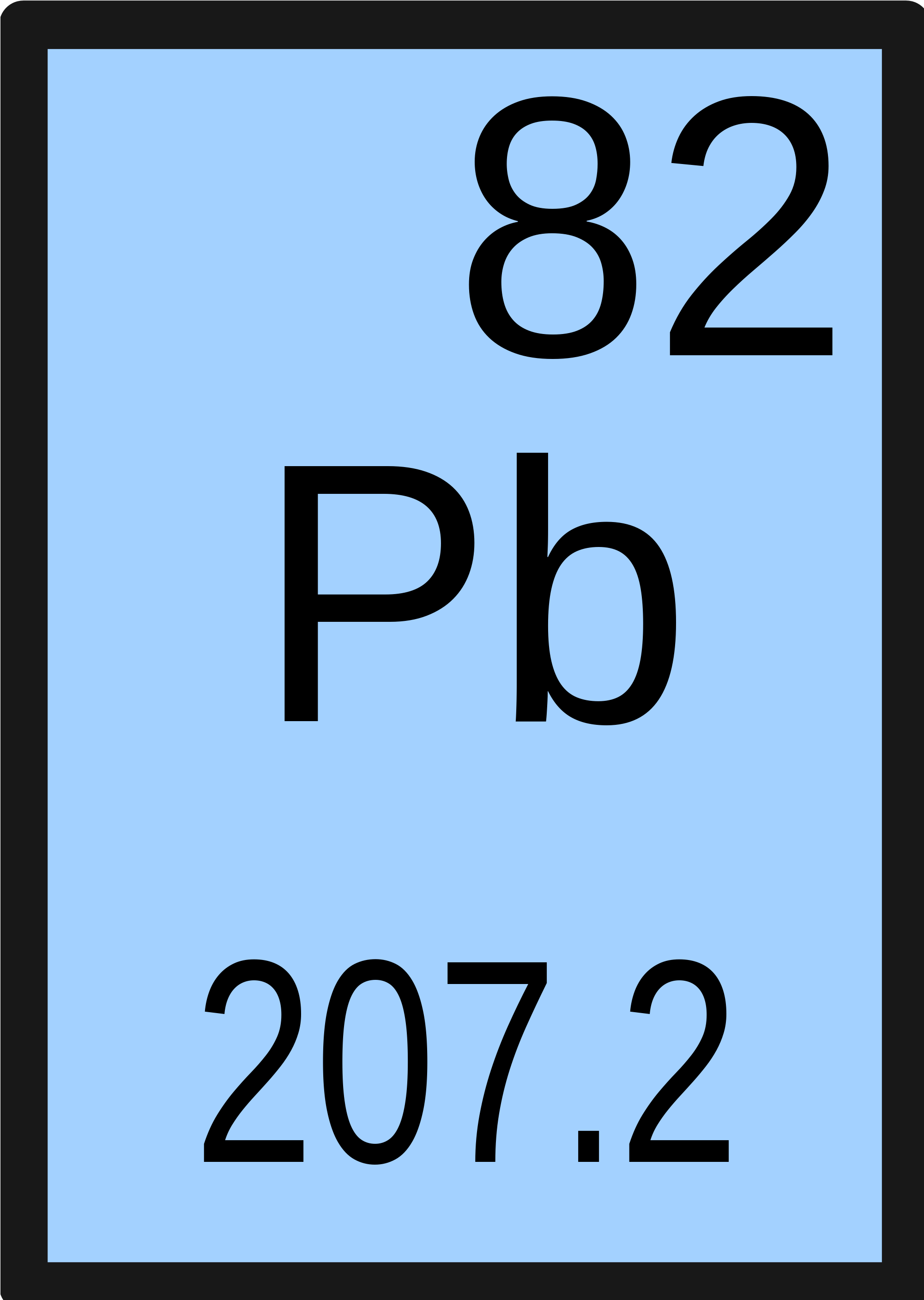 В настоящее время ядовитые свинцовые белила заменены более дорогими, но безвредными титановыми. Ограниченное применение (например, в качестве пигментов для художественных масляных красок) имеют пигменты, содержащих свинец: свинцовый крон лимонный 2PbCrO4·PbSO4, свинцовый крон желтый 13PbCrO4·PbSO4, красного цвета свинцово-молибдатный крон 7PbCrO4·PbSO4·PbMoO4.
В настоящее время ядовитые свинцовые белила заменены более дорогими, но безвредными титановыми. Ограниченное применение (например, в качестве пигментов для художественных масляных красок) имеют пигменты, содержащих свинец: свинцовый крон лимонный 2PbCrO4·PbSO4, свинцовый крон желтый 13PbCrO4·PbSO4, красного цвета свинцово-молибдатный крон 7PbCrO4·PbSO4·PbMoO4.
Свойства свинца.
Свинец обычно имеет грязно-серый цвет, хотя свежий его разрез имеет синеватый отлив и блестит. Однако блестящий металл быстро покрывается тускло-серой защитной пленкой оксида. Плотность свинца (11,34 г/см3) в полтора раза больше, чем у железа, вчетверо больше, чем у алюминия; даже серебро легче свинца. Недаром в русском языке «свинцовый» – синоним тяжелого: «Ненастной ночи мгла по небу стелется одеждою свинцовой»; «И как свинец пошел ко дну» – эти пушкинские строки напоминают, что со свинцом неразрывно связано понятие гнета, тяжести.
Свинец очень легко плавится – при 327,5° С, кипит при 1751° С и заметно летуч уже при 700° С. Этот факт очень важен для работающих на комбинатах по добыче и переработке свинца. Свинец – один из самых мягких металлов. Он легко царапается ногтем и прокатывается в очень тонкие листы. Свинец сплавляется со многими металлами. С ртутью он дает амальгаму, которая при небольшом содержании свинца жидкая.
По химическим свойствам свинец – малоактивный металл: в электрохимическом ряду напряжений он стоит непосредственно перед водородом. Поэтому свинец легко вытесняется другими металлами из растворов его солей. Если опустить в подкисленный раствор ацетата свинца цинковую палочку, свинец выделяется на ней в виде пушистого налета из мелких кристалликов, имеющего старинного название «сатурнова дерева». Если затормозить реакцию, обернув цинк фильтровальной бумагой, вырастают более крупные кристаллы свинца.
Наиболее типична для свинца степень окисления +2; соединения свинца(IV) значительно менее устойчивы. В разбавленных соляной и серной кислотах свинец практически не растворяется, в том числе из-за образования на поверхности нерастворимой пленки хлорида или сульфата. С крепкой серной кислотой (при концентрации более 80%) свинец реагирует с образованием растворимого гидросульфата Pb(HSO4)2, а в горячей концентрированной соляной кислоте растворение сопровождается образованием комплексного хлорида H4PbCl6. Разбавленной азотной кислотой свинец легко окисляется:
В разбавленных соляной и серной кислотах свинец практически не растворяется, в том числе из-за образования на поверхности нерастворимой пленки хлорида или сульфата. С крепкой серной кислотой (при концентрации более 80%) свинец реагирует с образованием растворимого гидросульфата Pb(HSO4)2, а в горячей концентрированной соляной кислоте растворение сопровождается образованием комплексного хлорида H4PbCl6. Разбавленной азотной кислотой свинец легко окисляется:
Pb + 4HNO3 ® Pb(NO3)2 + 2NO2 + H2O. Разложение нитрата свинца(II) при нагревании – удобный лабораторный метод получения диоксида азота:
2Pb(NO3)2 ® 2PbO + 4NO2 + O2.
В присутствии кислорода свинец растворяется также в ряде органических кислот. При действии уксусной кислоты образуется легкорастворимый ацетат Pb(CH2COO)2 (старинное название – «свинцовый сахар»). Свинец заметно растворим также в муравьиной, лимонной и винной кислотах. Растворимость свинца в органических кислотах могло раньше приводить к отравлениям, если пищу готовили в посуде, луженной или паянной свинцовым припоем. Растворимые соли свинца (нитрат и ацетат) в воде гидролизуются:
Свинец заметно растворим также в муравьиной, лимонной и винной кислотах. Растворимость свинца в органических кислотах могло раньше приводить к отравлениям, если пищу готовили в посуде, луженной или паянной свинцовым припоем. Растворимые соли свинца (нитрат и ацетат) в воде гидролизуются:
Pb(NO3)2 + H2O Pb(OH)NO3 + HNO3. Взвесь основного ацетата свинца («свинцовая примочка») имеет ограниченное медицинское применение в качестве наружного вяжущего средства.
Свинец медленно растворяется и в концентрированных щелочах с выделением водорода: Pb + 2NaOH + 2H2O ® Na2Pb(OH)4 + H2, что указывает на амфотерные свойства соединений свинца. Белый гидроксид свинца(II), легко осаждаемый из растворов его солей, также растворяется как в кислотах, так и в сильных щелочах:
Pb(OH)2 + 2HNO3 ® Pb(NO3)2 + 2H2O; Pb(OH)2 + 2NaOH ® Na2Pb(OH)4. При стоянии или нагревании Pb(OH)2 разлагается с выделением PbO. При сплавлении PbO со щелочью образуется плюмбит состава Na2PbO2.
Из щелочного раствора тетрагидроксоплюмбата натрия Na2Pb(OH)4 тоже можно вытеснить свинец более активным металлом. Если в такой нагретый раствор положить маленькую гранулу алюминия, быстро образуется серый пушистый шарик, который насыщен мелкими пузырьками выделяющегося водорода и потому всплывает. Если алюминий взять в виде проволоки, выделяющийся на ней свинец превращает ее в серую «змею».
При нагревании свинец реагирует с кислородом, серой и галогенами. Так, в реакции с хлором образуется тетрахлорид PbCl4 – желтая жидкость, дымящая на воздухе из-за гидролиза, а при нагревании разлагающаяся на PbCl2 и Cl2. (Галогениды PbBr4 и PbI4 не существуют, так как Pb(IV) – сильный окислитель, который окислил бы бромид- и иодид-анионы.) Тонкоизмельченный свинец обладает пирофорными свойствами – вспыхивает на воздухе. При продолжительном нагревании расплавленного свинца он постепенно переходит сначала в желтый оксид PbO (свинцовый глет), а затем (при хорошем доступе воздуха) – в красный сурик Pb3O4 или 2PbO·PbO2. Это соединение можно рассматривать также как свинцовую соль ортосвинцовой кислоты Pb2[PbO4]. С помощью сильных окислителей, например, хлорной извести, соединения свинца(II) можно окислить до диоксида:
Pb(CH3COO)2 + Ca(ClO)Cl + H2O ® PbO2 + CaCl2 + 2CH3COOH. Диоксид образуется также при обработке сурика азотной кислотой:
Pb3O4 + 4HNO3 ® PbO2 + 2Pb(NO3)2 + 2H2O. Если сильно нагревать коричневый диоксид, то при температуре около 300° С он превратится в оранжевый Pb2O3 (PbO·PbO2), при 400°С – в красный Pb3O4, а выше 530° С – в желтый PbO (разложение сопровождается выделением кислорода). В смеси с безводным глицерином свинцовый глет медленно, в течение 30–40 минут реагирует с образованием водоупорной и термостойкой твердой замазки, которой можно склеивать металл, стекло и камень.
Диоксид свинца – сильный окислитель. Струя сероводорода, направленная на сухой диоксид, загорается; концентрированная соляная кислота окисляется им до хлора:
PbO2 + 4HCl ® PbCl2 + Cl2 + H2O, сернистый газ – до сульфата: PbO2 + SO2 ® PbSO4, а соли Mn2+ – до перманганат-ионов: 5PbO2 + 2MnSO4 + H2SO4 ® 5PbSO4 + 2HMnO4 + 2H2O. Диоксид свинца образуется, а затем расходуется при зарядке и последующем разряде самых распространенных кислотных аккумуляторов. Соединения свинца(IV) обладают еще более типичными амфотерными свойствами. Так, нерастворимый гидроксид Pb(OH)4 бурого цвета легко растворяется в кислотах и щелочах: Pb(OH)4 + 6HCl ® H2PbCl6; Pb(OH)4 + 2NaOH ® Na2Pb(OH)6. Диоксид свинца, реагируя с щелочью, также образует комплексный плюмбат(IV):
PbO2 + 2NaOH + 2H2O ® Na2[Pb(OH)6]. Если же PbO2 сплавить с твердой щелочью, образуется плюмбат состава Na2PbO3. Из соединений, в которых свинец(IV) входит в состав катиона, наиболее важен тетраацетат. Его можно получить кипячением сурика с безводной уксусной кислотой:
Pb3O4 + 8CH3COOH ® Pb(CH3COO)4 + 2Pb(CH3COO)2 + 4H2O. При охлаждении из раствора выделяются бесцветные кристаллы тетраацетата свинца. Другой способ – окисление ацетата свинца(II) хлором: 2Pb(CH3COO)2 + Cl2 ® Pb(CH3COO)4 + PbCl2. Водой тетраацетат мгновенно гидролизуется до PbO2 и CH3COOH. Тетраацетат свинца находит применение в органической химии в качестве селективного окислителя. Например, он весьма избирательно окисляет только некоторые гидроксильные группы в молекулах целлюлозы, а 5-фенил-1-пентанол под действием тетраацетата свинца окисляется с одновременной циклизацией и образованием 2-бензилфурана.
Органические производные свинца – бесцветные очень ядовитые жидкости. Один из методов их синтеза – действие алкилгалогенидов на сплав свинца с натрием:
4C2H5Cl + 4PbNa ® (C2H5)4Pb + 4NaCl + 3Pb. Действием газообразного HCl можно отщеплять от тетразамещенных свинца один алкильный радикал за другим, заменяя их на хлор. Соединения R4Pb разлагаются при нагревании с образованием тонкой пленки чистого металла. Такое разложение тетраметилсвинца было использовано для определения времени жизни свободных радикалов. Тетраэтилсвинец – антидетонатор моторного топлива.
Получение свинца.
Количество добываемого свинца непрерывно возрастает. Если в 1800 во всем мире его было получено около 30 000 тонн, то в 1850 – 130 000 т, в 1875 – 320 000 т, в 1900 – 850 000 т, 1950 – почти 2 млн. т, а в настоящее время в год добывают около 5 млн. т. По объему производства свинец занимает четвертое место среди цветных металлов – после алюминия, меди и цинка.
Основной источник свинца – сульфидные полиметаллические руды, содержащие от 1 до 5% свинца. Руду концентрируют до содержания свинца 40 – 75%, затем подвергают обжигу: 2PbS + 3O2 ® 2PbO + 2SO2 и восстанавливают свинец коксом и оксидом углерода(II). Более экономичный, так называемый автогенный, способ заключается в проведении реакции PbS + 2PbO ® 3Pb + SO2 (PbO образуется при частичном обжиге PbS). Получаемый из руды свинец содержит от 3 до 7% примесей в виде меди, сурьмы, мышьяка, олова, алюминия, висмута а также золота и серебра. Их удаление (или выделение, если это экономически рентабельно), требует сложных и длительных операций. Очистку свинца можно проводить также методом электрохимического рафинирования. Электролитом служит водный раствор фторосиликата свинца PbSiF6. На катоде оседает чистый свинец, а примеси концентрируются в анодном шламе, содержащем много ценных компонентов, которые затем выделяют.
Свинец в организме человека.
Соединения свинца ядовиты. Но очевидным это стало далеко не сразу. В прошлом покрытия гончарных изделий свинцовой глазурью, изготовление свинцовых водопроводных труб, использование свинцовых белил (особенно в косметических целях), применение свинцовых трубок в конденсаторах паров на винокуренных заводах – все это приводило к накоплению свинца в организме. Древние греки знали, что вино и кислые соки нельзя держать в глазурованных глиняных сосудах (глазурь содержала свинец), а вот римляне этим правилом пренебрегали. Джемс Линд, рекомендовавший в 1753 английскому адмиралтейству лимонный сок как средство против цинги для моряков в дальнем плавании, предостерегал от хранения сока в гончарных глазурованных изделиях. Тем не менее случаи отравления, в том числе и смертельные, наблюдались по той же причине и двести лет спустя.
Свинец проникает в организм через желудочно-кишечный тракт или дыхательную систему и разносится затем кровью по всему организму. Причем вдыхание свинцовой пыли значительно опаснее присутствия свинца в пище. В воздухе городов содержание свинца составляет в среднем от 0,15 до 0,5 мкг/м3. В районах, где расположены предприятия по переработке полиметаллических руд, эта концентрация выше.
Свинец накапливается в костях, частично замещая кальций в фосфате Са3(РО4)2. Попадая в мягкие ткани – мышцы, печень, почки, головной мозг, лимфатические узлы, свинец вызывает заболевание – плюмбизм. Как и многие другие тяжелые металлы, свинец (в виде ионов) блокирует деятельность некоторых ферментов. Было установлено, что их активность снижается в 100 раз при увеличении концентрации свинца в крови в 10 раз – с 10 до 100 микрограммов на 100 мл крови. При этом развивается анемия, поражаются кроветворная система, почки и мозг, снижается интеллект. Признак хронического отравления – серая кайма на деснах, расстройство нервной системы. Особенно опасен свинец для детей, так как он вызывает задержку в развитии. В то же время десятки миллионов детей во всем мире в возрасте до 6 лет имеют свинцовое отравление; основная причина – попадание в рот краски, содержащей свинец. Антидотом при отравлении может служить кальциевая соль этилендиаминтетрауксусной кислоты. В отравленном организме происходит замещение кальция на ионы свинца, которые удерживаются в этой соли очень прочно и в таком виде выводятся.
Свинец легко может попасть в организм с питьевой водой, если она соприкасалась с металлом: в присутствии углекислого газа в раствор медленно переходит растворимый гидрокарбонат Pb(HCO3)2. В Древнем Риме, где для подачи воды использовали свинцовые трубы, такое отравление было весьма распространенным, на что указывают анализы останков римлян. Причем отравлялись, в основном, богатые римляне, пользовавшиеся водопроводом, хранившие вино, оливковое масло и другие продукты в освинцованных сосудах, использовавшие содержащие свинец косметические средства. Достаточно, чтобы в литре воды был всего один миллиграмм свинца – и питье такой воды становится очень опасным. Это количество свинца так малó, что не изменяет ни запаха, ни вкуса воды, и только точные современные приборы могут его обнаружить.
Свинцовым отравлением некоторые историки объясняют и болезненность ряда русских царей. В 1633 в московском Кремле закончили строительство водопровода. Вода в него поступала из колодца в нижнем этаже Свибловой башни, стоявшей на слиянии Неглинной и Москвы-реки. Воду из колодца качали при помощи подъемной машины – взвода (с тех пор эта кремлевская башня называется Водовзводной). Машину приводили в движение лошади. Воду закачивали в большой бак, а оттуда вода сама по трубам текла на царскую кухню, в сады, другие места. Трубы были изготовлены из свинца; бак для воды изнутри тоже был выложен свинцовыми листами, чтобы вода из него не просачивалась в щели. Особенно много свинца накапливалось в воде за ночь, после ее неподвижного стояния в свинцовом баке и трубах.
Кремлевский «свинцовый водопровод» работал чуть больше 100 лет – его уничтожил пожар 1737. И в период действия этого водопровода русские цари жили меньше обычного. Так, царь и великий князь Иван V Алексеевич, сын царя Алексея Михайловича и первой жены его, Милославской, прожил всего 29 лет. Незадолго до смерти он выглядел дряхлым стариком. С детства он был, как писали тогда, «слабый и болезненный, немощен телом и рассудком, заикался, скорбен головою, страдал цингою и глазною болезнью». Из шести братьев царя пятеро не дожили до 20 лет. Некоторые ученые считают, что это последствия свинцового отравления. А вот шестой брат, Петр Алексеевич, будущий Петр I, избежал отравления – детство и отрочество он провел не в Кремле, а в подмосковных селах. Да и позднее он мало бывал в Кремле – много воевал, путешествовал по Европе, а потом и вовсе перенес столицу на берега Невы. Кстати, первый водопровод в Петербурге, который давал воду для дворцов и фонтанов Летнего сада, был деревянным. Его трубы были сделаны из бревен с просверленными в них отверстиями. Свинец же Петр использовал в военных целях – для отливки пуль.
А вот как пишут о свинцовом отравлении современные медицинские справочники: вялость, апатия, потеря памяти, раннее слабоумие, ослабление зрения, больные выглядят старше своих лет. Удивительно напоминает старинное описание царя Ивана Алексеевича!
Травились когда-то не только «свинцовой водой». Свинец широко использовали при изготовлении посуды (свинцовая глазурь), свинцовых белил, которыми окрашивали стены домов. Сейчас такое применение свинца строжайше запрещено. Белила, например, делают цинковые или титановые. Тем не менее у жителей промышленно развитых стран свинца в организме больше, чем у жителей отсталых и развивающихся стран, а у городских жителей больше, чем у сельских. Разница может быть огромной – в сотни раз.
Свинцовое загрязнение приобрело в 20 в. глобальный характер. Даже в снегах Гренландии его содержание за сто лет увеличилось в пять раз, а в центрах крупных городов в почве и растениях свинца в 25 раз больше, чем на окраинах! Загрязнение свинцом наблюдается в районах его добычи, а также в местах переработки и автострад, особенно если еще используется этилированный бензин. Немало свинца оседает на дне озер в виде охотничьей дроби. Каждый год в Мировой океан со сточными водами попадает более полумиллиона тонн этого ядовитого металла. А кто не видел выброшенные в мусорные ящики, а то и просто в канавы отработанные аккумуляторы! Пока свинец дешев, собирание и переработка его отходов невыгодна. Малая растворимость большинства соединений свинца, к счастью, не позволяет ему накапливаться в значительных количествах в воде. В водах Мирового океана его содержится в среднем 0,03 мкг/л (3·10–9%). Мало в среднем свинца и в живом веществе – 10–4%.
Применение свинца.
Несмотря на ядовитость свинца, отказаться от него невозможно. Свинец дешев – вдвое дешевле алюминия, в 11 раз дешевле олова. После того как в 1859 французский физик Гастон Планте изобрел свинцовый аккумулятор, для изготовления аккумуляторных пластин с тех пор израсходовали миллионы тонн свинца; в настоящее время на эти цели уходит в ряде стран до 75% всего добываемого свинца! Постепенно снижается применение свинца для изготовления очень ядовитого антидетонатора – тетраэтилсвинца. Способность тетраэтилсвинца улучшать качество бензина было открыто группой молодых американских инженеров в 1922; в своих поисках они руководствовались периодической таблицей элементов, планомерно приближаясь к наиболее эффективному средству. С тех пор производство тетраэтилсвинца непрерывно росло; максимум приходится на конец 1960-х, когда только в США ежегодно с выхлопами выбрасывались сотни тысяч тонн свинца – по килограмму на каждого жителя! В последние годы применение этилированного бензина запрещено во многих регионах, и его производство снижается.
Мягкий и пластичный свинец, не ржавеющий в присутствии влаги, – незаменимый материал для изготовления оболочек электрических кабелей; на эти цели в мире расходуется до 20% свинца. Малоактивный свинец используют для изготовления кислотоупорной аппаратуры для химической промышленности, например, для облицовки реакторов, в которых получают соляную и серную кислоты. Тяжелый свинец хорошо задерживает губительные для человека излучения и потому свинцовые экраны используются для защиты работников рентгеновских кабинетов, в свинцовых контейнерах хранят и перевозят радиоактивные препараты. Свинец содержат также подшипниковые сплавы баббиты, «мягкие» припои (самый известный – «третник» – сплав свинца с оловом).
В строительстве свинец используют для уплотнения швов и создания сейсмостойких фундаментов. В военной технике – для изготовления шрапнели и сердечников пуль.
Илья Леенсон
Свинец
Свине́ц — элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение названия
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается в языках балтийской группы: švinas (литовский), svins (латышский), а также в восточнославянских — украинском (свинець) и белорусском (свінец).
Латинское plumbum, употребляемое, помимо остальных, Петронием Арбитром дало английское слово plumber — водопроводчик (в Древнем Риме трубы водопровода были именно из этого металла, как наиболее подходящего для отливки), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Физические свойства
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К) при температуре 0 °C. Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Свинец широко используют для защиты от гамма-излучения, как элемент с большим атомным номером (и следовательно большим количеством электронов на один атом), достаточно распространённый в природе, не радиоактивный.
Плотность — 11,3415 г/см³ (при 20 °C)
Температура плавления — 327,4 °C (621,32 °F; 600,55 K)
Температура кипения — 1740 °C (3164 °F; 2013,15 K)
Химические свойства
Свинец не очень активен химически. На металлическом разрезе свинца виден металлический блеск, постепенно исчезающий из-за образования тонкой плёнки PbO.
С кислородом образует ряд соединений Pb2О, PbO, Pb2О3, Pb3О4, PbO2. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре при взаимодействии свинца и горячего водяного пара получаются оксиды свинца и водород.
Оксидам PbO и PbO2 соответствуют амфотерные гидроксиды Pb(ОН)2 и Pb(ОН)4.
При реакции Mg2Pb и разбавленной HCl получается небольшое количество PbH4. PbH4 — газообразное вещество без запаха, которое очень легко разлагается на свинец и водород. При большой температуре галогены образовывают со свинцом соединения вида PbX2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа PbX4. Свинец с азотом прямо не реагирует. Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Pb(II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb(II). В ряду напряжений свинец стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и H2SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки труднорастворимых хлорида PbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа H2SO4 и HCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[PbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Pb(II). По растворимости в воде соли свинца делятся на нерастворимые (например, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (хлорид и фторид) и растворимые (к примеру, ацетат, нитрат и хлорат свинца). Соли Pb(IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Pb(II). Соли Pb(IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (PbO3)2- и (PbO4)4-, хлороплюмбатов [PbCl6]2-, гидроксоплюмбатов [Pb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют со свинцом с выделением водорода и гидроксоплюмбитов типа [Pb(ОН)4 X2].
Потенциал ионизации Еион=7,42 эВ.
Источник: Википедия
Другие заметки по химии
Изотопы свинца | Производственное объединение «Электрохимический завод»
Свинец с точки зрения изотопного состава в основном является смесью стабильных изотопов 204Pb (свинец-204), 206Pb (свинец-206), 207Pb (свинец-207) и 208Pb (свинец-208).
Свинец — последний элемент в периодической таблице, у которого существуют стабильные изотопы, элементы после свинца стабильных изотопов не имеют (хотя висмут-209 на практике можно считать стабильным, т.к. его период полураспада примерно в миллиард раз больше возраста Вселенной). Изотопы 206Pb, 207Pb, 208Pb являются радиогенными и образуются в результате радиоактивного распада соответственно 238U (уран-238), 235U (уран-235) и 232Th (торий-232).
| ИЗОТОП | ПРИРОДНОЕ СОДЕРЖАНИЕ, % | СТЕПЕНЬ ОБОГАЩЕНИЯ, % | ХИМИЧЕСКАЯ ФОРМА |
| 204Pb | 1,40 | 99,90 | металл (Pb) |
| 206Pb | 24,10 | ||
| 206Pb | 22,10 | 99,00 | |
| 208Pb | 52,40 | 99,80 |
Основные сферы использования: атомная энергетика, геология, научные исследования, медицина.
| По данным открытых источников | |
| ИЗОТОП | ОБЛАСТИ ПРИМЕНЕНИЯ |
| 204Pb | — создание изотопных эталонов свинца, используемых при поиске урана; — разработка нейтронно-активационных детекторов для спектрометрии интенсивных нейтронных полей |
| 206Pb | — создание изотопных эталонов свинца, используемых при поиске урана; — производство медицинского радиоизотопа 205Bi (висмут-205) |
| 207Pb | — в системах управления и защиты (СУЗ) в реакторах; — создание изотопных эталонов свинца, используемых при поиске урана; — определение возраста горных пород; — производство медицинского радиоизотопа 205Bi (висмут-205) |
| 208Pb | — проведение ряда химических исследований; — получение богатых нейтронами изотопов вольфрама и лютеция; — исследования характеристик нейтронных звезд; — возможное использование в качестве теплоносителя в нейтронных полях |
Свинец-204, свинец-206 и свинец-207 используются, чтобы измерить уровни свинца в крови. | |
► К таблице выпускаемых изотопов
Металлургия свинца
Свинец — элемент периодической системы Менделеева. Имеет порядковый номер 82 и атомную массу 207,2. В природе находится в виде соединений, но встречаются и металлические самородки.
Физические свойства
Свинец представляет собой серебристо-белый металл с синеватым оттенком. На воздухе приобретает темно-серый цвет, покрываясь тонкой защитной пленкой оксида. Обладает высокой ковкостью. Температура плавления составляет 327,46 ˚C. Плотность в нормальных условиях — 11,336 г/см3. Он обладает низкой теплопроводностью. Например: у серебра этот показатель в 10 раз выше.
Химические свойства
Металл плохо растворяется в минеральных кислотах. В результате действия серной и соляной кислот на поверхности образуются труднорастворимые соли (PbCl2 иPbSO4), препятствующие проникновению химических реагентов. Лучше всего реакция проходит в разбавленном растворе азотной кислоты.
Pb + 4HNO3 = Pb(NO3)2 + 2NO2 + 2H2O
Для перевода в растворимое состояние также используют некрепкую уксусную кислоту. В результате образуется ацетат свинца.
Применение
Известно, что металл применялся еще в древности. Его использовали для изготовления монет, посуды, труб, элементов кровли и др. Ядовитые свойства свинца стали известны несколько позже и ему на смену пришли более безопасные материалы.
В современных реалиях основное применение металла — производство свинцовых аккумуляторов. Кроме этого, он востребован для выплавки припоев разных марок, сплавов на основе меди, олова, цинка, алюминия и др.
Из свинца выполняются листовые материалы и трубы для химического производства, оболочки для электрических кабелей. Значительный процент от общего объема выплавленного свинца расходуется для производства тетраэтилсвинца.
Это соединение повышает значение полезного использования бензина в двигателях внутреннего сгорания. Еще одним потребителем соединений свинца является производство красок и химических реактивов. Свойство металла поглощать излучение используется для защиты от радиации.
Получение
Для выплавки свинца в основном используют руды. Кроме этого, почти половину металла извлекают из вторичного сырья: отработанных аккумуляторов, шламов и шлаков, полученных в цветной металлургии. Природные источники, содержащие свинец, которые подходят для промышленной переработки — галенит, церрусит и англезит. Помимо, интересующего элемента они содержат в значительных количествах медь, цинк и железо, в виде примесей — висмут, сурьму, мышьяк, селен, германий, индий и др. Также в полиметаллических рудах встречаются драгоценные металлы: золото и серебро. Содержание свинца в исходном сырье обычно не превышает 8—9 %. Этого недостаточно, поэтому необходимо предварительное обогащение. Процесс проводят методом селективной флотации. Такой способ позволяет получить концентраты свинца, меди, цинка, железа и бария. Не поддающаяся извлечению часть элементов остается в отвалах обедненной руды.
На металлургическую переплавку отправляют концентрат. Процентное содержание, которого приведено в таблице.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Примеси драгоценных металлов составляют до 5 кг/т.
Основную массу свинца получают по технологии, включающей несколько стадий.
- Подготовка шихты. На этом этапе важно добиться однородности исходного материала, как по химическому составу, так и по размеру кусков. Предварительный расчет должен создать условия для саморасплавления агломерата. Такой прием позволяет опустить процесс введения флюса.
- Обжиг для агломерации. Его цель добиться перевода сульфидных форм соединений в оксидные. Вместе с этим происходит окускование материала, что позволит плавить его в шахтной печи. Для этих целей используют устройства специального назначения. Химизм процесса описывается уравнениями:
2PbS + 3O2 = 2PbO + 2SO2
2PbO + PbS = 3Pb + SO2
Значение извлечения свинца в агломерат находится в пределах от 99,5 до 99,7 %.
- Плавка шахтным способом. Ее задача добиться максимального извлечения свинца и сопутствующих драгоценных металлов. Возможные примеси цинка необходимо перевести в отходы. Плавильный агрегат мало чем отличается от подобных печей в производстве меди и никеля. Функции восстановителя выполняет кокс. Он создает достаточную атмосферу для протекания реакции:
PbO + CO = Pb + CO2
Другие химические соединения (например: оксид железа (II) и оксид цинка) не восстанавливаются при таких условиях и поэтому переходят в шлак.
- Процесс огневого рафинирования чернового продукта. Получаемый свинец не может похвастаться чистотой. В нем содержится ряд примесей. Их сумма колеблется от 2 до 10 %.
Для достижения, заявленных в марках ГОСТа, значений, требуется несколько этапов очистки чернового свинца. В процессе происходит удаление групп элементов: меди и теллура; мышьяка, сурьмы, олова; цинка и висмута; кальция и магния.
В ходе технологического процесса происходит выделение газообразного оксида серы (IV), который улавливают и используют в производстве серной кислоты. Пылевые отходы возвращают на стадию агломерации. Штейн служит сырьем в получении меди, а шлаки отправляют на пирометаллургию, для извлечения ценных компонентов. Их расплавляют и при температуре от 1200 до 1300 ˚C и продувают через слой подходящий восстановитель. В результате расплавленные металлические частицы удаляют из пространства печи газообразным потоком, который поступает в охладительную камеру. Мелкая пыль удерживается с помощью фильтров, а крупная фракция остается в котле-утилизаторе. Показатель извлечения из шлака для цинка и свинца колеблется от 85 до 95 %.
|
МЕХАНІЗМИ ІНТОКСИКАЦІЇ УДК 615.9/546.81:616.057/612.3:001.5
С.П. Луговской, к.м.н., Л.А. Легкоступ НИИ медицины труда АМН Украины, г. Киев,
Свинец как глобальный загрязнитель среды Свинец как загрязнитель окружающей среды и классический токсикант продолжает оставаться в центре внимания не только экологов, токсикологов и гигиенистов, но также патологов и клиницистов, представляющих разные области медицины и биологии. Это обусловлено тем, что за сравнительно короткий исторический период содержание этого потенциально токсичного химического вещества (ПТХВ) в окружающей среде увеличилось в десятки и даже сотни раз, а главное, приобрелo глобальный характер. Свидетельством этому служат результаты исследований «возрастных» слоёв арктического льда и многочисленных археологических останков [1, 2]. Свинец и его соединения среди представителей многочисленного класса тяжелый металлов считаются одними из наиболее токсичных. О токсическом действии металла и его соединений на организм человека известно с античных времен. Результаты исследований костных останков древних римлян обнаружили в них высокие концентрации этого металла, что свидетельствует о свинцовом массовом отравлении жителей древнего Рима. В недавней публикации Б.А. Курлянского о направлениях международной деятельности в области химической безопасности особо подчеркивалось, что важнейшим критерием приоритетности служит распространенность химических веществ в окружающей среде. Среди всех классов ПТХВ ведущее место занимают тяжелые металлы, а среди них, в первую очередь, свинец [3]. Общие природные запасы свинца на планете оцениваются в 100 млн. т [4,5]. Из этого естественного источника в окружающую среду ежегодно поступает до 210 тыс. т металла, преимущественно в виде силикатной пыли почвы, вулканического дыма, морских солевых аэрозолей и метеоритной пыли [4]. Воды мирового океана содержат 41,1 млн. т свинца при средней его концентрации в морской воде 0,03 мкг/л. Среднее содержание металла в воде рек колеблется от 0,2 до 8,7 мкг/л, а ежегодный вынос свинца в океан вместе с речными стоками составляет около 37 тыс. т [5]. В современных условиях промышленные предприятия являются одним из ведущих источников антропогенного загрязнения окружающей среды свинцом. Ежегодные техногенные выбросы металла в окружающую среду, в среднем, составляют 400000 т в год [6]. В отдельных индустриально развитых странах (Россия) в окружающую среду ежегодно с промышленными выбросами поступает от 0,6 до 1,4 тыс. т. свинца, со сточными водами — около 0,05 тыс. т., от автотранспорта — около 4 тыс. т. [7]. Установлено, что в непосредственной близости от предприятий черной и цветной металлургии, теплоэнергетики, нефтехимии, электротехнических предприятий, машиностроения и пр. образуются обширные геохимические провинции с повышенным содержанием этого металла в объектах окружающей среды [7, 8, 9]. В результате водной и воздушной трансгрессии свинцом могут загрязняться территории, находящиеся на значительном расстоянии от источника выбросов. В современной промышленности и быту наиболее часто используются следующие соединения свинца: оксид свинца (свинцовый глет), свинцовый сурик, хромат свинца (крокоит или желтый крон), металлический свинец, свинцовые сплавы и припои, а также органические соединения свинца в виде тетраэтил- и тетраметил свинца. Неорганические соединения металла используются для производства антикоррозионных покрытий и красящих пигментов, лакокрасочной продукции и пр. Металлический свинец и его оксиды используют для производства аккумуляторных батарей и электрических кабелей. Оксиды свинца — в производстве стекла, глазури и полиграфии. Органические соединения металла используют как компоненты антидетонационных присадок к топливу для двигателей внутреннего сгорания [4]. Загрязнение производственной среды свинцом в современных условиях происходит в результате добычи и переработки природного сырья, при выплавке металлического свинца и производстве его сплавов, неорганических и органических соединений, пигментов, красок и пр. Среди производственных и технологических процессов, которые приводят к выбросам свинца во внешнюю среду, особое место занимают процессы дробления и измельчения сырья; плавление и литьё; обрубка, шлифовка и полировка металлоизделий; травление; гальванические процессы и лужение; приготовление шихты и её обжиг; сушка, покраска изделий и многое др. Известно, что в результате производственных процессов, где используется свинец, характерно его воздействие на человека в виде аэрозолей, образующихся вследствие конденсации и окисления паров на воздухе [5, 10, 11]. В объектах внешней среды свинец обычно содержится в питьевой воде в концентрациях от 0,01 до 0,03 мг/л, в атмосферном воздухе — 0,03-0,1 мкг/м3; в почве — 10 мкг/г. При этом среднее содержание свинца в почве обычно коррелирует с его содержанием в органах и тканях диких и домашних животных (печень, почки, легкие, скелет, волосы, от 2,3 до 35 мкг/г), что может рассматриваться как возможное поступление этого металла в организм преимущественно с пищей. Содержание свинца в пищевых продуктах в норме колеблется от 0,02 до 3,0 мг/кг сырой массы [4, 5]. Основными путями поступления свинца в организм человека из объектов внешней среды является ингаляционный путь, вместе с вдыхаемым воздухом и энтеральный путь, с питьевой водой и продуктами питания. При этом техногенные выбросы металла обычно приводят к его многократному повышению в объектах окружающей среды, что часто обуславливает повышение его содержания в продуктах питания [12, 13]. Среднее содержание свинца в организме взрослого человека в норме составляет около 130 мг, из них около 110 мг содержится в скелете. По данным А.И. Войнар, общее поступление свинца в организм человека составляет в среднем 0,4 мг/сутки. Известно, что большая часть металла, от 44 до 100 %, поступает в организм через желудочно-кишечный тракт вместе с продуктами питания. Около 0,01-0,024 мг/сут поступает в организм с питьевой водой [14]. При условии содержания этого металла в атмосферном воздухе городов до 3,0 мкг/м3 его поступление в организм человека через органы дыхания может составить около 0,01-0,1 мг/сут. По данным Л.Р. Ноздрюхиной, в организм человека с пищей поступает 0,22 мг, с водой 0,1 мг и пылью 0,08 мг свинца [15]. Курильщики способны дополнительно потреблять по 1 мкг свинца на 1 выкуренную сигарету, в результате чего концентрация этого металла в крови у них несколько выше, чем у некурящих людей [16]. В растениях, организме животных и человека наряду со стабильным свинцом обнаруживаются и нестабильные изотопы этого металла в виде 210Pb. Установлено, что основным его источником поступления в организм является радон (222Rn), постоянно выделяющийся из почвы. В регионах с нормальным естественным радиационным фоном поступление 210Pb с пищей составляет около 0,11 Бк/сут. Доказано, что с морепродуктами в организм человека способно поступать до 0,36 Бк/сут 210Pb [16, 17]. У жителей континентальных районов северных широт концентрация 210Pb в костной золе в среднем составляет 0,55510-2 Бк/г, что соответствует общему его содержанию в скелете на уровне 14,8 Бк. При этом, около 12,14 Бк 210Pb в скелете накапливается за счет пищи и 2,81 Бк за счет вдыхания из атмосферного воздуха. У рабочих некоторых профессиональных групп, таких как горняки железорудных шахт, которые не имеют непосредственного профессионального контакта со свинцом и его соединениями, но подвергаются действию высоких уровней 222Rn и его дочерних продуктов распада, присутствующих в рудничной атмосфере выявлено носительство свинца в крови, на уровне «настораживающего» и даже «опасного». Носительство свинца в крови обнаруживается также и у лиц, принимавших участие в ликвидации последствий аварии на ЧАЭС в 1996-1997 гг. [18]. Установлено, что в результате распада 222Rn образуются звенья коротко- и долгоживущих радионуклидов, среди которых до 50 % объемной доли могут составлять изотопы свинца [19]. Избыточные концентрации металла, поступающие в организм с продуктами питания растительного происхождения, были обнаружены в результате выращивания их на открытом грунте, где длительно хранились боевые снаряды, изготовленные из свинца [20]. Клиническая картина свинцового поражения желудочно-кишечного тракта Клиническая картина острого и хронического сатурнизма характеризуется наличием ряда синдромов, среди которых ведущее место занимают изменения органов желудочно-кишечного тракта (ЖКТ) [21, 22, 23]. При сатурнизме расстройства ЖКТ выражаются нарушением желудочной секреции, в связи с чем может наблюдаться как повышенная, так и пониженная секретообразующая функция желудка. Часто отмечаются явления дискинезии тонкого и толстого кишечника, сопровождающиеся расстройствами всасывательной и моторно-эвакуаторной функции. За счет ингибирующего действия свинца на кишечные ферменты нарушаются процессы пристеночного пищеварения. Крайним проявлением патологии ЖКТ при свинцовой интоксикации является кишечная колика. Клинически она характеризуется появлением резких болей в животе, стойким запором, подъемом артериального давления, повышением температуры тела, умеренным лейкоцитозом, появлением темно-красной окраски мочи за счет присутствия копропорфирина и др. При свинцовой интоксикации в патологический процесс часто вовлекается печень. За счет энзимопатического действия свинца нередко развивается токсический гепатит, что приводит к выраженной функциональной недостаточности органа [24]. В современных условиях выраженные формы свинцовой колики встречаются крайне редко. В большинстве случаев патология ЖКТ у лиц, контактирующих со свинцом, проявляется в виде хронического гастрита, дуоденита и еюнита, диспепсии и хронического гепатита. При этом закономерно прослеживается связь частоты выявляемой патологи от возраста рабочих, их производственного стажа, содержания свинца в объектах окружающей среды и биосубстратах [22]. Как было установлено, растворимость соединений свинца, а также состояние секретообразующей функции органов ЖКТ способны взаимно влиять друг на друга [6, 11, 24]. Морфологические исследования биоптатов тонкой кишки лиц с клиническими признаками профессионального сатурнизма выявили атрофию слизистой оболочки (СО) в двенадцатиперстной и тощей кишках в виде полиморфизма кишечных ворсинок. Гипосекреторное состояние тонкого кишечника морфологически характеризовалось гиперплазией и уменьшением числа бокаловидных клеток и клеток Панета в эпителиальном пласте. Эпителий СО кишки характеризовался вакуольной дистрофией и отеком цитоплазмы клеток с формированием в них очагов парциальных некрозов. В митохондриях эпителиоцитов наблюдались явления отека, сопровождавшиеся их набуханием, просветлением матрикса, дископлексацией и дисорганизацией крист [24, 25]. Наряду с изменениями в эпителиальном пласте при свинцовой интоксикации в СО тонкой кишки наблюдались структурно-функциональные нарушения собственной пластинки в виде склеротических изменений различной интенсивности. В экспериментах было показано, что при избытке свинца в организме происходит изменение химизма соединительной ткани. Это приводит к накоплению в ней гликозаминогликанов типа хондроитинсульфата, уплотнению основного вещества, коллагенизации аргирофильных волокон и развитию склероза [26]. Сосудистые нарушения при избытке свинца часто обусловлены регулирующим влиянием металла на активность протеинкиназы эндотелия сосудов, которое особо выражено в момент репарации поврежденного эндотелиального пласта [27, 28]. Всасывание свинца в желудочно-кишечном тракте В ЖКТ свинец попадает с питьевой водой и продуктами питания. Значительные количества ингалированных частичек свинца могут задерживаться слизью в верхних дыхательных путях и продвигаться мерцательным эпителием бронхов в носоглотку, где происходит их заглатывание, что, обуславливает энтеральный путь поступления этого металла в организм. Известно, что свинец в ЖКТ всасывается преимущественно путем пассивной и облегченной диффузии. В тонкой кишке всасывание металла происходит при участии кальцийсвязывающего белка [6]. В меньших количествах, чем в тонком кишечнике, металл всасывается в толстой кишке, преимущественно, при участии механизмов пассивной диффузии. На процесс всасывания металла и его соединений влияют состояние голода и сытости. Используя ряд функциональных методов, было показано, что после еды в тонком кишечнике всасывается 3 % введенного в желудок металла, а при введении его натощак — 60 %. У голодных крыс в кишечнике всасывается в 2 раза больше свинца, чем у накормленных [24]. Всасывание свинца различными отделами кишечника была продемонстрировано в экспериментах на крысах с использованием модели вывернутых мешочков отрезков кишки. Было выявлено, что наибольшие количества металла (702,58±40,16 нмоль/г сырой массы) всасывались в тощей кишке, меньше (646,74±28,22 нмоль/г сырой массы) — в двенадцатиперстной. Самые низкие показатели всасывания свинца (520,83±21,25 нмоль/г сырой массы) были выявлены в подвздошной кишке. На всасывание металла влияли предварительные нагрузки животных микроэлементами железа и цинка, которые заметно снижали его связывание всеми отделами кишечника. Вероятно, что эти микроэлементы благодаря физико-химическим свойствам способны конкурировать за активные центры связывания и переноса субстратов в СО. Было установлено, что по сравнению с изолированным поступлением в желудок крыс исследуемых микроэлементов более эффективно предупреждало всасывание свинца в кишечнике совместное их поступление в организм [29]. Данные современной литературы свидетельствуют о роли кальция в процессах всасывания свинца [30]. Имеются свидетельства о том, что увеличение внутриклеточного кальция приводит к насыщению центров связывания этого иона на молекулах кальмодулина, что повышает сродство последнего к внутриклеточному Са2+-насосу. Установлено, что кальмодулин является межклеточным рецептором и мощным модулятором ряда клеточных функций. Под контролем этого межклеточного мессенджера находится функция ряда клеточных ферментов таких, как аденилаткиназа, фосфодиэстераза, гуанилатциклаза, Са2+ зависимая АТФ-аза и протеинкиназа, фосфорилаза и фосфолипаза А2. Под регулирующим контролем этого белка в клетках происходят процессы фосфорилирования, высвобождение медиаторов, деполимеризация микротрубочек, нормальное функционирование цитоскелета и пр. Роль этого белка в процессах всасывания свинца кишечными эпителиоцитами обусловлена, вероятно, его локализацией в щеточной каёмке. При совместном поступлении в ЖКТ свинца и кальция он способен связывать равное количество ионов Ca2+ и Pb2+. Обмен кальция в организме регулируется витамином D3, который, одновременно способен повышать накопление свинца в тканях организма, усиливая его токсичность. Установлено, что при увеличении дозы витамина D3 в корме цыплят от 200 до 500 М.Е. на 1 кг рациона его метаболит 1,25-дигидроксивитамин D3 проявляет высокую активность в обеспечении эффекта кумуляции свинца [31]. Возможно, это объяснятся различной способностью кальция и свинца образовывать связи с различными лигандами. В настоящее время интенсивно изучается роль примембранного (пристеночного) слоя слизистых наложений и гликокаликса в процессе всасывания различных металлов. Показано, что эти структуры обладают высокой сорбционной ёмкостью за счет большого числа заряженных групп в гликопротеидах и характеризуются большой гетерогенностью, а также определенной специфичностью связывающих мест [32]. Используя технику сканирующей электронной микроскопии было показано, что в гликокаликсе центры связывания для свинца пространственно разобщены с центрами связывания для цинка и кадмия, но имеют общие с кальцием и ртутью [33]. Экспериментальные данные, характеризующие метаболизм свинца в желудочно-кишечном тракте Одну из основных ролей в СО кишки играет структурно-функциональный микрорайон, который включает в себя эпителиальную выстилку, базальные мембраны, кровеносные и лимфатические капилляры, интерстициальные пространства, а также клетки интерстиция и паренхимы. Известно, что эта структурно-функциональная единица СО кишки выполняет важную функцию поддержания трофического оптимума для жизнедеятельности клеток паренхимы, их антигенного постоянства, защиту от возможных повреждений продуктами собственного метаболизма и различными факторами, поступающими как из внешней среды, так и циркулирующих в крови [34]. Метаболизм свинца в кишечном эпителиоците, как и многих других металлов, изучен недостаточно. С учетом разрозненных данных судьба металла, поступившего в кишечный эпителиоцит, может быть представлена следующим образом. Везикулы, содержащие комплекс металла с белком, сливаются с базолатеральной мембраной эпителиоцита и содержимое поступает в межклеточное пространство, проникает (посредством диффузии) через базальную мембрану в собственную пластинку СО тонкой кишки и дальше в кровеносные капилляры путём микропиноцитоза через фенестры эндотелиальных клеток и межклеточные пространства. Кровь, содержащая металл и оттекающая от тонкой кишки, поступает в воротную вену и далее в печень. В этом органе свинец попадает в гепатоциты, где преимущественно накапливается в ядерной, микросомальной и митохондрально-лизосомальной фракциях. О том, что свинец имеет высокую тропность к митохондриям свидетельствуют данные о его обнаружении в этих субклеточных структурах в виде комплексов с фосфатами и кальцием [6]. Расчеты показали, что на фракцию митохондрий гепатоцитов приходится около 86 нг свинца, в то время, как на фракцию микросом, лишь 35 нг [11]. О прочности фиксации свинца в различных внутриклеточных компартментах свидетельствует ряд экспериментальных данных, которые демонстрируют возможность удаления из ядерной фракции клеток за 1 час до 80 % содержащегося в ней металла. Из митохондрий за это время удаляется до 20 % свинца. При наличии убедительных сведений о преимущественном накоплении свинца в клеточных ядрах, публикации последних лет все же относят свинец к металлам с преимущественно внеядерной локализацией (митохондрии, лизосомы, комплекс Гольджи) [35]. В гепатоцитах свинец частично метаболизируется под действием внутриклеточных ферментов и образует комплексные соединения с желчными кислотами. В этом виде он с током желчи выделяется в просвет тонкого кишечника. С.D.Klassen et al. было показано, что внутривенное введение свинца в организм приводит к 40-100-кратному повышению его концентрации в желчи, по сравнению с плазмой крови [36]. Это дало возможность предположить, что свинец в комплексе с желчными кислотами приобретает свойства для активного его всасывания в кишечнике. Из кишечника, обычно, часть металла выводится с фекалиями, а часть всасывается вновь, обеспечивая тем самым процесс печеночно-кишечной рециркуляции. Часть металла при прохождении через кишечные эпителиоциты попадает в лизосомы клеток, где находятся металлосвязывающие протеины типа металлотионеинов [37]. Вместе с отторгающимися с поверхности ворсин эпителиоцитами комплексы металла попадают в просвет кишечника, где определенная его часть всасывается. Не всосавшаяся в кишечнике часть свинца выводится из организма с фекалиями. Таким образом, слущенные с верхушек ворсин кишечные эпителиоциты способны осуществлять механизм элиминации избытка свинца из организма. Существует предположение, что в процессах элиминации металла большую роль играют бокаловидные клетки и клетки Панета [24]. Последние в своих секреторных гранулах содержат большие количества эссенциального цинка, природного антагониста свинца, дефицит которого часто обнаруживается в организме при сатурнизме [6, 8]. Свинец, поступающий с пищей и водой, способен накапливаться в слюнных железах. Показано, что при введении ацетата свинца с питьевой водой крысам в концентрациях 50 мкг/л, 500 мг/л и 1000 мг/л в течение 6 недель в слюнных железах увеличивалось содержание металла, по сравнению с контролем от 3 до 10 раз. При этом избыток свинца в слюнных железах приводил к нарушению секретообразующей функции альвеолярных клеток железы и выраженным ультраструктурным изменениям в митохондриях [38]. Кишечный эпителий способен повреждаться под действием экзогенного свинца. Эксперименты, проведенные на культуре изолированных энтероцитов, показали, что цитотоксическим действием на культуру клеток линии I-407 (при 48-и часовой инкубации) обладает нитрат свинца в дозе 1,99 ммоль. При этом, цитоксический эффект проявлялся выраженными дистрофическими изменениями клеток монослоя и снижением в них содержания глютатиона, что может причиной нарушения антиоксидантных функций [39]. Деструктивные изменения клеток при избытке свинца в организме связывают с универсальным механизмом активации ПОЛ. Было показано, что свинец, наряду с другими металлами и некоторыми органическими полютантами, способен инициировать образование реактивных форм кислорода в гепатоцитах. В результате чего отмечалась активация процессов ПОЛ с повреждением внутриклеточных мембранных структур (митохондрии, микросомы и др.) [40]. Экспериментально было показано, что свинец способен инициировать особый вид клеточной гибели — апоптоз [41]. Одним из механизмов его индукции, предположительно является активация свинцом Са2+, Mg2+-зависимой эндонуклеазы [42]. Показано, что деградация ДНК и апоптоз возникают при повышении концентрации внутриклеточного Са2+. Это может приводить к нарушению Са2+ — зависимых механизмов репликации. Существуют доказательства и того, что свинец индуцирует апоптоз вследствие блокады клеточных Са2+-каналов [43]. Это еще раз подчеркивает тесноту связи между биологической ролью кальция и свинца в живом организме. До настоящего времени не ясен вопрос о роли свинца в механизмах его токсического действия на геном клетки. Последние достижения молекулярной биологии показали значимость взаимоотношений типа «нутриенты — геном — развитие клеток» [35]. Цинксодержащие клетки являются мишенью биологических эффектов свинца. К числу последних в полной мере относятся клетки Панета СО тонкой кишки и В-клетки островков Лангерганса поджелудочной железы. Исследованиями показано, что избыток свинца в организме способен приводить к изменениям структуры и функции цинксодержащих клеток. Длительная лабильная «загрузка» организма малыми дозами свинца (1/50 ЛД50), обычно сопровождается угнетением, а затем восстановлением нарушенных функций, которое, вероятно, происходит за счет включения механизмов вторичной адаптации [44]. Современные биологические средства торможения свинцовой интоксикации, как правило, направлены не только на коррекцию ключевых обменных нарушений, «токсикодинамическая биопрофилактика», но и на снижение задержки свинца в организме, «токсикокинетическая биопрофилактика» [45, 46]. Для систематического использования в целях биопропрофилактики свинцовой интоксикации перспективными в настоящее время являются энтеросорбенты растительного происхождения. Среди последних особое место принадлежит пектинам. Перспективность их использования для биопрофилактики профессионального и экологически обусловленного сатурнизма бесспорна. Каковы же ближайшие перспективы и основные направления изучения воздействия свинца на структурно-функциональное состояние системы пищеварения, которая занимает в живом организме важное место в обеспечении поступления, аккумуляции, метаболизации и элиминации этого металла? Среди них, на наш взгляд, следует прежде всего выделить дальнейшие исследования по изучению функциональных и структурных основ всасывания, метаболизации и элиминации свинца. Также оправданным представляется изучение структурных основ адаптации и компенсации нарушенных функций на разных уровнях организации живого организма (молекулярном, субклеточном, клеточном, тканевом и др.). Перспективными являются исследования по установлению структурно-функциональных критериев напряжения адаптационно-защитных механизмов в ответ на экзогенное воздействие металла, разработка адекватных и чувствительных методов, показателей и тестов для выявления эффектов, развивающихся в органах и тканях ЖКТ под влиянием малых доз и концентраций свинца, а также анализ возрастных особенностей реакций организма, с последующей разработкой и поиском новых, эффективных методов диагностики и средств биологической профилактики профессионально и экологически обусловленного сатурнизма. Рассмотренная в настоящем обзоре проблема относится к числу достаточно универсальных. Примечательно также, что в целом исследования в области токсикологии тяжелых металлов были определены в качестве фундаментальных на І съезде токсикологов Украины, состоявшемся в октябре 2001 г. в Киеве [47].
Литература | Зміст | |
Влияние различных систем удобрения на накопление тяжелых металлов в сельскохозяйственной продукции
Белоус Н.М. Влияние различных систем удобрения на накопление тяжелых металлов в сельскохозяйственной продукции / Н.М. Белоус, В.Ф. Шаповалов, Ф.В. Моисеенко, М.Г. Драганская // Вестник Брянской государственной сельскохозяйственной академии.- Брянск, [2006].- С. 22-29
На примере Новозыбковского района.
— Экология сельского хозяйства области
Н. М. Белоус, В. Ф.Шаповалов, Ф. В. Моисеенко, М. Г. Драганская
Брянская государственная сельскохозяйственная академия
Новозыбковская государственная сельскохозяйственная опытная станция ВНИИА
им. Д.Н. Прянишникова.
В процессах современной хозяйственной деятельности населения Земли происходит загрязнение окружающей среды различными химическими средствами, в том числе токсическими — токсикантами.
По степени опасности химические вещества подразделяются на три класса (ГОСТ 17.4.1.02-83): 1 — высоко опасные, 2 — умеренно опасные, 3 — малоопасные (табл. 1).
Таблица 1
Отнесение химических веществ, попадающих в почву из выбросов, отбросов, отходов к классам опасности
|
Класс опасности
|
Химическое вещество
|
|
1
|
Мышьяк, кадмий, ртуть, селен, свинец, цинк, фтор, бена (а) пирен.
|
|
2
|
Бор, кобальт, никель, молибден, медь, сурьма, хром.
|
|
3
|
Барий, ванадий, вольфрам, марганец, стронций, ацетофенон.
|
Установлено, что наиболее опасными токсикантами, оказывающими непосредственное отрицательное влияние на человека и животного, а также вызывающими в их организме синергетические эффекты являются тяжелые металлы [1].
Основными загрязнителями среди тяжелых металлов являются кадмий, ртуть, свинец, мышьяк, хром. Они оказывают негативное влияние на урожайность сельскохозяйственных культур, ухудшают качество продукции, нарушают системы иммунных барьеров, что приводит к поражению растений болезнями и вредителями. Существенное ингибирование ферментов в почве вызывают также серебро, никель и цинк.
Принято считать действие тяжелых металлов на сельскохозяйственные культуры отрицательным, если урожай достоверно снижается на 10% и более [2].
Тяжелые металлы — группа химических элементов, имеющих плотность более 5 г/см3 или относительную атомную массу более 40. Однако имеется группа металлов, за которыми закрепилось только одно негативное понятие — «тяжелые» в смысле «токсичные». Эту группу составляют ртуть, кадмий и свинец.
Тяжелые металлы принципиально изменяют поступление в растения микроэлементов, выполняющих важные биохимические функции, органически связанные с повышением устойчивости организма к ионизирующему облучению. Это обстоятельство имеет принципиальное значение для зон радиоактивного загрязнения. Принятые в настоящее время предельно-допустимые концентрации (ПДК) содержания тяжелых металлов в почах не учитывают эти аспекты, и базируются лишь на санитарно-гигиенических критериях.
Ртуть оказывается в культурном ландшафте в результате использования ее соединений в качестве фунгицидов.
Поступление кадмия может быть связано с широким использованием в сельском хозяйстве фосфатов.
Свинец поставляется в агросферу в основном с отработанными газами двигателей внутреннего сгорания автомобильного транспорта.
Однако во всех случаях сельскохозяйственные территории подвергаются локальному загрязнению за счет автомобильного транспорта. При этом необходимо учитывать, что загрязнение почвенного покрова происходит, как правило, полуэлементным составом токсических веществ.
Свинец аккумулируется почвой и растениями. Токсическое действие его на растения проявляется с концентрации порядка 5 мг/кг почвы и выше. Однако соединения свинца вредны для растений во всех концентрациях.
Кадмий характеризуется высокой токсичностью относительно к почвенной биоте и фитотоксичностью. Высокая фитотоксичность кадмия объясняется в первую очередь тем, что он может выступать в роли цинка во многих биохимических процессах, нарушая работу ферментов, связанных с дыханием и другими физиологическими процессами (карбоангидра-за, различные дегидрогеназы и фосфатозы), а также участвующих в белковом обмене (про-теиназа и пептидаза), ферментов нуклеинового обмена и др. Как химический аналог цинка, кадмий заменяет его в анаиматической системе, необходимой для фосфоритования глюкозы и сопровождающей процесс образования и потребления углеводов.
Замещение цинка кадмием в растительном организме приводит к цинковой недостаточности, что в свою очередь вызывает угнетение и гибель растений. Высокой чувствительностью к недостатку цинка характеризуются большинство плодовых культур: вишня, груша, яблони; из сельскохозяйственных культур — луговые травы, морковь, редька, фасоль, горох, шпинат, кукуруза. Это обстоятельство необходимо учитывать для почв песчаных, малогуму-сированных, нуждающихся в микроэлементах [1].
Многие исследователи делают вывод, что предельная концентрация кадмия в почве, с учетом его токсического действия на микробиологические процессы и снижение уровня плодородия почв должна находиться, в зависимости от состояния естественного уровня плодородия, в пределах от 0,2 до 2,0 мг/кг почвы. При этом в одних и тех же условиях разные виды растений усваивают из почвы различные количества свинца и кадмия. Отмечается повышенное накопление свинца и кадмия зеленым луком, морковью, свеклой, капустой, картофелем, помидорами [9].
Изложенное выше указывает на необходимость проведения детального обследования сферы сельскохозяйственного производства на загрязненных радионуклидами почвах по содержанию свинца и кадмия в продукции, производимой в этих условиях.
Тяжелые металлы поступают в сельскохозяйственные растения следующими путями:
С осадками сточных вод, сточными водами и бытовым мусором [1,2,3].
Основным источником атмосферного загрязнения, связанного с деятельностью человека, являются тепловые и иные электростанции (27%) предприятия черной металлургии (24,3%), предприятия по добыче нефти (15,5%), транспорт (13,1), предприятия цветной металлургии (10,5%), а также предприятия по добыче и изготовлению строительных материалов (8,1%) [1].
Тяжелые металлы в минеральных удобрениях являются естественными примесями, содержащимися в горнорудах. Наиболее существенными как по набору, так и по концентрациям примесей тяжелых металлов являются фосфорные удобрения. Среди элементов, содержащихся в простом суперфосфате, могут присутствовать кадмий, хром, кобальт, медь, свинец, никель, ванадий, цинк.
Пестициды представлены всеми химическими соединениями, преимущественно органическими, некоторые из них являются органоминеральными или чисто минеральными веществами. Отдельные пестициды содержат в своем составе тяжелые металлы, такие, как ртуть, медь, цинк, железо.
Очистка сточных вод канализаций крупных городов и районных центров с развитой промышленностью дает большое количество осадка, состоящего из органического вещества с различными минеральными включениями. Органическое вещество коммунальных стоков обладает способностью поглощать из воды катионы солей тяжелых металлов. В осадках сточных вод могут находиться такие элементы как: марганец, кобальт, молибден, ртуть, барий, свинец, цинк, медь, никель, кадмий, хром, серебро, олово [1,3].
Из отходов промышленности, используемых в качестве удобрений, необходимо назвать различные шлаки, золу каменного угля и сланца, фосфогипс, цементную пыль. В отходах промышленности, в частности, в составах шлаков, содержатся такие тяжелые металлы, как стронций и хром.
Интенсивное использование минеральных, органических удобрений и мелиорантов (извести) изменяет химию элементов в почве, их подвижность. Так, физиологически кислые минеральные удобрения повышают подвижность кадмия и цинка в почвах, физиологически щелочные — снижают. Внесение в почву органических удобрений и извести уменьшает подвижность тяжелых металлов из почвы. Обычно прирост биомассы растений определяет поступление металлов из почвы, в результате концентрации их в растениях уменьшается, а вынос из почвы увеличивается.
Минздравом России 27.12.1994 года были утверждены Гигиенические нормативы ГН 2.1.7.020-94 «Ориентировочно — допустимые концентрации (ОДК) тяжелых металлов и мышьяка в почвах». Эти нормативы дифференцированы в разрезе типов почв. В таблице 2 представлена группировка песчаных и супесчаных почв.
Таблица 2
Группировка песчаных и супесчаных почв для агроэкологической оценки по содержанию валовых форм тяжелых металлов и мышьяка, мг/кг
(Максимов и др., 2002г).
|
№№
|
Элемент
|
Класс
|
Группы
| ||||
|
пп
|
опасности
|
1
|
5
|
3
|
4
|
5
| |
|
1
|
Мышьяк
|
1
|
<1,0
|
1,0-2,0
|
2,1-4,0
|
4,1-6,0
|
>6,0
|
|
2
|
Ртуть
|
1
|
<1,0
|
1,0-2,1
|
2,2-4,2
|
4,3-6,2
|
>6,2
|
|
3
|
Свинец
|
1
|
<16,0
|
16,0-32,0
|
32,1-64,0
|
64,1-96,0
|
>96,0
|
|
4
|
Цинк
|
1
|
<27,0
|
27,0-55,0
|
55,1-110
|
110,1-165
|
>165
|
|
5
|
Кадмий
|
1
|
<0,25
|
0,25-0,50
|
0,51-1,00
|
1,01-1,50
|
>1,5
|
|
б
|
Медь
|
2
|
<16,0
|
16,0-33,0
|
33,1-165
|
165,1-330
|
>330
|
|
7
|
Никель
|
2
|
<10,0
|
10,0-20,0
|
20Д-100
|
100,1-200
|
>200
|
|
8
|
Хром**
|
2
|
<50,0
|
50,0-100
|
101-500
|
501-1000
|
>1000
|
Примечание: * — численное значение верхней границы 2-й группы соответствует ПДК (ОДК) элемента в почвах. ** — только для трехвалентного хрома.
Градация почв по содержанию валовых и подвижных форм тяжелых металлов включает 5 групп. Первая группа соответствует концентрации элементов в почвах ниже 0,5 ПДК (ОДК), а численное значение верхней границы второй группы соответствует ПДК (ОДК) данного элемента в почве. Почвы, попавшие в третью группу, относятся к территории с неудовлетворительной экологической ситуацией. Четвертая группа характеризует почвы с чрезвычайной экологической ситуацией, а пятая — к зоне экологического бедствия. Почвы, относящиеся к первым трем группам агроэкологической оценки пригодны для возделывания всех сельскохозяйственных культур., однако на почвах, отнесенных к третьей группе, вся продукция растениеводства должна систематически контролироваться на содержание тяжелых металлов.
Почвы, относящиеся к зонам чрезвычайной и катастрофической экологической ситуации, пригодны для возделывания только технических культур по специальной технологии [2].
По данным агрохимической службы Минсельхоза России объем обследованных пахотных земель на содержание тяжелых металлов по отношению к их общей площади на 01.01.2000 г. в целом по Брянской области составляет (тыс. га): свинец -24,5 (1,97%), кадмий -24,5 (1,97%), цинк -24,5 (1,97%), медь -24,5 (1,97%). Следует отметить, что к наиболее загрязненным регионам имеющие загрязненные почвы относится Брянская область — по свинцу (АЗ%). по кадмию П .8%Y
Для того, чтобы проследить, как влияет систематическое внесение удобрений на изменение содержания микроэлементов и тяжелых металлов в дерново-подзолистой песчаной почве, в 1988 г. после четырех ротаций 8-польного севооборота был проведен анализ почвенных образцов на содержание подвижных форм микроэлементов (табл. 3).
Внесение удобрений не сказалось на содержание в почве железа, незначительно повысило содержание никеля и меди.
Возросло содержание цинка, марганца, стронция. Увеличение содержания цинка и марганца связано с внесением торфонавозного компоста, а стронция с внесением фосфоритной муки. Наблюдается увеличение содержания в почве под влиянием удобрений свинца ( с 0,07 до 0,14 мг/кг), хрома (с 0,26 до 0,43 мг/кг), кобальта (с 0,20 до 0,56 мг/кг) и особенно кадмия (с 0,06 до 0,044 мг/кг).
Таблица 4
Влияние длительного применения удобрений на содержание микроэлементов в дерново-подзолистой песчаной почве (мг/кг).
|
Вариант
|
Zn
|
Fe
|
Mn
|
Си
|
Pb
|
Ni
|
Cr
|
Co
|
Cd
|
Sr
|
|
Картофель
|
0,62
|
13,2
|
8,0
|
2,0
|
0,07
|
0,24
|
0,26
|
0,20
|
0,006
|
0,69
|
|
ТНК (80т/га) +СаСО3 (1,5т/га) +
N300P400K360
|
0,71
|
13,0
|
10,3
|
2,6
|
0,14
|
0,27
|
0,43
|
0,56
|
0,044
|
0,86
|
На содержание микроэлементов в почве оказывает влияние вносимый торфонавозный компост. Повышенное содержание цинка, марганца, меди, никеля обусловлено внесением повышенной дозы компоста -80 т/га в год, хрома, кобальта, кадмия — внесение фосфоритной муки.
Следует отметить, что содержание микроэлементов в почве ниже оптимального и их применение дает положительный эффект, что подтверждено дополнительными исследованиями. Содержание тяжелых металлов не достигает предельно допустимых концентраций.
Для разработки способов нейтрализации негативного развития процессов загрязнения проведены экспериментальные исследования в 1988-1991 гг. в опытном хозяйстве ВНИИА «Волна революции» Новозыбковского района Брянской области на дерново-слабоподзолистой песчаной почве. Агрохимические показатели плодородия почвы пахотного слоя на опытном участке перед закладкой опыта были следующими: содержание гумуса 1,66%, рН сол-6,6, сумма поглощенных оснований 5,14 м. экв. на 100 г почвы, подвижных форм фосфора 250 мг/кг и обменного калия 200 мг/кг. Опыт был заложен по схеме, разработанной В.Н. Перегудовым (1976,1983), на основе теории планирования многофакторного эксперимента, включает 32 варианта и представляет специальную выборку -1/8 часть полного факториального эксперимента 4x4x4x4. Каждый вид удобрений и их сочетаний изучали на двух фонах: естественный и сидеральный горчица белая, 15 т/га зеленой массы.
Размер делянок 60 м . Свинец и кадмий в пробах картофеля определяли после мокрого озоления на атомно-обсорбционном спектрометре.
Таблица 5
Влияние удобрений на содержание кадмия и свинца в клубнях картофеля, мг/ кг (в среднем за 1989-1991 гг.)
|
Вариант
|
Содержание кадмия
|
Содержание свинца
| |||
|
Естественный фон
|
Сидеральный фон
|
Естественный фон
|
Сидеральный фон
| ||
|
Контроль
|
0,025
|
0,100
|
0,83
|
1,08
| |
|
Навоз, 80 т/га
|
0,045
|
0,075
|
0,90
|
1,27
| |
|
N120
|
0,045
|
0,003
|
1,10
|
1,03
| |
|
Р120
|
0,055
|
0,025
|
0,68
|
0,74
| |
|
K120
|
0,060
|
0,025
|
1,00
|
1,07
| |
|
N120P120
|
0,065
|
0,023
|
0,68
|
0,72
| |
|
N120K120
|
0,080
|
0,065
|
0,59
|
1,00
| |
|
Р120К120
|
—
|
0,030
|
0,64
|
0,88
| |
|
N60P60K60
|
0,020
|
0,030
|
0,55
|
0,78
| |
|
N120P120K120
|
0,050
|
0,070
|
0,80
|
0,91
| |
|
N180P180K180
|
0,050
|
0,005
|
0,84
|
1,05
| |
|
В среднем по фону
|
0,045
|
0,041
|
0,78
|
0,96
| |
Как видно из данных таблицы 3 содержание кадмия в клубнях картофеля на естественном фоне находятся в пределах 0,020-0,80 мг/кг, на сидеральном фоне 0,005 -0,100 мг/кг сухой массы клубней.
В нескольких пробах концентрация кадмия была очень мала, что по вышеуказанной методике не определяли. При содержании абсолютно сухого вещества в клубнях картофеля 22,5% ПДК равняется 13,3 мг/кг. Следовательно, во всех вариантах практически все полученные результаты по содержанию кадмия значительно ниже этого показателя. Существенного влияния разных доз, сочетаний и соотношений удобрений и фона на накопление кадмия в клубнях картофеля также не отмечено.
Содержание свинца в высушенных пробах клубней картофеля колебалось в пределах 0,55-1,10 мг/кг, составляя в среднем за два года по естественному фону 0,78 мг/кг и сидеральному -0,96 мг/кг, то есть по сидерату отмечали повышение содержания свинца в клубнях картофеля на 18%.
В среднем за годы исследований максимальное (1,07 мг/кг) содержание свинца по сидеральному фону выявлено в варианте при внесении калийных удобрений К:2о, а по естественному фону 1,10 мг/кг в варианте N120, то есть во всех вариантах с удобрениями накопление свинца в клубнях картофеля было значительно ниже ПДК. Если рассматривать варианты опытов, то уменьшение содержания свинца в клубнях картофеля при применении удобрений на естественном фоне произошло в вариантах N60P60K60N60K60.
На сидеральном фоне во всех вариантах от внесения бесподстилочного навоза в дозе 80 т/га увеличивало содержание свинца в клубнях картофеля на 11%, на остальных вариантах опыта содержание свинца в клубнях картофеля незначительно уменьшилось.
На Новозыбковской опытной станции, расположенной на дерново-подзолистой песчаной почве с содержанием гумуса 1,4-1,7% (по Тюрину) рНсол-6,2-6,3, фосфора и калия по Кирсанову 28-35 и 5-7 мг на 100 г почвы, обозначилась необходимость изучения влияния органических удобрений в виде возрастающих доз подстилочного, бесподстилочного навоза КРС и свиного сбалансированных по азоту на поступление тяжелых металлов в клубни картофеля. В физическом весе одинарная доза подстилочного навоза -40 т/га, бесподстилочного навоза -35 т/га, свиного-32 т/га. Применяли все виды навоза в дозах от одной до трех под первую культуру севооборота картофель.
Тяжелые металлы особенно прочно фиксируются верхним горизонтом почвы богатым гумусом. Поэтому в детоксикации тяжелых металлов важная роль принадлежит органическим удобрениям, которые образуют с ними органо-минеральные соединения низкой растворимости.
В наших исследованиях увеличение органического вещества в почве, за счет высоких доз различных видов навоза, значительно в 2,4-7,0 раз уменьшило поступление тяжелых металлов в клубни картофеля.
Применение двойной дозы 80т/га подстилочного навоза снизило 2,4 раза, содержание меди, в 4,6 раза цинка и в 3,0 раза свинца. От применения трех доз подстилочного навоза (120 т/га) эффект снижения возрос: меди уменьшилось в 7 раз, а цинка и свинца не обнаружено по сравнению с вариантом без навоза (табл.5).
Таблица 5
Влияние видов и возрастающих доз навоза на содержание тяжелых металлов в клубнях картофеля, мг/кг (1996-2002гг).
|
Вариант
|
Подстилочный навоз КРС
|
Бесподстилочный навоз КРС
|
|
Свиной
|
навоз
| ||||
|
Сu
|
Zn
|
Рb
|
Сu
|
Zn
|
Рb
|
Сu
|
Zn
|
Рb
| |
|
Без на-воза-кон-троль
|
1,35
|
2,25
|
0,12
|
1,75
|
0,9
|
0,04
|
1,55
|
1,25
|
0,09
|
|
Две дозы
|
0,57
|
0,49
|
0,04
|
1,55
|
1,25
|
0,09
|
|
|
|
|
Три дозы
|
0,19
|
не обнаружено
|
не обнаружено
|
0,97
|
0,23
|
не обнаружено
|
0,86
|
0,39
|
не обнаружено
|
Бесподстилочный и свиной навоз в применении тройной дозы проявили эффект действия на понижение меди в 1,8 раза, цинка — в 3,9 и 3,2 раза, наличие свинца в клубнях картофеля не обнаружено.
Интенсивное использование минеральных, органических удобрений и особенно извести изменяет химию тяжелых металлов в почве и их подвижность [4,6,7,8]. Поэтому изучение этой проблемы весьма актуально. В связи с этим нами были проведены экспериментальные исследования в 1993-2003 гг. в полевом стационарном опыте на дерново-слабоподзолистой почве. Агрохимическая характеристика пахотного слоя почвы была следующая: содержание гумуса 1,56-1,76%, рНС0Л.-4,8-5,()6, содержание подвижных Р2О5 и К2О, оответственно 259-281 и 33-64 мг на 1 кг почвы соответственно.
Результаты наших исследований, полученные в полевых опытах, показали, что ртути и кобальта в продукции не обнаружено.
Содержание меди в сухом веществе картофеля колебалось в пределах 0,59 -1,92 и не превышало допустимого уровня (ГОСТ -96-5 мг/кг) (табл.6).
Таблица 6
Влияние удобрений на содержание тяжелых металлов в клубнях картофеля, мг/кг сухого вещества
|
Вариант
|
Содержание, мг/кг
| |||
|
медь
|
свинец
|
цинк
|
кадмий
| |
|
Контроль
|
1,64
|
0,12
|
7,0
|
0,015
|
|
Навоз 80 т/га
|
1,13
|
0,30
|
3,3
|
0,017
|
|
Навоз 40 т/га +N75P30K90
|
1,46
|
0,09
|
5,1
|
0,044
|
|
N75P30K90
|
1,92
|
0,13
|
5,9
|
0,056
|
|
N225P90K270
|
1,77
|
0,20
|
5,9
|
0,039
|
|
Навоз 40 т/га + N75P30K90+ пестициды
|
1,01
|
0,16
|
3,4
|
0,026
|
|
N75P30K90+ пестициды
|
0,74
|
0,31
|
2,7
|
0,016
|
|
N150P60K180+ пестициды
|
0,59
|
0,13
|
2,9
|
0,050
|
|
N225P90K270+ пестициды
|
0,90
|
0,29
|
5,6
|
0,025
|
Примечание. Пестициды: зенкор -1,0 кг/га, ридомил — 2,0 кг/га, актара -0,06 кг/га раундап -5,0 л/га.
Внесение подстилочного навоза КРС в дозе 80 т/га уменьшило поступление в клубни картофеля меди и цинка, а содержание свинца увеличилось на 0,18 мг/ка по сравнению с контролем. Совместное внесение половинной дозы подстилочного навоза и минеральных удобрений в дозе N75P30K90 увеличило поступление в клубни картофеля меди, цинка, а свинца значительно
уменьшилось по сравнению с полной дозой подстилочного навоза. При внесении минеральных удобрений в дозе N75P30K.90 концентрация меди, свинца цинка повысилась по сравнению с орга-но-минеральными удобрениями. Применение тройной дозы минеральных удобрений увеличило содержание меди и свинца в клубнях картофеля по сравнению с двойной NPK, а содержание цинка уменьшилось. Применение пестицидов обеспечивало снижение в клубнях картофеля меди и цинка, а содержание свинца увеличивалось. Наибольшее содержание цинка отмечено в контроле (7мг/кг), но и здесь оно не превышало ПДК (10мг/кг).
Количество кадмия в продукции, также не превышало ПДК (мг/кг). Контрольный вариант давал самое низкое содержание кадмия в продукции (0,015 мг/кг).
ПДК содержания исследуемых тяжелых металлов в зерне овса не была превышена ни в одном из вариантов (табл.7). Содержание меди в зерне овса при применении удобрений и пестицидов понижалось по отношению к контролю в 1,7-2,9 раза, свинца в 1,7-5,6, цинка в 1,2-1,9 раза.
Наибольшее накопление меди, свинца и цинка отмечено в контроле 4,68, 0,28 и 14,2 мг/кг. Пестициды увеличили содержание меди в зерне овса в 1,1 раза, а цинка в 1,3-1,6 раза. Содержание кадмия под действием средств химизации почти не изменялось.
Таблица 7 Влияние удобрений на содержание тяжелых металлов в зерне овса, мг/кг
|
Вариант
|
Содержание, мг/кг
| ||||
|
медь
|
свинец
|
цинк
|
|
кадмий
| |
|
Контроль — без удобрений
|
4,68
|
0,28
|
14,2
|
|
0,030
|
|
Последействие 80 т/га навоза
|
2,68
|
0,15
|
11,2
|
|
0,032
|
|
Последействие 40 т/га навоза +N55P20K50
|
1,79
|
0,14
|
8,8
|
|
0,021
|
|
N55P20K50
|
1,75
|
0,05
|
8,4
|
|
0,030
|
|
N110P40K100
|
1,61
|
0,05
|
8,4
|
|
0,028
|
|
N165P60K150
|
1,67
|
0,17
|
7,5
|
|
0,033
|
|
Последействие 40 т/га навоза + N55Р20К50+пестициды
|
1,92
|
0,09
|
12,5
|
|
0,030
|
|
N55Р20К50+пестициды
|
1,98
|
0,12
|
10,6
|
|
0,030
|
|
N110Р40К100+пестициды
|
1,74
|
0,08
|
11,7
|
|
0,024
|
|
N165P60K150+ пестициды
|
2,72
|
0,08
|
10,8
|
|
0,029
|
Пестициды: Диален -1,5 л/га, Байлетон -1,0 кг/га, Децис-0,3 л/га.
Примечание. Согласно ГОСТ-96, ПДК тяжелых металлов в зерне овса следующая: медь -10 мг/кг, свинец -0,5 мг/кг, цинк -50 мг/кг.
Как и на овсе, содержание меди в зерне озимой ржи было наибольшим в контрольном варианте (2,45 мг/кг). Применение средств химизации способствовало его снижению (табл. 8).
Внесение удобрений понижало содержание цинка в зерне, по отношению к контролю, в 1,4-3 раза, наибольшее снижение отмечено в варианте N210P90K180 (на 7,4 мг/кг). Обработка посевов пестицидами увеличивала переход цинка в продукцию и самое высокое его содержание в зерне, наблюдалось в варианте с последействием 40 т/га навоза + ,2 мг/кг).
Таблица 8
Влияние удобрений на содержание тяжелых металлов в зерне озимой ржи, мг/кг
|
Вариант
|
Содержание, мг/кг
| |||||
|
медь
|
свинец
|
цинк
|
кадмий
| |||
|
Контроль — без удобрений
|
2,45
|
0,05
|
11,2
|
0,004
| ||
|
Последействие 80 т/га навоза на 3-й культуре
|
2,25
|
0,11
|
7,9
|
0,006
| ||
|
Последействие 40 т/га навоза на 3-й культуре
+N70P30K60
|
1,92
|
0,10
|
6,5
|
0,004
| ||
|
N70P30K60
|
2,08
|
0,04
|
5,9
|
0,005
| ||
|
N140P60K120
|
1,60
|
0,04
|
4,8
|
0,006
| ||
|
N210P90K180
|
1,36
|
0,12
|
3,8
|
0,004
| ||
|
Последействие 40 т/га навоза на 3-й культуре + N70Р30К60+пестициды
|
2,19
|
0,15
|
13,2
|
0,011
| ||
|
К70Р30К60+пестициды
|
1,67
|
0,10
|
8,8
|
0,004
| ||
|
N140Р60К120+пестициды
|
1,78
|
0,05
|
8,0
|
0,008
| ||
|
N210P90K180+ пестициды
|
1,65
|
0,07
|
5,1
|
0,006
| ||
Пестициды: кампозан -4,0 л/га, диален -1,5 л/га, децис -0,3 л/га, байлетон -1,0 кг/га.
Примечание. Согласно ГОСТ -96, ПДК тяжелых металлов в зерне озимой ржи следующая: медь-10 мг/кг, свинец 0,5 -мг/кг, цинк -50 мг/кг.
Пестициды. Кампозан — 4,0 л/га, диален -1,5 л/га, децис -0,3 л/га, байлетон -1,0 кг/га.
Выводы
Исследования накопления тяжелых металлов в урожае сельскохозяйственных культур показали, что их содержание было весьма незначительным или обнаруживались их следы.
Установлено, что органическое вещество почв при внесении подстилочного навоза в дозе 80 т/га снижает поступление меди, цинка в клубни картофеля, снижая их токсичность, а от внесения 3-х доз подстилочного навоза (120 т/га) содержание меди уменьшилось в 7 раз.
Содержание меди в зерне овса от применения удобрений и пестицидов понижалось по отношению к контролю в 1,7-2,9 раза, свинца в 1,7-5,6, цинка в 1,2-1,9 раза.
В зерне озимой ржи содержание меди от применения удобрений и пестицидов понижалось в 1,1-1,8 раза, цинке в 1,3-2,9 раза.
Следовательно, комплексное научно-обоснованное применение средств химизации является одним из важнейших приемов снижения негативного действия указанных тяжелых металлов.
Литература
1. Алексеев Ю.В. Тяжелые металлы в почвах и растениях. Л. Агропромиздат, 1987,142 с.
2. Максимов П.Г., Васильев Н.М., Кузнецов А.В., Аристархов А.Н., Лобас Н.В., Курганова Е.В., Гавриленко А.П., Аристархова Г.Г., Кузнецова И.А. Агроэкологическая характеристика пахотных почв Российской Федерации по содержанию тяжелых металлов, мышьяка и фтора. — М.: Агроконсальт, 2002.-50 с.
3. Минеев ВТ. Агрохимия М.: Колос, 2004-720 с.
4. Графская Г.А., Хостанцева Н.В. Проблема рекультивации почв, загрязненных тяжелыми металлами. // Бюллетень ВИУА, № 114. М.: Агроконсальт, 2001.с.80.
5. Панова А. А. Влияние минеральных и органических удобрений на содержание тяжелых металлов в почве. // Агрохимия. 1991, № 3, с.62-69.
6. Белоус Н.М., Моисеенко Ф.В., Ратников А.Н. Влияние удобрений на содержание кадмия и свинца в клубнях картофеля. // Химия в сельском хозяйстве. 1995, №5. с.31-33.
7. Моисеенко Ф.В. Влияние длительного применения удобрений на содержание микроэлементов и тяжелых металлов в дерново-подзолистой песчаной почве. // Бюллетень ВНИ-ИА, № 114. М: Агроконсальт, 2001. С.131.
8. Гришина А.В. Агроэкологическая оценка уровней содержания тяжелых металлов в экосистемах Владимирской области. // Автореферат дисс. канд. с.-х. наук. М.: 2001. с. 21.
9. Черных Н.А., Овчаренко М.М. Тяжелые металлы и радионуклиды в биогеоценозах. М.: Агроконсальт, 2002. с. 200.
Расшифровка: Химия в ее стихии: свинец(Promo) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит Здравствуйте, на этой неделе мы погружаемся в новые глубины, поскольку мы встречаемся с металлом, который породил отвес, рок-группу, водопровод и даже отравление, а не упомянуть поколение алхимиков, тщетно пытавшихся превратить это вещество в золото.Это, конечно же, свинец, и нам предстоит размахивать им научным писателем Филом Боллом. Фил Болл Свинец — это ИА металлов — медленный, тупой и тяжелый. В латинской форме, plumbum , он вошел в наш словарь благодаря своему мягкому и тяжеловесному характеру: когда-то мы погружались в глубины с подвешенным серым шариком вещества, подчеркнуто управляемым силой тяжести, в то время как водопроводчики давно продали свои ковкие свинцовые трубы. для пластика. Все, что связано со свинцом, имеет тенденцию к чрезмерному мраку: в древней схеме металлического символизма свинец был связан с Сатурном, меланхоличной планетой, олицетворяемой старым богом, также называемым Кроносом, который кастрировал своего отца и проглотил своих детей.Даже искра гламура, которую металл получает от ассоциации с величайшей рок-группой мира, проистекает из предсказания Иа-Иа, что они утонут, как свинцовый воздушный шар или дирижабль. Да, свинец — это оригинальный хэви-металл, самый известный преступник в этой токсичной группе. Свинец повреждает мозг и почки, он может вызвать анемию и форму подагры с печальным названием сатурнианской подагры. Даже римляне знали об отравлении свинцом — доктор Корнелий Цельс предупреждал о вреде свинцового белила, используемого в красках и косметике, а инженер Витрувий рекомендовал глиняные трубы вместо свинцовых.Однако мы учились медленно. Свинцово-белила, форма карбоната свинца, оставались лучшим белым пигментом художника вплоть до девятнадцатого века, когда его заменили цинковыми белилами. По мере того, как производство красок стало индустриальным, свинец распространил болезни и смерть среди фабричных рабочих: в отчете «Труды Королевского общества» в семнадцатом веке среди причин, вызванных им, были указаны головокружение, головокружение, слепота, тупость и паралитические расстройства. И уже в 2007 году производитель игрушек Mattel был вынужден отозвать миллионы игрушек китайского производства, окрашенных свинцовой краской.Между тем, токсичная струйка свинца из припоя и электродов батарей медленно вымывается со свалок по всему миру. В 2006 году Европейский Союз фактически запретил использование свинца в большинстве бытовой электроники, но он по-прежнему используется в других странах. Для алхимиков свинец был самым низким из металлов — в некотором смысле, именно с него зародились все металлы. Говоря о неблагородных металлах, которые алхимия пыталась превратить в серебро и золото, не было ничего более низменного, чем свинец. Алхимики считали, что свинец медленно превращается в другие металлы в земле.Но алхимия также дала свинцу шанс избавиться от его серого и безвкусного образа. Чтобы из свинца нарисовать великолепные цвета, не нужно много времени. Древние технологи бланшировали тусклый металл, помещая полоски свинца в горшки с уксусом и запирая их в сарае, полном навоза. Пары уксуса и газ от ферментированного навоза разъедали свинец до свинцовой белила. Аккуратно нагрейте его, и он станет желтым: это форма оксида свинца, известная как глет, а в средние века — массикот. Нагрейте его еще немного, и он станет ярко-красным, так как вы образуете другой вид оксида.Оба эти вещества использовались художниками — красный свинец долгое время был их лучшим красным цветом, который в средние века использовали для росписи многих ярких одежд. Это был фирменный цвет святого Иеронима. Для алхимиков эти изменения цвета были не просто способом создания пигментов. Они означали, что в металле происходят более глубокие изменения, приближающие его к цвету золота. Поэтому неудивительно, что их эксперименты часто начинались со свинца. Они не приблизились к созданию настоящего золота, но начали исследовать процессы химического превращения. Однако свинец, кажется, привык раскрывать свои истинные и грязные цвета. Находясь на воздухе, он может продолжать поглощать кислород, пока не станет черным. Красный свинец стал шоколадно-коричневым на картинах по всему миру, от Японии до Индии и Швейцарии. В городских галереях есть еще одна опасность, так как сернистые пары загрязнений вступают в реакцию с красным свинцом или сернистым свинцом. Кажется, от этого никуда не деться: у свинца хмурое и меланхоличное сердце. Крис Смит Фил Болл погружается в глубины научной истории свинца.Очередной выпуск химии в своей стихии обещает стать рекордсменом. Марк Пеплоу Вы можете многое узнать о ком-то, встретившись с его семьей, и то же самое можно сказать о стихии. Вот почему мы так много узнали об астате. Считается, что верхний километр земной коры, который часто провозглашается самым редким природным элементом в мире, содержит менее 50 мг астата, что делает его самым редким элементом, установленным в Книге рекордов Гиннеса. Крис Смит И вы можете услышать, как Марк Пеплоу рассказывает историю самого редкого химического вещества в мире в химии в его элементе на следующей неделе. Я Крис Смит, спасибо за внимание, увидимся в следующий раз. (Промо) (Окончание промо) |
свинец | Определение, использование, свойства и факты
Свинец (Pb) , мягкий серебристо-белый или сероватый металл группы 14 (IVa) периодической таблицы Менделеева.Свинец очень податлив, пластичен, плотен и плохо проводит электричество. Известный в древности и считающийся алхимиками старейшим из металлов, свинец очень прочен и устойчив к коррозии, о чем свидетельствует продолжающееся использование свинцовых водопроводных труб, установленных древними римлянами. Символ Pb, обозначающий свинец, является сокращением латинского слова «свинец», plumbum .
Британская энциклопедия, Inc.
Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов.Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 82 |
|---|---|
| атомный вес | 207,19 |
| точка плавления | 327,5 ° C (621,5 ° F) |
| плотность | 11,29 грамм / см 3 при 20 ° C (68 ° F) |
| степени окисления | +2, +4 |
| электронная конфигурация | [Xe ] 4 f 14 5 d 10 6 с 2 6 p 2 или 1 с 2 2 с 2 2 p 6 3 с 2 3 p 6 3 d 10 4 с 2 4 p 6 4 d 10 4 f 14 5 с 2 5 p 6 5 d 10 6 с 2 6 p 2 |
Возникновение и распространение
Свинец часто упоминается в ранних библейских рассказах.Вавилоняне использовали металл в качестве пластин для записи надписей. Римляне использовали его для изготовления табличек, кальянов, монет и даже кухонной утвари; действительно, в результате последнего применения отравление свинцом было признано во времена Августа Цезаря. Соединение, известное как белый свинец, очевидно, было приготовлено как декоративный пигмент по крайней мере еще в 200 г. до н. Э. Современные разработки относятся к разработке в конце 1700-х годов месторождений в районе Миссури-Канзас-Оклахома в Соединенных Штатах.
По весу содержание свинца в земной коре почти такое же, как и содержание олова.Космически на 10 6 атомов кремния приходится 0,47 атома свинца. Космическое содержание сравнимо с содержанием цезия, празеодима, гафния и вольфрама, каждый из которых считается достаточно дефицитным элементом.
Несмотря на то, что свинца не так много, естественные процессы концентрации привели к появлению значительных залежей, имеющих коммерческое значение, особенно в Соединенных Штатах, но также и в Канаде, Австралии, Испании, Германии, Африке и Южной Америке. Значительные месторождения находятся в США в западных штатах и в долине Миссисипи.Свинец, редко встречающийся в свободном виде в природе, присутствует в нескольких минералах, но все они имеют второстепенное значение, за исключением сульфида PbS (галенита или свинца), который является основным источником производства свинца во всем мире. Свинец также содержится в англезите (PbSO 4 ) и церуссите (PbCO 3 ). К началу 21 века Китай, Австралия, США, Перу, Мексика и Индия были крупнейшими производителями свинца в концентрате.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчас
Свинец может быть извлечен путем обжига руды с последующей плавкой в доменной печи или путем прямой плавки без обжига. Дополнительное рафинирование удаляет примеси, присутствующие в слитках свинца, полученных любым способом. Почти половина всего очищенного свинца извлекается из вторичного лома. (Для коммерческого производства см. обработка свинца.)
Использование металла
Известна только монокристаллическая модификация с плотноупакованной металлической решеткой.Свойства, которые определяют множество применений элементарного свинца, включают его пластичность, легкость сварки, низкую температуру плавления, высокую плотность и способность поглощать гамма-излучение и рентгеновское излучение. Расплавленный свинец — отличный растворитель и собиратель элементарного серебра и золота. Применение свинца в конструкции ограничено его низкой прочностью на растяжение и усталость, а также его тенденцией течь даже при небольшой нагрузке.
Свинец после резки быстро окисляется, образуя тускло-серый налет, который ранее считался недооксидом свинца, Pb 2 O, но теперь признан смесью свинца и монооксида свинца, PbO, который защищает металл от дальнейшей коррозии.Точно так же, хотя свинец растворим в разбавленной азотной кислоте, соляной или серной кислотами он подвергается только поверхностному воздействию, поскольку образующиеся нерастворимые хлоридные (PbCl 2 ) или сульфатные (PbSO 4 ) покрытия препятствуют продолжению реакции. Из-за этой общей химической стойкости значительные количества свинца используются в кровлях, в качестве покрытий для электрических кабелей, прокладываемых в земле или под водой, и в качестве футеровок для водопроводных труб, трубопроводов и конструкций для транспортировки и обработки коррозионных веществ.
Элементный свинец также может быть окислен до иона Pb 2+ ионами водорода, но нерастворимость большинства солей Pb 2+ делает свинец устойчивым к воздействию многих кислот. Окисление в щелочных условиях осуществляется легче, и ему способствует образование растворимых частиц свинца в степени окисления +2. Оксид свинца (PbO 2 , со свинцом в качестве иона Pb 4+ ) является одним из наиболее сильных окислителей в кислотном растворе, но он сравнительно слаб в щелочном растворе.Легкость окисления свинца увеличивается за счет образования комплекса. Электроосаждение свинца лучше всего проводить из водных растворов, содержащих гексафторсиликат свинца и гексафторкремниевую кислоту.
Свинец находит множество других применений, самое крупное из которых — производство аккумуляторных батарей. Он используется в боеприпасах (дроби и пули), а также в составе припоя, металлического сплава, подшипниковых сплавов, легкоплавких сплавов и олова. В тяжелом и промышленном оборудовании листы и другие детали, изготовленные из соединений свинца, могут использоваться для гашения шума и вибрации.Поскольку свинец эффективно поглощает коротковолновое электромагнитное излучение, он используется в качестве защитного экрана вокруг ядерных реакторов, ускорителей частиц, рентгеновского оборудования и контейнеров, используемых для транспортировки и хранения радиоактивных материалов. Вместе с составным оксидом свинца (PbO 2 ) и сплавами свинца-сурьмы или свинца-кальция он используется в обычных аккумуляторных батареях.
Свинец между строк | Химия природы
Somobrata Acharya исследует историю, свойства и использование свинца — древнего металла, который все еще очень актуален для сегодняшних технологий, но его следует использовать с осторожностью.
Свинец был одним из первых металлов, известных человеку. История элемента 82 восходит к 6400 г. до н.э. от неолитического поселения Чатал-Хююк (расположенного в центральной части современной Турции). оферет у евреев и молибд у древних греков упоминается как «свинец» в Ветхом Завете 1 . Обычно он использовался в древности, а также, как полагают, использовался в «Висячих садах» Вавилона в качестве листов для удержания влаги.Широкое применение — например, для водопроводных труб по всей Римской империи — возникло из-за того, что этот гибкий и податливый тяжелый металл широко распространен и прост в использовании; кроме того, его свойства можно регулировать, легируя его другими металлами, такими как медь или сурьма. Он сыграл решающую роль во время промышленной революции.
Символ свинца Pb происходит от его латинского названия plumbum , которое на самом деле использовалось для обозначения мягких металлов в более общем смысле. Фактически, свинец и олово не различались четко до XVI века, когда свинец обозначался как plumbum nigrum (черный свинец), а олово — как plumbum Candidum или album (светлый свинец).Латинское корневое название сохранилось в других языках — например, это «plomb» на французском языке — и в английском языке через слова «сантехник» и «сантехника», поскольку свинец был популярным материалом для труб из-за его высокой коррозионной стойкости.
Чистый свинец имеет голубовато-белый цвет с ярким блеском и кристаллизуется в гранецентрированной кубической структуре без известных аллотропных модификаций. 2 . Под воздействием влаги этот блеск теряется из-за образования оксидного покрытия, которое защищает лежащий под ним металл.Свинец встречается в природе, редко в чистом виде, но в рудах с другими металлами; наиболее распространенным в земной коре является галенит (PbS). Естественное образование свинца происходит при радиоактивном распаде урана и тория через радон ( 222 Rn). Известны четыре стабильных изотопа: 204 Pb, 206 Pb, 207 Pb и 208 Pb, первые три из которых используются для оценки возраста горных пород. Соединения свинца существуют в основном в степенях окисления +2 или +4, причем первое встречается чаще.
Ранний способ извлечения свинца из руды (на фото) включал обжиг руды на воздухе, в результате чего сульфид свинца превращался в оксидные и сульфатные формы, а затем плавку с известняком и коксом для получения сырого свинца. Сегодня около половины годового производства свинца приходится на горнодобывающую промышленность, а остальное — на переработку.
Предоставлено: © MARY EVANS PICTURE LIBRARY / ALAMY
Соединения свинца связаны с рядом важных открытий, имеющих решающее значение для современных технологий.Выпрямляющие свойства были обнаружены у точечных контактов металл – галенит Ф. Брауном в 1874 г. 3 . В 1901 году Дж. К. Бозе обнаружил электромагнитную волну с помощью галенита — ключевое событие для развития радио 4 . Инфракрасные детекторы на основе халькогенидов свинца (то есть сульфидов, селенидов и теллуридов) представляют собой крупный прорыв в инфракрасной технологии, например, для ночного видения и спектроскопических аналитических методов, которые теперь доступны химикам. Халькогениды свинца также характеризуются малой шириной запрещенной зоны, которая изменяется в зависимости от размеров кристаллитов и охватывает широкий спектральный диапазон — явление, называемое эффектом квантового ограничения, которое лежит в основе таких устройств, как полевые транзисторы, солнечные элементы. и фотоприемники.
Широко распространенное производство и потребление свинца продолжалось до двадцатого века за счет использования в бензине, свинцово-кислотных аккумуляторах, краске, защите от излучения и в промышленности поливинилпласта в качестве стабилизатора. Однако люди подвержены отравлению свинцом в результате острого или, чаще, хронического воздействия. Свинец накапливается в организме и препятствует различным процессам, вызывая нейротоксические эффекты с различными симптомами. Еще в римский период болезни были связаны со свинцом благодаря использованию напитков со «свинцовым сахаром» (ацетат свинца) и труб для водоснабжения.Тем не менее, эти ранние предупреждения не применялись до середины двадцатого века, после чего во многих странах начали пристально следить за использованием свинца, что привело к таким мерам, как запреты на бензин и краски.
К счастью, отравление свинцом теперь можно лечить хелатирующими агентами (обычно этилендиаминтетраацетатом), используя их большее сродство к тяжелому металлу с образованием комплексов, которые могут выводиться из организма. К сожалению, считается, что при нынешних темпах использования металл, на который мы полагались в течение тысяч лет, закончится примерно через четыре десятилетия.Более позитивной стороной этой ситуации является то, что эти разработки вызывают возобновление интереса к переработке отходов и значительный прогресс в технологии топливных элементов.
Ссылки
- 1
Меллор, Дж. У. Комплексный трактат по неорганической и теоретической химии Том VII, Глава XLVII (Longmans & Green, 1937).
Google Scholar
- 2
Рохов Э.Г. Химия германия, олова и свинца (Oxford Pergamon, 1973).
Google Scholar
- 3
Braun, F. Ann. Phys. Chem. 153 , 556–563 (1874).
Google Scholar
- 4
Rogalski, A. Opto-Electronic Review 20 , 279–308 (2012).
Google Scholar
Скачать ссылки
Информация об авторе
Принадлежность
Сомобрата Ачарья находится в Центре передовых материалов Индийской ассоциации развития науки, Калькутта, Индия
Сомобрата Ачарья
Высокоселективное быстрое колориметрическое определение иона Pb2 + в пробах воды и краске на основе индуцированной металлом агрегации наночастиц золота, закрытых N-деканоилтрометамином
- Мегараджан Сенган
- , Рави Кант Камлекар
- и Анбажаган Вираппан
Spectrochimica Acta, часть A: молекулярная и биомолекулярная спектроскопия
(2020)Пожар в соборе Парижской Богоматери и свинцовые материалы в окружающей среде
- Нацуки Дэйт
- , Атоки Сато
- , Кадзуя Такеучи
- , Тошихиро Мори
- , Кохеи Йокосука
- , Юки Ито
- , Кента Шима
Чомо Тагуки
- , Кенто Янагава
- , Томми Кенджи Джайлс
- и Такаширо Акицу
Тяжелые металлы в плотине и плотинах ниже по течению и связанный с этим риск для здоровья человека
- Qaphelani Ngulube
- , Champaklal T.Парех
- и Стивен Маджони
Химия Африка
(2020)- Натрий (Na — Natrium)
- Калий (K — Kalium)
- Железо (Fe — Ferrum)
- Медь (Cu — Cuprum)
- Серебро (Ag — Argentum)
- Олово (Sn — Stannum)
- Сурьма (Sb — Stibium)
- Вольфрам (W — Wolfram)
- Золото (Au — Aurum)
- Ртуть (Hg — Hydragery) )
- Свинец (Pb — Plumbum)
- Свинец является относительно распространенным элементом, поскольку он является конечной точкой схем распада многих радиоактивных элементов с более высокими атомными номерами.
- Поскольку его довольно легко извлечь (для металла), свинец использовался с доисторических времен. Свинец был легко доступен простым людям в Римской империи, нашел применение в посуде, водопроводе, монетах и статуях. Люди использовали его для изготовления предметов повседневного обихода в течение тысяч лет, пока в конце 19 века он не оказался ядовитым.
- Тетраэтилсвинец был добавлен в бензин для уменьшения детонации двигателя в 1920-х годах. Даже когда его изобрели, было известно, что он ядовит. Несколько заводских рабочих умерли от воздействия свинца. Однако использование этилированного газа не прекращалось до 1970-х годов, а запрет на использование в дорожных транспортных средствах — до 1996 года. Металл по-прежнему используется в автомобильных аккумуляторах, для изготовления этилированного стекла и для защиты от радиации. Производство и использование этого металла во всем мире продолжает расти.
- Свинец — металл после переходного периода.Он не такой реактивный, как многие другие металлы, за исключением порошкообразного состояния. Он проявляет слабый металлический характер, часто образуя ковалентные связи с другими элементами. Элемент легко соединяется с самим собой, образуя кольца, цепочки и многогранники. В отличие от большинства металлов, свинец мягкий, тусклый и не очень хорошо проводит электричество.
- Свинцовый порошок горит бело-голубым пламенем. Металлический порошок пирофорен.
- Грифель карандаша на самом деле представляет собой графитовую форму углерода, но металлический свинец достаточно мягкий, чтобы оставить след.Свинец использовался как один из первых инструментов для письма.
- Соединения свинца имеют сладкий вкус. Ацетат свинца называли «сахаром свинца» и раньше использовали в качестве подсластителя.
- Раньше людям было трудно отличить олово от свинца. Считалось, что это две формы одного и того же вещества. Свинец назывался «plumbum nigrum» (черный свинец), а олово — «plumbum Candidum» (светлый свинец).
- Baird, C .; Канн, Н. (2012). Химия окружающей среды (5-е изд.). В. Х. Фриман и компания. ISBN 978-1-4292-7704-4.
- Эмсли, Джон (2011). Строительные блоки природы: Путеводитель по элементам от А до Я . Издательство Оксфордского университета. С. 492–98. ISBN 978-0-19-960563-7.
- Greenwood, Norman N .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- Хаммонд, К. Р. (2004). Элементы, в Справочнике по химии и физике (81-е изд.). CRC Press. ISBN 978-0-8493-0485-9.
- Вист, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4.
- Самый важный шаг, который могут предпринять родители, врачи и другие люди, — это предотвратить воздействие свинца до того, как оно произойдет .
- До недавнего времени определяли уровень свинца в крови у детей, если результат теста составлял 10 или более микрограммов на децилитр свинца в крови.Теперь эксперты используют новый уровень, основанный на популяции США детей в возрасте от 1 до 5 лет, которые входят в 2,5% лучших детей при тестировании на содержание свинца в крови (по сравнению с детьми, которые подвергаются большему воздействию свинца, чем большинство детей). В настоящее время это 5 микрограммов на децилитр свинца в крови. Новое, более низкое значение означает, что больше детей, вероятно, будут идентифицированы как имеющие воздействие свинца, что позволяет родителям, врачам, должностным лицам здравоохранения и сообществам принять меры раньше, чтобы уменьшить воздействие свинца на ребенка в будущем.
- Поведение и проблемы с обучением
- Низкий IQ и гиперактивность
- Замедленный рост
- Проблемы со слухом
- Анемия
- Заставить ребенка родиться слишком рано или слишком маленьким;
- Повредить мозг, почки и нервную систему ребенка;
- Повышение вероятности обучения или поведенческих проблем; и
- Поставить мать на риск выкидыша.
- Сердечно-сосудистые эффекты, повышение артериального давления и частота гипертонии;
- Пониженная функция почек; и
- Репродуктивные проблемы (как у мужчин, так и у женщин).
- Осмотрите и обслужите все окрашенные поверхности, чтобы предотвратить порчу краски.
- Быстро и полностью устраните повреждения, вызванные водой.
- Следите за чистотой и отсутствием пыли в доме.
- Очистите окрашенные области, где трение может привести к образованию пыли, например двери, окна и ящики. Протрите эти участки влажной губкой или тряпкой, чтобы удалить осколки краски или пыль.
- Используйте только холодную воду для приготовления еды и напитков.
- Выпускные отверстия для промывочной воды, используемые для питья или приготовления пищи.
- Регулярно очищайте от мусора выпускные решетки или аэраторы кранов.
- Часто мойте детские руки, бутылочки, пустышки и игрушки.
- Научите детей вытирать и снимать обувь и мыть руки после игр на открытом воздухе.
- Убедитесь, что члены вашей семьи едят хорошо сбалансированное питание. Дети со здоровым питанием усваивают меньше свинца.См. «Свинец и здоровая диета», «Что вы можете сделать, чтобы защитить своего ребенка» (PDF).
- Если вы выполняете ремонт, ремонт или покраску дома, убедитесь, что ваш подрядчик имеет сертификат безопасности свинца и соблюдает методы работы, безопасные для свинца (PDF).
Соответствие
Сомобрата Ачарья.
Об этой статье
Цитируйте эту статью
Ачарья, С. Проведите между строк.
Nature Chem 5, 894 (2013). https://doi.org/10.1038/nchem.1761
Ссылка для скачивания
Дополнительная литература
Тагиро Тагуки
Тагиро Кеиго
Таго-329
Пожарная наука и техника
(2020)
Свинец — это голубовато-белый блестящий металл. Он очень мягкий, податливый, пластичный и относительно плохой проводник электричества. Он очень устойчив к коррозии, но тускнеет при контакте с воздухом.Изотопы свинца являются конечными продуктами каждого из трех рядов встречающихся в природе радиоактивных элементов. Заявки Свинцовые трубы с символами римских императоров, использовавшиеся в качестве сточных вод из бань, все еще используются. Сплавы включают олово и припой. Тетраэтилсвинец (PbEt 4 ) все еще используется в некоторых марках бензина (бензин), но постепенно прекращается по экологическим причинам. Свинец в окружающей среде Свинец в природе встречается редко.В настоящее время свинец обычно содержится в руде вместе с цинком, серебром и медью и добывается вместе с этими металлами. Главный минерал свинца в Галените (PbS), а также добываются месторождения церуссита и англезита. Галена добывается в Австралии, которая производит 19% нового свинца в мире, за ней следуют США, Китай, Перу и Канада. Некоторые также добываются в Мексике и Западной Германии. Мировая добыча нового свинца составляет 6 миллионов тонн в год, а общие полезные запасы оцениваются в 85 миллионов тонн, что меньше 15-летнего предложения. Свинец встречается в окружающей среде естественным образом. Однако большая часть концентрации свинца в окружающей среде является результатом деятельности человека. Из-за применения свинца в бензине образовался неестественный цикл свинца. В двигателях автомобилей свинец сжигается, поэтому образуются соли свинца (хлор, бром, оксиды).
Подробнее о свинце в воде Вернуться к периодической диаграмме . |
Почему некоторые элементы Периодической таблицы представлены буквами, которые не имеют четкой связи с их названиями?
Ответ
Некоторые элементы были известны в древности и поэтому имеют латинские названия.
Периодическая таблица. 2019. Фото Н. Ханачека. Национальный институт стандартов и технологий (NIST).
В периодической таблице одиннадцать элементов представлены буквами, не совпадающими с их названиями:
Почти все эти элементы были известны в древности и поэтому имеют латинские названия.Некоторые из названий также привели к другим словам, которые распространены в английском языке. Например, от слова «plumbum», что по-латыни означает «свинец» (Pb), мы получили слова «сантехник» и «водопроводчик», потому что свинец веками использовался в водопроводных трубах.
Другие имена имеют разное происхождение. Например, гидраргирум, латинское название ртути (Hg), произошло от оригинального греческого слова гидраргирос, что означало «водное серебро». Также исторически известная как «ртуть», элементарная ртуть — это блестящий серебряный металл, который находится в жидком состоянии при комнатной температуре.
Таблица типов элементов и объяснение пластин, показывающих различные химические элементы и их атомный вес. Между 1808-1827 гг. В г. Новая система химической философии Джона Далтона. Отдел эстампов и фотографий, Библиотека Конгресса.
Вольфрам получил символ W от немецкого названия Wolfram. Вольфрам происходит из вольфрамита, который был одной из руд, в которой чаще всего находили вольфрам. Само название Tungsten на самом деле шведское и переводится на английский как «тяжелый камень».
Слово «калий» происходит от английского «pot ash», которое использовалось для выделения солей калия. Мы получили K от названия калиум, данного немецким химиком Мартином Генрихом Клапротом, которое произошло от щелочи, происходящей от арабского al-qalyah, или «растительный пепел».
Этимология названий элементов может увести вас в фантастическое приключение, и вы можете быть удивлены тем, где вы оказались. В разделе для дальнейшего чтения можно найти книги по истории химических элементов.
Периодическая таблица элементов.PubChem, Национальная медицинская библиотека США (NLM), Национальный центр биотехнологической информации, Национальные институты здравоохранения.
Опубликовано: 05.05.2020. Автор: Справочная секция по науке, Библиотека Конгресса
Факты о свинце — элемент 82 или Pb
Свинец — это тяжелый металлический элемент, обычно встречающийся в радиационной защите и мягких сплавах. Это тускло-серый металл с символом элемента Pb и атомным номером 82. Вот коллекция интересных фактов о свинце, в том числе о его свойствах, использовании и источниках.
Интересные факты о свинце
Свинцовые атомные данные
Название элемента: Lead
Символ: Pb
атомный номер: 82
Атомный вес: 207.2
Группа элементов: Основной металл
Открытие: Известен древним, история которого насчитывает не менее 7000 лет. Упоминается в книге Исход.
Происхождение имени: Англосаксонское: свинец; символ с латинского: отвес.
Плотность (г / куб. См): 11,35
Температура плавления (° K): 600,65
Температура кипения (° K): 2013
Свойства: Свинец — чрезвычайно мягкий, очень ковкий и пластичный, плохо проводящий электричество, устойчивый к коррозии, бело-голубой блестящий металл, который на воздухе тускнеет до тускло-серого цвета.Свинец — единственный металл, в котором отсутствует эффект Томсона. Свинец — это накопительный яд.
Атомный радиус (пм): 175
атомный объем (куб.см / моль): 18,3
Ковалентный радиус (пм): 147
Ионный радиус: 84 (+ 4e) 120 (+ 2e)
Удельная теплоемкость (при 20 ° C Дж / г моль): 0,159
Теплота плавления (кДж / моль): 4,77
Теплота испарения (кДж / моль): 177.8
Температура Дебая (° K): 88.00
Полинг Номер отрицания: 1,8
Первая ионизирующая энергия (кДж / моль): 715,2
Степени окисления: 4, 2
Электронная конфигурация: [Xe] 4f 14 5d 10 6s 2 6p 2
Структура решетки: Гранецентрированная кубическая (FCC)
Константа решетки (Å): 4.950
Изотопы: Природный свинец представляет собой смесь четырех стабильных изотопов: 204 Pb (1,48%), 206 Pb (23,6%), 207 Pb (22,6%) и 208 Pb (52,3%) . Известно 27 других изотопов, все радиоактивные.
Применение: Свинец используется в качестве звукопоглотителя, защиты от рентгеновского излучения и для поглощения вибраций. Он используется в рыболовных грузах, для покрытия фитилей некоторых свечей, в качестве охлаждающей жидкости (расплавленный свинец), в качестве балласта и для электродов.Свинцовые соединения используются в красках, инсектицидах и аккумуляторных батареях. Оксид используется для изготовления свинцового «хрусталя» и бесцветного стекла. Сплавы используются в качестве припоя, олова, металла, пуль, дроби, антифрикционных смазок и сантехники.
Источники: Свинец существует в своей естественной форме, хотя встречается редко. Свинец можно получить из галенита (PbS) в процессе обжарки. Другие распространенные свинцовые минералы включают англезит, церуссит и миним.
Другие факты: Алхимики считали свинец самым древним металлом.Он был связан с планетой Сатурн.
Источники
Узнайте о свинце | Свинец
Что такое свинец?
Свинец — это природный элемент, который в небольших количествах содержится в земной коре.Хотя он имеет несколько полезных применений, он может быть токсичным для людей и животных, вызывая последствия для здоровья.
Где найден свинец?
Свинец можно найти во всех частях нашей окружающей среды — в воздухе, почве, воде и даже внутри наших домов. Большая часть нашего воздействия происходит от деятельности человека, включая использование ископаемого топлива, включая использование в прошлом этилированного бензина, некоторые типы промышленных объектов и использование в прошлом красок на основе свинца в домах. Свинец и соединения свинца используются в самых разных продуктах, которые можно найти в наших домах и вокруг них, включая краски, керамику, трубы и сантехнические материалы, припои, бензин, батареи, боеприпасы и косметику.
Свинец может попасть в окружающую среду в результате прошлых и текущих применений. Свинец также может попадать в окружающую среду из промышленных источников и загрязненных участков, таких как бывшие плавильные заводы. Хотя естественные уровни свинца в почве колеблются от 50 до 400 частей на миллион, добыча, выплавка и рафинирование привели к значительному увеличению уровней свинца в окружающей среде, особенно вблизи участков добычи и плавки.
Когда свинец выбрасывается в воздух из промышленных источников или самолетов с искровым зажиганием, он может перемещаться на большие расстояния, прежде чем осесть на землю, где обычно прилипает к частицам почвы.Свинец может переходить из почвы в грунтовые воды в зависимости от типа соединения свинца и характеристик почвы.
Федеральные и государственные нормативные стандарты помогли снизить количество свинца в воздухе, питьевой воде, почве, потребительских товарах, продуктах питания и на рабочем месте.
Подробнее об источниках воздействия свинца:
Начало страницы
Кто в опасности?
Дети
Свинец особенно опасен для детей, потому что их растущие тела поглощают больше свинца, чем взрослые, а их мозг и нервная система более чувствительны к разрушающему воздействию свинца.Младенцы и маленькие дети также могут быть более подвержены воздействию свинца, потому что они часто кладут в рот руки и другие предметы, на которые может попасть свинец из пыли или почвы. Дети также могут подвергаться воздействию свинца при употреблении в пищу и питье пищи или воды, содержащих свинец, или от посуды или стаканов, содержащих свинец, вдыхая свинцовую пыль из краски на основе свинца или загрязненной свинцом почвы или играя с игрушками с краской на основе свинца.
Взрослые, включая беременных
Взрослые могут подвергаться воздействию свинца при употреблении в пищу и питье пищи или воды, содержащих свинец, либо из посуды или стаканов, содержащих свинец.Они также могут вдыхать свинцовую пыль, проводя время в местах, где ухудшается качество краски на основе свинца, а также во время ремонтных или ремонтных работ, которые вызывают повреждение окрашенных поверхностей в старых домах и зданиях. Работа или хобби, связанное с использованием свинца, например изготовление витражей, может увеличить экспозицию, как и некоторые народные средства, содержащие свинец. Воздействие свинца из этих источников на беременную женщину вызывает особую озабоченность, поскольку это может привести к контакту с ее развивающимся ребенком.
Начало страницы
Данные по воздействию свинца
The U.S. Центры по контролю и профилактике заболеваний (CDC) Национальный центр статистики здравоохранения Exitmonitors контролирует уровень свинца в крови в Соединенных Штатах. Получите информацию о количестве детей с повышенным уровнем свинца в крови, а также о количестве и проценте детей, прошедших тестирование на свинец в вашем районе. Выход
Согласно CDC (PDF) Выход
EPA использует данные CDC, чтобы показать тенденции уровней свинца в крови у детей в «Дети Америки и окружающая среда» .
Начало страницы
Какое влияние на здоровье оказывает свинец?
Свинец может поражать почти все органы и системы вашего тела. Наиболее подвержены воздействию свинца дети в возрасте шести лет и младше.
Дети
Даже низкий уровень свинца в крови детей может привести к:
В редких случаях проглатывание свинца может вызвать судороги, кому и даже смерть.
Беременные
Свинец со временем может накапливаться в нашем организме, где он откладывается в костях вместе с кальцием. Во время беременности свинец выделяется из костей матери вместе с кальцием и может перейти от матери, подвергая воздействию свинца плод или грудного ребенка. Это может привести к серьезным последствиям для развивающегося плода и младенца, в том числе:
Узнайте больше о влиянии свинца на беременных и кормящих женщин:
Другое Взрослые
Свинец вреден и для других взрослых. Взрослые, подвергшиеся воздействию свинца, могут пострадать от:
Подробнее о влиянии свинца на здоровье
Начало страницы
Снизьте ваши шансы контакта с свинцом
Простые шаги, такие как поддержание чистоты и ухода за домом, во многом помогут предотвратить воздействие свинца.Вы можете снизить вероятность воздействия свинца в вашем доме как сейчас, так и в будущем, выполнив следующие действия:
Определите, подвержена ли ваша семья риску отравления свинцом, с помощью Контрольного списка домашних отравлений свинцом (PDF).
Начало страницы
Что мне делать, если я думаю, что мой ребенок или я подверглись воздействию свинца?
Поговорите со своим педиатром, терапевтом или местным агентством здравоохранения о том, что вы можете сделать.Ваш врач может сделать простой анализ крови, чтобы проверить вас или вашего ребенка на предмет воздействия свинца. Вы также можете проверить свой дом на наличие источников свинца.
.