Гидроксид кальция — щелочь, востребованное во многих областях экономики вещество
Гидроокись кальция — неорганическое соединение, щелочь кальция. Ее формула Ca(OH)2. Так как это вещество известно человечеству с древнейших времен, то у него есть традиционные названия: гашеная известь, известковая вода, известковое молоко, пушенка.
Пушенка — тонкоизмельченный порошок. Известковое молоко — водная взвесь щелочи, непрозрачная белая жидкость. Известковая вода — прозрачный водный раствор щелочи, получается после фильтрации известкового молока.
Гашеная известь получила название по способу получения: негашеную известь (оксид кальция) заливают водой (гасят).
Свойства
Мелкий кристаллический порошок белого цвета, без запаха. Очень плохо растворяется в воде, совсем не растворяется в спирте, легко растворяется в разбавленной азотной и соляной кислотах. Пожаробезопасен и даже препятствует возгоранию. При нагревании разлагается на воду и оксид кальция.
Сильная щелочь. Вступает в реакции нейтрализации с кислотами с образованием солей — карбонатов. При взаимодействии с металлами выделяется взрывоопасный и горючий водород. Вступает в реакции с оксидами углерода (IV) и (II), с солями.
Реакция получения гидроокиси кальция методом «гашения» происходит с большим выделением тепла, вода начинает кипеть, едкий раствор разбрызгивается в разные стороны — это надо учитывать при работе.
Меры предосторожности
Попадание на кожу частиц сухого порошка или капель раствора гидроокиси кальция вызывает раздражение, зуд, химический ожог, язвы, сильную боль. Повреждение глаз может вызвать потерю зрения. Проглатывание вещества вызывает ожог слизистой горла, рвоту, кровавую диарею, резкое снижение давления, повреждение внутренних органов. Вдыхание частиц пыли может привести к затрудняющей дыхание опухоли горла.
Перед тем, как вызвать «Скорую помощь»:
— при отравлении дать пострадавшему выпить молока или воды;
— если химикат попал в глаза или на кожу, то места повреждения нужно промывать большим количеством воды хотя бы в течение четверти часа;
— если реактив случайно вдохнули, то пострадавшего нужно вывести из помещения и обеспечить доступ свежего воздуха.
Работать с гидроокисью кальция следует в хорошо проветриваемых помещениях с применением средств защиты: резиновых перчаток, защитных очков и респираторов. Химические эксперименты должны проводиться в вытяжном шкафу.
Применение
— В строительной индустрии хим.реактив добавляют в связывающие растворы, штукатурку, белила, гипсовые растворы; на его основе изготавливают силикатный кирпич и бетон; с его помощью подготавливают почву перед укладкой дорожных покрытий. Побелка деревянных деталей конструкций и заборов придает им огнестойкие свойства и защищает от гниения.
— Для нейтрализации кислотных газов в металлургии.
— Для получения твердых масел и добавок к маслам — в нефтеперерабатывающей отрасли.
— В химпроме — для производства щелочей натрия и калия, хлорной извести («хлорки»), стеарата кальция, органических кислот.
— В аналитической химии известковая вода служит индикатором углекислого газа (поглощая его, она мутнеет).
— С помощью гидроокиси кальция очищают сточные и промышленные воды; нейтрализуют кислоты поступающей в водопроводы воды, чтобы снизить ее коррозионное воздействие; удаляют из воды карбонаты (умягчают воду).
— С помощью Ca(OH)2 удаляют волосяной покров со шкур в кожевенном деле.
— Пищевая добавка Е526 в пищепроме: регулятор кислотности и вязкости, отвердитель, консервант. Используется при изготовлении соков и напитков, кондитерских и мучных изделий, маринадов, соли, детского питания. Применяется в сахарном производстве.
— В стоматологии известковое молоко используют для дезинфекции корневых каналов.
— Для лечения кислотных ожогов — в медицине.
— В сельском хозяйстве: средство для регулирования рН почв; в качестве натурального инсектицида от клещей, блох, жуков; для приготовления популярного фунгицида «бордосская жидкость»; для побелки стволов деревьев от вредителей и солнечных ожогов; как антимикробный и противогрибковый препарат для хранения овощей на складах; как минеральное удобрение.
— Гидроокись кальция снижает электросопротивление почвы, поэтому ею обрабатывают грунт при установке заземления.
— Хим.реактив используется при производстве эбонита, тормозных накладок, кремов для эпиляции.
Купить гашеную известь по хорошей цене, в розницу и оптом, с доставкой или самовывозом можно в химическом магазине PrimeChemicalsGroup.
Применение извести вместе с удобрениями | Статья
Известь незаменима в сельском хозяйстве: она помогает менять кислотность почвы, бороться с вредителями и сорняками.
Все о гашеной извести: состав, описание, получение и обработка
Известь — это обработанный известняк (оксид кальция), в своем изначальном состоянии комовой материал, который плохо перемешивается с землей и требует дополнительной обработки. Перед применением ее нужно погасить: смешать с холодной водой в соотношении 1:1.
Для гашения подходит только железная эмалированная посуда и только холодная вода, которую надо вводить небольшими порциями, постоянно перемешивая. При взаимодействии с горячей водой образуются нерастворимые соединения.
Реакция проходит с выделением большого количества тепла, в результате оксид кальция переходит в гидроксид, а само вещество распадается на мелкие частицы, которые легко использовать в дальнейшем.
Известь для изменения кислотно-щелочного баланса
Картофель, томаты, тыква и некоторые другие сельскохозяйственные культуры лучше растут в кислой почве. Но остальные — огурцы, капуста, кабачки, перец, лук, свекла, сельдерей — предпочитают земли с высоким значением рН. Для них раз в 3-4 года проводится известкование почвы.
Для этого в осенний или весенний период (при вскапывании участка) на глубину 20 см в почву вводят гашеную известь. Ее количество зависит от рН (его можно измерить с помощью обычной лакмусовой бумажки). При осенней обработке вещество полностью усваивается к моменту посадок, при весенней — понемногу растворяется в грунте в течение сезона.
Также известь можно добавить в компост, чтобы предотвратить его закисление.
Известь для борьбы с сорняками и вредителями
Известкование почвы уничтожает корни и побеги сорняков, которые предпочитают кислую среду: клевера, пырея, мокрицы, лютиков, хвоща.
Также после обработки сокращается численность проволочника и медведки: эти вредители плохо переносят щелочные почвы.
Процедура внесения добавки не меняется, но количество вещества нужно строго рассчитывать, чтобы не допустить перенасыщения субстрата кальцием.
Известь для защиты плодовых деревьев
Мягкая щелочь — Справочник химика 21
Первым химиком-пневматиком был англичанин Дж. Блэк (1728—1799). Он был врачом, и первые его исследования стояли 3 связи с медицинскими проблемами. В 1756 г. он стал профессором университета в Глазго, а через 10 лет перешел в Эдинбургский университет. Докторскую работу Дж. Блэк посвятил разработке рецепта препарата, растворяющего камни в мочевом пузыре. Для этой цели в те времена применяли едкие щелочи. Имея в виду смягчить действие щелочи, Дж. Блэк приступил к изучению причины едкости щелоче ., объясняемой наличием в них аристотелевского огня . Осуществив переход от мягкой щелочи к едкой — от карбоната кальция к едкой извести, Дж. [c.51]
В трудах арабских алхимиков приводятся подробные описания способа повышения едкости поташа и соды. Последние были названы мягкими щелочами в отличие от едких щелочей, которые получались при обработке мягких щелочей известью. Название едкие щелочи до сих пор сохранилось в химии. [c.12]
Последние были названы мягкими щелочами в отличие от едких щелочей, которые получались при обработке мягких щелочей известью. Название едкие щелочи до сих пор сохранилось в химии. [c.12]
При растворении известняка и полученной из него негашеной извести расходовалось равное количество кислоты и получалось одинаковое количество одной и той же соли. Но в первом случае энергично выделялись пузырьки, тогда как во втором случае растворение протекало спокойно, без шипения. Далее, добавление мягкой щелочи к раствору полученной соли вызывало выпадение осадка, вес которого после высушивания оказывался равным весу первоначально взятого известняка, а свойства совпадали со свойствами последнего. В частности, он снова растворялся в кислотах с шипением и выделением пузырьков. [c.18]
Превращение мягких щелочей в едкие при действии извести выражается уравнением [c.19]
Фиксируемый воздух (углекислота] переходит из мягкой щелочи к извести, причем образуется мягкая земля [мел], т. е. [c.19]
е. [c.19]
Следовательно, по Блэку мягкие щелочи родственны мягким землям и мягкая щелочь является соединением фиксируемого воздуха с веществом, аналогичным извести. [c.19]
Желая смягчить действие подобных средств, Блэк прежде всего занялся изучением природы едкости щелочей. Как и его современники, он полагал, что едкость щелочей связана с наличием в их составе элемента-огня. Так, считалось, что известняк при сильном прокаливании превращается в едкую известь вследствие присоединения огненной материи . Но изучая переход от мягкой щелочи (известняка) к едкой (извести), Блэк убедился в ошибочности таких представлений. Он нашел, что при прокаливании известняка к нему не только не присоединяется какая-либо материя, а наоборот, прокаливание сопровождается выделением из известняка значительного количества воздуха . После тщательного изучения свойств этого воздуха Блэк назвал его фиксируемым воздухом , так как оказалось, что этот воздух легко поглощается — фиксируется (связывается) едкими щелочами, например раствором едкой извести. [c.294]
[c.294]
Природные известняки и мраморы (необожженные) также относили к мягким щелочам, ибо они шипели и вскипали от кислот. Это свойство исчезало после обжига, при котором известь из мягкой становилась едкой. Появление едких свойств теория флогистона объясняла очень просто подвергаясь при обжиге действию огня, известь поглощает огненную материю , которая и сообщает ей едкость . [c.79]
При добавлении к раствору мягкой щелочи некоторого количества едкой извести огненные частицы, которые в ней содержатся, вмешиваются в эту соль и делают ее более едкой, более действительной . Так говорилось в одном учебнике химии, вышедшем в 1675 году. [c.79]
Таким аппаратом решил воспользоваться и Блэк, желавший поймать огненную материю . Он поместил в сосуд отвешенное количество прокаленной извести, соединил его трубкой с наполненным водой приемником газа и стал ждать. Прошло несколько дней. Известь утратила свою едкость. Однако это не сопровождалось выделением какого-либо газообразного вещества. Наоборот, Блэк обнаружил значительное уменьшение объема находящегося в приборе воздуха. Он взвесил известь, заметно изменившую свой вид, и установил, что вес ее увеличился. Отсюда вытекало, во-первых, что едкая известь поглотила часть воздуха, и, во-вторых, что различие между едкими и мягкими щелочами зависит вовсе не от огненной материи . [c.80]
Наоборот, Блэк обнаружил значительное уменьшение объема находящегося в приборе воздуха. Он взвесил известь, заметно изменившую свой вид, и установил, что вес ее увеличился. Отсюда вытекало, во-первых, что едкая известь поглотила часть воздуха, и, во-вторых, что различие между едкими и мягкими щелочами зависит вовсе не от огненной материи . [c.80]
Тогда Блэк взял употребляемое в медицине вещества, добываемое из морской воды, — магнезию. Мягкая магнезия обладает всеми свойствами мягких щелочей — вскипает с кислотами, после прокаливания становится едкой. Блэк обратил внимание на интересный факт при прокаливании вес мягкой магнезии сильно уменьшается, образующаяся в результате прокаливания едкая магнезия не вскипает от действия кислот, но дает с ними точно такие же соли, как и мягкая магнезия. А это значит, что мягкие щелочи — сложные, а яе элементарные тела, ибо они распадаются при прокаливании на едкую щелочь и какое-то другое вещество, от ко- [c.80]
Из всех мягких щелочей при прокаливании выделялся один и тот же газ, причем вес его всегда был равен разнице в весе между мягкой щелочью и образовавшейся из нее едкой щелочью. [c.81]
[c.81]
Абсолютного доказательства строения, приписываемого метатиазину, предложено не было. Если метатиазин обработать мягкой щелочью, то происходит дальнейшая перегруппировка его в вещество, которому приписывается строение 2-меркапто-З-фенилпиримидина. Постулированный механизм показан [c.490]
В XVII и даже XVIII в. едкие щелочи, которыми пользовались химики, были сильно загрязнены мягкими щелочами. [c.12]
Состав мягких щелочей. Результаты своих исследований Блэк (1728—1799) изложил в диссертации Опыты с белой магнезией [magnesia alba — Mg O.,], известью и другими щелочными веществами (1756). [c.18]
Один из основоположпиков аналитической химии. Изучал (1755) состав и свойства едких и мягких щелочей, установив, что разница между ними заключается в наличии в составе мягких щелочей фиксируемого воздуха — углекислого газа. Выделил (1756) углекислый газ при обжиге извест- [c.62]
Несмотря на ясность и доказательность выводов Блэка, в то время еще приверженца теории флогистона, его исследования многие ученые подвергли критике и даже нападкам. Против представлений Блэка о причине едкости щелочей выступпл, в частности, немецкий химик И. ф. Мейер, который, в противовес мнению Блэка, считал, что при прокаливании известняка и белой магнезии теряется не фиксируемый воздух , а лишь вода и что переход от мягкой щелочи к едкой связан с поглощением из огня особой жирной кислоты a idum pingue). Вслед за Мейером взгляды [c.295]
Против представлений Блэка о причине едкости щелочей выступпл, в частности, немецкий химик И. ф. Мейер, который, в противовес мнению Блэка, считал, что при прокаливании известняка и белой магнезии теряется не фиксируемый воздух , а лишь вода и что переход от мягкой щелочи к едкой связан с поглощением из огня особой жирной кислоты a idum pingue). Вслед за Мейером взгляды [c.295]
Этап получения элементов в свободном состоянии путем электролиза (Г. Дэви, 1807—1808 гг.) и химическим путем калий, натрий, кальций, стронций, барий и магний. Все они, впрочем, и ранее были известны в виде огнепостоянных (едких) щелочей и щелочных земель, или мягких щелочей. [c.352]
Один из основоположников пневматической химии и термохимии. Изучал (1754) состав и свойства едких и мягких щелочей, установив, что разница между ними заключается в надшчии в составе мягких щелочей связанного воздуха — углекислого газа. Выделил (1754) углекислый газ при обжиге известняка и белой магнезии (карбоната магния) и показал, что газ легко поглощается едкими щелочами.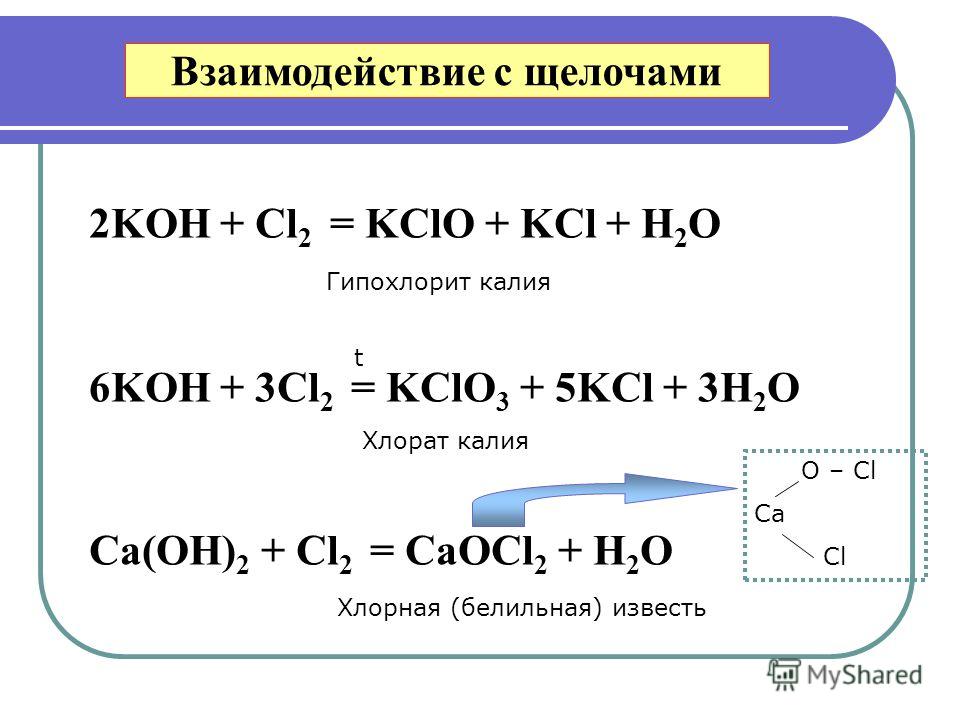 Установил, что выделение углекислого газа из известняка и белой магнезии достигается также при действии на них к-т. В исследованиях пользовался весами и точно определял потерю в массе мягких щелочей при выделении из них газа. Изобрел калориметр. Ввел (1759—1763) понятия скрытой теплоты, теплоемкости и впервые измерил теплоты плавления указал на различие между кол-вом теплоты и ее интенсивностью (т. е. т-рой). Способствовал ниспровержению теории флогистона. [c.56]
Установил, что выделение углекислого газа из известняка и белой магнезии достигается также при действии на них к-т. В исследованиях пользовался весами и точно определял потерю в массе мягких щелочей при выделении из них газа. Изобрел калориметр. Ввел (1759—1763) понятия скрытой теплоты, теплоемкости и впервые измерил теплоты плавления указал на различие между кол-вом теплоты и ее интенсивностью (т. е. т-рой). Способствовал ниспровержению теории флогистона. [c.56]
Щелочь. Основания. Свойства оснований
Нерастворимое основание: гидроксид меди
Основания — называют электролиты, в растворах которых отсутствуют анионы, кроме гидроксид-ионов (анионы — это ионы, которые имеют отрицательный заряд, в данном случае — это ионы OH — ). Названия оснований состоят из трёх частей: слова гидроксид, к которому добавляют название металла (в родительном падеже). Например, гидроксид меди (Cu(OH)2).
Например, гидроксид меди (Cu(OH)2).
Для некоторых оснований могут используются старые названия, например гидроксид натрия (NaOH) — натриевая щелочь.
Едкий натр, гидроксид натрия, натриевая щелочь, каустическая сода — всё это одно и тоже вещество, химическая формула которого NaOH. Безводный гидроксид натрия — это белое кристаллическое вещество. Раствор — прозрачная жидкость, на вид ничем не отличимая от воды. При использовании будьте осторожны! Едкий натр сильно обжигает кожу!
В основу классификации оснований положена их способность растворяться в воде. От растворимости в воде зависят некоторые свойства оснований. Так, основания, растворимые в воде, называют щелочью. К ним относятся
гидроксиды натрия (NaOH), гидроксид калия (KOH), лития (LiOH), иногда к их числу прибавляют и гидроксид кальция (Ca(OH)2)), хотя на самом деле — это малорастворимое вещество белого цвета (гашенная известь).
Получение оснований
Получение оснований и щелочей может производиться различными способами. Для получения щелочи можно использовать химическое взаимодействие металла с водой.
Такие реакции протекают с очень большим выделением тепла, вплоть до воспламенения (воспламенение происходит по причине выделения водорода в процессе реакции).
2Na + 2H2O → 2NaOH + H2
Негашенная известь — CaO
CaO + H2O → Ca(OH)2
Но в промышленности эти методы не нашли практического значения, конечно кроме получения гидроксида кальция Ca(OH)2.
Получение гидроксида натрия и гидроксида калия связано с использованием электрического тока. При электролизе водного раствора хлорида натрия или калия на катоде выделяются водород, а на аноде — хлор, при этом в растворе, где происходит электролиз, накапливается щелочь!
KCl + 2H2O →2KOH + H2 + Cl2 (эта реакция проходит при пропускании электрического тока через раствор).
Нерастворимые основания осаждают щелочами из растворов соответствующих солей.
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Свойства оснований
Щелочи устойчивы к нагреванию. Гидроксид натрия можно расплавить и расплав довести до кипения, при этом он разлагаться не будет.
Щелочи легко вступают в реакцию с кислотами, в результате которого образуется соль и вода. Эта реакция ещё носит название — реакция нейтрализации
KOH + HCl → KCl + H2O
Щёлочи взаимодействуют с кислотными оксидами, в результате которой образуется соль и вода.
2NaOH + CO2 → Na2CO3 + H2O
Нерастворимые основания, в отличии от щелочей, термически не стойкие вещества. Некоторые из них, например, гидроксид меди, разлагаются при нагревании,
Некоторые из них, например, гидроксид меди, разлагаются при нагревании,
Cu(OH)2 + CuO → H2O
другие — даже при комнатной температуре (например, гидроксид серебра — AgOH).
Нерастворимые основания взаимодействуют с кислотами, реакция происходит лишь в том случае, если соль, которая образуется при реакции, растворяется в воде.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Растворение щелочного металла в воде с изменение цвета индикатора на ярко-красный
Щелочные металлы — такие металлы, которые при взаимодействии с водой образуют щелочь. К типичному представителю щелочных металлов относится натрий Na. Натрий легче воды, поэтому его химическая реакция с водой происходит на её поверхности. Активно растворяясь в воде, натрий вытесняет из неё водород, при этом образуя натриевую щелочь (или гидроксид натрия) — едкий натр NaOH.
Реакция протекает следующим образом:
2Na + 2H2O → 2NaOH + H2
Подобным образом ведут себя все щелочные металлы.
Если перед началом реакцией в воду добавить индикатор фенолфталеин, а затем опустить в воду кусочек натрия, то натрий будет скользить по воде, оставляя за собой ярко розовый след образовавшейся щелочи (щелочь окрашивает фенолфталеин в розовый цвет)
Гидроксид железа
Гидроксид железа является основанием. Железо, в зависимости от степени его окисления, образует два разных основания: гидроксид железа, где железо может иметь валентности (II) — Fe(OH)2 и (III) — Fe(OH)3.
Как и основания, образованные большинством металлов, оба основания железа не растворимы в воде.
Гидроксид железа 3-х валентного
Гидроксид железа (II) — белое студенистое вещество (осадок в растворе), которое обладает сильными восстановительными свойствами. К тому же, гидроксид железа (II) очень не стойкий. Если к раствору гидроксида железа (II) добавить немного щёлочи, то выпадет зелёный осадок, который достаточно быстро темнеет о превращается в бурый осадок железа (III).
К тому же, гидроксид железа (II) очень не стойкий. Если к раствору гидроксида железа (II) добавить немного щёлочи, то выпадет зелёный осадок, который достаточно быстро темнеет о превращается в бурый осадок железа (III).
Гидроксид железа (III) имеет амфотерные свойства, но кислотные свойства у него выражены значительно слабее. Получить гидроксид железа (III) можно в результате химической реакции обмена между солью железа и щёлочью. Например
Fe2(SO4)3 + 6 NaOH → 3 Na2SO4 +2 Fe(OH)3
Что такое едкая щелочь и чем она опасна? | Вечные вопросы | Вопрос-Ответ
У берегов Японии в пятницу, 30 сентября, терпит бедствие танкер с едкой щелочью. Предотвратить экологическую катастрофу пытаются экстренные службы.
Едкая щелочь — это растворимые в воде гидроокиси металлов (едкое кали, едкий натр, едкая известь, едкий барит). На воздухе они активно «растекаются», поглощая пары воды из воздуха. Едкая щелочь хорошо растворяется в воде, выделяя при этом огромное количество теплоты, что может негативно сказаться на морской экосистеме.
На воздухе они активно «растекаются», поглощая пары воды из воздуха. Едкая щелочь хорошо растворяется в воде, выделяя при этом огромное количество теплоты, что может негативно сказаться на морской экосистеме.
Едкая щелочь опасна для человека, она обладает свойством разъедать кожу, оставляя сильные ожоги. Водные окиси щелочных металлов проникают глубоко в ткани, вызывая обширные поражения. Концентрированные или мало разведенные едкие щелочи обжигают и разрушают все слизистые оболочки полости рта, пищевода и желудка. При попадании в глаза могут вызвать слепоту.
Отравление щелочами встречается реже, чем кислотами. В качестве противоядий при отравлении вводят внутрь 1 % растворы лимонной, виннокаменной, уксусной или соляной кислот, слизистое питье с прибавлением тех же кислот, молоко, белковую воду, масляную эмульсию, лед кусочками.
При наружных ожогах применяют примочки из 5%-ных растворов вышеуказанных кислот и ванны из подкисленной воды.
Смертельная доза гидроксидов натрия и калия — 10-15 г. Смертельные исходы наблюдаются в 50% случаев отравления. Смерть может наступить в первые часы и сутки от ожогового шока, а в более поздние сроки — от пневмонии, массивных кровотечений и других причин.
Смертельные исходы наблюдаются в 50% случаев отравления. Смерть может наступить в первые часы и сутки от ожогового шока, а в более поздние сроки — от пневмонии, массивных кровотечений и других причин.
Каковы симптомы отравления едкой щелочью?
При отравлении едкой щелочью появляются сильная жажда, рвота, часто с кровью, а также кровавый понос. Возникают сильные боли во рту и по ходу пищеварительного тракта, приводящие к развитию болевого шока. В результате ожога и отека горла может возникнуть асфиксия (удушение). Одновременно отмечается поражение почек и печени. В остром периоде возможны повторные пищеводно-желудочные кровотечения и отек легких.
Где применяют едкую щелочь?
Едкая щелочь активно применяется в промышленности, а также в бытовых нуждах, при производстве моющих средств, к которым относятся мыло, шампунь и так далее. Гидроксид натрия, например, широко используется и в химической отрасли как реагент в различных химических реакциях, а также для обработки и нейтрализации кислоты.
Смотрите также:
Что такое никстамализация или почему тартильи сложно приготовить в Европе? ЧАСТЬ 1
В последние годы в любой престижной мировой кулинарной школе студенты изучают технику с непонятным названием Никстамализация. Так что же скрывается за этим термином? И почему эта техника так важна?
Никстамализация – это древний процесс, который позволяет сделать кукурузу более питательной и собственно превращает ее в тесто для тортильи.
Традиционная мексиканская кухня, как и многие другие кухни мира, была основана на необходимости выживать, используя то, что доступно в окружающей среде. Если брать пищу животного происхождения, употребляемую в Мексике, используются все части животного, включая даже менее ценные, например, голову, язык и щеки, а также глаза, уши, яички, губы, хвост и кишки. Эти «недооцененные части животных», наряду с другими видами пищи, включая некоторые дикие растения и насекомые, являются сутью того, что миру известно как «тако».
Изобретение тако часто приписывают Писателю Хорхе Ибаргуэнгойтия, которое он творчески описывает так:
«Я хочу придумать что-то такое, чтобы оно было без тарелки, ложки, салфеток и скатерти, которое не нужно мыть, и гарантирующее, что то, что кладется в мой рот, никогда не касалось губ другого человека».
Тако – это идея, которая, как и бутерброд, пицца, суши и кебаб, стала глобальной. Во всем мире для приготовления тако используют кукурузные тортильи, но эти лепешки часто изготовлены из некачественной промышленной муки, замороженные или высушенные, или законсервированы другим способом для перевозок на большие расстояния. В результате получается дорогая мексиканская пища, приготовленная без души. Некоторые прилагают дополнительные усилия, чтобы привезти хорошую кукурузную муку из разных частей Мексики, но это довольно сложно.
Интересно, что, хотя кукуруза является традиционным ингредиентом тортильи для тако, приготовление именно мексиканской тортильи требует использования особенной технологии. Именно никстамализация придает лепешкам особый вкус.
Именно никстамализация придает лепешкам особый вкус.
Само слово «никстамализация» происходит от науаских слов nixtli (пепел) и tamalli (тесто).
Можно предположить, что использование пепла в приготовлении пищи произошло случайно. Возможно, слабощелочная зола от огня попала в горшок, в котором готовилась кукуруза, и это сделало ее хорошо усвояемой пищей. Открытие более сильных щелочей, таких как негашеная известь (оксид кальция, CaO), получаемой из карбоната кальция (CaCO3), а также гидроксида кальция (Ca(OH)2), получаемого путем гашения извести (CaO) водой, могло сделать процесс более эффективным и последовательным, помогая кукурузе стать здоровым и быстро готовящимся тестом.
Стандартный метод, основанный на традиционном способе приготовления:
чтобы никстамализировать кукурузу, следует варить зерна кукурузы в 1% растворе гидроксида кальция (также известного как гашеная известь) при 80° C в течение часа, затем снять с огня и настаивать в течение 16-18 часов в том же растворе.
Когда сушеная кукуруза настаивается в теплом щелочном растворе, происходит ряд полезных химических превращений.
Почти сразу же цвет кукурузы становится ярче и усиливается по мере того, как повышение среды рН изменяет его пигментные соединения, усиливая желтизну ксантофиллов, а в некоторых сортах, делает розовые антоцианы темнее.
Бледно-белая кукуруза становится желтой; желтая кукуруза становится оранжевой; темно-фиолетовая кукуруза превращается в ярко-красную.
Затем, сложный, но привлекательный аромат разлетается и заполняет кухню. Этот маслянистый, насыщенный «аромат кукурузных чипсов» состоит из комбинации ароматических химических веществ, которые в мельчайших количествах присутствуют в никстамализированной кукурузе.
После настаивания следует слить и промыть несколько раз никстамализированную кукурузу (ее также называют «никстамал»), чтобы удалить оставшийся кальций и ослабленный внешний слой с зерен (но не весь).
Теперь кукуруза готова и ее нужно измельчить вручную с помощью больших каменных жернов под названием «metate», что буквально означает «ручной камень». Содержание воды в тесте должно составлять около 55% . Поэтому, иногда, во время помола следует добавить немного воды. Полученное тесто называется masa.
Давайте поговорим о химических реакциях, происходящих во время процесса. Их сложно описать лучше, чем это сделал МакГи:
«Один из основных клееобразных компонентов стенок клеток растений, гемицеллюлоза, хорошо растворяется в щелочных условиях. Никстамализация смягчает оболочку зерна и частично отделяет ее от остальной части ядра, так что ее можно растереть и смыть … в тоже время, высвобождается большая часть связанного ниацина, что позволяет нам делать пищу более полезной».
Во время настаивания [в щелочном растворе после варки] щелочная среда насквозь смягчает оболочку и стенки клеток, заставляет белки связываться друг с другом и растворяет часть масел и эмульгаторов зерен. После настаивания щелочной раствор и размягченные оболочки смываются, а ядра, в том числе проростки, измельчают каменными жерновами для получения тестообразного материала, называемого masa. С помощью каменного помола, ядра измельчаются, разминаются, и замешивается тесто, в котором много крахмала, белка, масел, эмульгаторов и клетчатки, а также кальция с известкового раствора. При дальнейшем замешивании эта комбинация превращается в вязкое пластичное тесто». Помимо размывания околоплодника, частичная желатинизация крахмалов в ядре во время приготовления дополнительно помогает последующему образованию эластичного теста.
После настаивания щелочной раствор и размягченные оболочки смываются, а ядра, в том числе проростки, измельчают каменными жерновами для получения тестообразного материала, называемого masa. С помощью каменного помола, ядра измельчаются, разминаются, и замешивается тесто, в котором много крахмала, белка, масел, эмульгаторов и клетчатки, а также кальция с известкового раствора. При дальнейшем замешивании эта комбинация превращается в вязкое пластичное тесто». Помимо размывания околоплодника, частичная желатинизация крахмалов в ядре во время приготовления дополнительно помогает последующему образованию эластичного теста.
Проще говоря, никстамализация:
— разрушает ряд белков и углеводов в кукурузе, и производит летучие соединения»;
— может способствовать растворению в воде ароматических соединений, которые обычно в ней не растворяются»;
— размягчение кукурузной структуры позволяет высвобождать летучие ароматические соединения, которые раньше были ограничены жесткой структурой зерна.
Между тем, щелочной раствор, кислотный баланс которого составляет Ph 12,4, частично разрушает клеточные стенки зерна. Повара, которые работают с кальцием, должны быть осторожны и не допустить его попадания на кожу и другие чувствительные органы, чтобы избежать раздражения. Не забудьте тщательно промыть никстамал после настаивания, чтобы хорошо вымыть любые остатки кальция. Из-за высокой щелочности промывочной воды следует придерживаться определенных мер безопасности при проведении никстамализации в больших объемах во избежание проблем с загрязнением окружающей среды.
Два компонента жестких клеточных стенок кукурузного зерна – пектин и гемицеллюлоза – растворяются в процессе никстамализации, теряя жесткую кристаллическую структуру, которая придает прочность кукурузному зерну. Это заставляет твердую, блестящую оболочку зерна смягчиться и отделиться, и ее можно затем легко стереть и смыть, когда сливается щелочной раствор.
Эти вязкие растворенные молекулы пектина, которые находятся внутри зерна, а также и в каком-то проценте оболочки, которую шеф-повар специально оставит в смеси, – это то, что позволит превратить кукурузу в вязкое тесто после его помола. Каким образом? Отдельные молекулы пектина имеют форму длинных ветвящихся цепей. Когда возле них появляется кальций – он присутствует в растворе гидроксида кальция, используемом в процессе никстамализации – пектиновые цепи захватывают друг друга. Так происходит явление, называемое образованием поперечных межмолекулярных связей. Этот процесс образует сетку пектина, которая удерживается в воде, делая из нее желе. (Пектиновое желе – также активный ингредиент джемов и фруктовых желе, придающим им всем известную консистенцию.) Также некоторые молекулы пектина и гемицеллюлозы разрушаются во время никстамализации, освобождая вязкие сахара, помогающие связывать текстуру теста.
Каким образом? Отдельные молекулы пектина имеют форму длинных ветвящихся цепей. Когда возле них появляется кальций – он присутствует в растворе гидроксида кальция, используемом в процессе никстамализации – пектиновые цепи захватывают друг друга. Так происходит явление, называемое образованием поперечных межмолекулярных связей. Этот процесс образует сетку пектина, которая удерживается в воде, делая из нее желе. (Пектиновое желе – также активный ингредиент джемов и фруктовых желе, придающим им всем известную консистенцию.) Также некоторые молекулы пектина и гемицеллюлозы разрушаются во время никстамализации, освобождая вязкие сахара, помогающие связывать текстуру теста.
В тесте «masa» эти желеобразные молекулы удерживают воду, то есть молекулы воды прилипают к другим молекулам воды, поэтому «masa» держится вместе до тех пор, пока в нем присутствует влага. Но тесто не остается влажным надолго. Влага испаряется, а также извлекается из структуры теста и поглощается присутствующими в нем крахмалами, и там влага уже не помогает тесту «masa» быть эластичным.
Как применить никстамализацию к другим зерновым культурам.
Часть 2 Применение никстамилизации к зерновым культурам Европы
по материалам: Nordic Food Lab и Cook’s Science
Цветная побелка стен и потолков известью и мелом
Цветная побелка стен и потолков – это классическая белая побелка известью или мелом, в которую вводится пигмент (краситель).
Цвет пигмента и его количество являются определяющими в получении декоративного покрытия побелки – конечный цвет, его насыщенность и укрывистость (непрозрачность).
В быту для многих слово «побелка» ассоциируется непременно с белым цветом. Это обусловлено тем, что меловая (известковая) побелка изначально белого цвета, поэтому в 99% побелка выполнялась именно в таком виде. Применение красителя сводилось к использованию одного пигмента – ультрамарин (синька). Колеровка в другие цвета выполнялась крайне редко. Столь редкое применение других пигментов основано на незнании, что побелку можно колеровать, как это делать, какой пигмент использовать. Понимание и умение колерования известковой (меловой) побелки способны значительно расширить возможности использования побелки.
Понимание и умение колерования известковой (меловой) побелки способны значительно расширить возможности использования побелки.
Как сделать (приготовить) цветную побелку
Известковая цветная побелка
Гашеная известь — это щелочь, поэтому может быть колерована только сухими щёлочеустойчивыми пигментами (жидкие красители для в/э красок щелочь съест, исключение — универсальные жидкие пигменты, в описании которых сказано о их совместимости с известковыми пастами, растворами). Для этого в уже готовую известковую смесь (как развести известь см. здесь) вводят щелочеустойчивый колер: окись хрома – зелёный, железный сурик – красно-коричневый, охра – жёлтый, ультрамарин – синий, умбра – коричневый, сажа – чёрный и другие. При этом нужно учесть, что большое количество пигмента (более 5% от массы извести) значительно снижает прочность и срок службы цветной известковой побелки. Поэтому получить яркий насыщенный цвет, не во вред эксплуатационным характеристикам покрытия, практически невозможно – как правило, это приглушённые оттенки основных цветов.
Цветная побелка известью является светоустойчивым, декоративным покрытием и обладает антисептическими, антиплесневыми свойствами, и может применяться: по старой известковой побелке, при наружной отделки жилых домов, стены и потолки различного рода помещений, фасадов зданий, заборов, подвалов, погребов и других помещений подверженных воздействию сырости.
Меловая цветная побелка
В отличие от гашеной извести мел не является щёлочью, и может быть колерован как сухими пигментами, так и жидкими. Для этого в уже готовую меловую смесь (как развести мел см. здесь) добавляют колер нужного цвета. При этом нужно учитывать, что цвет сырой колерованной побелки темнее чем он же в высохшем виде на поверхности. Поэтому, для получения максимально желаемого цвета, необходимо выполнять «выкраски».
Цветная побелка мелом применима только внутри, в сухих помещениях не подверженных воздействию сырости (дома, квартиры, цеха, склады, школы, садики, побелка по старой меловой побелке, производственные помещения и т. д). При этом, цветная побелка мелом, в отличие от известковой, мажется и берётся руками.
д). При этом, цветная побелка мелом, в отличие от известковой, мажется и берётся руками.
Какие цвета получаются при смешивании красителей с побелкой
Так как известковая и меловая побелка белого цвета, то смешивание цветов происходит между основным белым и пигментом (белый + пигмент). При таком сочетании получаются цвета в пастельной палитре. Количество добавляемого красителя определяет оттенок конечного цвета.
Таблица колеровки побелки
| Базовый + пигмент | Получаемый цвет | Пример |
| Белый + красный | розовый, светло-розовый | |
| Белый + синий | голубой, светло-синий | |
| Белый + зелёный | пастельно-зелёный | |
| Белый + коричневый | светло-коричневый, бежевый | |
| Белый + чёрный | серый, светло-серый |
Полученные цвета являются наиболее простым и удачным результатом сочетания побелки с красителем. В более сложном варианте к основному цвету могут добавляться два и более пигмента (напр. чтобы получить цвет морской волны: белый + зеленый и чёрный в определённой пропорции). А некоторые цвета и вовсе получить невозможно (напр. чёрный)
В более сложном варианте к основному цвету могут добавляться два и более пигмента (напр. чтобы получить цвет морской волны: белый + зеленый и чёрный в определённой пропорции). А некоторые цвета и вовсе получить невозможно (напр. чёрный)
Цветная побелка — нанесение (видео)
Смотрите больше Наших работ (фото + видео)
Цветная побелка — Цены на услуги 2021 г
Наименование услуги | Цена* (грн/м²) | |
| от 300м² | от 2000м² | |
| Побелка мелом (цвет: серый, светло-серый, голубой, светло-синий, розовый, коричневый, бежевый) | от 22 | от 20 |
| Побелка мелом (цвет: пастельно-зеленый) | от 24 | от 22 |
| Побелка известью (цвет: серый, светло-серый, голубой, светло-синий, розовый, коричневый, бежевый) | от 26 | от 24 |
| Побелка известью (цвет: пастельно-зеленый) | от 28 | от 26 |
| Обеспыливание поверхности | от 5 | от 3 |
| Смывка (счистка) старой побелки — мокрый способ | от 35 | от 28 |
| Пескоструйная очистка старой побелки — сухой способ | от 80 | от 70 |
В «Цену» входит: работа + материал
- в «работу» входит: цветная побелка
- в «материал» входит: клей, краситель, соль, мел или известь
* +2 грн. помещение высотой h = от 3 м. до 8 м.
помещение высотой h = от 3 м. до 8 м.
* +4 грн. помещение высотой h = от 8 м. до 15 м.
* +2 грн. при необходимости дополнительной подготовки поверхности локально до 20% (счистка плохо держащейся побелки, штукатурки, краски, шпатлевки)
* + доп. работы и материалы по укрывке (защите) пола, окон, дверей, коммуникаций и т.д.
* окончательную цену определяет специалист после осмотра объекта.
Примечание
Выполняем побелку объёмом более 300 м.кв.: производственные помещения, промышленные комплексы, склады, цеха, ангары, подвалы, СТО, фасады зданий, спорткомплексы, школы, классы, аудитории, детские садики. За комнаты, квартиры, дома — не беремся.
Дополнительные телефоны: (044) 223-14-16 (098) 716-14-12 (099) 966-54-00 или пишите (отправляйте фото) нам на [email protected] и Viber.
Работаем не только в г. Киеве и Киевской обл., готовы выехать в любой город Украины.
Не пропустите скидки, акции и интересные публикации, подписывайтесь в Facebook Instagram
Смотрите также:
Побелка мелом. Как развести мел для побелки. Применение меловой побелки
Как развести мел для побелки. Применение меловой побелки
Побелка известью. Как приготовить известковый раствор для побелки
Известковая побелка с медным купоросом (дезинфекция) помещений
Побелка подвала. Преимущества побелки подвала известью
Побелка помещений. Преимущества выполнения работ побелкой
Побелка: мелом или известью? Что общего и отличительного
Ремонт после пожара. Как избавиться от запаха после пожара
Недорогой ремонт нежилых помещений
Побелка
Щелочной или щелочной | Дайджест Дайджест
Часто ответ на этот вопрос: «Да!» При определенных условиях почвы могут быть
содержать щелочь (общий термин для обозначения минеральных солей) и быть щелочной (иметь значение pH
выше 7,0). Тем не менее, я слышу, что эти термины часто используются как синонимы, но они
не эквивалентны. В этом первом посте я исследую нюансы разделения этих
общие почвенные условия Юты.
В качестве обзора: шкала pH, используемая для измерения кислотности или щелочности среды,
колеблется от низкого уровня 1,0 (сильнокислый) до высокого 14,0 (сильно щелочной или щелочной)
при нейтральном значении 7,0. Большинство почв во всем мире имеют рН от 5,0 до 5,0.
9,0 (от 6,5 до 8,5 в Юте). Почвы со значением pH выше 7,0 считаются щелочными и
при этих более высоких значениях pH часто забуферены различными карбонатными минералами, особенно
карбонат кальция (называемый кальцитом или известью) в почвах Юты и Межгорного Запада.
Щелочные почвы с высоким содержанием извести (часто называемые «известковые почвы») могут или не могут
иметь высокое содержание растворимых солей. Растворимые минеральные соли накапливаются в результате эвапотранспирации.
со временем из наших засушливых и полузасушливых почв, где удаление воды из поверхностных слоев
превышает осадки, оставляя соль позади. Сильное осаждение смывает такие соли
вне почв во влажных средах.Накопленные растворимые минеральные соли вместе
(и я мог бы добавить, архаично) называемые «щелочью», особенно соли основных катионов,
или элементы «щелочные металлы», то есть кальций, магний, калий и натрий.
В то время как щелочность определяется по pH, измеряется содержание растворимой соли (или щелочи).
по электропроводности почвы (ЕС). Растворенные соли в почвенных растворах проводят электрический ток.
тока и пропорционально, следовательно, более высокое значение ЕС пропорционально более высокому содержанию соли.В следующем посте мы рассмотрим влияние солей на почвы.
Любая почва со значением pH выше 7,0 является «щелочной», а любая почва, содержащая высоко растворимые
считается, что содержание соли содержит «щелочь», но может существовать любое условие, и часто
делает, независимо от другого. Следовательно, требуются оба измерения (pH и EC).
чтобы узнать, какие условия применяются.
Грант Кардон, специалист по расширенным грунтам УрГУ
Почтовое отправление:
«Белая щелочь» обычно используется для обозначения любых солевых отложений (от кремового до белого).
на поверхности почвы. Термин «черная щелочь» используется для обозначения почв с высоким содержанием натрия.
карбонатное содержание. Карбонат натрия снижает уровень pH в почвах выше 9,0. При этом
Карбонат натрия снижает уровень pH в почвах выше 9,0. При этом
Уровень pH, органическое вещество почвы (или гумус) в почвах может растворяться и впитываться в
поверхность почвы, придающая солевые отложения на поверхности почвы от темно-коричневого до черного цвета.
Для чего используется известь при очистке воды?
Известь — это промышленный продукт, изготовленный из известняка (карбонат кальция) или доломита (карбонат кальция и магния).Сырье перерабатывается в негашеную и гашеную известь. Поскольку он щелочной, его часто используют для регулирования pH воды и почв, содержащих кислые компоненты. Он используется для очистки как питьевой, так и сточной воды.
Общие типы продуктов извести для очистки воды
Обычный карбонат кальция или магния обрабатывается несколькими способами для создания химически разных продуктов для разных целей. Негашеную известь получают путем нагревания карбоната кальция в процессе, называемом «кальцинирование», с выделением диоксида углерода и оксида кальция.Негашеную известь можно дополнительно обработать путем измельчения и добавления небольшого количества воды для получения гашеной извести, также называемой гашеной известью, которая представляет собой гидроксид кальция.
Негашеную известь получают путем нагревания карбоната кальция в процессе, называемом «кальцинирование», с выделением диоксида углерода и оксида кальция.Негашеную известь можно дополнительно обработать путем измельчения и добавления небольшого количества воды для получения гашеной извести, также называемой гашеной известью, которая представляет собой гидроксид кальция.
Известь в умягчении воды
«Жесткая» вода содержит растворенные минеральные соединения, в том числе кальций и магний, которые удаляются в процессе умягчения. Может показаться нелогичным добавлять кальций в воду для удаления кальция из воды, но этот процесс использует химические реакции в среде с высоким pH для образования соединений кальция, которые осаждаются в твердые частицы, которые затем могут быть отфильтрованы.Например, бикарбонат кальция реагирует с известью с образованием карбоната кальция и воды.
Известь для очистки городских сточных вод
Как и в случае умягчения воды, известь повышает pH сточных вод, содержащих фосфор и азот из органических источников, что может вызвать цветение водорослей. В среде с высоким pH известь соединяется с фосфором с образованием фосфатов кальция, которые выпадают в осадок из воды в виде твердого вещества. «Отгонка аммиака» использует ту же среду с высоким pH для выпуска азота (в виде гидроксида аммония) в атмосферу в виде газа.
В среде с высоким pH известь соединяется с фосфором с образованием фосфатов кальция, которые выпадают в осадок из воды в виде твердого вещества. «Отгонка аммиака» использует ту же среду с высоким pH для выпуска азота (в виде гидроксида аммония) в атмосферу в виде газа.
Известь в очистке промышленных сточных вод
Во многих промышленных процессах — от горнодобывающей промышленности до производства стали и консервирования фруктов — образуются кислые сточные воды, которые необходимо очищать перед сбросом. Известь служит для нейтрализации кислот, а также для осаждения различных металлов в твердые частицы, которые можно извлечь. Другие, более едкие агенты, такие как каустическая сода, могут выполнять аналогичные функции, но известь дешевле и безопаснее в обращении, а образующийся шлам улавливает больше металлов с меньшей тенденцией к их выщелачиванию.
Щелочные ожоги | HealthLink BC
Обзор темы
Щелочные продукты включают продукты из извести, штукатурку и строительный раствор, очистители для духовок и канализации, порошки для посудомоечных машин, удобрения и искры от «бенгальских огней». Они могут вызвать серьезные повреждения за очень короткое время, в зависимости от типа, силы и продолжительности контакта щелочи с телом. Щелочные химические вещества способны проникать в более глубокие слои тканей и повредить их.
Они могут вызвать серьезные повреждения за очень короткое время, в зависимости от типа, силы и продолжительности контакта щелочи с телом. Щелочные химические вещества способны проникать в более глубокие слои тканей и повредить их.
При химическом ожоге выясните, какое химическое вещество вызвало ожог. Немедленно позвоните в токсикологический центр для получения дополнительной информации о том, как лечить ожог. Когда вы звоните в Центр по борьбе с отравлениями, возьмите с собой контейнер с химическим веществом, чтобы вы могли прочитать этикетку с содержимым сотруднику по борьбе с отравлениями.
Большинство химических ожогов сначала лечат путем смывания химического вещества с тела большим количеством прохладной воды, но не все химические вещества обрабатываются таким образом. Важно правильно лечить ожог, чтобы избежать дальнейших осложнений.
Химические ожоги промыть водой
- Немедленно промыть большим количеством прохладной воды.
 Полоскание в течение 1 минуты после ожога может снизить риск осложнений.
Полоскание в течение 1 минуты после ожога может снизить риск осложнений. - Промойте пораженный участок не менее 20 минут.
- Не используйте сильную струю воды, так как это может повредить место ожога.
- Попросите человека, получившего химический ожог, удалить химическое вещество, если он или она может.
- Наденьте перчатки, чтобы защитить себя от химического вещества, если вам нужно его удалить.
- Во время промывки зоны снимите всю одежду или украшения, на которых есть это химическое вещество.
- Если по прошествии 20 минут ощущение жжения не исчезнет, снова промойте пораженный участок проточной водой в течение 10–15 минут.
Химические ожоги без промывки водой
Некоторые щелочные ожоги усугубляются, если промыть (промыть) водой.
- Сухие порошки , такие как сухая известь, сначала удаляются щеткой, потому что добавление воды может привести к образованию горящей жидкости.
 Смахнув порошок, промывайте его водой в течение 20 минут.
Смахнув порошок, промывайте его водой в течение 20 минут. - Металлические соединения покрыты минеральным маслом.
Самая важная первая помощь при попадании химического вещества в глаза — это немедленно промыть вещество большим количеством воды, чтобы снизить вероятность серьезного повреждения глаз. Информацию о химическом ожоге глаз см. В разделе «Ожоги глаз».
Кредиты
Текущий по состоянию на:
26 июня 2019 г.,
Автор: Healthwise Staff
Медицинский обзор:
Уильям Х.Блахд-младший, доктор медицины, FACEP — неотложная медицина
Адам Хусни, доктор медицины, семейная медицина
Кэтлин Ромито, доктор медицины, семейная медицина
Мартин Дж. Габика, доктор медицины, семейная медицина
По состоянию на 26 июня 2019 г.
Автор: Healthwise Staff
Медицинский обзор: Уильям Х. Блахд-младший, доктор медицины, FACEP — неотложная медицина и Адам Хусни, доктор медицины — семейная медицина и Кэтлин Ромито, доктор медицины — семейная медицина и Мартин Дж. Габица MD — Семейная медицина
Щелочные ожоги | Мичиган Медицина
Обзор темы
Щелочные продукты включают продукты из извести, штукатурку и строительный раствор, средства для чистки духовок и канализации, порошки для посудомоечных машин, удобрения и искры от «бенгальских огней».«Они могут вызвать серьезные повреждения за очень короткое время, в зависимости от типа, силы и продолжительности контакта щелочи с телом. Щелочные химические вещества способны проникать и повреждать более глубокие слои тканей.
Когда произошел химический ожог, выясните, какое химическое вещество вызвало ожог. Немедленно позвоните в токсикологический центр , чтобы получить дополнительную информацию о том, как лечить ожог. Когда вы звоните в центр по борьбе с отравлениями, возьмите с собой контейнер с химическим веществом, чтобы вы могли прочитать этикетка с содержимым для сотрудника токсикологической службы.
Большинство химических ожогов лечится сначала путем смывания (смывания) химического вещества с вашего тела большим количеством прохладной воды, но не все химические вещества обрабатываются таким образом. Важно правильно лечить ожог, чтобы избежать дальнейших осложнений.
Химические ожоги промыть водой
- Немедленно промыть большим количеством прохладной воды. Полоскание в течение 1 минуты после ожога может снизить риск осложнений.
- Промойте пораженный участок не менее 20 минут.
- Не используйте сильную струю воды, так как это может повредить место ожога.
- Попросите человека, получившего химический ожог, удалить химическое вещество, если он или она может.
- Наденьте перчатки, чтобы защитить себя от химического вещества, если вам нужно его удалить.
- Во время промывки зоны снимите всю одежду или украшения, на которых есть это химическое вещество.
- Если по прошествии 20 минут ощущение жжения не исчезнет, снова промойте пораженный участок проточной водой в течение 10–15 минут.
Химические ожоги без промывки водой
Некоторые щелочные ожоги усугубляются, если промыть (промыть) водой.
- Сухие порошки , такие как сухая известь, сначала удаляются щеткой, потому что добавление воды может привести к образованию горящей жидкости. Смахнув порошок, промывайте его водой в течение 20 минут.
- Металлические соединения покрыты минеральным маслом.
Самая важная первая помощь при попадании химического вещества в глаза — это немедленно промыть вещество большим количеством воды, чтобы снизить вероятность серьезного повреждения глаз.Информацию о химическом ожоге глаз см. В разделе «Ожоги глаз».
Кредиты
Текущий по состоянию на:
26 февраля 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
Уильям Х. Блахд-младший, доктор медицины, FACEP — неотложная медицина
Адам Хусни, доктор медицины, семейная медицина
Кэтлин Ромито, доктор медицины — семейная медицина
H.Майкл О’Коннор, доктор медицины, неотложная медицина,
Мартин Дж. Габика, доктор медицины, семейная медицина,
По состоянию на: 26 февраля 2020 г.
Автор:
Здоровый персонал
Медицинский обзор: Уильям Х. Блахд младший, доктор медицины, FACEP — неотложная медицина и Адам Хусни, доктор медицины — семейная медицина и Кэтлин Ромито, доктор медицины — семейная медицина и доктор Х. Майкл О’Коннор — неотложная медицина и Мартин Дж.Габица MD — Семейная медицина
Британская ассоциация извести (BLA), входящая в Ассоциацию минеральных продуктов (MPA)
Нейтрализация кислоты:
Гашеная известь, негашеная или доломитовая известь смешивают с водой, чтобы получить щелочную суспензию, которая нейтрализует низкий pH кислот.
Известковое молоко также можно использовать, чтобы избежать использования оборудования для суспендирования. Часто во время реакции осаждается нерастворимая соль кальция, что может помочь удалить примеси из системы.
Газобетонные блоки:
Негашеную известь смешивают с цементом, песком, водой и алюминиевым порошком, чтобы получить суспензию, которая поднимается и затвердевает, образуя блоки с сотовой структурой, обладающие превосходными тепло- и звукоизоляционными свойствами.
Тепло, выделяемое при реакции негашеной извести с водой и щелочными условиями в сочетании с алюминиевым порошком, генерирует пузырьки водорода, которые заставляют блоки подниматься. Вырабатываемое тепло впоследствии вызывает затвердевание суспензии.Затем блоки нагревают в автоклаве, который способствует реакции между кальцием и силикатами в песке или PFA и придает дополнительную прочность. Доломитовая известь и / или модифицированная негашеная известь могут быть добавлены для уменьшения чрезмерной усадки или растрескивания, что становится все более актуальным для материалов, подвергающихся высоким нагрузкам, таких как оживленные дорожные развязки.
Сельское хозяйство:
Карбонат кальция, негашеная известь, доломитовая известь и гашеная известь
все это можно использовать для регулирования pH почвы для оптимального роста
условий и, следовательно, повышения урожайности.Использование негашеной извести,
гашеная известь и / или их смеси с карбонатом кальция и
Магниевый известняк поможет ускорить регулирование pH, что может
помогают лечить состояния.
Алюминий:
Негашеная известь может использоваться в качестве компонента смазок для непрерывного литья, а гашеная известь — в качестве носителя смазки при волочении проволоки.
Непрерывное литье можно использовать для материалов на основе различных металлов, таких как алюминий.Расплавленная прядь проходит через охлаждаемую форму, в результате чего образуется оболочка из затвердевшего металла. Кожа металла контактирует с формой, но высокотемпературные смазки предотвращают прилипание затвердевшего металла, позволяя расплавленной сердцевине ускользнуть. Металлы на основе алюминия затем можно использовать для самых разных целей — от строительства самолетов до жестяных банок.
Асфальт:
Гашеная известь может использоваться в качестве добавки к горячим асфальтовым смесям, повышая устойчивость асфальта к отгонке воды.Известь также действует как минеральный наполнитель и как антиоксидант.
- Удаление воды (также известное как чувствительность к воде) — многие смеси асфальт-заполнитель страдают потерей связи между вяжущим и заполнителем в присутствии воды. Это приводит к потере прочности, что приводит к преждевременному разрушению смеси. Поэтому используются многие вещества, препятствующие отслаиванию, включая известь, цемент, амины и диамины. Опыт США показал, что известь является наиболее подходящей для самого широкого диапазона заполнителей и асфальтов.
- Минеральный наполнитель — гашеная известь, добавляемая в качестве минерального наполнителя, увеличивает вязкость связующего, увеличивает жесткость, прочность на разрыв, прочность на сжатие и сопротивление водоотталкиванию. Все это увеличивает долговечность смеси.
- Антиоксидант — добавление гашеной извести снижает окисление связующего, которое вызывает затвердевание и повышение жесткости, что приводит к преждевременному разрушению горячих асфальтовых смесей.
Пожалуйста, обратитесь к Техническому разделу для получения более подробной информации.
Твердые биологические вещества:
Большое количество органических и неорганических шламов можно обрабатывать с помощью негашеной или доломитовой извести для увеличения содержания твердых частиц. Биологический отстой можно дезинфицировать, повысив температуру и pH за счет добавления этих материалов. С помощью этого метода возможно лечение биосолидами.
Пожалуйста, обратитесь к Техническому разделу для получения более подробной информации.
Кирпичей:
Кирпич из силиката кальция изготавливается путем смешивания негашеной или гашеной извести с кварцевым песком. Кирпичам придают форму, а затем нагревают в автоклаве, что способствует реакции между кальцием и силикатами в песке и придает дополнительную прочность.
Строение:
Изначально известь была основным материалом для производства бетона, но к концу 19 века была заменена на более качественное связующее, известное как портландцемент.Цемент имел много преимуществ по сравнению с продуктами на основе извести, поскольку производился из широкого спектра сырья, давал гораздо большую прочность и был более прочным, чем натуральная гидравлическая известь,
Однако известь по-прежнему играет важную роль в следующих областях:
- Для осушения, улучшения и стабилизации почв.
- Как компонент строительных растворов, штукатурок для наружных и внутренних работ.
- В качестве средства против отслаивания при производстве асфальта и гудронированного покрытия для дорожного строительства.
- В качестве связующего при производстве ряда автоклавированных изделий из силиката кальция (включая кирпич, газобетон, огнестойкие плиты и бетон).
Кирпич силикатный кальций:
Кирпич из силиката кальция изготавливается путем смешивания негашеной или гашеной извести с кварцевым песком. Кирпичам придают форму, а затем нагревают в автоклаве, что способствует реакции между кальцием и силикатами в песке и придает дополнительную прочность.
Химические вещества:
Одно из основных применений извести, доломитовой извести и их производных — это сырье при производстве широко используемых химикатов. Две основные области использования извести — это производство неорганических химикатов или присадок к маслам.
Известь или ее производные являются важными строительными блоками при производстве многих неорганических солей, таких как фосфат кальция, добавка к зубной пасте, цитрат кальция, добавка к продуктам питания и напиткам, и нитрит кальция, добавка для обработки осадка.
Гашеная известь широко используется в производстве масляных присадок к смазочным материалам, в частности сульфонатов, фенолятов и салицилатов. Присадки к маслу используются в качестве моющих средств и продлевают срок службы двигателей автомобилей, кораблей и т. Д. …
Корм для кур:
Известь сахарных заводов может использоваться как один из многих ингредиентов, необходимых для производства жизненно важных добавок к корму для кур. Создается смесь, которая затем сушится и затвердевает с образованием гранул.Добавки дают цыплятам для улучшения и увеличения прочности их яичной скорлупы. В целом добавка проста, эффективна и недорога в изготовлении и использовании.
Кроме того, гашеную известь можно добавлять в подстилку для кур, используемую на птицефабриках, для продления срока службы помета и обеспечения степени защиты от паразитов и болезней.
Загрязненная земля:
Загрязненные земли можно обрабатывать с помощью извести, доломитовой извести и / или известковых вяжущих смесей для регулирования pH и иммобилизации сульфатов, фосфатов и тяжелых металлов.
Десульфуризация:
Дымовые газы и кислотные сточные воды, содержащие оксиды серы, можно обрабатывать, вводя известняк, мел, негашеную или гашеную известь в виде порошка или суспензии, способствуя реакции с образованием нерастворимого сульфата кальция или гипса, которые затем можно собирать. Если этот процесс проводится в правильных условиях, можно получить товарный побочный продукт из гипса.
Питьевая вода:
«Гашеная» известь широко используется в производстве воды для потребления человеком, фактически, по количеству она даже конкурирует с хлором как основным химическим веществом, используемым при очистке воды.
Очистка воды состоит из нескольких основных процессов в зависимости от количества примесей, которые необходимо уменьшить. Они следующие:
- Удаление взвешенных / коллоидных веществ (помогает уменьшить вкус, запах и окраску).
- Снижение твердости.
- Снижение концентрации растворенных металлов.
- Дезинфекция.
- Регулировка pH.
В целом при очистке воды используется широкий спектр химикатов. Известь используется как щелочь и как источник ионов кальция.
Очистка сточных вод:
Известковые продукты широко используются для очистки сточных вод и сточных вод с целью:
- Нейтрализует кислоты
- Отрегулируйте pH перед дальнейшей обработкой или сбросом
- Металлы в осадке
- Осадок сульфата и фторида
- Уменьшить количество питательных веществ (фосфаты и азот)
- Изменить характеристики шламов, полученных в результате обработки
Более широкое использование извести, чем конкурирующих щелочей, отражает ее более высокую рентабельность, эффективность удаления большинства тяжелых металлов и лучшие физические и химические характеристики осадка, которые обычно достигаются.
Рыбоводство:
Уровень pH кислых прудов и озер можно контролировать и повышать с помощью гашеной извести. В целом это создает более благоприятную среду для водных организмов, в частности рыб. Поэтому рыбоводы используют известь для поддержания подходящей среды обитания для разведения рыбы.
Обработка дымовых газов:
Известь, являясь наиболее рентабельной щелочью, широко используется для удаления кислых газов, выбрасываемых электростанциями.
Технологии снижения кислотных газов на основе извести можно разделить на 5 групп:
- Мокрая очистка — , при которой газы обрабатываются молочной известью для удаления SO 2 (диоксид серы), а продукты нейтрализации удаляются в виде суспензии.
- Полусухая очистка — , при которой известковое молоко распыляется на газы для удаления SO 2 (диоксид серы), а продукты реакции удаляются с помощью пылесборника.
- Высокотемпературное (более 850 ° C) сухое нагнетание гашеной извести — , при котором кальцинированная известь и образующиеся оксиды кальция вступают в реакцию с кислыми газами (SO 2 ). Продукты реакции также удаляются с помощью пылесборника.
- Сухое впрыскивание гашеной извести при низких температурах (ниже 300 ° C) — удаляет HCl, HF и SO 2 . Аналогичным образом удаляются продукты реакции с помощью пылесборника.
- Низкотемпературная (ниже 300 ° C) абсорбция гашеной известью — в неподвижном слое, используемом для удаления гафния из печей для обжига керамических изделий.
СКАЧАТЬ ССЫЛКУ Grimsby Operations: обработка дымовых газов — 28 kb
Плодоводство:
По мере созревания яблок и других фруктов выделяется углекислый газ. При хранении углекислый газ снижает уровень кислорода в атмосфере и ускоряет порчу фруктов.За счет циркуляции воздуха вокруг фруктов и над гашеной извести уровень углекислого газа снижается, и фрукты остаются свежими и годными к употреблению дольше.
Остатки от переработки цитрусовых смешивают с известью, сушат и продают на корм скоту. Известь также можно использовать для нейтрализации отработанной лимонной кислоты и повышения pH фруктовых соков для стабилизации вкуса и цвета.
Производство стекла:
Хотя известняк обычно более рентабелен при производстве стекла, доломитовая известь и известь с высоким содержанием кальция в тонко измельченных формах также может использоваться при определенных обстоятельствах.Обожженная известь часто обеспечивает большую прозрачность стекла, чем известняк из-за:
- Низкое содержание органических веществ.
- Оксид железа присутствует в форме двухвалентного железа, а не трехвалентного железа.
Оба преимущества также снижают потребность в дорогостоящих добавках для обесцвечивания. Сообщается, что в процессах производства стекла с использованием средне- и мелкозернистых материалов замена известняка негашеной известью увеличивает скорость растворения и снижает потребность в тепле, тем самым увеличивая производственную мощность печи.
Известкование кислой почвы — Добавление извести
По на
Ваша почва кислая, и вы хотите изменить pH, чтобы она была менее кислой. Универсальный совет — добавить в почву известь, то есть известковать почву. Известь щелочная, она нейтрализует кислотность почвы и делает ее более нейтральной. Добавление извести, безусловно, работает, но есть одна загвоздка!
Anemone Pamina в садах Аспен Гроув
Что такое лайм?
Строго говоря, известь — это оксид кальция или гидроксид кальция, но этот термин также используется для описания широкого спектра кальцийсодержащих соединений.Сельскохозяйственная известь — это обычно карбонат кальция или известняк. Все эти почвенные кондиционеры нейтрализуют кислоты и делают их менее кислыми.
Известкование — что происходит с почвой?
Почва способна «буферизовать» себя. Это означает, что вы можете добавить немного извести в кислую почву, и pH почвы не изменится. Эта способность почвы нейтрализовать известь называется «буферизацией». Если вы продолжите добавлять все больше и больше извести, вы достигнете точки, когда почва больше не сможет буферизовать, и pH начнет расти.Сколько буферизует ваша почва? Это важный вопрос при добавлении извести, потому что вам нужно добавить достаточно извести, чтобы преодолеть эффект буферизации, а затем добавить еще, чтобы изменить pH.
Буферный эффект почвы можно измерить, и он называется «буферный pH». Не зная pH буфера, вы просто не знаете, сколько извести добавить в почву.
Как вы измеряете pH буфера?
Коммерческая лаборатория тестирования почвы может измерить и сообщить «pH буферного раствора». Используя это значение, он может затем порекомендовать количество извести, которое вам нужно добавить в почву.
В предыдущем посте я обсуждал точность тестеров почвы в Soil pH Testers — Are They Accurate ?, , но еще большая проблема с этими тестерами заключается в том, что они не измеряют pH буферного раствора.
Поскольку наборы для садовой почвы не измеряют pH буферного раствора, они не очень полезны для регулирования pH кислых почв.
Известкование газонов
Многие специалисты по садоводству рекомендуют регулярно добавлять известь на газон. Как видно из приведенного выше обсуждения, вы не сможете узнать, сколько добавить, без теста на почву.Не добавляйте известь на лужайку, если только проверка почвы не покажет, что это необходимо.
Если вы пытаетесь избавиться от мха на лужайке из-за повышенной кислотности, прочтите этот пост; Почему у меня на лужайке растет мох?
Эта запись находится в рубрике Почва и помечена как Известь, pH.
Известкование закисленных озер и прудов | Публикации VCE
Что такое известкование?
«Известкование», как следует из этого слова, представляет собой добавление известняка (кальцита), в первую очередь карбоната кальция (CaCO 3 ), для нейтрализации кислых вод и почв и защиты их от быстрых колебаний pH.Известняк обычно применяется на лужайках, садах, пастбищах и пахотных землях для обеспечения кальцием, важным питательным веществом для растений, и для снижения кислотности почвы.
Известняк также можно применять для озер, прудов и окружающих их водосборов, чтобы защитить их от подкисления, добавить кальций и восстановить их важные экологические, экономические и рекреационные ценности. Добавление известняка для поддержания почти нейтрального pH (pH 7) делает воду озера и пруда безопасной для водных организмов.
Преимущества извести
- Недорого
- Доступен
- Нетоксичен
- Природный минерал
- Легко распределяется
- Растворяется в воде
Что такое pH?
pH воды является выражением содержания в ней кислоты или основания.Шкала pH варьируется от 0 (очень кислая) до 14 (очень щелочная). Например, аккумуляторная кислота имеет pH ниже 1, а щелочь имеет pH выше 13; оба являются очень едкими соединениями, вредными для человека и водных организмов.
Вода с показателем pH от 0 до 6,9 кислая; что с pH от 7,1 до 14 является основным (щелочным). Большинство природных озерных вод имеют pH от 6 до 9 и являются слегка щелочными из-за присутствия карбонатов и бикарбонатов. Урожайность рыбы обычно выше в щелочной (pH 7,1-9) воде.
Что такое щелочность?
Щелочность воды означает ее способность нейтрализовать кислоты или противостоять изменениям pH.Щелочность — это мера концентрации трех основных ионов: карбонатов (CO 3 ), бикарбонатов (HCO 3 ) и гидроксидов (OH) в воде, выраженных в мг / л эквивалента карбоната кальция. В целом мягкая вода с низкой щелочностью (<30 мг / л) содержит мало основных ионов, имеет низкую буферную способность, чтобы противостоять колебаниям pH, и более восприимчива к подкислению. Жесткая вода обычно имеет высокую щелочность (> 100 мг / л), много основных ионов, высокую буферную способность и менее чувствительна к подкислению.
Почему известкование?
Известкование — один из наиболее экономически эффективных методов замедления воздействия подкисления, восстановления кислых вод и увеличения численности и разнообразия водных организмов. Он также снижает токсическое воздействие металлов, особенно алюминия, меди, кадмия, свинца, никеля и цинка, которые могут угрожать рыбе, другим водным организмам и здоровью человека.
Очень кислые озера (т.е. pH ниже 4) часто лишены рыбы, лягушек, саламандр, раков, насекомых и планктона.Некоторые виды спортивной рыбы, такие как полосатый окунь и лососевые, чувствительны к изменениям pH и предпочитают озерные воды со значениями pH от 7 до 9. Поскольку очень кислые поверхностные воды могут иметь токсичные концентрации алюминия в растворе, водные животные могут подвергаться воздействию потенциально смертельная двойная доза ядовитой кислоты и металлов.
Путем нейтрализации кислых вод и уменьшения токсичных растворенных металлов известкование может улучшить воспроизводство и выживаемость водных организмов и способствовать здоровью и сбалансированности популяций рыб.Растворенный в воде кальций извести усваивается и используется мидиями и раками для образования своих защитных панцирей, а также молодыми и взрослыми рыбами для образования чешуек, развития костей и роста.
Улучшает ли известкование спортивное рыболовство?
Известкование во многих отношениях способствует спортивным популяциям рыб. Известкование улучшает общее качество воды и здоровье рыб в закисленных озерах и прудах. Рыба в кислой воде испытывает стресс, имеет более низкую сопротивляемость болезням и медленнее растет до меньшего максимального размера, чем рыба в щелочных озерах.Высокая кислотность и токсичные металлы убивают икру и личинки рыб и снижают успешность нереста. Известкование нейтрализует кислую воду, снижает стресс и выводит токсины из тяжелых металлов.
Известкование обогащает озеро, добавляя кальций, важное питательное вещество, и высвобождая фосфор, еще одно важное питательное вещество, из ила на дне озера. Производство во всей пищевой цепочке (планктон-насекомые-рыба) стимулируется известкованием, а возросшее изобилие естественных пищевых продуктов поддерживает рост и воспроизводство спортивных рыб.В результате известкования может происходить ускоренный рост укоренившихся водных растений, которые служат рассадниками для молодых спортивных рыб.
Что необходимо учитывать перед известкованием?
Перед добавлением извести убедитесь, что проблема заключается в подкислении. Симптомы, похожие на подкисление, могут быть следствием других проблем. Например, плохой улов или сокращение количества рыбы может быть результатом перелова, а не плохого воспроизводства, вызванного кислой водой.
Известкование щелочных вод не требуется. Проверяйте pH в разное время дня в течение нескольких недель, чтобы надежно определить диапазон значений pH.Как правило, если озеро является кислой или мягкой водой со значениями pH менее 6,5 (и кислотонейтрализующей способностью менее 50 микроэквивалентов на литр), общей щелочностью менее 20 миллиграммов на литр (мг / л) и общей жесткостью. при концентрациях ниже 25 мг / л известкование может быть полезным.
Что такое твердость?
Общая жесткость воды — это показатель содержания в ней минеральных веществ, выраженный в мг / л эквивалента карбоната кальция. Кальций и магний являются основной причиной жесткости природных вод, но ионы других металлов (Al, Fe, Zn, Mn) также влияют на жесткость воды.Мягкая вода (жесткость 100 мг / л) обычно имеет высокое содержание кальция и менее склонна к подкислению.
Доказательства подкисления
- Является ли озеро кислым (pH <6,5)?
- Сильно ли колеблется дневной pH (2 единицы за 24 часа)?
- Это озеро с мягкой водой (щелочность <10 мг / л и жесткость <25 мг / л)?
- Увеличиваются ли уровни металлов (Al, Zn, Ni, Cu, Cd, Pb)?
Характеристики озера или пруда
- Время пребывания (время удерживания) воды)> 3 месяцев
- Площадь поверхности озера> 1 акр?
- Средняя глубина> 8 футов?
Рыба и другие водные животные
- Имеются ли данные о видах и численности рыб?
- Имеется ли популяция рыб (зарыбленная или естественная)?
- Присутствуют ли другие водные животные (мидии, раки)?
- Рост спортивной рыбы медленный, а производство ограничено?
А как насчет разрешений на известкование?
Для известкования общественных или частных поверхностных вод может потребоваться разрешение от государственных или федеральных агентств.Владельцы частных озер и прудов могут нуждаться в разрешениях, а могут и не нуждаться в них, но они несут ответственность за химическое изменение вод ниже по течению. Некоторые штаты, такие как Нью-Йорк, приняли подробные правила и инструкции по известкованию поверхностных вод. Другие оценивают известкование в зависимости от конкретного участка.
Заявки на получение разрешений и нормативную информацию обычно можно получить в государственных агентствах по водным или природным ресурсам. Как правило, информация, необходимая для получения разрешения, аналогична информации, необходимой для проектирования и определения обработки, включая (а) предлагаемый материал для обработки и норму внесения и (б) данные, относящиеся к этому озеру, по фоновому качеству воды, водным растениям и физические и гидрологические характеристики.
Известкование может быть вредным для естественно кислых водно-болотных угодий (т. Е. Болот, болот и болот) и связанных с ними кислотолюбивых растений (мох сфагнум, черная ель, клюква, кожанный лист). Известкование водно-болотных угодий не рекомендуется, поскольку это может изменить химический состав воды, тем самым навсегда изменив сообщества растений и животных.
Уведомление общественности о дате, времени, способе известкования и общих мерах предосторожности для рекреационных пользователей рекомендуется на частных озерах и обычно требуется в общественных водах.Поскольку известкование может временно обесцветить воду, стимулировать кратковременное цветение водорослей и изменить вкус и минеральный состав питьевой воды, рекомендуется предварительная общественная просветительская программа при известковании водоемов.
Что такое время пребывания?
Время пребывания (время удерживания) — это время, необходимое для замены всей воды в озере. Например, в небольших озерах (
Какие источники кислотности?
Подкисление озер и прудов не всегда вызывается кислотными отложениями.Некоторые болота, болота и болотные воды содержат высокие уровни встречающихся в природе органических кислот. Пенсильвания, Западная Вирджиния и Вирджиния — это штаты, где кислотный дренаж угольных шахт может происходить, когда серосодержащие минералы подвергаются воздействию воздуха и воды. Сток из шахт обычно имеет низкий уровень pH и может вызвать гибель рыбы.
Вырубка древесины и лесовосстановление, строительство зданий и дорог, а также другие виды изменений в землепользовании могут влиять на кислотность поверхностных вод. Изменения в землепользовании могут увеличивать или уменьшать кислотность озер за счет изменения химического состава (кислотно-щелочного соотношения) в пределах водосбора.
Источники кислотности
- Кислотный дождь и снег
- Кислотный дренаж шахт
- Болотные и болотные воды
- Природные органические кислоты
- Кислые почвы и
- геологические слои
Как известкование улучшает спортивное рыболовство?
Озера и пруды с мягкой водой редко поддерживают обильные популяции рыбы или планктона. Планктон, основа пищевой цепи, часто ограничен в кислых водах с низкой щелочностью. Поверхностные воды с низкой щелочностью обычно кислые и бесплодные; присутствует небольшое количество растворенных питательных веществ, и большинство питательных веществ задерживается в кислых донных илах.Известняк нейтрализует кислый донный ил (т.е. увеличивает pH почвы) и способствует высвобождению фосфора и других ограничивающих питательных веществ, необходимых для фотосинтеза зелеными растениями.
Известкование поверхностных вод нейтрализует кислотность и увеличивает pH, щелочность и жесткость до уровней, способствующих росту планктона и спортивной рыбы. Извещение не только добавляет кальций, но и высвобождает абсорбированные элементы (фосфор и углерод), важные для роста и поддержки водных организмов.
Добавление известняка и удобрений — обычные методы управления рыболовством для увеличения производства спортивной рыбы в прудах, даже в тех водах, которые не подвержены воздействию кислоты.Их не следует применять одновременно, поскольку известняк может осаждать фосфор и уменьшать его доступность.
Защитное или смягчающее известкование?
Защитное (профилактическое) известкование, как следует из названия, используется для предотвращения повышения кислотности озера или пруда за счет повышения щелочности воды (буферной способности). Восприимчивые озера с мягкой водой и пруды, которые имеют небольшую буферную способность и расположены в районах, подверженных сильным кислотным осаждениям, являются хорошими целями для защитного известкования.Этот тип известкования может потребовать только периодического добавления известняка в поверхностные воды или окружающий водораздел. Как правило, более рентабельно предотвращать подкисление озера, чем восстанавливать подкисленное озеро.
Подкисленные озера и пруды можно восстановить путем смягчающего известкования. Целью смягчающего известкования является восстановление и защита качества воды и содействие восстановлению водной флоры и фауны в закисленных озерах и прудах. Для содействия полному восстановлению озерных ресурсов может потребоваться постоянное внесение известняка и использование других методов управления рыболовством, таких как зарыбление.
Какой тип известняка следует применять?
Мелкоизмельченный (измельченный) сельскохозяйственный известняк (кальцит, карбонат кальция) рекомендуется для известкования озер и прудов. Сельскохозяйственный известняк (аглим) — относительно недорогое, широко доступное, простое в обращении, натуральное и нетоксичное соединение, которое растворяется (хотя и нелегко) в воде. Аглим можно купить с различными размерами частиц, от мелкой пыли до горных пород. Мелкие частицы известняка (
) Используйте высококачественную сельскохозяйственную известь, не содержащую загрязняющих веществ (<5% магния) и питательных веществ (с низким содержанием нитратов и фосфатов).Доломитовый известняк с высоким содержанием (> 5%) карбоната магния (MgCO 3 ) может привести к плохому растворению и нейтрализации. Однако, поскольку доломитовый известняк может быть единственным нейтрализующим материалом, легко доступным в вашем районе, он является приемлемой альтернативой аглиму.
Содержание кальция в известняке напрямую связано с его способностью нейтрализовать кислотность. Содержание кальция должно составлять> 70% (предпочтительно 90-100%) CaCO 3 по весу.
Какие типы известняка не следует применять?
 Полоскание в течение 1 минуты после ожога может снизить риск осложнений.
Полоскание в течение 1 минуты после ожога может снизить риск осложнений. Смахнув порошок, промывайте его водой в течение 20 минут.
Смахнув порошок, промывайте его водой в течение 20 минут.