Температура кипения и плавления металлов, температура плавления стали
Температура кипения и плавления металлов
В таблице представлена температура плавления металлов tпл, их температура кипения tк при атмосферном давлении, плотность металлов ρ при 25°С и теплопроводность λ при 27°С.
Температура плавления металлов, а также их плотность и теплопроводность приведены в таблице для следующих металлов: актиний Ac, серебро Ag, алюминий Al, золото Au, барий Ba, берилий Be, висмут Bi, кальций Ca, кадмий Cd, кобальт Co, хром Cr, цезий Cs, медь Cu, железо Fe, галлий Ga, гафний Hf, ртуть Hg, индий In, иридий Ir, калий K, литий Li, магний Mg, марганец Mn, молибден Mo, натрий Na, ниобий Nb, никель Ni, нептуний Np, осмий Os, протактиний Pa, свинец Pb, палладий Pd, полоний Po, платина Pt, плутоний Pu, радий Ra, рубидий Pb, рений Re, родий Rh, рутений Ru, сурьма Sb, олово Sn, стронций Sr, тантал Ta, технеций Tc, торий Th, титан Ti, таллий Tl, уран U, ванадий V, вольфрам W, цинк Zn, цирконий Zr.
По данным таблицы видно, что температура плавления металлов изменяется в широком диапазоне (от -38,83°С у ртути до 3422°С у вольфрама). Низкой положительной температурой плавления обладают такие металлы, как литий (18,05°С), цезий (28,44°С), рубидий (39,3°С) и другие щелочные металлы.
Наиболее тугоплавкими являются следующие металлы: гафний, иридий, молибден, ниобий, осмий, рений, рутений, тантал, технеций, вольфрам. Температура плавления этих металлов выше 2000°С.
Приведем примеры температуры плавления металлов, широко применяемых в промышленности и в быту:
- температура плавления алюминия 660,32 °С;
- температура плавления меди 1084,62 °С;
- температура плавления свинца 327,46 °С;
- температура плавления золота 1064,18 °С;
- температура плавления олова 231,93 °С;
- температура плавления серебра 961,78 °С;
- температура плавления ртути -38,83°С.
Максимальной температурой кипения из металлов, представленных в таблице, обладает рений Re — она составляет 5596°С. Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Плотность металлов в таблице находится в диапазоне от 0,534 до 22,59 г/см3, то есть самым легким металлом является литий, а самым тяжелым металлом осмий. Следует отметить, что осмий имеет плотность большую, чем плотность урана и даже плутония при комнатной температуре.
Теплопроводность металлов в таблице изменяется от 6,3 до 427 Вт/(м·град), таким образом хуже всего проводит тепло такой металл, как нептуний, а лучшим теплопроводящим металлом является серебро.
Температура плавления стали
Представлена таблица значений температуры плавления стали распространенных марок. Рассмотрены стали для отливок, конструкционные, жаропрочные, углеродистые и другие классы сталей.
Температура плавления стали находится в диапазоне от 1350 до 1535°С. Стали в таблице расположены в порядке возрастания их температуры плавления.
| Сталь | tпл, °С | Сталь | tпл, °С |
|---|---|---|---|
| Стали для отливок Х28Л и Х34Л | 1350 | Коррозионно-стойкая жаропрочная 12Х18Н9Т | 1425 |
| Сталь конструкционная 12Х18Н10Т | 1400 | Жаропрочная высоколегированная 20Х23Н13 | 1440 |
| Жаропрочная высоколегированная 20Х20Н14С2 | 1400 | Жаропрочная высоколегированная 40Х10С2М | 1480 |
| Жаропрочная высоколегированная 20Х25Н20С2 | 1400 | Сталь коррозионно-стойкая Х25С3Н (ЭИ261) | 1480 |
| Сталь конструкционная 12Х18Н10 | 1410 | Жаропрочная высоколегированная 40Х9С2 (ЭСХ8) | 1480 |
| Коррозионно-стойкая жаропрочная 12Х18Н9 | 1410 | Коррозионно-стойкие обыкновенные 95Х18…15Х28 | 1500 |
| Сталь жаропрочная Х20Н35 | 1410 | Коррозионно-стойкая жаропрочная 15Х25Т (ЭИ439) | 1500 |
| Жаропрочная высоколегированная 20Х23Н18 (ЭИ417) | 1415 | Углеродистые стали | 1535 |
Источники:
- Волков А.
 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с. - Казанцев Е. И. Промышленные печи. Справочное руководство для расчетов и проектирования.
- Физические величины. Справочник. А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
ICSC 1611 — 2,6-DI-трет-БУТИЛФЕНОЛ
ICSC 1611 — 2,6-DI-трет-БУТИЛФЕНОЛ
| 2,6-DI-трет-БУТИЛФЕНОЛ | ICSC: 1611 |
| Октябрь 2005 |
| CAS #: 128-39-2 | |
| UN #: 3077 | |
| EINECS #: 204-884-0 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее. | НЕ использовать открытый огонь. | Использовать распыленную воду, пену, порошок, двуокись углерода. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. |
| Кожа | Покраснение. Боль. | Защитные перчатки. | Снять загрязненную одежду. Ополоснуть и затем промыть кожу водой с мылом. |
| Глаза | Покраснение. Боль. | Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Боль в горле. Ощущение жжения в горле и груди. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Дать выпить один или два стакана воды. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: респиратор с фильтром для органических газов и паров, подходящий для концентрации вещества в воздухе. НЕ допускать попадания этого химического вещества в окружающую среду. ПластиковыеСмести просыпанное вещество в закрытые контейнеры. Тщательно собрать оставшееся. Затем хранить и утилизировать в соответствии с местными правилами. |
Согласно критериям СГС ООН
Транспортировка |
| ХРАНЕНИЕ | |
Хранить в местах не имеющих сливов или доступа к канализации Отдельно от пищевых продуктов и кормов. См. химические опасности. См. химические опасности. | |
| УПАКОВКА | |
| Загрязняет морскую среду. |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| 2,6-DI-трет-БУТИЛФЕНОЛ | ICSC: 1611 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C14H22O |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| Вещество очень токсично для водных организмов. Бионакопление этого химического вещества может происходить по пищевой цепочке, например, в рыбе. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации.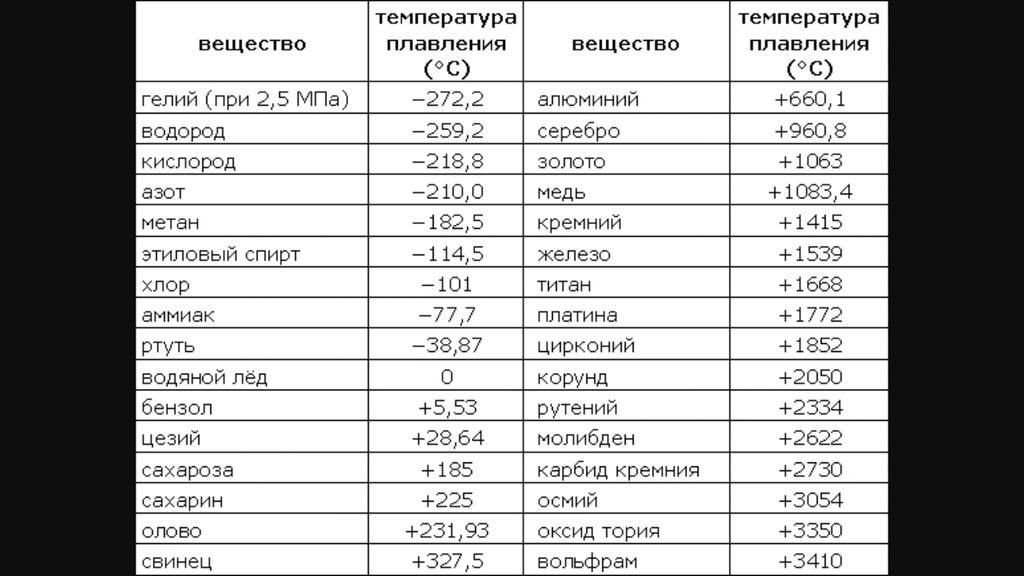 © Версия на русском языке, 2018 |
Медь — свойства, характеристики | Cu-prum.ru
Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.
2. Химические свойства.
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.
Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды — это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
Самые распространённые руды — это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.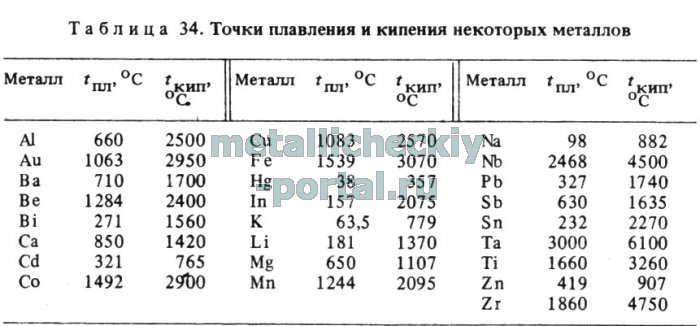
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.
Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.
Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Медь — ООО «ВИРС» — комплексные поставки цветных металлов
Медь — химический элемент I группы периодической системы Менделеева; атомный номер — 29, атомная масса — 63,546. Температура плавления- 1083 ° C
Температура плавления- 1083 ° C, температура кипения — 2595 ° C; плотность — 8,98 г/см 3 . 2 у технически чистой меди.
2 у технически чистой меди.
Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не принимают термической обработки, и их механические свойства и износостойкость определяются химическим составом сплавов меди и его влиянием на структуру. Модуль упругости медных сплавов (900-12000 кгс/мм 2 ниже, чем у стали).
Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов меди с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред и хорошей электропроводностью.
Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов меди, а пластичность у однофазных.
Медь является материалом для изготовления множества видов цветного проката, в их числе медная лента и проволока, медные прутки и шины, медные листы (листовая медь).
Изготавливают медную проволоку, листовую медь, медные ленты и полосы посредством литья и обработки давлением.
Медь, а следовательно, цветной прокат, изготовленный на ее основе, обладает следующими особыми свойствами:
- превосходно проводить тепло и электричество. Так, электропроводность, которая свойственна меди и находится на втором месте после серебра, в 1,7 раза выше нежели у алюминия, в 6 раз превышает электропроводность железа и платины. Нужно учитывать – электропроводность тем лучше, чем медь чище.
- ковкостью и тягучестью
- устойчивостью к изменению температуры и воздействию ультрафиолетовых лучей
- отличной пластичностью, возможностью применения любых видов сварки
- высокой устойчивостью к коррозии. Подвергаясь атмосферному воздействию, влиянию паров воды и сернистого газа, медь покрывается плотной плёнкой зеленовато-серого цвета. Плёнка защищает медь от дальнейшего окисления. Благодаря этому свойству медь, как и сплавы, изготовленные на ее основе, востребованы в холодильной технике, в строительстве линий электропередач, в электромашиностроении и приборостроении, химическом машиностроении.

Медь применяется также в строительстве и оборудовании домов при создании систем водоснабжения, кондиционирования, отопления, в электротехнике, приборостроении, медицине. Порядка 50% всей меди расходует электропромышленность.
Технически чистая медь поставляется в виде слитков-полуфабрикатов, а также катодных листов. Но из-за недостаточной прочности такую медь используют крайне редко как конструкционный материал. Востребованы же сплавы меди, самые распространенные – латунь (медь+цинк, где содержание цинка – до 50%) и бронза.
Сплавы меди
Латунь — двойные и многокомпонентные медные сплавы, с основным легирующим элементом — цинком. По сравнению с медью обладают более высокой прочностью и коррозионной стойкостью.
Бронза — это сплав из меди, в которых основными легирующими элементами являются различные металлы, кроме цинка. Маркируют бронзы буквами Бр, за которыми следуют заглавные буквы легирующих элементов, а через тире цифры, показывающие их процентное содержание.
химический элемент, температура плавления и кипения, пошаговая инструкция
Медь входит в семёрку самых древних металлов, с которыми люди познакомились на самом начальном этапе своего существования. Период с 4 по 3 тысячелетие до нашей эры так и называется медный век в истории развития человечества. Древние люди изготавливали из неё предметы быта, орудия труда и боевое оружие. Это стало возможным благодаря относительно невысокой температуре плавления меди.
Купрум: характеристика элемента
Научное наименование меди Cuprum (Купрум) происходит от названия греческого острова Кипр, где медь начали добывать ещё в середине третьего тысячелетия до нашей эры. В периодической таблице Менделеева химический элемент медь имеет 29 атомный (порядковый) номер, находится в 11 группе четвёртого периода. Принадлежит к пластичным переходным металлам. В чистом виде имеет характерный золотисто-розовый цвет. Чистую медь легко окислить, поэтому в естественных условиях она всегда образует на своей поверхности тонкую оксидную плёнку, которая придаёт ей красноватый оттенок.
Физические свойства
Это второй металл после серебра по уровню электропроводности, что делает её крайне востребованной в современной электронике. Второе ценное качество — высокая теплопроводность, это позволяет её широко применять во всевозможных теплообменниках и в холодильной аппаратуре.
- Температура плавления 1083 градуса.
- Температура кипения 2567 градусов.
- Удельное сопротивление при 20 градусах составляет 1,68·10 -3 Ом·м.
- Плотность 8,92 г/см.
Нахождение в природе
В природе встречается в самородном виде и в виде соединений.
Самые крупные месторождения самородной меди находятся в США в районе озера Верхнего. Именно в этом районе был найден самый крупный медный самородок весом 3560 килограмм. А также много самородной меди встречается в рудных горах Германии.
В России и на постсоветском пространстве добыча меди происходит путём извлечения из сульфидной руды. Её можно добыть, извлекая из медного колчедана или халькопирита CuFeS2. Наиболее известны такие месторождения, как Удокан в Забайкалье и Джезказган в Казахстане.
Сульфиты меди чаще всего образуются в так называемых среднетемпературных гидротермальных жилах. Могут образовываться и в осадочных породах в виде медистых песчаников и сланцев.
Как правило, медная руда всегда добывается открытым способом. Процентное содержание чистой меди в руде составляет от 0,2 до 1,0 процента в зависимости от месторождения.
Медные сплавы
Являются самыми первыми металлическими сплавами, получение которых человечество освоило ещё на самой заре своего развития. При какой температуре плавится медь, зависит от того, в каком сплаве она находится. В настоящее время наиболее известны и востребованы такие сплавы, как:
- Латунь.
 Сплав с добавление цинка, содержание которого может доходить до 40%. Цинк повышает пластичность и прочность металла. Температура, при которой латунь плавится, составляет 880 — 950 градусов.
Сплав с добавление цинка, содержание которого может доходить до 40%. Цинк повышает пластичность и прочность металла. Температура, при которой латунь плавится, составляет 880 — 950 градусов. - Бронза. Сплав с оловом, с добавлением некоторых других компонентов, таких как кремний, бериллий, свинец. Получать бронзу из меди человек научился ещё в самом начале бронзового века. Бронза не утратила своей актуальности даже с наступлением века железа, например, ещё в начале 20 века стволы пушек изготавливали из так называемой орудийной бронзы. Температура, при которой бронза начинает плавиться, составляет 930 — 1140 градусов.
- Мельхиор. Кроме меди, содержит в своём составе 5−30% никеля. Никель увеличивает прочность медного сплава и повышает его электрическое сопротивление. Кроме того, сильно повышается коррозионная стойкость. Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью.
 Но он обладает более высокой механической прочностью, чем обычное серебро.
Но он обладает более высокой механической прочностью, чем обычное серебро. - Дюраль, или дюралюминий. Основную массу сплава составляет алюминий 93%, на медь приходится 5%, оставшиеся 2% занимают марганец, железо и магний. Название происходит от названия немецкого города Дюрен, где в 1906 году был впервые получен этот высокопрочный сплав алюминия. Одной из его особенностей является тот факт, что его прочностные характеристики с течением времени имеют тенденцию к увеличению. Поэтому он не теряет своей прочности после нескольких лет эксплуатации, как другие металлы. В настоящее время этот сплав является основой самолётостроения.
- Ювелирные сплавы. Сплавы меди с золотом. Тем самым увеличивается устойчивость драгметалла к механическим воздействиям и истиранию.
Переплавка меди дома
Этот металл обладает целым набором полезных свойств, которые делают её весьма желанным металлом в домашнем хозяйстве. А относительно невысокая температура при плавлении и изрядное количество медного лома, которое можно обнаружить на ближайшей свалке, позволяют задавать вопрос о том, как расплавить медь в домашних условиях, не как риторический, а вполне реальный и практический.
А относительно невысокая температура при плавлении и изрядное количество медного лома, которое можно обнаружить на ближайшей свалке, позволяют задавать вопрос о том, как расплавить медь в домашних условиях, не как риторический, а вполне реальный и практический.
График плавления меди
Расплавление любого металла заключается в том, что под воздействием высоких температур разрушается кристаллическая решётка и металл переходит из твёрдого состояния в жидкое. Можно выделить некоторые закономерности, свойственные любому металлу в процессе расплавления:
- Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние.
- При достижении температуры плавления, для меди это 1083 градуса, температура внутри металла перестаёт повышаться, несмотря на то что общий нагрев и передача тепла продолжаются.
- После того как вся масса метала переходит в расплавленное состояние, температура внутри металла снова начинает резко повышаться.

В случае процесса охлаждения расплавленного металла происходит всё то же самое, но в обратной последовательности. Сначала происходит резкое снижение температуры внутри металла, затем на значении 1080 градусов падение температуры прекращается до тех пор, пока вся масса метала не перейдёт в твёрдое состояние. После этого температура снова начинает резко падать, пока не сравняется с температурой окружающего воздуха и кристаллизация не завершится окончательно.
Температура кипения
Медь начинает активно выделять углерод в виде пузырьков газа при температуре 2560 градусов. Внешне это очень напоминает кипение воды. На самом деле это процесс активного окисления меди, в результате которого металл теряет практически все свои уникальные свойства. Детали, отлитые из кипящей меди, имеют в своей структуре большое количество пор, которые будут уменьшать механическую прочность материала и ухудшать его декоративные свойства. Потому в процессе плавки необходимо внимательно следить за температурой и не допускать закипания меди.
Потому в процессе плавки необходимо внимательно следить за температурой и не допускать закипания меди.
Способы плавки
Медный лом можно переплавить в домашних условиях разными способами в зависимости от технического оснащения домашней мастерской. При этом нужно иметь в виду, что придётся нагревать медь не до её температуры плавления, а чуть выше — примерно до 1100−1200 градусов.
Для этих целей годятся следующие приспособления:
- Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса.
- Газовая горелка. Ручная газовая горелка размещается под дном ёмкости из тугоплавкого материала, в которой непосредственно будет размещаться медный лом.
 Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла. Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля.
Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла. Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля. - Паяльная лампа. Способ практически ничем не отличается от плавки с помощью газовой горелки. Но в этом случае невозможно достигнуть относительно высоких температур, поэтому он годится для переплавки сплавов меди, которые обладают меньшей температурой плавления, чем чистая медь.
- Кузнечный горн. На раскалённые древесные угли специального костра помещается тугоплавкий тигель с измельчённым металлом. Для ускорения процесса расплавления задействуют обычный бытовой пылесос, включённый в режиме выдувания. Труба пылесоса должна быть небольшого диаметра и иметь металлический наконечник, в противном случае она расплавится. Данный способ подходит для тех, кто занимается плавкой меди дома регулярно и имеет дело с большими объёмами исходного материала, который необходимо отжечь.

- Микроволновая печь. Бытовая мощная микроволновка с небольшими изменениями конструкции может легко плавить довольно большие объёмы медного лома. Для этого необходимо убрать из микроволновки вращающуюся тарелку, а вместо неё поместить соответствующих размеров тигель, который необходимо сделать из тугоплавкого материала, например, из шамотного кирпича.
Пошаговая инструкция
Процесс плавления любого металла происходит поэтапно и подчиняется определённому алгоритму, который одинаков как для промышленного производства, так и для кустарного. Для тех, кто озадачен вопросом плавки меди в домашних условиях, пошаговая инструкция будет выглядеть следующим образом:
- Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления.

- После полного расплавления всего объёма медного лома тигель с помощью специальных длинных щипцов извлекается из печи.
- На поверхности расплавленного металла образуется плёнка его оксида. Эту плёнку необходимо аккуратно сдвинуть в сторону к одной из стенок тигля. Для этих целей используют специальный крючок, изготовленный из тугоплавкого металла.
- После того как металл освобождён от оксидной плёнки, необходимо его очень быстро разлить в предварительно подготовленные формы.
Практические рекомендации
Температура плавления меди в домашних условиях зависит от того, в каком сплаве она содержится.
Техническая чистая медь содержится в проводах и кабелях, а также в обмотках трансформаторов, электродвигателей и генераторов. При этом нужно иметь в виду, что химически чистая медь содержится только в столовых приборах и в прочей кухонной утвари. Во всех остальных случаях в ней присутствуют те или иные вредные компоненты.
youtube.com/embed/hynyPI9aBYA» frameborder=»0″ allowfullscreen=»allowfullscreen»/>
В чистом виде обладает повышенной вязкостью в расплавленном состоянии, поэтому отливать из неё изделия сложной конфигурации и небольших размеров очень сложно. Гораздо легче для этих целей использовать латунь.
В сплавах бронзы, изготовленных вначале и середине прошлого века, использовали в качестве компонентов мышьяк и сурьму. Поэтому следует избегать расплавления так называемой старинной бронзы, так как пары мышьяка могут привести к отравлению организма.
Оцените статью: Поделитесь с друзьями!
Цветные металлы и сплавы
Подробности
- Подробности
-
Опубликовано 27.05.2012 13:22 -
Просмотров: 11940
Наибольшее применение в технике имеют следующие цветные металлы: медь, латунь, бронза, алюминий и его сплавы, свинец, олово, цинк.
Медь. Медь представляет собой металл красновато-розового цвета. Температура плавления меди 1083°. Медь обладает высокой электропроводностью, теплопроводностью, пластичностью и стойкостью против атмосферной коррозии. По сравнению со сталью теплопроводность и электропроводность меди выше в шесть раз.
Высокая пластичность позволяет производить прокатку ее в холодном состоянии в тонкие листы. Прочность нагартованной меди достигает 40 кг!мм2, а отожженной и литой — 18—20 кг/мм2.
Обычно применяется медь марок МО, M1, М2, МЗ, (М4) (ГОСТ 859-41), отличающихся друг от друга содержанием примесей. Наиболее чистой от примесей является медь марки МО (количество примесей 0,05%) и марки M1 (примесей 0,1%). Чем меньше примесей, тем лучше медь поддается сварке.
При нагревании свыше 600° С прочность меди резко снижается, она становится хрупкой. В жидком состоянии медь легко поглощает газы и окисляется. Это ограничивает ее применение для литых изделий, а также затрудняет сварку.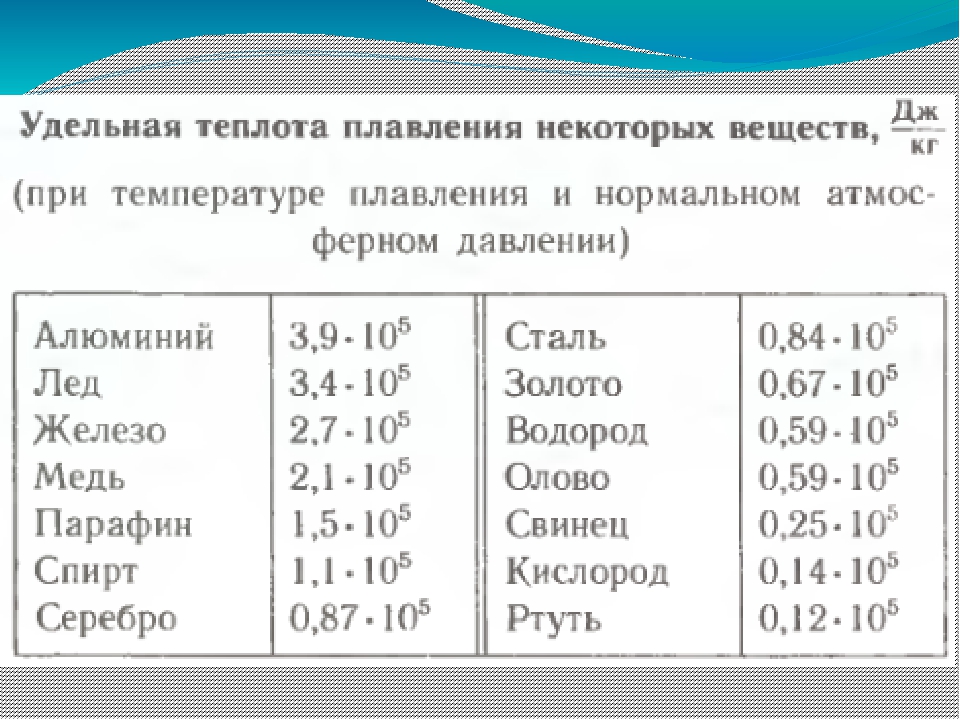 Высокая теплопроводность и жидко текучесть в расплавленном состоянии также затрудняют сварку меди.
Высокая теплопроводность и жидко текучесть в расплавленном состоянии также затрудняют сварку меди.
С понижением температуры механические свойства меди не снижаются, что позволяет применять медь в конструкциях, работающих при низкой температуре. Благодаря высокой электропроводности медь широко применяется в электропромышленности, в химическом машиностроении и других отраслях промышленности для изготовления баков, котлов, теплообменной аппаратуры и т. д.
Латунь. Латунь представляет собой сплав меди с цинком золотисто-желтого цвета. Содержание цинка в латуни 20—45%. Температура плавления латуни в зависимости от состава достигает 880— ‘950° С. С увеличением содержания цинка температура плавления понижается. Латунь достаточно хорошо сваривается и прокатывается. Изготовляется и применяется она обычно в виде листов, прутков, трубок и проволоки. Широкое применение латуни обусловливается ее меньшей стоимостью по сравнению с медью.
По ГОСТ 1019-47 латуни разделяются в зависимости от их химического состава на ряд марок: томпак марок Л96 и Л90 (содержание меди 88—97%), полутомпак марок JI80 и Л85 (меди 79— 86%), латунь марок Л62, Л68 и Л70 (цифра обозначает среднее содержание меди). Кроме того, имеются алюминиевые латуни марки ЛА77-2 (меди 76—79%, алюминия в среднем до 2%), марганцовистые, железомарганцовистые и др. Такие латуни обладают повышенной прочностью и вязкостью.
Кроме того, имеются алюминиевые латуни марки ЛА77-2 (меди 76—79%, алюминия в среднем до 2%), марганцовистые, железомарганцовистые и др. Такие латуни обладают повышенной прочностью и вязкостью.
Бронза. Сплавы меди с оловом, марганцем, алюминием, никелем, кремнием, бериллием и другими элементами называют бронзами. Наиболее известны оловянистые бронзы, содержащие олова от 3 до 7%. Оловянистая бронза обладает очень малой усадкой и хорошими литейными свойствами.
Бронзы применяются в промышленности, главным образом в качестве литейного материала для изготовления подшипников и деталей, работающих на трение, а также для различного рода арматуры котлов, аппаратов и т. д.
Температура плавления бронзы зависит от количества в ней примесей и в среднем составляет: для оловянистых бронз 900—950 ° С, для безоловянистых — 950— 1080° С. Бронзы хорошо свариваются.
По ГОСТ 5017-49 различают следующие марки: Бр. ОФ 6,5-0,15 (олова 6—7%, фосфора 0,1—0,25%), Бр. ОФ 4-0,25 (олова 3,5— 4%, фосфора 0,2—0,3%), Бр. ОЦС-4-4-2,5 (олова 3—5%, цинка 3—5%, свинца 1,5—3,5%).
ОЦС-4-4-2,5 (олова 3—5%, цинка 3—5%, свинца 1,5—3,5%).
Алюминий и его сплавы. Алюминий — очень легкий металл, светло-серого, почти белого цвета. Он почти в три раза легче стали. Его удельный вес 2,7 г/см3. Алюминий имеет высокую теплопроводность и электропроводность и хорошо сопротивляется окислению благодаря тонкой, но прочной пленке окислов, защищающей его поверхность. Температура плавления алюминия 658° С. Несмотря на низкую температуру плавления, алюминий требует для расплавления большого количества тепла благодаря своей высокой удельной теплоемкости. Механические свойства чистого алюминия невысоки.
Сплавы алюминия с медью (дюралюминий), с магнием (электрон), с кремнием (силумин) и другие обладают прочностью, близкой к прочности малоуглеродистой стали.
В чистом виде алюминий применяется в электротехнике и химическом машиностроении. Алюминиевые сплавы широко применяются в промышленности в качестве литейного материала, а также в виде листового и сортового металла. Алюминий и его сплавы хорошо свариваются.
Алюминий и его сплавы хорошо свариваются.
Из большого количества алюминиевых сплавов в сварных конструкциях чаще всего применяют алюминиево-марганцевый сплав АМц (содержащий до 1,6% марганца), дюралюминий (марки Д1, Д6, Д16) и др.
Все алюминиевые сплавы могут быть разделены на литейные, из которых изготовляются литые детали, и деформируемые, которые используются для изготовления полуфабрикатов прокаткой, прессованием, ковкой, штамповкой (полосы, листы, трубы и другие профили).
Литейные сплавы обозначаются АЛ1-АЛ13 (ГОСТ 2685-44) и отличаются низкими механическими свойствами (предел прочности от 12 до 28 кг/мм2у относительное удлинение от 0,5 до 9%).
Деформируемые алюминиевые оплавы (ГОСТ 4784-49) делятся на две группы: неупрочняющиеся термической обработкой (сплавы марки АМц, АМг) « упрочняющиеся (Д6, Д16, В95).
Упрочняющиеся оплавы (Д6, Д16) после термической обработки имеют предел прочности 42—46 кг/мм2 и относительное удлинение 15—17%. Такие сплавы обозначаются Д6Т, Д16Т.
При сварке указанных упрочняющихся сплавов значительный нагрев металла в зоне, расположенной рядом со швом, приводит к понижению механических свойств (предел прочности понижается до 21—22 кг/мм2).
Магний и его сплавы. Чистый магний в машиностроении не применяется. Широко применяются сплавы магния с алюминием, марганцем, цинком. Магниевые сплавы относятся к легчайшим металлам. Их удельный вес равен 1,75—1,85 г/см3. Температура плавления 648—650° С. Магниевые сплавы удовлетворительно свариваются газовой сваркой. Они могут быть как литейные (марки МЛ1-7-МЛ6, ГОСТ 2855-45), так и деформируемые (марки МА1Ч-МА5).
Цинк — металл синевато-белого цвета. Температура плавления 419° С, температура кипения 906° С. Цинк легко окисляется, пары его весьма вредны для здоровья.
Свинец отличается большим удельным весом (11,3 г/см3), малой теплопроводностью (9% от теплопроводности меди), низкой температурой плавления (325° С), малой прочностью на разрыв (1,35 кг/мм2) и значительным относительным удлинением — 50 %.
При нагревании свинец легко окисляется, покрываясь пленкой окиси с температурой плавления 850° С.
Пары и пыль свинца очень ядовиты.
Свинец и его сплавы свариваются удовлетворительно.
Олово — мягкий и вязкий металл серебристо-белого цвета; температура плавления 232° С. Для него характерна хорошая стойкость против окисления на воздухе и слабая окисляемость в воде. Применяется для лужения посуды, изготовления припоев и различных медных сплавов.
Читайте также
Добавить комментарий
Припои марки А ПОС-30ф 8мм, П -14 ф 2,8мм ТУ 48-1728138/ОПП-006-2000 ООО Дон-энергокомплект г. Ростов-на-Дону
Применение: Электро и радиоаппаратура, печатные схемы, точные приборы без перегрева.
Температура плавления: 183-190°C
Химический состав: Олово 61% Свинец 39%
Пайка металлов: Бронза, Латунь, Медь, Нержавейка, Олово, Свинец, Сталь
Харакетристики:
Припой ПОС-61 в классификации припоев занимает особенное место. Это обусловлено тем, что в этом сплаве отмечается содержание канифоли, поэтому его можно с успехом использовать для лужения и пайки самых разных контрольно-измерительных приборов.
Это обусловлено тем, что в этом сплаве отмечается содержание канифоли, поэтому его можно с успехом использовать для лужения и пайки самых разных контрольно-измерительных приборов.
Припой ПОС 61 — это по-своему универсальный материал, который идеально подойдет для любой разновидности проводов. Также отмечается, что он неплохо себя показывается при пайке микросхем. Кроме того, если нельзя во время работы допустить перегрев места пайки, то припой ПОС-61 справится с задачей куда эффективнее, чем многие другие сплавы. Производитель отмечает, что основной сферой использования припоя ПОС61 является пайка жил к полупроводниковым устройствам, выводам разъемов, медных проводов. Стоит отметить, что это оптимальный выбор для соединения следующих металлов: сталь, латунь, бронза, медь. Припой ПОС 61, если сравнивать с другими оловянно-свинцовыми припоями, представленными на рынке, имеет более высокий уровень чистоты и рассчитан на пайку электромонтажа. За счет повышенного содержания меди в припое снижается интенсивность растворения проводов из меди, а также во много раз увеличивается степень износостойкости медных стержней электрических паяльников. Температура плавления припоя ПОС 61 составляет 183 0С, в то время как полностью он расплавляется при 190 градусах. Пайка с помощью этого припоя может быть выполнена при помощи традиционного паяльного инструмента.
Температура плавления припоя ПОС 61 составляет 183 0С, в то время как полностью он расплавляется при 190 градусах. Пайка с помощью этого припоя может быть выполнена при помощи традиционного паяльного инструмента.
Состав припоя ПОС 61: свинец (39-50%), олово (50-61%). Одновременно с этим, по ГОСТу 21930-76 главным фактором, который определяет характеристики припоя, является химический состав. Помимо свинца и олова в припое ПОС 61 содержатся следующие примеси: Sb, Cu, As, Bi, Ni, S, Zn, Al, Fe.
Применение: Электроаппаратура, детали из оцинкованного железа с герметичными швами.
Температура плавления: 183-238°C
Химический состав: Олово 40% Свинец 60%
Пайка металлов: Бронза, Латунь, Медь, Сталь
Харакетристики:
Припой ПОС-40 является оловянно-свинцовым припоем, поэтому его область использования довольно-таки широка. С помощью припоя этой марки осуществляется пайка железа, латуни медных проводов, элементов из оцинкованного железа с полностью герметичными швами. Именно поэтому припой активно используется в сфере электрооборудования, при ремонте медных и латунных трубопроводов, ремонте радиаторов.
Припой ПОС-40 может быть использован с любым видом паяльного оборудования, поэтому, в большинстве случаев, именно он выбирается для проведения пайки и лужения различных элементов не только в локальном ремонте, но и в заводских масштабах.
Припой ПОС 40 великолепно подходит для формирования прочного (если требуется, и полностью герметичного) шва, а также для получения электроконтакта с небольшим переходным сопротивлением. За счет того, что имеет температуру плавления намного меньшую, чем соединяемые металлы, то он плавится, оставляя при этом основной металл абсолютно твердым. Компоненты будут диффундировать в основной металл, который будет растворяться в припое, за счет чего начнет формироваться промежуточная прослойка, соединяющая все элементы в одно целое после застывания.
Производители выпускает припой ПОС 40 в виде проволоки (без канифоли) и трубок (с сосновой канифолью).
Осуществлять пайку этим припоем можно простым паяльным инструментом, не опасаясь при этом перегрева элементов, потому что припой полностью расплавляется уже при температуре в 238 градусов. Если требуется припой, который будет плавиться при более низких температурах, то рекомендуется выбирать модель ПОС 61 и другие соответствующие виды.
Применение: Пайка изделий машиностроения.
Температура плавления: 183-238°C
Химический состав: Олово 30% Свинец 70%
Пайка металлов: Бронза, Латунь, Медь, Сталь
Харакетристики:
Припой ПОС-30 — оловянно-свинцовый припой, используемый для пайки и лужения радио- и электроаппаратуры приборов с герметичными швами, печатных схем, внутренних швов и медицинских устройств, деталей с герметическими швами из оцинкованного железа. Припой ПОС 30 не имеет достойных зарубежных аналогов и относится к категории мягких припоев, потому что температура его плавления не превышает 300 0С. Сплав является бессурьмянистым.
Отлично подходит для пайки меди, латуни и железа. В промышленных масштабах применяется в энергетической сфере. Во время пайки ПОС 30 с поверхностью детали формируют высококачественную зону промежуточного сплава. Любители и профессионалы используют припой ПОС-30 для пайки электроприборов и радиоаппаратуры.
Пруток припоя ПОС 30 диаметром 8 мм будет легко гнуться руками, потому что в нем отмечается высокое содержание свинца. В отличие от свинца олово будет придавать припою повышенную степень жесткости и прочности. В состав ПОС 30 входит олово (29-31%) и свинец (69-71%). Температура плавления припоя составляет 256 оС (начало плавления отмечается на 183 градусах). Для большинства радиоэлектронных элементов подобная температура считается предкритической, что обязательно нужно учитывать перед проведением паяльных работ. Именно поэтому, если есть определенный риск повреждения аппаратуры или каких-либо элементов, то лучше воспользоваться припоями с более низкой температурой плавления. Также в состав припоя также входят различные примеси: сурьма, медь, мышьяк, никель, железо, алюминий цинк, сера, висмут.
Применение: Электро и радиоаппаратура, печатные схемы, точные приборы без перегрева.
Температура плавления: 183-190°C
Химический состав: Олово 61% Свинец 39%
Пайка металлов: Бронза, Латунь, Медь, Нержавейка, Олово, Свинец, Сталь
Харакетристики:
Припой ПОС-61 в классификации припоев занимает особенное место. Это обусловлено тем, что в этом сплаве отмечается содержание канифоли, поэтому его можно с успехом использовать для лужения и пайки самых разных контрольно-измерительных приборов.
Припой ПОС 61 — это по-своему универсальный материал, который идеально подойдет для любой разновидности проводов. Также отмечается, что он неплохо себя показывается при пайке микросхем. Кроме того, если нельзя во время работы допустить перегрев места пайки, то припой ПОС-61 справится с задачей куда эффективнее, чем многие другие сплавы. Производитель отмечает, что основной сферой использования припоя ПОС61 является пайка жил к полупроводниковым устройствам, выводам разъемов, медных проводов. Стоит отметить, что это оптимальный выбор для соединения следующих металлов: сталь, латунь, бронза, медь. Припой ПОС 61, если сравнивать с другими оловянно-свинцовыми припоями, представленными на рынке, имеет более высокий уровень чистоты и рассчитан на пайку электромонтажа. За счет повышенного содержания меди в припое снижается интенсивность растворения проводов из меди, а также во много раз увеличивается степень износостойкости медных стержней электрических паяльников. Температура плавления припоя ПОС 61 составляет 183 0С, в то время как полностью он расплавляется при 190 градусах. Пайка с помощью этого припоя может быть выполнена при помощи традиционного паяльного инструмента.
Состав припоя ПОС 61: свинец (39-50%), олово (50-61%). Одновременно с этим, по ГОСТу 21930-76 главным фактором, который определяет характеристики припоя, является химический состав. Помимо свинца и олова в припое ПОС 61 содержатся следующие примеси: Sb, Cu, As, Bi, Ni, S, Zn, Al, Fe.
Применение: Электроаппаратура, детали из оцинкованного железа с герметичными швами.
Температура плавления: 183-238°C
Химический состав: Олово 40% Свинец 60%
Пайка металлов: Бронза, Латунь, Медь, Сталь
Харакетристики:
Припой ПОС-40 является оловянно-свинцовым припоем, поэтому его область использования довольно-таки широка. С помощью припоя этой марки осуществляется пайка железа, латуни медных проводов, элементов из оцинкованного железа с полностью герметичными швами. Именно поэтому припой активно используется в сфере электрооборудования, при ремонте медных и латунных трубопроводов, ремонте радиаторов.
Припой ПОС-40 может быть использован с любым видом паяльного оборудования, поэтому, в большинстве случаев, именно он выбирается для проведения пайки и лужения различных элементов не только в локальном ремонте, но и в заводских масштабах.
Припой ПОС 40 великолепно подходит для формирования прочного (если требуется, и полностью герметичного) шва, а также для получения электроконтакта с небольшим переходным сопротивлением. За счет того, что имеет температуру плавления намного меньшую, чем соединяемые металлы, то он плавится, оставляя при этом основной металл абсолютно твердым. Компоненты будут диффундировать в основной металл, который будет растворяться в припое, за счет чего начнет формироваться промежуточная прослойка, соединяющая все элементы в одно целое после застывания.
Производители выпускает припой ПОС 40 в виде проволоки (без канифоли) и трубок (с сосновой канифолью).
Осуществлять пайку этим припоем можно простым паяльным инструментом, не опасаясь при этом перегрева элементов, потому что припой полностью расплавляется уже при температуре в 238 градусов. Если требуется припой, который будет плавиться при более низких температурах, то рекомендуется выбирать модель ПОС 61 и другие соответствующие виды.
Припой ПМФОЦр 6-4-0,03 купить Припой ПМФОЦр 6-4-0,03 ТУ 48-17228138
Применение: Пайка кондиционеров, холодильников, теплообменников, волноводов.
Температура плавления: 640-680°C
Химический состав: Медь 89% Фосфор 6% Олово 4% Цирконий 0,03%
Пайка металлов: Бронза, Латунь, Медь, Серебро
Харакетристики:
Припой ПМФОЦр 6-4-0.03 относится к категории медно-фосфорных. В припое этой марки отмечается высокое содержание фосфора и меди, а также значительное количество циркония и олова.
Это среднеплавкий припой, который имеет повышенную текучесть, отличную устойчивость к коррозийным процессам и агрессивной среде. Основная сфера использования сплава — пайка меди и ее различных сплавов (мельхиора, латуни, бронзы).
Одновременно с этим, ПМФОЦр зачастую применяется как заменитель серебряных припоев в процессе ремонта ювелирных изделий. Запрещено осуществление пайки чугуна и стали припоями с содержанием фосфора, потому что соединение получается хрупким и не способно выдержать нагрузки вибрационного, ударного и изгибающего типа. Это обусловлено тем, что по границе шва фосфоритов образуется видимая пленка. Особенностью припоя ПМФОЦр можно назвать то, что он является самофлюсующимся. Именно поэтому, если им осуществляется пайка изделий из меди, то в этом случае нет никакой необходимости использовать флюс. Как правило, припой этой марки применяется в ремонте бытовых смесителей, кондиционеров, при изготовлении климатического оборудования, электромашин высокой мощности. В классификации припоев ПМФОЦр относится к категории среднеплавких самофлюсующихся припоев, что допускает осуществление пайки без использования флюса. Пайка с помощью этого припоя может выполняться горелкой любого типа (ацетиленовой, пропановой горелкой, паяльной лампой), с помощью аргонодуговой сварки. Основное условие в этом случае — спаиваемые детали должны нагреться до темно-красного свечения (вишневый оттенок). Затем необходимо нагревать припой до того момента, пока он не начнет растекаться должным образом.
Применение: Пайка холодильников, термодатчики, теплообменники, часы.
Температура плавления: 630-660°C
Химический состав: Медь 53% Фосфор 7% Никель 7% Цинк 33%
Пайка металлов: Медь, Никель, Серебро, Сталь
Харакетристики:
Припой П-81 рассчитан на пайку при изготовлении климатического оборудования, теплообменников, калориферов, термодатчиков, производстве часов и т.п. Пайка с помощью этого припоя может осуществляться только с применением флюса. Допускается изготовление закладных элементов различной формы и колец для осуществления автоматической пайки (подобные работы должны проводиться только в заводских условиях на походящем для этого оборудовании).
П-81 в своем составе содержит несколько основных элементов: цинк (32-36%), медь (52-54%), никель и фосфор (по 6-7%). При помощи припоя П-81 допускается соединение следующих материалов: никель и никелевые сплавы (в том числе и латунь), медь, чугун, серебро, сталь (в том числе нержавейка), твердые сплавы и их всевозможные комбинации. С помощью припоя П-81 разрешается пайка с использованием флюса. П-81 может похвастать особенными свойствами и некоторыми конкурентными преимуществами. Среди них необходимо выделить высокий уровень надежности и долговечности фреоновых элементов, повышенный предел прочности на срез, высокое качество в процессе ремонта твердосплавных инструментов, высокая степень герметичности паяных конструкций в условиях повышенного давления. Нельзя не отметить и то, что П-81 производитель считает столь же эффективным, как и некоторые высокосеребряные припои. При работе с припоем этой марки рекомендуется использовать флюсы, которые соответствуют следующим припоям: ФК-250 (235), ПВ-209.
Температура плавления припоя составляет 630-660 оС, в том время как рекомендованная температура пайки варьируется от 680 до 700 оС. Предел прочности сплава находится в пределах 170 Мпа.
Припой П-81 показывает себя особенно эффективным, если его использовать взамен высокосеребряных припоев марок ПСр40, ПСр29.5, ПСр25, ПСр45.
Применение: Пайка холодильников, кондиционеров, теплообменников, волноводов, бытовых смесителей.
Температура плавления: 640-680°C
Химический состав: Медь 90% Фосфор 6% Олово 4%
Харакетристики:
Припой П-14 представляет собой соединение, в котором присутствует значительное количество меди (основа), олова (от 3,5 до 4,5%) и фосфора (от 5,3 до 6,3%). Все это делает его уместным для использования в процессе пайки калориферов, теплообменников, холодильников, кондиционеров, электрических машин высокой мощности, волноводов и бытовых смесителей. Идеально он способен соединять такие материалы, как серебро, медь и медные сплавы. Отметим, что пайка меди при помощи припоя марки П-14, осуществляется даже без добавления флюса.
Изготавливают припой этого типа в виде проволоки с различным диаметром, прутка с различным диаметром, ленты с различной толщиной и шириной. Если припой выполнен в виде проволоки, то в ней может присутствовать продольный паз с флюсом марки ФК-320 и марки ФК-235. Поэтому осуществляя пайку той или иной детали можно легко подбирать оптимальный для каждого случая вариант.
В процессе пайки следует придерживаться определенной температуры. Если пайка проводится в газовом пламени, то она должна быть не выше 740 и не ниже 720 градусов, а если пайка в печи — то не менее 800 и не более 820 градусов. Ударная вязкость разрушения составляет порядка 1,5-3 кДж.м/см2, а прочность паяных соединений равна 290-320 МПа.
Применение: Лужение алюминиевых оболочек и пайка алюминиевых жил.
Температура плавления: 300-320°C
Химический состав: Олово 42-45% Цинк 54% Медь 1,2-1,5%
Пайка металлов: Алюминий
Харакетристики:
Припой марки А представляет собой одну из востребованных разновидностей оловянно-медно-цинковых припоев. Именно эти три главных компонента составляют его основу и предопределяют и главные свойства, и сферы, в которых его использование будет отличаться максимальной эффективностью.
Идеально подходит припой марки А для использования в процессе проведения пайки алюминиевых жил и выполнения лужения алюминиевых оболочек. Этому благоволит и то, что он вполне стоек к негативному воздействию коррозии и обладает превосходными технологическими свойствами. Важна и температура плавления этого соединения. Она варьируется в диапазоне от 400 до 400 градусов Цельсия. В то время, как плотность припоя этого типа составляет 7,2 г/см3. Все это следует учитывать при проведении пайки и лужения изделий.
В составе припоя преобладает содержание цинка, его количество варьируется от 56% до 59%, олова в соединении не более 42,1% и не менее 38,6%. Меди в разы меньше — не более 2%, в некоторых случаях ее присутствие может не превышать показателя в 1,5%. И это предопределяет большую часть свойств припоя, уместность его использования в определенных сферах, а также ряд других важных показателей.
Применение: Пайка генераторов, шинопроводов, электродвигателей большой мощности, трансформаторов
Температура плавления: 714-850°C
Химический состав: Медь 93% Фосфор 7%
Пайка металлов: Латунь, Медь, Серебро
Характеристики:
Припой МФ-7 входит в категорию медно-фосфорных припоев и предполагает наличие в своем составе порядка 7% фосфора, о чем и свидетельствует маркировка изделия. Он превосходно показывает себя при пайке латуней и бронз, нейзильбера и медно-никелевых сплавов. Хотя, основной сферой использования в данном случае принято считать пайку меди и разнообразных медных сплавов без применения флюсов. Необходимость во флюсах отсутствует, поскольку припой этой марки относится к самофлюсующим припоям.
Применять припой, изготовленный под маркой МФ-7, для пайки сталей и чугуна не рекомендуется. В этих сферах он зарекомендовал себя не самым лучшим образом. В этих случаях возникает образование хрупких фосфидов железа непосредственно в паяном шве и как следствие — утрачивается пластичность.
Идеально подходит данный вид припоя для пайки кондиционеров и холодильников. В обоих случаях необходимо применять газопламенный нагрев и придерживаться температуры пайки в диапазоне от 732 до 816 градусов Цельсия. Припою характерна высокая жидкотекучесть и низкая температура плавления, что приравнивает его по свойствам к серебряным и медно-цинковым припоям, востребованным при пайке медных сплавов и самой меди.
Температура плавления: 700-900°C
Пайка металлов: Медь, Серебро, Сталь
Харакетристики:
Флюс Бура в промышленной сфере используется достаточно часто. Также сферой его применения считается пайка ювелирных изделий, где необходимо точно рассчитать состав используемых материалов и тип инструментов для пайки. Универсальным решением в этом случае является именно флюс, созданный на основе борной кислоты или буры.
Бура — важнейшая добавка при плавке, которая позволяет обеспечить формирование тигля глазури на стенках, растворение окислов металлов и предохранить расплав от проникновения кислорода. Бура — это соль тетраборной кислоты, которая существует в виде декагидрата в свободной форме. Изготовление флюса такого типа ведется с помощью борной кислоты и буры, которые в соотношении 1:1 по массе растворяются в воде. Чтобы приготовить 1 л флюса бура, необходимо смешать 100 г борной кислоты и 100 г буры, добавив их в 1 л воды, после чего довести до кипения. После естественного остывания массы ее следует отфильтровать. Соотношение борной кислоты и буры в составе флюса необходимо варьировать в зависимости от того, с каким именно металлом предполагается работать. Если это золото, то основу флюса должна составлять борная кислота, а не бура. Обратная ситуация с серебром.
Флюс бура считается нейтральным флюсом. Он также может быть использован для высокотемпературной пайки меди, стали, чугуна, твердых сплавов с серебряными и медными паяльными сплавами.
Флюс ЛТИ-120 купить Флюс ЛТИ-120 500 мл.
Применение: Лужение сплавов меди, стали, никеля, свинца, цинка, серебра, олова, кадмия, палладия.
Температура плавления: 200-300°C
Пайка металлов: Медь, Никель, Олово, Свинец, Серебро, Сталь, Цинк
Харакетристики: Флюс ЛТИ-120 на отечественном рынке представлен достаточно давно. Он относится к категории активированных флюсов, в которой ЛТИ-120 считается уже давно одним из лучших. В состав этого флюса входят уникальные добавки, которые позволяют в разы увеличить его эффективность. Кроме того, предусмотрено наличие полностью пасивирующих добавок. Взаимодействие флюса в полной мере будет зависеть от температуры, при которой проводятся работы. При обычной температуре флюс не проявляет никакой активности и не способен проводить ток даже на повышенных частотах. По завершению паяльных работ остатки флюса можно не убирать, потому что они будут представлены в виде твердого вещества, не подверженного каким-либо внешним факторам. Зачастую остатки флюса выступают в качестве защитного покрытия паяльных соединений. По уровню активности флюс марки ЛТИ-210 схож с современными паяльными кислотами. В состав флюса входят следующие вещества: этиловый спирт, канифоль, диэтиламин солянокислый, триэтаноламин. Именно поэтому допускается его использование при пайке железа, нержавейки, бронзы, меди, стали, никеля, серебра и ряда других веществ. После того, как работы будут завершены, вентилировать помещение необязательно. Если необходимо смыть остатки, то это можно сделать при помощи ацетона или спирта.
Флюс ПВ-209 купить Флюс ПВ-209
Применение: Пайка меди, твердых сплавов, нержавеющих и конструкционных сталей.
Температура плавления: 600-900°C
Пайка металлов: Медь, Нержавейка, Серебро, Сталь
Харакетристики: Флюс ПВ-209 рассчитан на высокотемпературную пайку серебряными и медными припоями никеля, меди, серебра и сплавов, а также особо твердых и жаропрочных сплавов. Флюс позволяет полностью удалить окисные пленки, а также предотвратить их формирование при нагреве. Флюс также способствует уменьшению поверхностного натяжения жидкого припоя, защите поверхностей, подготовленных к пайке, от негативных внешних воздействий.
Производство флюса ПВ-209 ведется по оригинальной технологии. Нанесение флюса на поверхности, подготовленные к пайке, удобнее всего производить в виде пасты. Ее можно получить с помощью замешивания флюса в воде (пропорция 1:1 в соответствии с массой). Текучесть пасты регулируется добавлением воды.
Если флюс используется в виде порошка и осуществляется пайка нелегированной стали, то разрешен нагрев до побежалости с дальнейшим нанесением флюса. В процессе пайки нержавеющей стали флюс рекомендуется наносить пастой и контролировать целостность поверхности. При пайке твердосплавных поверхностей их требуется нагревать равномерно и полностью. Остатки флюса после пайки могут быть удалены с помощью кипячения в воде или 10%-ным раствором лимонной кислоты.
Паяльная кислота Флюс и реактивы для пайки
Характеристики:
Паяльная кислота — это хлорид цинка, что является химическим соединением цинка и хлора (формула — ZnCl2). Паяльная кислота активно используется для пайки меди, углеродистых сталей, никеля и сплавов с помощью легкоплавких припоев в диапазоне температур от 150 до 320 оС. Также в состав паяльной кислоты (помимо хлорида цинка) входят: соляная кислота, хлорид аммония, специальная смачивающая присадка. Кроме того, паяльную кислоту часто называют активным флюсом в жидком агрегатном состоянии.
Паяльная кислота может быть получена с помощью растворения цинка (либо его окиси) в растворе соляной кислоты с дальнейшим выпариванием раствором. Кроме того, вещество получается по средствам нагревания жидкого цинка в токе хлора.
Физические и химические свойства паяльной кислоты:
• Температура кипения — 730 оС;
• Температура плавления — 315-320 оС;
• Молекулярная масса — 136,2954;
• Растворимость в воде — 79.8% при 0 оС;
• Концентрированные составы обладают кислой средой, потому при диссоциации в воде наблюдается образование соляной кислоты.
Паяльная кислота также используется для лужения проводов и пайка радиодеталей микросхем. Срок годности паяльной кислоты не превышает 12 месяцев с условием соблюдения стандартов хранения. Хранение вещества нужно производить в плотной закрытой таре, не допуская воздействия прямых солнечных лучей и тепла. Если в помещении проводились работы с использованием паяльной кислоты, его нужно хорошенько проветрить по их завершению.
Флюс паяльный ФКСп купить Флюс ФКСп 500 мл.
СПИРТОКАНИФОЛЬНЫЙ ФЛЮС (он же КЭ, СКФ, и ФКЭт -на этилацетате, жидкая канифоль).
Применение: Для пайка элементов радиомонтажа и печатных плат легкоплавкими припоями при температурах 250-280ºC.
Состав: канифоль сосновая не менее 30%, АИПС-70%.
Пайка металлов: медь; серебряное, оловянное, оловянно-свинцовое, оловянно-висмутовое, оловянно-никелевое, кадмиевое, золотое покрытия.
Характеристики : ручная и механизированная пайка и лужение электромонтажных элементов печатных плат и элементов радио электроники в изделиях радио и бытовой электронной аппаратуры. Консервация изделий радио и бытовой электронной аппаратуры для сохранения паяемости в условиях складского хранения и хранения в условиях сборочного цеха в течение одного года. Остатки флюса при ручной пайке изделий бытовой радио аппаратуры (пайке подстроечных элементов, подпайке, исправлении дефектов) допускается не удалять. Остатки флюса при групповой пайке изделий бытовой радио аппаратуры («волной» припоя, погружением, протягиванием) следует удалять.
Медь — Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: медь
(Promo)
Вы слушаете Химию в ее стихии, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе монеты, проводимость и медь.Чтобы рассказать об элементе, который перенес нас из каменного века в информационный век, вот Стив Милон.
Steve Mylon
Плохая медь, до недавнего времени кажется, что она буквально и фигурально выделялась среди своих родственников из переходных металлов, серебра и золота. Я предполагаю, что это совокупный результат, которого история в изобилии. Практически никогда не бывает таких популярных элементов из-за их полезности и интересного химического состава. Но для Золота и Серебра все так поверхностно.Они популярнее, потому что красивее. Моя жена, например, не химик, и не мечтала носить медное обручальное кольцо. Возможно, это связано с тем, что оксид меди имеет неприятную привычку окрашивать вашу кожу в зеленый цвет. Но если бы она только нашла время, чтобы узнать о меди, чтобы немного ее узнать; может быть, тогда она отвернется от других и с гордостью будет носить его.
Некоторые сообщают, что медь — это первый металл, который добывают и обрабатывают люди.Независимо от того, так это или нет, существуют свидетельства того, что цивилизации использовали медь еще 10 000 лет назад. Для перехода культур от каменного века к бронзовому веку им была нужна медь. Бронза состоит из 2 частей меди и одной части олова, а не серебра или золота. Важность меди для цивилизации никогда не снижалась, и даже сейчас из-за ее превосходной проводимости медь пользуется большим спросом во всем мире, поскольку быстро развивающиеся страны, такие как Китай и Индия, создают инфраструктуру, необходимую для подачи электричества в дома своих граждан.Например, за последние пять лет цена на медь выросла более чем в четыре раза. Возможно, самая большая пощечина этому важному металлу — его использование в монетах во многих странах мира. Оранжево-коричневые монеты, как правило, имеют низкий номинал, в то время как блестящие, более похожие на серебро монеты, занимают место наверху. Даже в 5-центовой монете Соединенных Штатов никель выглядит блестящим и серебристым, но на самом деле он содержит 75% меди и только 25% никеля. Но мы даже не называем это медью.
Конечно, я мог бы продолжать и отмечать много интересных фактов и фактов о меди и о том, почему другие должны относиться к ней с симпатией. Они легко могли бы, потому что это отличный проводник тепла, но я нахожу этот металл таким интересным и по многим другим причинам. Медь — один из немногих металлов-индикаторов, который важен для всех видов. По большей части биологические потребности в меди довольно низки, поскольку только некоторые ферменты, такие как цитохромоксидаза и супероксиддисмутаза, нуждаются в меди в своих активных центрах.Обычно они основаны на цикле окисления-восстановления и играют важную роль в дыхании. Для людей потребность также довольно низкая, всего 2 мг меди в день для взрослых. Однако слишком мало меди в вашем рационе может привести к высокому кровяному давлению и повышению уровня холестерина. Интересно, что для меди зазор, разделяющий необходимое количество и токсичное количество, довольно мал. Он может быть самым маленьким для всех необходимых следов металлов. Вероятно, поэтому он обычно используется в качестве пестицида, фунгицида и альгицида, потому что такие небольшие количества могут выполнить работу.
На мой взгляд, вы вряд ли найдете в таблице Менделеева металл, который обладает универсальностью меди и до сих пор не пользуется уважением среди аналогов, которого он заслуживает. Хотя его гораздо больше, чем золота и серебра, его значение в истории не имеет себе равных, и его полезность на макроуровне сопоставима только с его полезностью в микромасштабе. Никакой другой металл не может конкурировать.
Итак, я постараюсь объяснить это своей жене, когда в этот праздничный сезон подарю ей пару медных сережек или красивое медное ожерелье.Я предполагаю, что она задирает нос, потому что подумает, что это тот материал, из которого сделаны гроши, хотя в наши дни на самом деле это не так.
Крис Смит
Мужчина, женатый на меди, это Стив Милон. В следующий раз мы углубимся в открытие элемента с очень ярким темпераментом.
Питер Уотерс
Его младший кузен Эдмунд Дэви помогал Хэмфри в то время, и он рассказывает, как, когда Хэмфри впервые увидел, как мельчайшие шарики калия прорвались сквозь корку поташа и загорелись, он не мог сдержать своей радости.Дэви имел полное право восхищаться этим удивительным новым металлом. Он выглядит так же, как другие яркие блестящие металлы, но его плотность меньше плотности воды. Это означало, что металл будет плавать по воде. По крайней мере, так было бы, если бы он не взорвался при контакте с водой. Калий настолько реактивен; он даже среагирует и прожигёт дыру во льду.
Крис Смит
Питер Уотерс с историей элемента номер 19, калия. Это будет в Химии на следующей неделе в его элементе .Я надеюсь, ты сможешь присоединиться к нам. Я Крис Смит, спасибо за внимание и до свидания!
(промо)
(конец промо)
Медь — точка плавления — точка кипения
Медь — точка плавления и точка кипения
Температура плавления меди 1084,62 ° C .
Температура кипения меди 2927 ° C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Точка кипения — насыщение
В термодинамике термин насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданных температуре и давлении. Температура, при которой начинается испарение (кипение) для данного давления, называется температурой насыщения или точкой кипения . Давление, при котором начинается испарение (кипение) для данной температуры, называется давлением насыщения.Если рассматривать температуру обратного перехода от пара к жидкости, ее называют точкой конденсации.
Точка плавления — насыщение
В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии. Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда рассматривается как температура обратного перехода от жидкости к твердому телу, она упоминается как точка замерзания или точка кристаллизации.
Медь — Свойства
| Элемент | Медь |
|---|---|
| Атомный номер | 29 |
| Символ | Cu |
| Категория элемента | Переходный металл |
| Фаза на STP | цельный |
| Атомная масса [а.е.м.] | 63,546 |
| Плотность при стандартном давлении [г / см3] | 8.92 |
| Электронная конфигурация | [Ар] 3d10 4s1 |
| Возможные состояния окисления | +1,2 |
| Сродство к электрону [кДж / моль] | 118,4 |
| Электроотрицательность [шкала Полинга] | 1,9 |
| Энергия первой ионизации [эВ] | 7,7264 |
| Год открытия | неизвестно |
| Первооткрыватель | неизвестно |
| Тепловые свойства | |
| Точка плавления [шкала Цельсия] | 1084.62 |
| Точка кипения [шкала Цельсия] | 2927 |
| Теплопроводность [Вт / м K] | 401 |
| Удельная теплоемкость [Дж / г К] | 0,38 |
| Теплота плавления [кДж / моль] | 13,05 |
| Теплота испарения [кДж / моль] | 300,3 |
–
–
–
меди | Области применения, свойства и факты
Возникновение, использование и свойства
Самородная медь обнаружена во многих местах как первичный минерал в базальтовых лавах, а также как восстановленная из соединений меди, таких как сульфиды, арсениды, хлориды и карбонаты.(Минералогические свойства меди см. В таблице самородных элементов.) Медь встречается в сочетании со многими минералами, такими как халькоцит, халькопирит, борнит, куприт, малахит и азурит. Он присутствует в золе морских водорослей, во многих морских кораллах, в печени человека, а также во многих моллюсках и членистоногих. Медь играет такую же роль в переносе кислорода в гемоцианине голубых моллюсков и ракообразных, как железо в гемоглобине краснокровных животных. Медь, присутствующая в организме человека в качестве микроэлемента, помогает катализировать образование гемоглобина.Медно-порфировое месторождение в Андах в Чили — самое известное месторождение этого минерала. К началу 21 века Чили стала ведущим производителем меди в мире. Другие крупные производители включают Перу, Китай и США.
медь
Медь с полуострова Кевино, штат Мичиган, США
Фотография Сэнди Гримм. Хьюстонский музей естествознания
В промышленных масштабах медь производится в основном плавлением или выщелачиванием, обычно с последующим электроосаждением из сульфатных растворов.Для более подробной информации о производстве меди, см. обработка меди. Основная часть производимой в мире меди используется в электротехнической промышленности; большая часть остатка объединяется с другими металлами с образованием сплавов. (Это также имеет технологическое значение в качестве гальванического покрытия.) Важным рядом сплавов, в которых медь является главным компонентом, являются латуни (медь и цинк), бронзы (медь и олово) и никелевое серебро (медь, цинк и никель, нет. серебро). Есть много полезных сплавов меди и никеля, включая монель; два металла полностью смешиваются.Медь также образует важную серию сплавов с алюминием, называемых алюминиевой бронзой. Бериллиевая медь (2 процента Be) — необычный медный сплав, поскольку его можно упрочнять путем термической обработки. Медь входит в состав многих металлов для чеканки монет. Спустя долгое время после того, как бронзовый век перешел в железный, медь оставалась вторым по значению металлом после железа. Однако к 1960-м годам более дешевый и более доступный алюминий занял второе место в мировом производстве.
| страна | добыча рудника 2016 (метрические тонны) * | % мировой добычи рудников | продемонстрированные запасы 2016 г. (метрические тонны) * | % мировых продемонстрированных запасов |
|---|---|---|---|---|
| * Приблизительно. | ||||
| ** Из-за округления данные не суммируются с приведенной суммой. | ||||
| Источник: Министерство внутренних дел США, Mineral Commodity Summaries 2017. | ||||
| Чили | 5 500 000 | 28,4 | 210 000 000 | 29,2 |
| Перу | 2 300 000 | 11,9 | 81 000 000 | 11,3 |
| Китай | 1,740,000 | 9.0 | 28 000 000 | 3,9 |
| США | 1 410 000 | 7,3 | 35 000 000 | 4,9 |
| Австралия | 970 000 | 5,0 | 89 000 000 | 12,4 |
| Конго (Киншаса) | 910 000 | 4,7 | 20 000 000 | 2,8 |
| Замбия | 740 000 | 3,8 | 20 000 000 | 7.4 |
| Канада | 720 000 | 3,7 | 11 000 000 | 1,5 |
| Россия | 710 000 | 3,7 | 30 000 000 | 4,2 |
| Мексика | 620 000 | 3,2 | 46 000 000 | 6,4 |
| другие страны | 3 800 000 | 19,6 | 150 000 000 | 20,8 |
| всего мира | 19 400 000 ** | 100 ** | 720 000 000 | 100 ** |
Медь — один из самых пластичных металлов, не особенно прочный или твердый.Прочность и твердость заметно повышаются при холодной обработке из-за образования удлиненных кристаллов той же гранецентрированной кубической структуры, которая присутствует в более мягкой отожженной меди. Обычные газы, такие как кислород, азот, диоксид углерода и диоксид серы, растворимы в расплавленной меди и сильно влияют на механические и электрические свойства затвердевшего металла. Чистый металл уступает только серебру по теплопроводности и электропроводности. Природная медь представляет собой смесь двух стабильных изотопов: медь-63 (69.15 процентов) и медь-65 (30,85 процента).
медные кабели
медные электрические кабели. Из-за высокой электропроводности меди она широко используется в электротехнической промышленности.
© Pegasus / Fotolia
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Поскольку медь находится ниже водорода в электродвижущем ряду, она не растворяется в кислотах с выделением водорода, хотя она будет реагировать с окисляющими кислотами, такими как азотная и горячая концентрированная серная кислота.Медь сопротивляется воздействию атмосферы и морской воды. Однако длительное пребывание на воздухе приводит к образованию тонкого зеленого защитного покрытия (патины), которое представляет собой смесь гидроксокарбоната, гидроксосульфата и небольших количеств других соединений. Медь — умеренно благородный металл, на нее не действуют неокисляющие или не образующие комплекс разбавленные кислоты в отсутствие воздуха. Однако он легко растворяется в азотной кислоте и в серной кислоте в присутствии кислорода. Он также растворим в водном растворе аммиака или цианида калия в присутствии кислорода из-за образования очень стабильных цианокомплексов при растворении.Металл реагирует при нагревании красным калом с кислородом с образованием оксида меди CuO и, при более высоких температурах, оксида меди Cu 2 O. При нагревании он реагирует с серой с образованием сульфида меди Cu 2 S.
Факты о меди: химические и физические свойства
Медь — хорошо известный элемент из-за ее характерного красноватого металлического цвета и потому, что она встречается в чистом виде в повседневной жизни. Вот набор фактов об этом прекрасном переходном металле:
Быстрые факты: медь
- Обозначение элемента : Cu
- Атомный номер : 29
- Атомный вес : 63.546
- Внешний вид : Красновато-оранжевый цельный металл
- Группа : Группа 11 (переходный металл)
- Период : Период 4
- Открытие : Ближний Восток (9000 г. до н.э.)
Основные факты о меди
Атомный номер: Атомный номер меди — 29, что означает, что каждый атом меди содержит 29 протонов.
Символ: Cu (от латинского: cuprum )
Атомный вес: 63.546
Открытие: Медь известна с доисторических времен. Его добывают более 5000 лет. Человечество использовало металл на Ближнем Востоке по крайней мере с 9000 г. до н.э. Медный кулон, датируемый 8700 годом до нашей эры, был найден в Ираке. Ученые считают, что только железо из метеоритов и золото использовалось людьми раньше, чем медь.
Электронная конфигурация: [Ar] 4s 1 3d 10
Слово Происхождение: Latin cuprum : с острова Кипр, который славится своими медными рудниками и староанглийским coper и Coper .Современное название меди впервые появилось в употреблении около 1530 года.
Свойства: Медь имеет температуру плавления 1083,4 +/- 0,2 ° C, точку кипения 2567 ° C, удельный вес 8,96 (20 ° C), валентность 1 или 2. Медь красноватого цвета и имеет яркий металлический блеск. Он податлив, пластичен и хорошо проводит электричество и тепло. По электропроводности он уступает только серебру.
Использование: Медь широко используется в электротехнической промышленности.Помимо многих других применений, медь используется в сантехнике и для изготовления кухонной посуды. Латунь и бронза — два важных медных сплава. Соединения меди токсичны для беспозвоночных и используются в качестве альгицидов и пестицидов. Соединения меди используются в аналитической химии, например, при использовании раствора Фелинга для проверки содержания сахара. Американские монеты содержат медь.
Источники: Иногда медь появляется в самородном виде. Он содержится во многих минералах, включая малахит, куприт, борнит, азурит и халькопирит.Месторождения медных руд известны в Северной Америке, Южной Америке и Африке. Медь получают путем плавки, выщелачивания и электролиза сульфидов, оксидов и карбонатов меди. Медь коммерчески доступна с чистотой 99,999%.
Классификация элемента: Переходный металл
Изотопы: Известно 28 изотопов меди от Cu-53 до Cu-80. Существует два стабильных изотопа: Cu-63 (содержание 69,15%) и Cu-65 (содержание 30,85%).
Физические данные по меди
Плотность (г / куб. См): 8,96
Точка плавления (K): 1356,6
Температура кипения (K): 2840
Внешний вид: Ковкий, пластичный, красновато-коричневый металл.
Атомный радиус (пм): 128
Атомный объем (куб.см / моль): 7,1
Ковалентный радиус (пм): 117
Ионный радиус: 72 (+ 2e) 96 (+ 1e)
Удельная теплоемкость (при 20 ° C Дж / г моль): 0.385
Теплота плавления (кДж / моль): 13,01
Теплота испарения (кДж / моль): 304,6
Температура Дебая (K): 900 · 10 315,00
Номер отрицания Полинга: 1,90
Первая ионизирующая энергия (кДж / моль): 745,0
Степени окисления: 2, 1
Структура решетки: Гранецентрированная кубическая
Константа решетки (Å): 3,610
Регистрационный номер CAS: 7440-50-8
Медная мелочь
- Медь использовалась с древних времен.Историки даже называют период времени между неолитом и бронзовым веком медным веком.
- Медь (I) горит синим цветом при испытании на пламя.
- Медь (II) горит зеленым светом при испытании пламенем.
- Атомный символ меди Cu происходит от латинского термина «cuprum», означающего «металл Кипра».
- Соединения сульфата меди используются для предотвращения роста грибка и водорослей в стоячих водоемах, таких как пруды и фонтаны.
- Медь — это красно-оранжевый металл, который темнеет до коричневого цвета при контакте с воздухом.Если он подвергается воздействию воздуха и воды, он образует сине-зеленый цвет.
- Содержание меди в земной коре составляет 80 частей на миллион.
- Содержание меди в морской воде составляет 2,5 x 10 -4 мг / л.
- Медные листы были добавлены на днище судов, чтобы предотвратить «биообрастание», когда водоросли, другие виды зелени и ракушки будут цепляться за корабли и замедлять их движение. Сегодня медь добавляют в краску, используемую для окраски днища кораблей.
Источники
Хаммонд, К.Р. (2004). «Элементы», в Справочнике по химии и физике (81-е изд.). CRC Press. ISBN 0-8493-0485-7.
Ким, BE. «Механизмы приобретения, распределения и регулирования меди». Nat Chem Biol., T. Nevitt, DJ Thiele, Национальный центр биотехнологической информации, Национальная медицинская библиотека США, март 2008 г., Bethesda MD.
Массаро, Эдвард Дж., Изд. (2002). Справочник по фармакологии и токсикологии меди . Humana Press.ISBN 0-89603-943-9.
Смит, Уильям Ф. и Хашеми, Джавад (2003). Основы материаловедения и инженерии . McGraw-Hill Professional. п. 223. ISBN 0-07-292194-3.
Уист, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4.
Медь — обзор | ScienceDirect Topics
14.16.5.4 Комплексообразование с тяжелыми металлами
В CHEC-II (1996) сообщалось только об очень небольшом количестве комплексов металлов, включающих большие кольцевые гетероциклы.В последнее десятилетие была проведена новая информация и проведены исследования по большим кольцам, содержащим селен и теллур, особенно краун-эфирам, благодаря их очень специфическим свойствам и характеристикам.
Были синтезированы многочисленные комплексы [18] aneO 4 Te 2 (L), в которых лиганд ведет себя только как донор Te 2 , включая цис — [MX 2 L] (M = Pd или Pt; X = Cl или Br), [RhCl 2 L 2 ] Y (Y = Cl или PF 6 ), [CuL 2 ] BF 4 , [AgL 2 ] BF 4 и [Cu 2 L] [BF 4 ] 2 .Комплексы охарактеризованы с помощью микроанализа, многоядерной ЯМР-спектроскопии ( 1 H, 125 Te { 1 H}, 195 Pt, 63 Cu), масс-спектрометрии с ионизацией электрораспылением (ESI), УФ / видимая область. и инфракрасная (ИК) спектроскопия, если необходимо. Сообщалось также о двух комплексах [9] aneO 2 Te, цис — [MCl 2 {[9] aneO 2 Te} 2 ] (M = Pd или Pt) вместе с селеноэфиром. комплекс [PtCl 2 {[18] aneO 4 Se 2 }].Рентгеновские структуры [MCl 2 {[18] aneO 4 Te 2 }] (M = Pt или Pd) и [PtCl 2 {[18] aneO 4 Se 2 }] все обнаруживают цис — плоскую квадратную координацию без взаимодействия между металлом (Pt или Pd) и атомами кислорода эфира. Добавление по каплям разбавленного раствора MeCN [PtX 2 (MeCN) 2 ] (X = Cl или Br) или [PdX 2 (MeCN) 2 ] к кипящемуся раствору [18] aneO 4 Te 2 в CH 2 Cl 2 / MeCN образовывал желтые растворы, которые давали комплексы, обладающие стехиометрией [MX 2 ([18] aneO 4 Te 2 )] <2003JCD2852>.
Обработка SbX 3 (X = Cl, Br или, в некоторых случаях, I) 1 молярным эквивалентом L (L = MeS (CH 2 ) 2 SMe, MeS (CH 2 ) ) 3 SMe, MeSe (CH 2 ) 2 SeMe, MeC (CH 2 SMe) 3 , MeC (CH 2 SeMe) 3 , [12] aneS 4 ( 1,4,7,10-тетратиациклододекан), [14] aneS 4 (1,4,8,11-тетратиациклотетрадекан), [16] aneS 4 (1,5,9,13-тетратиациклогексадекан), [ 8] aneSe 2 (1,5-диселенациклооктан) или [16] aneSe 4 60 (1,5,9,13-тетраселенациклогексадекан)) в безводном CH 2 Cl 2 , MeCN, или раствор тетрагидрофурана (THF) давал порошкообразные твердые вещества от бесцветного до красно-оранжевого цвета с соотношением Sb: L 1: 1 в большинстве случаев и иногда с соотношением Sb: L 2: 1 <2001JCD1621>.
Обработка BiX 3 (X = Cl или Br) [8] aneSe 2 90 (1,5-диселенациклооктан), [16] aneSe 4 60 (1,5,9 , 13-тетраселенациклогексадекан) и [24] aneSe 6 91 (1,5,9,13,17,21-гексаселенациклотетракозан) давали с выходом от умеренного до высокого в виде сильно окрашенных порошкообразных твердых веществ, обладающих [BiX 3 (L)] (где L равно 90 , 60 или 91 ). Каждая из кристаллических структур [BiCl 3 ([8] aneSe 2 )] и [BiBr 3 ([16] aneSe 4 )] обнаруживает бесконечные одномерные лестничные структуры, полученные из почти плоского Bi 2 X 6 димерных единиц, связанных μ-мостиковыми циклическими селеноэфирами.Каждый Bi координирован с набором доноров Se 2 X 4 , причем атомы донора Se занимают взаимно транс -координационных сайтов. Селеноэфирные лиганды приняли экзоциклические структуры, и в [BiBr 3 ([16] aneSe 4 )] это два транс- атомов Se, которые координировались с Bi (iii), оставляя два других атома Se некоординирующими. . Структуры этих видов контрастируют с родственными комплексами, включающими ациклические селеноэфирные лиганды, и с несколькими структурно охарактеризованными галогенидными комплексами висмута (iii) с макроциклическими тиоэфирными лигандами <2000JCD2163>.
[16] aneSe 4 60 при обработке SnX 4 (X = Cl или Br) давал [SnX4 ([16] aneSe 4 )], в то время как реакция [8] aneSe 2 90 дали [SnCl 4 ([8] aneSe 2 )]. Эти разновидности представляют собой первые примеры аддуктов галогенида Sn (iv) с нейтральными лигандами 16-й группы, которые принимают полимерные структуры. Все комплексы представляют собой цепные полимеры, хотя существует неожиданная структурная зависимость от размера кольца макроцикла, дающая каждому отдельную структурную форму <2003NJC1784>.Подобные селеноэфирные лиганды были исследованы для образования комплекса с мышьяком <2002IC2070>, никелем <1998JCD2185>, медью <2000CJC598>, иридием <1996JCD3713>, рутением <1993CC1716, 1997JCD3719>, хромом <1997POL4253>, палладием и платина <1995IC651, 1995POL2753>.
Реакция 78 с [PdCl 2 (CNPh) 2 ], которую проводили в сухом толуоле в молярном соотношении 1: 2, дала оранжевый моноядерный комплекс палладия (ii) 92 <2004JOM (689 ) 2377>.
Циклические ди- и тетраселенэфирные лиганды были синтезированы с целью получения карбонильных комплексов переходных металлов и, следовательно, исследования их спектроскопических и структурных свойств. Кристаллические структуры с Mn (CO) 4 были получены в кипящем толуоле и проанализированы, хотя эти частицы быстро разлагаются в координирующих растворителях <1999JCD1077>. Аналогичное исследование было проведено для той же девятичленной кольцевой системы, но для комплексообразования использовались разные катионы, такие как серебро, медь или золото <1997JCD3493>.Гомологичные лестничные структуры [MCl 3 (1,5-диселенациклооктан)] (M = As, Sb, Bi), образованные из плоских звеньев M 2 Cl 6 , связанных селенэфирными лигандами с транс- атомами Se, обнаруживают неожиданные структурные паттерны <2004JCD980>.
Лигирующие свойства новых макроциклов дитиателлуры 23 и 24 были исследованы с различными видами переходных металлов, что дало fac — [Mn (CO) 3 (L)] CF 3 SO 3 , цис — [MCl 2 (L)] (M = Pd или Pt), [Rh (Cp *) (L)] — (PF 6 ) 2 , [Cu (L) ] BF 4 и [Ag (L)] CF 3 SO 3 .По возможности режим координации был установлен спектроскопическими методами; Были установлены эффекты размера кольца, и данные сравнивались с другими комплексами, включающими родственные циклические и ациклические лиганды <2003JCD2434>.
Взаимодействие 22-членного макроцикла селенааза 93 с Pt (ii) привело к образованию нового катионного металламакроциклического комплекса Pt (iv) посредством окислительного присоединения связи C – Se к Pt (ii), тогда как соответствующие реакции 94 с Pd (ii) давали катионные комплексы с различными лигирующими свойствами <2004CC322, 2000CC143>.Комплексообразование 93 и 94 с никелем (ii) <2004JOM (689) 1452> и ртутью (ii) также описано <1996JCD1203, 2000CCR49>.
Один из новых серий комплексов смешанных лигандов каркаса донорных атомов селена и азота был представлен Джексоном и сотрудниками <1996CC143>. Кобальтовый комплекс нитрокэпированного каркаса с набором доноров N 3 Se 3 95 получали с использованием нитрометана, формальдегида и открытого исходного селенсодержащего лиганда, уже образованного трихлорокобальтом.
фактов о меди | Живая наука
Блестящая красноватая медь была первым металлом, которым манипулировали люди, и сегодня она остается важным металлом в промышленности.
Самый старый металлический предмет, найденный на Ближнем Востоке, состоит из меди; это было крошечное шило , датируемое 5100 годом до нашей эры. А пенни США изначально был сделан из чистой меди (хотя в настоящее время это 97,5% цинка с тонкой медной оболочкой).
Согласно стандарту U, медь занимает третье место в мире по потребляемым промышленным металлам после железа и алюминия.С. Геологическая служба (USGS) . Около трех четвертей этой меди идет на производство электрических проводов, телекоммуникационных кабелей и электроники.
Помимо золота, медь — единственный металл в таблице Менделеева, цвет которого не является естественным серебряным или серым.
Химическое описание
- Атомный номер (количество протонов в ядре): 29
- Атомный символ (в периодической таблице элементов): Cu
- Атомный вес (средняя масса атома): 63.55
- Плотность: 8,92 грамма на кубический сантиметр
- Фаза при комнатной температуре: твердая
- Точка плавления: 1 984,32 градуса по Фаренгейту (1084,62 градуса Цельсия)
- Точка кипения: 5301 градус F (2927 градусов C)
- (Количество изотопов) атомы одного и того же элемента с разным числом нейтронов): 35; 2 стабильный
- Наиболее распространенные изотопы: Cu-63 (естественное содержание 69,15%) и Cu-65 (естественное содержание 30,85%)
История и характеристики
Большая часть меди содержится в рудах и должна быть выплавлена или извлечена из руды , для чистоты перед использованием.Но в результате естественных химических реакций иногда может выделяться самородная медь, согласно сайту химической базы данных Chemicool.
Люди изготавливали изделия из меди по крайней мере 8000 лет и выяснили, как плавить металл, примерно к 4500 году до нашей эры. Следующим технологическим скачком было создание медных сплавов путем добавления олова к меди, в результате чего получился более твердый металл, чем отдельные его части: бронза. Технологическое развитие положило начало бронзовому веку, периоду, охватывающему примерно 3300–1200 гг. До н. Э.C, и отличается использованием бронзовых инструментов и оружия, согласно истории.
Медные артефакты усыпаны повсюду в исторических записях. Археологи обнаружили крошечное шило, или заостренный инструмент, датируемое 5100 годом до нашей эры, которое было похоронено вместе с женщиной средних лет в древней деревне в Израиле. Шило представляет собой самый старый металлический предмет, когда-либо найденный на Ближнем Востоке. Согласно статье 2014 года, опубликованной в PLOS ONE, медь, вероятно, поступала из Кавказского региона, расположенного в горном регионе, охватывающем юго-восток России, Армению, Азербайджан и Грузию, на расстоянии более 600 миль (1000 километров).В Древнем Египте люди использовали медные сплавы для изготовления украшений, в том числе колец на пальцах ног . Исследователи также обнаружили массивные медные рудники X века до нашей эры. в Израиле.
По данным Геологической службы США, около двух третей меди на Земле содержится в магматических (вулканических) породах, а около четверти — в осадочных породах. Металл пластичный и податливый, хорошо проводит тепло и электричество — вот почему медь широко используется в электронике и проводке.
Медь становится зеленой из-за реакции окисления; то есть он теряет электроны при контакте с водой и воздухом.Полученный оксид меди имеет тускло-зеленый цвет. Эта реакция окисления является причиной того, что покрытая медью Статуя Свободы имеет зеленый цвет, а не оранжево-красный. Согласно Copper Development Association , выветрившийся слой оксида меди толщиной всего 0,005 дюйма (0,127 миллиметра) покрывает Lady Liberty, а вес покрытия составляет около 80 тонн (73 метрических тонны). По данным Исторического общества Нью-Йорка, изменение цвета с медного на зеленый цвет происходило постепенно и было завершено к 1920 году, через 34 года после того, как статуя была освящена и открыта.
Кто знал?
Вот несколько интересных фактов о меди:
- По словам Петера ван дер Крогта, голландского историка, слово «медь» имеет несколько корней, многие из которых происходят от латинского слова cuprum , образованного от фразы Cyprium aes , что означает «металл с Кипра», поскольку большая часть меди, используемой в то время, была добыта на Кипре.
- Если бы вся медная проводка в среднем автомобиле была проложена, она бы растянулась на 0.9 миль (1,5 км), по данным USGS.
- По данным лаборатории Джефферсона, по электрической проводимости (насколько легко ток может протекать через металл) медь уступает только серебру.
- Пенни делались из чистой меди только с 1783 по 1837 год. С 1837 по 1857 год гроши делались из бронзы (95 процентов меди, а остальные 5 процентов составляли олово и цинк). В 1857 году количество меди в пенни упало до 88 процентов (оставшиеся 12 процентов приходился на никель) и вернулось к своему прежнему рецепту в 1864 году.В 1962 году содержание пенни изменилось на 95 процентов меди и 5 процентов цинка. С 1982 года по сегодняшний день гроши на 97,5% состоят из цинка и 2,5% из меди.
- Медь нужна людям в рационе. По данным Национальной медицинской библиотеки США, этот металл является важным микроэлементом, который имеет решающее значение для образования красных кровяных телец. К счастью, медь содержится в различных продуктах питания, в том числе в зернах, бобах, картофеле и листовой зелени.
- Однако слишком много меди — это плохо.Проглатывание большого количества металла может вызвать боль в животе, рвоту и желтуху (желтоватый оттенок кожи и белый цвет глаз, которые могут указывать на неправильную работу печени) в краткосрочной перспективе. Длительное воздействие может вызвать такие симптомы, как анемия, судороги и диарея, часто с кровью и синим цветом.
- Иногда из-за старых медных труб в системе водоснабжения обнаруживается повышенный уровень меди. Например, в августе 2018 года государственная школьная система в Детройте отключила всю питьевую воду в государственных школах в качестве меры предосторожности из-за высокого уровня содержания меди и железа в воде, согласно Seattle Times.
- Медь обладает антимикробными свойствами и убивает бактерии, вирусы и дрожжи при контакте, согласно статье 2011 года в журнале Applied and Environmental Microbiology. В результате из меди можно даже вплетать ткани для изготовления антимикробной одежды, такой как носки, которые борются с грибком стопы.
- Медь также входит в состав некоторых типов внутриматочных спиралей (ВМС), используемых для контроля над рождаемостью, по данным клиники Майо. Медная проводка вызывает воспалительную реакцию, токсичную как для спермы, так и для яйцеклеток, чтобы предотвратить беременность.При любой медицинской процедуре существует риск побочных эффектов. Хотя, судя по статье 2017 года, опубликованной в Medical Science Monitor, токсичность меди не такова.
Электронная конфигурация и элементные свойства меди. (Изображение предоставлено Грегом Робсоном / Creative Commons, Андрей Маринкас Shutterstock)
Текущие исследования
Медицина: Антимикробные свойства меди сделали ее популярным металлом в области медицины. Многие больницы экспериментировали с покрытием поверхностей, к которым часто прикасаются, таких как перила кроватей и кнопки вызова, медью или медными сплавами, чтобы замедлить распространение внутрибольничных инфекций.Медь убивает микробы, нарушая электрический заряд клеточных мембран организмов, сказала Кассандра Сальгадо, профессор инфекционных заболеваний и больничный эпидемиолог в Медицинском университете Южной Каролины.
В 2013 году группа исследователей во главе с Сальгадо проверила поверхности в отделениях интенсивной терапии (ОИТ) в трех больницах, сравнивая комнаты, модифицированные медными поверхностями, прикрепленными к шести обычным объектам, которые подвергаются воздействию многих рук, с комнатами, не модифицированными медью.Ученые обнаружили, что в традиционных больничных палатах (без медных поверхностей) у 12,3 процента пациентов развиваются устойчивые к антибиотикам инфекции, такие как устойчивый к метициллину Staphylococcus aureus (MRSA) и устойчивый к ванкомицину Enterococcus (VRE). Для сравнения, в палатах, отделанных медью, только 7,1 процента пациентов заразились одной из этих потенциально разрушительных инфекций.
«Мы знаем, что если вы поместите медь в палату пациента, вы уменьшите микробную нагрузку», — сказал Сальгадо Live Science.«Я думаю, что это было показано снова и снова. Наше исследование было первым, продемонстрировавшим, что это может иметь клиническую пользу».
Исследователи больше ничего не изменили в условиях интенсивной терапии, кроме меди; врачи и медсестры все еще мыли руки, и уборка продолжалась в обычном режиме. Исследователи опубликовали свои результаты в 2013 году в журнале Infection Control and Hospital Epidemiology .
Сальгадо и ее команда также протестировали медную облицовку на стетоскопах, согласно статье 2017 года, опубликованной в American Journal of Infection Control, где исследователи обнаружили, что на стетоскопах с медным покрытием было значительно меньше бактерий, а 66% стетоскопов были полностью без бактерий.Дальнейшие исследования продолжаются, чтобы проверить идею меднения в других медицинских палатах, особенно в тех областях, где пациенты более мобильны, чем в отделениях интенсивной терапии. По ее словам, также необходим анализ затрат и выгод, в котором сравниваются затраты на установку меди и экономию, полученную за счет предотвращения дорогостоящих инфекций.
Электроника: Медь также играет огромную роль в электронике, и из-за ее изобилия и низкой цены исследователи работают над интеграцией металла во все большее количество передовых устройств.
На самом деле, медь может помочь в производстве футуристической электронной бумаги, носимых биосенсоров и другой «мягкой» электроники, сказал Венлун Ченг, профессор химической инженерии в Университете Монаш в Австралии. Ченг и его коллеги использовали медные нанопроволоки для создания «монолита из аэрогеля» — материала, который является очень пористым, очень легким и достаточно прочным, чтобы стоять самостоятельно, подобно сухой кухонной губке. В прошлом эти монолиты аэрогеля изготавливали из золота или серебра, но медь является более экономичным вариантом.
Смешивая медные нанопроволоки с небольшим количеством поливинилового спирта, исследователи создали монолиты аэрогеля, которые могут превращаться в своего рода резину, которую можно разрезать и под которой можно формовать, которая проводит электричество. Исследователи сообщили о своих выводах в 2014 году в журнале ACS Nano . Конечным результатом может стать робот с мягким телом или медицинский датчик, который идеально сочетается с изогнутой кожей, сказал Ченг Live Science. Он и его команда в настоящее время работают над созданием датчиков кровяного давления и температуры тела из монолитов медного аэрогеля — еще один способ, которым медь может помочь контролировать здоровье человека.
Физика: В эксперименте 2014 года кусок меди стал самым холодным кубическим метром (35,3 кубических футов) на Земле, когда исследователи охладили его до 6 милликельвинов, или шести тысячных градуса выше абсолютного нуля (0 кельвинов). ). Это самое близкое вещество с такой массой и объемом, которое когда-либо подходило к абсолютному нулю .
Исследователи Итальянского национального института ядерной физики положили 880 фунтов. (400 кг) медный куб внутри контейнера, называемого криостатом, который специально разработан для того, чтобы предметы были очень холодными.Это первый криостат или устройство для хранения вещей при низких температурах, способное удерживать вещества настолько близко к абсолютному нулю.
Создание криостата для экстремальных температур — это лишь первый шаг в новом эксперименте, в котором криостат будет действовать как детектор частиц. Исследователи надеются, что детектор, который находится в процессе ввода в эксплуатацию в соответствии с обновлением статуса за 2018 год, расскажет больше о субатомных частицах, называемых нейтрино, и о том, почему во Вселенной на больше материи, чем антиматерии .
Сельское хозяйство : Исследователи из Корнельского университета изучали влияние дефицита меди на сельскохозяйственные культуры, особенно на пшеницу. Пшеница является одним из важнейших продуктов питания в мире, а дефицит меди может привести как к снижению урожайности, так и к снижению плодородия сельскохозяйственных культур.
Исследователи изучали, как растения поглощают и перерабатывают медь. Они обнаружили в пшенице два белка, AtCITF1 и AtSPL7, которые жизненно важны для поглощения и доставки меди к репродуктивным органам пшеницы.С. Департамент сельского хозяйства.
Ранние испытания показали, что когда медь и другие питательные вещества обогащаются в почве и затем поглощаются пшеницей, урожайность увеличивается в семь раз. Хотя известно, что медь и другие минералы полезны для здоровья и плодородия сельскохозяйственных культур, вопрос о том, как и почему этот факт, не совсем понятен. Знания о том, почему медь полезна и как она влияет на рост и размножение растений, можно в дальнейшем использовать на таких культурах, как рис, ячмень и овес, и можно внести эти культуры с помощью минеральных удобрений, в состав которых входит медь, в почву когда-то был непригоден для земледелия.
Дополнительные ресурсы
- Американское онкологическое общество изучает исследования меди и утверждает, что она может играть роль в предотвращении или лечении рака.
- Агентство по охране окружающей среды предоставляет информацию о воздействии высоких уровней меди и влиянии коррозии меди на бытовые трубы.
- Национальный ускоритель Томаса Джефферсона (лаборатория Джефферсона) исследует историю и использование меди.
Эта статья была обновлена: сентябрь.12 августа 2018 г., автор проекта Live Science Рэйчел Росс.
It’s Elemental — Элемент Медь
Что в названии? От латинского слова cuprum , что означает «с острова Кипр».
Сказать что? Медь произносится как КОП-эр .
Археологические данные свидетельствуют о том, что люди использовали медь не менее 11000 лет. Относительно простые в добыче и переработке, люди открыли методы извлечения меди из руд по крайней мере 7000 лет назад.Римская империя добывала большую часть своей меди с острова Кипр, откуда и произошло название меди. Сегодня медь в основном получают из руд куприта (CuO 2 ), тенорита (CuO), малахита (CuO 3 · Cu (OH) 2 ), халькоцита (Cu 2 S), ковеллита (CuS ) и борнит (Cu 6 FeS 4 ). Крупные месторождения медной руды находятся в США, Чили, Замбии, Заире, Перу и Канаде.
Медь, которая в больших количествах используется в электротехнической промышленности в виде проволоки, уступает только серебру по электропроводности.Поскольку медь противостоит коррозии из-за воздуха, влаги и морской воды, она широко используется в производстве монет. Американские пенни, которые когда-то делались почти полностью из меди, теперь делают из цинка, покрытого медью. Медь также используется для изготовления водопроводных труб и украшений, а также других предметов.
Чистая медь обычно слишком мягкая для большинства применений. Люди впервые узнали около 5000 лет назад, что медь может быть усилена, если ее смешать с другими металлами. Два самых известных сплава меди — это бронза и латунь.Бронза, первый сплав, созданный людьми, представляет собой смесь меди, содержащую до 25% олова. Ранние люди использовали бронзу для изготовления инструментов, оружия, контейнеров и декоративных предметов. Латунь, смесь меди, содержащая от 5% до 45% цинка, была впервые использована около 2500 лет назад. Римляне первыми начали широко использовать латунь для изготовления монет, чайников и декоративных предметов. Сегодня латунь также используется в некоторых музыкальных инструментах, винтах и другом оборудовании, которое должно противостоять коррозии.
Гидратированный сульфат меди (CuSO 4 · H 2 O), также известный как голубой купорос, является наиболее известным соединением меди. Он используется как сельскохозяйственный яд, как альгицид при очистке воды и как синий пигмент для чернил. Хлорид меди (CuCl 2 ), еще одно соединение меди, используется для закрепления красителей на тканях. Хлорид меди (CuCl) — это ядовитый белый порошок, который в основном используется для поглощения диоксида углерода (CO 2 ).
 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.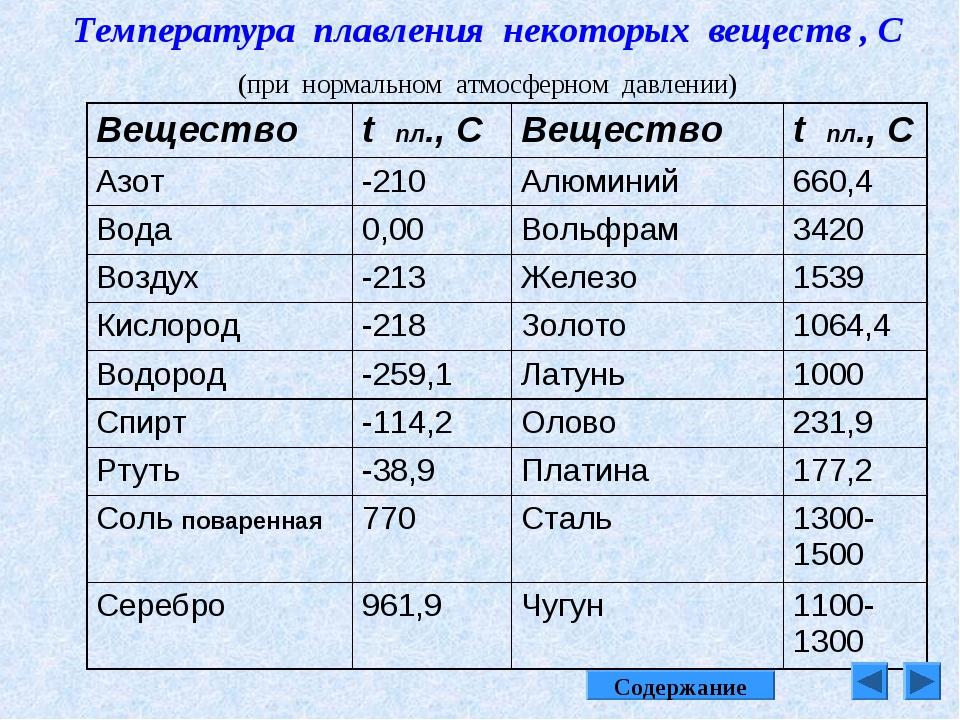


 Сплав с добавление цинка, содержание которого может доходить до 40%. Цинк повышает пластичность и прочность металла. Температура, при которой латунь плавится, составляет 880 — 950 градусов.
Сплав с добавление цинка, содержание которого может доходить до 40%. Цинк повышает пластичность и прочность металла. Температура, при которой латунь плавится, составляет 880 — 950 градусов. Но он обладает более высокой механической прочностью, чем обычное серебро.
Но он обладает более высокой механической прочностью, чем обычное серебро.
 Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла. Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля.
Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла. Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля.
