Определение изменений энтропии — Справочник химика 21
Ур. (VII, 51) и (VII, 52) выражают зависимость энтропии одного моля идеального газа от его объема и давления при постоянной температуре. Они применяются обычно для определения изменения энтропии газа при изотермическом расширении или сжатии его. В этом случае постоянные ks и ks исключаются и [c.231]
Определение изменения энтропии при комплексо-образовании в растворе. В соответствии с методикой, изложенной выше, определяют энтальпию образования комплексных соединений, образуемых одной солью с различными лигандами, и устанавливают состав комплексных соединений. На основании полученных результатов и справочных данных по константам нестойкости комплексных ионов вычисляют изменение энергии Гиббса и энтропии при комплексообразова-нии. [c.74]
Чтобы энтропии веществ были сравнимы (для их сопоставления и определения изменения энтропии в различных процессах, в том числе и химических реакциях), их, как и тепловые эффекты, принято относить к определенным условиям. Чаще всего значения 5 берут при = 25° С и Р = = 1 атм при этом газы считают идеальными, а для растворов (и ионов в растворах) принимают их состояние при кон-центрации равной единице. Энтропия при этих условиях обозначается и называется стандартной энтропией. Для некоторых веществ значения Змз приведены в табл. 6. [c.38]
При постоянной температуре из (111.34) получается формула, аналогичная (111.10). Она показывает, что с увеличением давления газа его энтропия уменьшается. Выведенные здесь соотношения применяются в вычислениях изменения энтропии при приведении газа к стандартным условиям, а условия стандартности состояния газа включают его соответствие уравнению идеального газа. Очень важно по причинам, которые станут ясны несколько позже (см. 5 этой главы), определение изменения энтропии при равновесном переходе вещества от кристаллического состояния при абсолютном нуле (энтропия So) до стандартного состояния при температуре 298,15° К (энтропия S29 ). Например, Н О (тв,0°К) HjO (пар, 1 атм, ид. газ, 298° К). Равновесный переход должен состоять из нескольких этапов. Первый этап — нагревание твердой воды от 0° К до температуры плавления. Изменение энтропии рассчитывается по (III.23). Именно [c.80]
Например, Н О (тв,0°К) HjO (пар, 1 атм, ид. газ, 298° К). Равновесный переход должен состоять из нескольких этапов. Первый этап — нагревание твердой воды от 0° К до температуры плавления. Изменение энтропии рассчитывается по (III.23). Именно [c.80]
При определении изменения энтропии необходимо учесть массу вещества, претерпевшего фазовое превращение. Теплота плавления 250 г свинца 23040-0,25 == 5760 Дж. Абсолютная температура плавления 327,4 ф 273,0 =з = 600,4 К. [c.12]
Определение изменения энтропии системы при реакции При стандартных условиях [c.196]
Определение изменения энтропии при полимеризации. Для определения изменения энтропии при полимеризации ASm можно воспользоваться измерением равновесной концентрации мономера и вести расчет по уравнению пс= (AH°IRT) — —AS° R. Другой возможный метод основан на экспериментальном определении предельной температуры полимеризации Тар-Если измерять скорость образования полимера или расходования мономера, то вблизи Гпр измеряемая скорость будет близка к нулю. Экстраполяция графика скорость—температура в область нулевой скорости позволяет найти Гпр с точностью не ниже 2—3 градусов. Дальнейший расчет основан на следующих соотношениях. [c.264]
Поскольку расчет Л5 реального процесса сводится к определению изменения энтропии в одном или нескольких обратимых процессах, необходимо прежде всего конкретизировать расчетные формулы для последних. [c.83]
Тепловой эффект реакции находим по теплотам образования, а для определения изменения энтропии системы воспользуемся стандартными энтропиями компонентов реагирующей системы, приведенными в [2, табл. 44]. Вначале запишем уравнение реакции [c.101]
Пример 2. Определение изменения энтропии при фазовых превращениях. Удельная теплота плавления свинца 23 040 Дж/кг. Температура плавления свинца 327,4 С. Найдите изменение энтропии при плавлении 250 г свинца. [c.12]
[c.12]
Во-вторых, хотя и сообщалось об образовании диметилциклобутанов при действии влажного бромистого алюминия на циклогексан [318], однако есть основания сомневаться в правильности идентификации этих соединений. Рассмотрение энергий напряжения в циклических углеводородах вместе с приблизительной оценкой изменения энтропии привело к заключению, что количество циклопропановых и циклобутановых изомеров цикло-гексана в равновесной смеси не может превышать 0,01% [266]. Следовательно, мало вероятно, что присутствие этих изомеров является источником ошибок в определении равновесия метилциклопентан — циклогексан. Наиболее правдоподобно, что неточно калориметрическое определение изменения энтропии. [c.146]
Последовательность расчета по формуле (119) обычно такова цикл разбивается на отдельные процессы (элементы), для которых составляются уравнения баланса энтропии, что позволяет определять Asj и соответственно Этот способ расчета требует использования тепловых диаграмм для определения изменения энтропии, которая в общем случае вычисляется по формуле [c.91]
Для количественного сопоставления этих факторов наиболее просто воспользоваться определением изменения энтропии при процессе, происходящем при постоянной температуре. В изотермических обратимых процессах (когда система может возвратиться в исходное состояние, не оставив каких-либо изменений в окружающей среде) изменение энтропии равняется тепловому эффекту перехода, деленному на абсолютную температуру [c.104]
Рассчитаем изменение энтропии чистого вещества с изменением температуры для случая, когда изменения физического состояния не происходит. Предположим, что процесс осуш ествляется при постоянном давлении. При определении изменения энтропии А8 будем считать процесс обратимым. Тогда [c.193]
Таким образом, чтобы найти изменения энтальпии и энтропии реакции опытным путем, необходимо определить константы равновесия при различных температурах и построить соответствующий фафик. Для определения величины изменения энтальпии не имеет значения, в каких величинах выражаются парциальные давления, так как тангенс угла наклона прямой меняться не будет. Выбор единиц измерения повлияет лишь на параллельное смещение прямой. Он повлияет на величину отсекаемого отрезка на оси ординат, и основная ошибка будет в определении изменения энтропии. Чтобы избежать этой ошибки, константу равновесия надо рассчитывать через объемные или мольные доли, соответственно, т. е. использовать безразмерные величины. [c.28]
Для определения величины изменения энтальпии не имеет значения, в каких величинах выражаются парциальные давления, так как тангенс угла наклона прямой меняться не будет. Выбор единиц измерения повлияет лишь на параллельное смещение прямой. Он повлияет на величину отсекаемого отрезка на оси ординат, и основная ошибка будет в определении изменения энтропии. Чтобы избежать этой ошибки, константу равновесия надо рассчитывать через объемные или мольные доли, соответственно, т. е. использовать безразмерные величины. [c.28]
Изменение энтальпии ЛЯ легко определялось калориметрически или рассчитывалось, исходя из теплот образования начальных и конечных веществ из одних и тех же веществ, обычно простых веществ в устойчивой при этой температуре форме. Трудности заключались в определении изменения энтропии AS в ходе реакции. Прямое экспериментальное определение энтропии невозможно, а ее расчет из температурных коэффициентов энергии Гиббса по уравнению [c.318]
Определение изменения энтропии по величине двулучепреломления, вызванного ориентацией под напряжением [c.154]
Уравнение (7,5.1) дает равноценное соотношение для расчета стандартной энтропии реакции А5у, отнесенной к опорной температуре 298 К. При наличии значений идеальногазовой теплоемкости — экспериментальных и рассчитанных по одному из методов, изложенных в разделе 7.3, для определения изменений энтропии в химических реакциях при любой температуре необходимо получить только значения [c.251]
В приложении III показано, что это уравнение может быть использовано для определения энтропии S или ее изменения. Мы же показали здесь (и то лишь для двух случаев), что статистическое определение изменения энтропии [c.321]
И классическое определение изменения энтропии через тепловой эффект [c.321]
К тому же заключению можно притти другим, более или менее равноценным путем, без явного использования идеи резонансной энергии.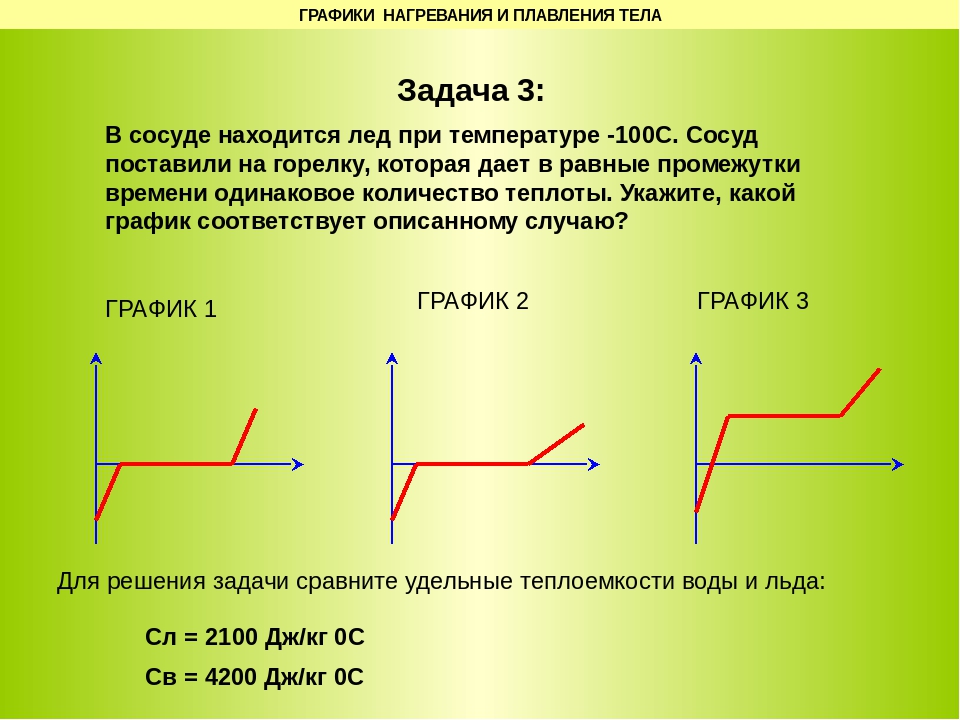 В хиноидной структуре недиссоциированной молекулы II атом кислорода несет формальный положительный заряд. Этот заряд делает атом кислорода более положительным или менее отрицательным, че.м атом кислорода в насыщенном спирте. Поэтому резонанс вызывает электростатический эффект, увеличивающий степень ионизации, как в хлормасляных кислотах. К большинству, хотя и не ко всем остальным примерам, рассмотренным в этом и следующем параграфах, также можно подойти с этих двух точек зрения. Преимущество второй из них в том, что она сводит эффект к чисто электростатическому взаимодействию и тем самым до некоторой степени уменьшает трудности в отношении определения изменения энтропии. Но мы используем прежний подход, основанный на энергии резонанса, так как такое рассмотрение является более общим и может быть применено к большему кругу вопросов. [c.244]
В хиноидной структуре недиссоциированной молекулы II атом кислорода несет формальный положительный заряд. Этот заряд делает атом кислорода более положительным или менее отрицательным, че.м атом кислорода в насыщенном спирте. Поэтому резонанс вызывает электростатический эффект, увеличивающий степень ионизации, как в хлормасляных кислотах. К большинству, хотя и не ко всем остальным примерам, рассмотренным в этом и следующем параграфах, также можно подойти с этих двух точек зрения. Преимущество второй из них в том, что она сводит эффект к чисто электростатическому взаимодействию и тем самым до некоторой степени уменьшает трудности в отношении определения изменения энтропии. Но мы используем прежний подход, основанный на энергии резонанса, так как такое рассмотрение является более общим и может быть применено к большему кругу вопросов. [c.244]
На основании определения изменения энтропии й5=С[c.51]
Из определения изменения энтропии при обратимом процессе [уравнение (1.5)] следует, что для вещества, нагреваемого от Ту до Т при постоянном давлении, оно равно [c.82]
Очень важно по причинам, которые станут ясны несколько позже (см. 5 этой главы), определение изменения энтропии при равновесном переходе вещества от кристаллического состояния при абсолютном нуле (энтропия 5о) до стандартного состояния при температуре 298,15 К (энтропия 5°298). Например, НгО (тв. О К) НгО (пар, 1 атм. ид. газ, 298 К). Равновесный переход должен состоять из нескольких этапов. Первый этап — нагревание твердой воды от О К До температуры плавления. [c.95]
Определение изменения энтропии системы при реакции [c.198]
Если а величин из й + 2 величин Р, Т, (Ль. .., цл остаются постоянными при изменении энтропии и чисел молей компонентов, т. е. а уравнений (IV. ) равны нулю и одно уравнение отлично от нуля [условие, при котором получены уравнения (IV. 5) и (1У.7)], то с / а+1 должно быть в этом случае равно нулю. Действительно, если при некоторых определенных изменениях энтропии и чисел молей компонентов имело бы положи- [c.126]
Действительно, если при некоторых определенных изменениях энтропии и чисел молей компонентов имело бы положи- [c.126]
Таким образом, получен критерий самопроизвольного протекания любого процесса при данных внешних условиях. Однако определение изменения энтропии внешней среды крайне затруднительно. Рассматривая необратимые процессы, можно принять, что обмен тепла между системой и окружающей средой происходит обратимо, т. е. [c.75]
Реакция образования фазы постоянного состава сопровождается определенными изменениями энтропии, теплосодержания и свободной энергии, так как при этом взаимодействия между атомами изменяются вполне определенным и единственным образом. [c.85]
Перед тем как дать математическое определение изменений энтропии на языке термодинамических величин, остановимся на нескольких примерах самопроизвольно протекающих процессов. Существенно, что некоторые из таких процессов могут происходить без совершения какой бы то ни было работы, откуда можно заключить, что совершение работы, вообще говоря, не является обязательным критерием самопроизвольного изменения состояния системы. Столь же важно наблюдение, согласно которому самопроизвольно протекающие процессы могут характеризоваться положительным, отрицательным или нулевым изменением внутренней энергии АЕ). Для изотермического смешения газов АЕ — 0. Вместе с тем при самопроизвольном растворении сульфата аммония в воде АЕ положительно. По сути дела, знак АЕ не определяет самопроизвольности протекания процесса или изменения энтропии. [c.87]
Иногда предлагается использовать функцию I—Т 8 не только при решении отдельных технических задач в соответствии со смыслом вывода выражения (53), но и положить ее, с приведенным выше определением как эксергии, в основу всего термодинамического анализа низкотемпературных процессов. Однако такой метод анализа сравнительно с обычным, базирующимся на применении в явном виде основной функции второго начала — энтропии, в области процессов, подлежащих рассмотрению в данном случае и связанных прежде всего с затратой работы, преимуществ не имеет. Можно, конечно, потери от необратимости определять по изменению значения функции /—Го5, но легко убедиться, что в конечном счете такое применение этой функции сводится прежде всего к определению изменений энтропии. При выполнении [c.28]
Можно, конечно, потери от необратимости определять по изменению значения функции /—Го5, но легко убедиться, что в конечном счете такое применение этой функции сводится прежде всего к определению изменений энтропии. При выполнении [c.28]
Для термодинамического анализа этого эффекта необходимо найти соответствующие потоки и силы, используя соотношение изменения энтропии. При определении изменения энтропии считаем, что система является адиабатически изолированной. Пусть объем системы будет V. В состоянии термостатического равновесия обе части системы, заключенные в разных резервуарах, имеют одинаковый запас энергии V, одинаковую массу М и, следовательно, одинаковую энтропию б . В качестве характеристик состояния системы выгодно выбрать энергию V и массу М, потому что они подчиняются закону сохранения. Изменение энергии и массы в резервуаре I равны Ш и а в резервуаре И, соответственно, — Аи и — АМ, так как вся система адиабатически изолирована. Изменение энтропии всей системы 13 целом может быть найдено суммированием изменения энтропии в обоих резервуарах / 1 и Дб» . Для этого предварительно разложим изменение энтропии в каждом из резервуаров (Ух и Дб ц в ряд Тейлора. Для резервуара [c.39]
В заключение этого параграфа сделаем некоторые замечания, касающиеся первого закона термодинамики. Формула (19) написана в качестве уравнения энергии и она удобна для определения изменения энтропии. Однако, можно написать аналогичное уравнение в другой [c.127]
Для определения изменения энтропии в результате реакции (4.130) можно воспользоваться формулой, выведенной Якобсоном и Стокмаером [30] [c.122]
Теория переходного состояния допускает, что частицы, столкнувшись, некоторое время (10 сек) могут находиться вместе при этом происходят определенные изменения в их строении. Это промежуточное состояние называется активированным состоянием или активированным комплексом его характеризует величина энергии активации.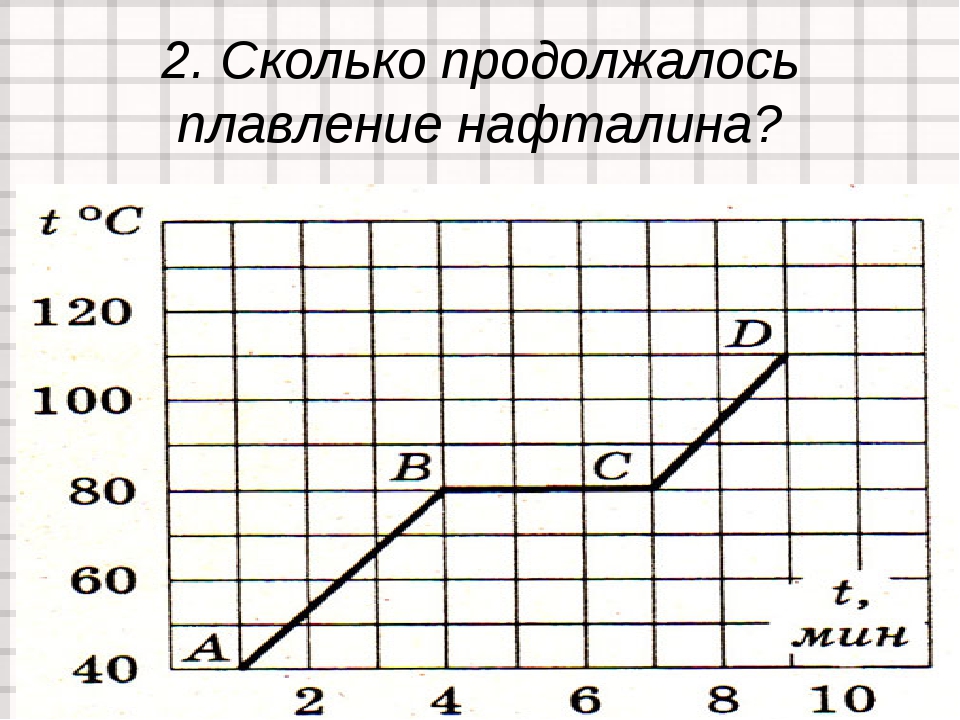 Кроме того, для активированного состояния характерно определенное изменение энтропии по сравнению с энтропией исходных продуктов — так называемая энтропия активации. (Напомним, что под энтропией системы понимают величину, связаннзоо с ве юятностью нахождения системы в данном состоянии. Энтропию можно считать мерой хаотичности, неупорядоченности системы чем более система неупорядочен-на, тем выше значение энтропии, и наоборот. Отсюда видно, что любой разрыв связей, рост числа частиц, принимающих участие в реакции, будут вести к повышению энтропии, тогда как появление новых связей, определенная ориентация [c.38]
Кроме того, для активированного состояния характерно определенное изменение энтропии по сравнению с энтропией исходных продуктов — так называемая энтропия активации. (Напомним, что под энтропией системы понимают величину, связаннзоо с ве юятностью нахождения системы в данном состоянии. Энтропию можно считать мерой хаотичности, неупорядоченности системы чем более система неупорядочен-на, тем выше значение энтропии, и наоборот. Отсюда видно, что любой разрыв связей, рост числа частиц, принимающих участие в реакции, будут вести к повышению энтропии, тогда как появление новых связей, определенная ориентация [c.38]
Величину / — Го5 при постоянной То можно рассматривать как функцию состояния. Иногда предлагается использовать эту функцию-не только при решении отдельных технических задач, но и положить ее в основу всего термодинамического анализа низкотемпературных процессов. Однако такой метод анализа сравнительно с обычным, базирующимся на применении в явном виде основной функции второго начала — энтропии, никаких особых преимуществ, в частности в области процессов, подлежащих рассмотрению в данном случае, не имеет. Легко убедиться, что применение функции 1 — ТоЗ в конечном счете сводится к определению изменений энтропии. Следует также отметить, что при выполнении технических расчетов с помощью обычных диаграмм точность расчето выше, чем при использовании диаграмм, включающих функцию / — То5. Возможности применения этой функции, кроме того, ограничены некоторой условностью ее определения, связанной с принятым температурным уровнем окружающей среды. [c.30]
Логарифмическое изменение удерживаемых объемов в гомологических рядах при изотермической хроматографии можно выразить в зависимости или от числа углеродных атомов, или от температуры кипения. В литературе было описано много примеров такого рода зависимостей. Парнелл 14], который собрал ряд примеров, отметил, что эта последовательность является результатом линейного изменения теплоты испарения или растворения АЯ с изменением числа углеродных атомов.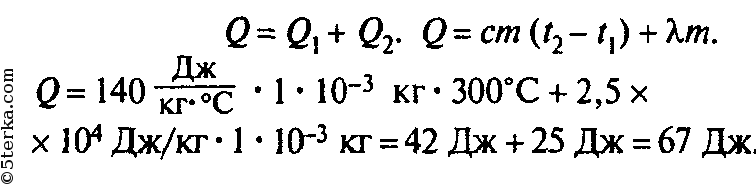 При обсуждении связи с изотермической хроматографией иногда не замечают, что одновременно подразумевается вполне определенное изменение энтропии раствора. В соответствии с выражением [c.169]
При обсуждении связи с изотермической хроматографией иногда не замечают, что одновременно подразумевается вполне определенное изменение энтропии раствора. В соответствии с выражением [c.169]
Для определения изменения энтропии воды при гидратации ионов в массе растворителя Улихом [491] была предложена гипотеза, согласно которой гидратация молекул воды вблизи иона адекватна их вмерзанию. Из данных табл. V.8 видно, что гипотеза Улиха справедлива лишь для многозарядных ионов (выше двух), из двузарядных ионов этой гипотезе подчиняется Ве . Вмерзания молекул воды вблизи одно и многих двузарядных ионов не наблюдается (неравенство «к > Н20(тв) для таких ионов нигде не нарушается) [1, 221, 466]. Для трех- и четырехзарядных ионов редкоземельных и актинидных элементов в первом и довольно точном приближении эта гипотеза справедлива [488]. [c.201]
Наряду с упомянутыми выше экспериментальными возможностями определения изменения энтропии при деформации каучука существует еще один путь— прямое калориметрирова-ние тепловых эффектов, сопровождающих деформацию. Этот экспериментальный подход был использован Диком и Мюллером [60], и уже в этом первом калориметрическом исследовании было показано, что натуральный каучук не является каучуком, обладающим идеальной энтропийной упругостью, так как, по данным калориметрии, доля энергетической составляющей общей силы при растяжении на 150—250% при комнатной температуре составляет примерно 35%. [c.185]
контрольная работа «Аграгатные состояния вещества» 8 класс
контрольная работа «Аграгатные состояния вещества» 8 класс
Автор: edu1
Методическая копилка —
Физика
Контрольные работы составлены на основе контрольных тестов А.Е. Марона
Вариант 1
|
I
|
|
|
II
|
|
|
III
|
|
Вариант 2
|
I
|
|
|
II
|
|
|
III
|
|
Вариант 3
|
I
|
|
|
II
|
|
|
III
|
|
Вариант 4
|
I
|
|
|
II
|
|
|
III
|
|
Припои оловянно-свинцовые в изделиях, ГОСТ 21931-76 Припои — присадочные металлы (сплавы), способные в расплавленном состоянии заполнить зазор между спаиваемыми изделиями и в результате затвердевания образовывать неразборное прочное соединение. Поставляются в виде круглой проволоки, ленты, трехгранных, круглых прутков, круглых трубок, заполненных флюсом, и порошка Некоторые виды припоев:
Припои оловянно-свинцовые в чушках, ГОСТ 21930-79 Настоящий стандарт распространяется на припои оловянно-свинцовые (ПОС) в чушках и в изделиях, применяемые в основном для лужения и пайки деталей.
Малосурьмянистые
Сурьмянистые
Одним из основных элементов электромонтажных и радиомонтажных работ является пайка. Качество монтажа во многом определяется правильным выбором необходимых припоев и флюсов, применяемых при пайке проводов, сопротивлений, конденсаторов и т. Для облегчения этого выбора ниже приводятся краткие сведения о твердых и легких припоях и флюсах, пользовании ими и их изготовлении. Пайка представляет собой соединение твердых ме- таллов при помощи расплавленного припоя, имеющего температуру плавления меньшую, чем температура плавления основного металла. Припой должен хорошо растворять основной металл, легко растекаться по его поверхности, хорошо смачивать всю поверхность пайки, что обеспечивается лишь при полной чистоте смачиваемой поверхности основного металла. Для удаления окислов и загрязнений с поверхности спаиваемого металла, защиты его от окисления и лучшего смачивания припоем служат химические вещества, называемые флюсами. Температура плавления флюсов ниже, чем температура плавления припоя. Различают две группы флюсов: 1) химически активные, растворяющие пленки окиси, а часто и сам металл (соляная кислота, бура, хлористый аммоний, хлористый цинк) и 2) химически пассивные, защищающие лишь спаиваемые поверхности от окисления (канифоль, воск, стеарин и т. п.). . В зависимости от химического состава и температуры плавления припоев различают пайку твердыми и мягкими припоями. К твердым относятся припои с температурой плавления выше 400°С, к легким — припои с температурой плавления до 400°С. Основные материалы, применяемые для пайки. Олово — мягкий, ковкий металл серебристо-белого цвета. Удельный вес при температуре 20°С — 7,31. Температура плавления 231,9°С. Хорошо растворяется в концентрированной соляной или серной кислоте. Сероводород на него почти не влияет. Ценным свойством олова является его устойчивость во многих органических кислотах. При комнатной температуре мало поддается окислению, но при воздействии температуры ниже 18°С способен переходить в серую модификацию («оловянная чума»). В местах появления частиц серого олова происходит разрушение металла. Переход белого олова в серое резко ускоряется при понижении температуры до -50°С. Свинец — синевато-серый металл, мягкий, легко поддается обработке, режется ножом. Удельный вес при температуре 20°С 11,34. Температура плавления 327qC. На воздухе окисляется только с поверхности. В щелочах, а также в азотной и органических кислотах растворяется легко. Стоек против воздействий серной кислоты и сернокислых соединений. Применяется для изготовления припоев. Кадмий — серебристо-белый металл, мягкий, пластичный, механически непрочный. Удельный вес 8,6. Температура плавления 321°С. Применяется как для антикоррозийных покрытий, так и в сплавах со свинцом, оловом, висмутом для легкоплавких припоев. Сурьма — хрупкий серебристо-белый металл. Удельный вес 6,68. Температура плавления 630,5°С. На воздухе не окисляется. Применяется в сплавах со свинцом, оловом, висмутом, кадмием для легкоплавких припоев. Висмут — хрупкий серебристо-серый металл. Удельный вес 9,82. Температура плавления 271°С. Растворяется в азотной и горячей серной кислотах. Применяется в сплавах с оловом, свинцом, кадмием для получения легкоплавких припоев. Цинк — синевато-серый металл. В холодном состоянии хрупок. Удельный вес 7,1. Температура плавления 419°С. В сухом воздухе окисляется, во влажном воздухе покрывается пленкой окиси, которая предохраняет его от разрушения. В соединении с медью дает ряд прочных сплавов.. Легко растворяется в слабых кислотах. Применяется для изготовления твердых припоев и кислотных флюсов. Медь — красноватый металл, тягучий и мягкий. Удельный вес 8,6 — 8,9. Температура плавления 1083 С. Растворяется в серной и азотной кислотах и в аммиаке. В сухом воздухе почти не поддается окислению, в сыром воздухе покрывается окисью зеленого цвета. Применяется для изготовления тугоплавких припоев и сплавов. Канифоль -продукт переработки смолы хвойных деревьев Более светлые сорта канифоли (более тщательно очищенные) считаются лучшими. Припой оловянно-свинцовый в изделиях и чушках ГОСТ 21930-76 настоящий стандарт распространяется на оловянно-свинцовые припои, применяемые для лужения и пайки деталей. В зависимости от химического состава оловянно-свинцовые припои изготавливаются следующих марок: Бессурьмянистые — ПОС-90, ПОС-63, ПОС-61, ПОС-50, ПОС-40, ПОС-30, ПОС-10; Малосурьмянистые — ПОССу 61-05, ПОССу 50-05, ПОССу 40-05, ПОССу 35-05, ПОССу 30-05, ПОССу 25-05, ПОССу 18-05; Сурьмянистые — ПОССу 40-2, ПОССу 30-2, ПОССу 25-2, ПОССу 18-2. Припои оловянно-свинцовые изготовляют в соответствии с требованиями настоящего стандарта по технологической инструкции, утвержденной в установленном порядке. Химический состав припоев должен соответствовать требованиям таблицы 1, массовая доля примесей указана в таблице 2. Химический состав оловянно-свинцовых припоев ГОСТ 21931-76 таблица 1
Примесный состав оловянно-свинцовых припоев ГОСТ 21931-76 таблица 2
Мягкие припои. Пайка мягкими припоями получила широкое распространение, особенно при производстве монтажных работ. Наиболее часто применяемые мягкие припои содержат значительное количество олова. В табл. 1 приведены составы некоторых свинцово-оловянных припоев. Таблица 1
При выборе типа припоя необходимо учитывать его особенности и применять в зависимости от назначения спаиваемых деталей. Наибольшее применение находит припой марки ПОС-40. Он применяется при пайке соединительных проводов, сопротивлений, конденсаторов. Припой ПОС-30 используют для пайки экранирующих покрытий, латунных пластинок и других деталей. Наряду с примеиением стандартных марок находит применение и припой ПОС-60 (60% олова и 40% свинца). Мягкие припои изготовляются в виде прутков, болванок, проволоки (диаметром до 3 мм) и трубок, наполненных флюсом. Технология указанных припоев без специальных примесей несложна и вполне осуществима в условиях мастерской: свинец расплавляют в графитовом или металлическом тигле и в него небольшими частями добавляют олово, содержание которого определяют в зависимости от марки припоя. Жидкий сплав перемешивают, снимают нагар с поверхности и расплавленный припой выливают в деревянные или стальные формочки. Добавление висмута, кадмия и других присадок не обязательно. Для пайки различных деталей, не допускающих значительного перегрева, применяются особо легкоплавкие припои, которые получают добавлением в свинцово-оловянные припои висмута и кадмия или одного из этих металлов. В табл. 2 приведены составы некоторых легкоплавких припоев. Таблица 2
При использовании висмутовых и кадмиевых припоев следует учитывать, что они обладают большой хрупкостью и создают менее прочный спай, чем свинцово-оловянные. Твердые припои. Твердые припои создают высокую прочность шва. В электро-и радиомонтажных работах они используются значительно реже, чем мягкие припои. В табл. 3 приведены составы некоторых медно-цинковых припоев. Таблица 3
В зависимости от содержания цинка изменяется цвет припоя. Эти припои применяются для пайки бронзы, латуни, стали и других металлов, имеющих высокую температуру плавления. Припой ПМЦ-42 применяется при пайке латуни с содержанием 60-68% меди. Припой ПМЦ-52 применяется при пайке меди и бронзы. Медно-цинковые припои изготовляются путем сплавления меди и цинка в электропечах, в графитовом тигле. Таблица 4
Серебряные припои обладают большой прочностью, спаянные ими швы хорошо изгибаются и легко обрабатываются. Кроме стандартных серебряных припоев, используются и другие, составы которых приведены в табл. 5. Таблица 5
Первый из них применяется для пайки меди, стали, никеля, второй, обладающий высокой проводимостью,- для пайки проводов; третий может применяться для пайки меди, но не пригоден для черных металлов; четвертый припой обладает особой легкоплавкостью, является универсальным для пайки меди, ее сплавов, никеля, стали. В ряде случаев в качестве припоя используется технически чистая медь с температурой плавления 1083°С. Припои для пайки алюминия. Пайка алюминия вызывает большие затруднения вследствие его способности легко окисляться на воздухе. В последнее время находит применение пайка алюминия с помощью ультразвуковых паяльников. В табл. 6 приведены составы некоторых припоев для пайки алюминия. Таблица 6
При пайке алюминия в качестве флюсов применяют органические вещества: канифоль, стеарин и т. Последний припой (твердый) применяется со сложным флюсом, в состав которого входит: хлористый литий (25-30%), фтористый калий (8-12%), хлористый цинк (8-15%), хлористый калий (59-43%). Температура плавления флюса около 450°С. Флюсы. От качества флюса во многом зависит хорошее смачивание припоем мест спайки и образование прочных швов. При температуре паяния флюс должен плавиться и растекаться равномерным слоем, в момент же пайки он должен всплывать на внешнюю поверхность припоя. Температура плавления флюса должна быть несколько «иже температуры плавления применяемого припоя. Химически активные флюсы (кислотные)- это флюсы, имеющие в большинстве случаев в своем составе свободную соляную кислоту. Существенным недостатком кислотных флюсов является интенсивное образование коррозии паяных швов. К химически активным флюсам прежде всего относится соляная кислота, которая употребляется для пайки стальных деталей мягкими припоями. Кислота, оставшаяся после пайки на поверхности металла, растворяет его и вызывает, появление коррозии. После пайки изделия необходимо промыть горячей проточной водой. Применение соляной кислоты при пайке радиоаппаратуры запрещается, так как во время эксплуатации возможно нарушение электрических контактов в местах пайки. Следует учитывать, что соляная кислота при попадании на тело вызывает ожоги. Хлористый цинк (травленая кислота) в зависимости от условий пайки применяется в виде порошка или раствора. Используется для пайки латуни, меди и стали. Для приготовления флюса необходимо в свинцовой или стеклянной посуде растворить одну весовую часть цинка в пяти весовых частях 50-процентной соляной кислоты. Признаком образования хлористого цинка служит прекращение выделения пузырьков водорода. Из-за того, что в растворе всегда имеется небольшое количество свободной кислоты, в местах пайки возникает коррозия, поэтому после пайки место спая должно тщательно промываться в проточной горячей воде. Бура (водная натриевая соль пироборной кислоты) применяется как флюс при пайке латунными и серебряными припоями. Легко растворяется в воде. При нагревании превращается в стекловидную массу. Температура плавления 741°С. Соли, образующиеся при пайке бурой, необходимо удалять механической зачисткой. Порошок буры следует хранить в герметически закрытых стеклянных банках. Нашатырь (хлористый аммоний) применяется в виде порошка для очистки рабочей поверхности паяльника перед лужением. Химически пассивные флюсы (бескислотные). К бескислотным флюсам относятся различные органические вещества: канифоль, жиры, масла и глицерин. Наиболее широко в электро- и радиомонтажных работах применяется канифоль (в сухом виде или раствор ее в спирте). Самое ценное свойство канифоли, как флюса, заключается в том, что ее остатки после пайки не вызывают коррозии металлов. Канифоль не обладает ни восстанавливающими, ни растворяющими свойствами. Она служит исключительно для предохранения места пайки от окисления. Для приготовления спирто-во-канифольного флюса берется одна весовая часть толченой канифоли, которая растворяется в шести весовых частях спирта. После полного растворения канифоли флюс считается готовым. При применении канифоли места пайки должны быть тщательно очищены от окислов. Часто для пайки с канифолью детали следует предварительно облуживать. Стеарин не вызывает коррозии. Используется для пайки с особо мягкими припоями свинцовых оболочек кабелей, муфт и др. Температура плавления около 50°С. В последнее время широкое применение получила группа флюсов ЛТИ, применяемых для пайки металлов мягкими припоями. По своим антикоррозийным свойствам флюсы ЛТИ не уступают бескислотным, но в то же время с ними можно паять металлы, которые раньше не поддавались пайке, например детали с гальваническими покрытиями. Таблица 7
При пайке с флюсом ЛТИ достаточно произвести очистку мест пайки только от масел, ржавчины и других загрязнений. При пайке оцинкованных деталей удалять цинк с места пайки не следует. Перед пайкой деталей с окалиной последняя должна быть удалена травлением в кислотах. Предварительное травление латуни не требуется. Флюс наносится на место спая с помощью кисточки, что можно сделать заблаговременно. Хранить флюс следует в стеклянной или керамической посуде. При пайке деталей сложного профиля можно применять паяльную пасту с добавлением флюса ЛТИ-120. Но флюсы ЛТИ-1 и ЛТИ-115 имеют один большой недостаток: после пайки остаются темные пятна, а также при работе с ними необходима интенсивная вентиляция. Флюс ЛТИ-120 не оставляет темных пятен после пайки и не требует интенсивной вентиляции, поэтому применение его значительно шире. Обычно остатки флюса после пайки можно не удалять. Но если изделие будет эксплуатироваться в тяжелых коррозийных условиях, то после пайки остатки флюса удаляются при помощи концов, смоченных спиртом или ацетоном. Изготовление флюса технологически несложно: в чистую деревянную или стеклянную посуду заливается спирт, насыпается измельченная канифоль до получения однородного раствора, затем вводится триэтаноламин, а затем активные добавки. После загрузки всех компонентов смесь перемешивается в течение 20-25 минут. Изготовленный флюс необходимо проверить на нейтральную реакцию с лакмусом или метилоранжем. Срок хранения флюса не более 6 месяцев. ФИЗИКО-МЕХАНИЧЕСКИЕ СВОЙСТВА ПРИПОЕВ
ЛЕГКОПЛАВКИЕ ПРИПОИ
1 Для пайки металлов с температурой плавления 200АC и выше | ||||||||||
Удельная теплота плавления свинца 2,5*104Дж/кг.
 3. Какое количество теплоты потребуется для нагревания 20 литров воды от 20 до 42оС в чугунной кастрюле массой 15 кг? 3. Какое количество теплоты необходимо затратить для превращения льда массой 5 кг в
3. Какое количество теплоты потребуется для нагревания 20 литров воды от 20 до 42оС в чугунной кастрюле массой 15 кг? 3. Какое количество теплоты необходимо затратить для превращения льда массой 5 кг в
Контрольная работа №1по теме «Тепловые явления»
Вариант №1
1. Определите количество теплоты, необходимое для нагревания чугунного радиатора водяного отопления массой 65 кг от 20 до 42оС. Удельная теплоемкость чугуна 460 Дж/кг оС.
2. При сгорании спирта выделилось 5,4 МДж теплоты. Определите массу сгоревшего спирта, если его удельная теплота сгорания равна 27 МДж/кг.
3. Стальную болванку массой 150 г, раскаленную до 650оС,опускают для закалки в сосуд, содержащий 800 г воды при температуре 15оС. Какова удельная теплоемкость стали, если вода нагрелась до 28оС? Удельная теплоемкость воды 4200 Дж/(кг оС).
4. Определите КПД примуса, если для нагревания 2 кг воды от 10 до 100оС в нем сожгли 40 г керосина. Удельная теплоемкость воды 4200 Дж/(кг оС), а удельная теплота сгорания топливо 46 МДж/кг.
Вариант №2
1. Какое количество теплоты потребуется для того, чтобы нагреть на 40оС медный цилиндр массой 0,5 кг. Удельная теплоемкость меди 400 Дж/кг оС.
2. При сгорании спирта выделилось 2,7 МДж теплоты. Определите массу сгоревшего спирта, если его удельная теплота сгорания равна 27 МДж/кг.
3. Стальное сверло массой 42 г при остывании от 140 до 40 оС выделяет столько же теплоты, сколько необходимо для нагревания воды массой 92 г от 35 до 40 оС. Определите удельную теплоемкость стали. Удельная теплоемкость воды 4200 Дж/(кг оС).
4. Определите КПД керосинки, если для нагревания 3 кг воды от 20 до 100оС в нем сожгли 35 г керосина. Удельная теплоемкость воды 4200 Дж/(кг оС), а удельная теплота сгорания топливо 46 МДж/кг.
Контрольная работа №2 по теме «Изменения агрегатного состояния вещества».
Вариант №1
1.Какое количество теплоты выделится при конденсации водяного пара массой 2,5кг, имеющего температуру 100оС? Удельная теплота парообразования воды 2,3 МДж/кг.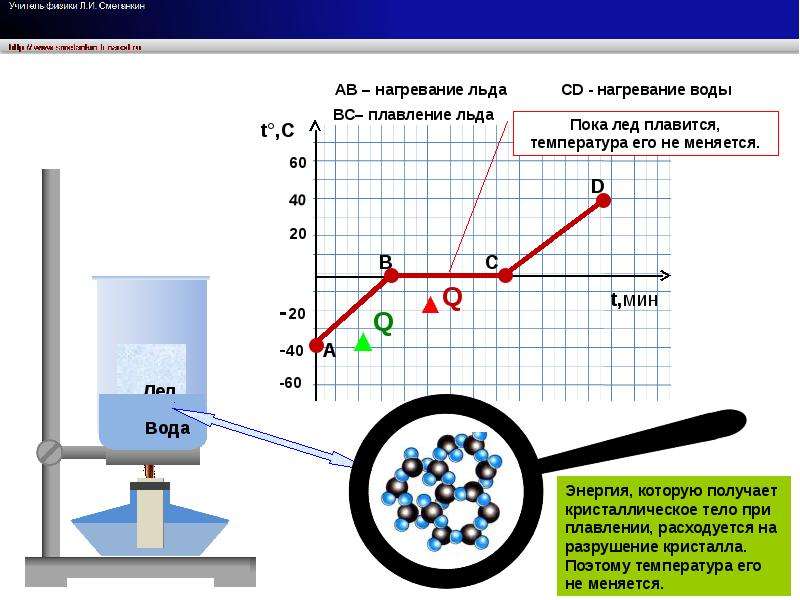
2. Какое количество теплоты необходимо для того, чтобы расплавить кусок свинца массой 0,5кг взятого при температуре плавления? Удельная теплота плавления свинца 2,5*104Дж/кг.
3. Какое количество теплоты потребуется для нагревания 20 литров воды от 20 до 42оС в чугунной кастрюле массой 15 кг? Удельная теплоемкость чугуна 460 Дж/(кг оС), Удельная теплоемкость воды 4200 Дж/(кг оС), плотность воды 1000 кг/м3.
4. Автомобиль на пути 36 км, развивал силу тяги 760 Н. Какая масса бензина, удельной теплотой сгорания 44 МДж/кг, сгорает при движении автомобиля? КПД двигателя автомобиля 22%.
Вариант №2
1. Какое количество теплоты выделится при кристаллизации 0,5кг цинка, взятого при температуре плавления ? Удельная теплота плавления цинка 120кДж/кг.
2. Из чайника выкипела вода массой 0,5кг. Какое количество теплоты оказалось излишне затраченным? Удельная теплота парообразования воды 2,3 МДж/кг.
3. Какое количество теплоты необходимо затратить для превращения льда массой 5 кг в воду температурой 0оС, если начальная температура льда –10°С? Удельная теплоемкость льда 2100 Дж/(кг оС), удельная теплота плавления льда 3,4.10-5 Дж/кг.
4. Какую массу воды можно нагреть от 10 до 100оС на примусе, если в нем сожгли 40 г керосина? КПД примуса 50%, удельная теплоемкость воды 4200 Дж/(кг оС), а удельная теплота сгорания топливо 46 МДж/кг.
Контрольная работа №3 по теме «Электрические явления»
Вариант №1
1. Вычислите сопротивление елочной гирлянды, состоящей из 20 ламп, соединенных последовательно, если каждая из них имеет сопротивление 12 Ом.
2. Какое количество теплоты выделится за 5 с в проводнике сопротивлением 25 Ом, если сила тока в цепи 2 А?
3. Две электрические лампы сопротивлением 250 Ом и 190 Ом включены последовательно в сеть с напряжением 220 В. Вычислите силу тока в каждой лампе и падение напряжения на каждой лампе?
4.Сколько времени потребуется для нагревания 2 литров воды, взятой при температуре 20 градусов, можно нагреть до температуры кипения при помощи кипятильника сопротивлением 48 Ом? Напряжение сети 127 В.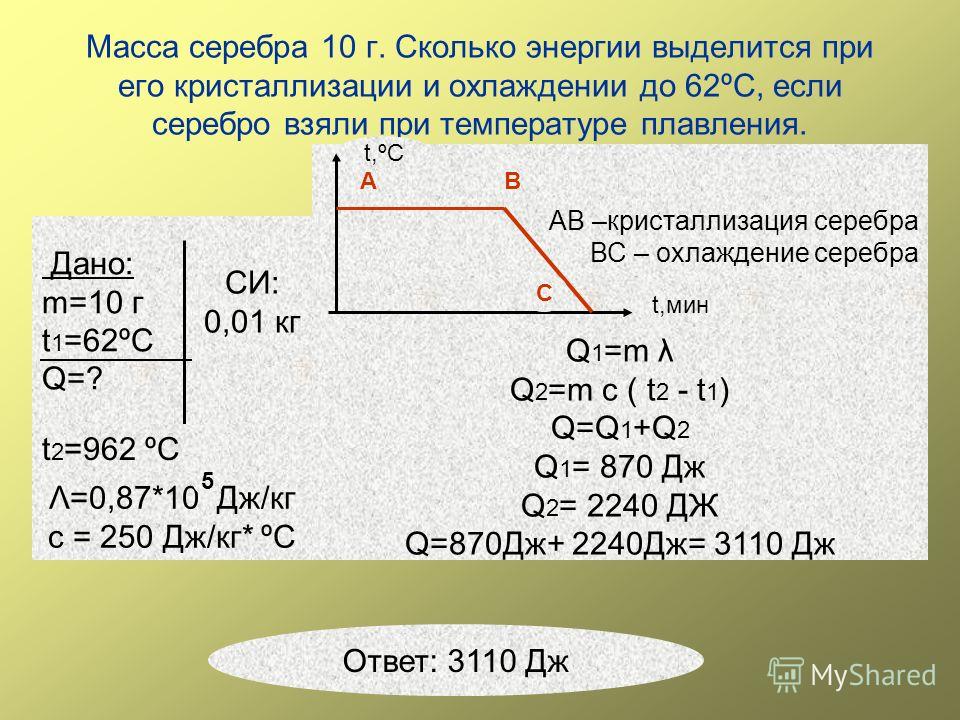 (Удельная теплоемкость воды 4200 Дж/кг*град.. Плотность воды 1000 кг/м3.)
(Удельная теплоемкость воды 4200 Дж/кг*град.. Плотность воды 1000 кг/м3.)
Вариант №2
1. Два резистора сопротивлением 3 Ом и 6 Ом соединены параллельно. Чему равно их общее сопротивление?
2. Электроплитка включена в сеть с напряжением 220 В работает 2 часа при этом ток в спирали электроплитки равен 3 А. Какую работу совершает электрический ток в спирали электроплитки?
3. Две лампочки сопротивлением 110 Ом и 55 Ом включены параллельно в сеть с напряжением 110 В. Вычислить силу тока в каждой лампочке и общую силу тока в цепи.
4. На сколько градусов нагреется 2 литра трансформаторного масла, взятого при температуре 10о С, при помощи нагревателя мощностью 800 Вт за 10 минут? Удельная теплоемкость масла 2400 Дж/кг*град. Плотность масла 800 кг/м3.
Контрольная работа №4 по теме «Световые явления»
Вариант №1
1. При каком условии тело даёт на экране резкую тень без полутени? Ответ поясните чертежом.
2. Девочка приближается к плоскому зеркалу со скоростью 0,25 м/с. С какой скоростью она сближается со своим изображением?
3. Почему, оценивая на глаз глубину водоёма, мы всегда ошибаемся: глубина кажется меньшей, чем в действительности? Ответ поясните рисунком.
4. Предмет помещён на расстоянии 40 см от тонкой линзы, оптическая сила которой равна 4 дптр. Какое и где получится изображение предмета? Чему равно фокусное расстояние линзы? Сделайте чертёж. Для устранения какого дефекта зрения может быть использована эта линза?
5. Объясните, почему цвет травы зелёный?
Вариант №2
1. Почему тень от ног человека на дороге более четкая, чем тень головы? Ответ обоснуйте.
2. Девочка стоит перед плоским зеркалом. Как изменится расстояние между девочкой и ее изображением в зеркале, если она отступит от зеркала на 1 м? Ответ пояснить рисунком.
3. Как нужно нацелиться в предмет, находящийся под водой, чтобы попасть в него – выше или ниже предмета? Ответ поясните чертежом.
4. Предмет помещён на расстоянии 60 см от тонкой линзы, оптическая сила которой равна – 2 дптр. Какое и где получится изображение предмета? Чему равно фокусное расстояние линзы? Сделайте чертёж. Для устранения какого дефекта зрения может быть использована эта линза?
5. Внутри светофора стоит обыкновенная лампочка, дающая белый свет. Почему мы видим во время работы светофора, что загораются красный, желтый и зеленый сигналы?
Итоговая контрольная работа
Итоговая контрольная работа.
1 вариант
Итоговая контрольная работа за 8 клаассИтоговая контрольная работа
Цель: Итоговый контроль знаний и умений.Дата проведения: 8а: 8б:
1.Напряжение на зажимах электрического утюга 220 В, сопротивление нагревательного элемента утюга 50 Ом. Чему равна сила тока в нагревательном элементе?
2.Сила тока в железном проводнике длиной 15 см и площадью поперечного сечения 0,02 мм2 равна 250 мА. Каково напряжение на концах проводника? Удельное сопротивление железа 0,1 Оммм2/м.
F
2F
3.Постройте изображение, даваемое собирающей линзой в случае показанном на рисунке. Опишите свойства изображения.
4.Найдите силу гравитационного притяжения двух соприкасающихся свинцовых шаров диаметром 1 м и массой 100 кг каждый.
5.Каков состав атомов серебра (Ag)?
II вариант.1.В электрической цепи через поперечное сечение проводника за 2 с проходит заряд 20 Кл. Определите силу тока в этом участке.
2.К сети напряжением 120 В параллельно подключены две электрические лампы сопротивлением 200 Ом каждая. Чему равно их общее сопротивление, общая сила тока, а также сила тока в каждой лампе?
3.Электроплитка рассчитана на напряжение 220 В и силу тока 3 А. Определите мощность тока в электроплитке.
4.Фокусное расстояние линзы 10 см. Чему равна оптическая сила этой линзы?
5.Постройте изображение, даваемое собирающей линзой в случае, показанном на рисунке. Опишите свойства изображения.
Опишите свойства изображения.
2F
F
Приложенные файлы
- 15452642
Размер файла: 23 kB Загрузок: 0
Температура плавления разных металлов в таблице
Каждый металл и сплав имеет собственный уникальный набор физических и химических свойств, среди которых не последнее место занимает температура плавления. Сам процесс означает переход тела из одного агрегатного состояния в другое, в данном случае, из твердого кристаллического состояния в жидкое. Чтобы расплавить металл, необходимо подводить к нему тепло до достижения температуры плавления. При ней он все еще может оставаться в твердом состоянии, но при дальнейшем воздействии и повышении тепла металл начинает плавиться. Если температуру понизить, то есть отвести часть тепла, элемент затвердеет.
Самая высокая температура плавления среди металлов принадлежит вольфраму: она составляет 3422Со, самая низкая — у ртути: элемент плавится уже при — 39Со. Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Как происходит
Плавление всех металлов происходит примерно одинаково — при помощи внешнего или внутреннего нагревания. Первый осуществляется в термической печи, для второго используют резистивный нагрев при пропускании электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.
При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул, возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.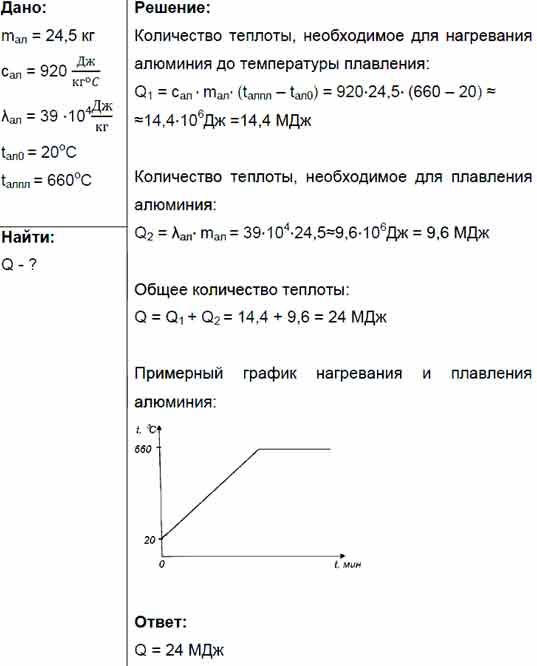
Разделение металлов
В зависимости от температуры плавления металлы делятся на:
- Легкоплавкие: им необходимо не более 600Со. Это цинк, свинец, виснут, олово.
- Среднеплавкие: температура плавления колеблется от 600Со до 1600Со. Это золото, медь, алюминий, магний, железо, никель и большая половина всех элементов.
- Тугоплавкие: требуется температура свыше 1600Со, чтобы сделать металл жидким. Сюда относятся хром, вольфрам, молибден, титан.
В зависимости от температуры плавления выбирают и плавильный аппарат. Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости. Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
- Увеличивается давление — увеличится величина плавления.
- Уменьшается давление — уменьшается величина плавления.
Таблица легкоплавких металлов и сплавов (до 600С
о )
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Олово | Sn | 232 Со | 2600 Со |
| Свинец | Pb | 327 Со | 1750 Со |
| Цинк | Zn | 420 Со | 907 Со |
| Калий | K | 63,6 Со | 759 Со |
| Натрий | Na | 97,8 Со | 883 Со |
| Ртуть | Hg | — 38,9 Со | 356.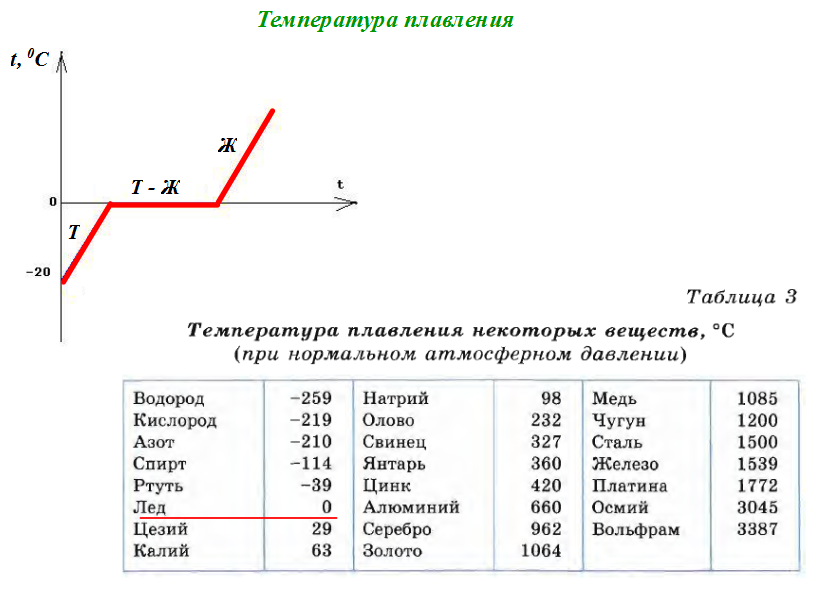 73 Со 73 Со |
| Цезий | Cs | 28,4 Со | 667.5 Со |
| Висмут | Bi | 271,4 Со | 1564 Со |
| Палладий | Pd | 327,5 Со | 1749 Со |
| Полоний | Po | 254 Со | 962 Со |
| Кадмий | Cd | 321,07 Со | 767 Со |
| Рубидий | Rb | 39,3 Со | 688 Со |
| Галлий | Ga | 29,76 Со | 2204 Со |
| Индий | In | 156,6 Со | 2072 Со |
| Таллий | Tl | 304 Со | 1473 Со |
| Литий | Li | 18,05 Со | 1342 Со |
Таблица среднеплавких металлов и сплавов (от 600С
о до 1600С о )
| Название элемента | Латинское обозначение | Температураы | |
| Плавления | Кипения | ||
| Алюминий | Al | 660 Со | 2519 Со |
| Германий | Ge | 937 Со | 2830 Со |
| Магний | Mg | 650 Со | 1100 Со |
| Серебро | Ag | 960 Со | 2180 Со |
| Золото | Au | 1063 Со | 2660 Со |
| Медь | Cu | 1083 Со | 2580 Со |
| Железо | Fe | 1539 Со | 2900 Со |
| Кремний | Si | 1415 Со | 2350 Со |
| Никель | Ni | 1455 Со | 2913 Со |
| Барий | Ba | 727 Со | 1897 Со |
| Бериллий | Be | 1287 Со | 2471 Со |
| Нептуний | Np | 644 Со | 3901,85 Со |
| Протактиний | Pa | 1572 Со | 4027 Со |
| Плутоний | Pu | 640 Со | 3228 Со |
| Актиний | Ac | 1051 Со | 3198 Со |
| Кальций | Ca | 842 Со | 1484 Со |
| Радий | Ra | 700 Со | 1736,85 Со |
| Кобальт | Co | 1495 Со | 2927 Со |
| Сурьма | Sb | 630,63 Со | 1587 Со |
| Стронций | Sr | 777 Со | 1382 Со |
| Уран | U | 1135 Со | 4131 Со |
| Марганец | Mn | 1246 Со | 2061 Со |
| Константин | 1260 Со | ||
| Дуралюмин | Сплав алюминия, магния, меди и марганца | 650 Со | |
| Инвар | Сплав никеля и железа | 1425 Со | |
| Латунь | Сплав меди и цинка | 1000 Со | |
| Нейзильбер | Сплав меди, цинка и никеля | 1100 Со | |
| Нихром | Сплав никеля, хрома, кремния, железа, марганца и алюминия | 1400 Со | |
| Сталь | Сплав железа и углерода | 1300 Со — 1500 Со | |
| Фехраль | Сплав хрома, железа, алюминия, марганца и кремния | 1460 Со | |
| Чугун | Сплав железа и углерода | 1100 Со — 1300 Со | |
Таблица тугоплавких металлов и сплавов (свыше 1600С
о )
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Вольфрам | W | 3420 Со | 5555 Со |
| Титан | Ti | 1680 Со | 3300 Со |
| Иридий | Ir | 2447 Со | 4428 Со |
| Осмий | Os | 3054 Со | 5012 Со |
| Платина | Pt | 1769,3 Со | 3825 Со |
| Рений | Re | 3186 Со | 5596 Со |
| Хром | Cr | 1907 Со | 2671 Со |
| Родий | Rh | 1964 Со | 3695 Со |
| Рутений | Ru | 2334 Со | 4150 Со |
| Гафний | Hf | 2233 Со | 4603 Со |
| Тантал | Ta | 3017 Со | 5458 Со |
| Технеций | Tc | 2157 Со | 4265 Со |
| Торий | Th | 1750 Со | 4788 Со |
| Ванадий | V | 1910 Со | 3407 Со |
| Цирконий | Zr | 1855 Со | 4409 Со |
| Ниобий | Nb | 2477 Со | 4744 Со |
| Молибден | Mo | 2623 Со | 4639 Со |
| Карбиды гафния | 3890 Со | ||
| Карбиды ниобия | 3760 Со | ||
| Карбиды титана | 3150 Со | ||
| Карбиды циркония | 3530 Со | ||
Оцените статью: Поделитесь с друзьями!
«Тепловые явления» самостоятельные работы 8 класс | Методическая разработка по физике (8 класс) на тему:
Проверка остаточных знаний
8 класс
- Напишите не менее 3-х формул изученных в 7 классе
- Подпишите какие физические величины по ним рассчитываются
- Распределите слова по группам и дайте название каждой группе слов
Скорость, секунда, ватт, масса, площадь, грамм
- Решите задачу
Штангист поднимает гирю массой 35 кг на высоту 1,4 м.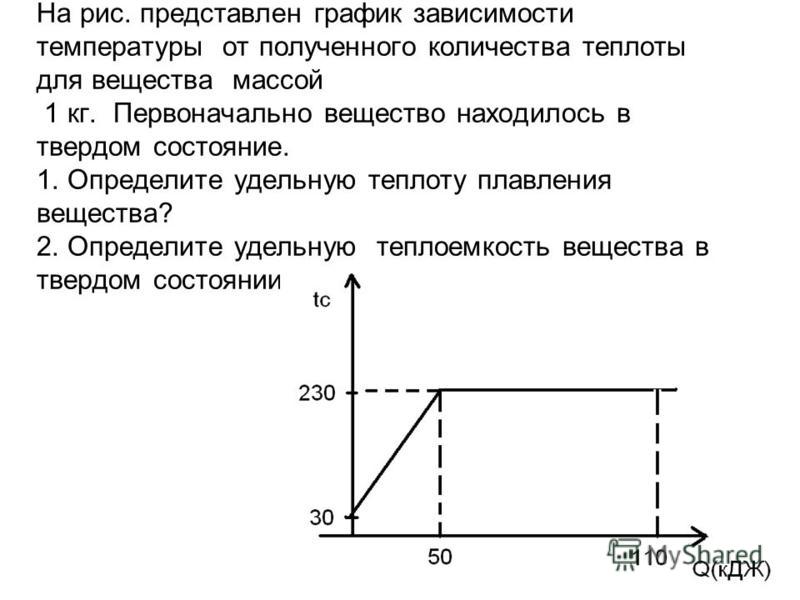 Какую работу он при этом совершает?
Какую работу он при этом совершает?
Проверка остаточных знаний
8 класс
- Напишите не менее 3-х формул изученных в 7 классе
- Подпишите какие физические величины по ним рассчитываются
- Распределите слова по группам и дайте название каждой группе слов
Киловатт, время, час, паскаль, сила, энергия
- Решите задачу
Двигатель мощностью 1,6 МВт работал 10 минут. Какую работу он при этом совершил?
Проверка остаточных знаний
8 класс
- Напишите не менее 3-х формул изученных в 7 классе
- Подпишите какие физические величины по ним рассчитываются
- Распределите слова по группам и дайте название каждой группе слов
Мощность, путь, ньютон, метр, давление, джоуль
- Решите задачу
Определите давление воды на стенки котла водяного отопления, если высоты труб 20 м?
Проверка остаточных знаний
8 класс
- Напишите не менее 3-х формул изученных в 7 классе
- Подпишите какие физические величины по ним рассчитываются
- Распределите слова по группам и дайте название каждой группе слов
Килограмм, плотность, мегаджоуль, объём, работа, километр
- Решите задачу
Определите объём куска алюминия, на который в керосине действует выталкивающая сила, равная 160 Н.
Проверка остаточных знаний
8 класс
- Напишите не менее 3-х формул изученных в 7 классе
- Подпишите какие физические величины по ним рассчитываются
- Распределите слова по группам и дайте название каждой группе слов
Скорость, секунда, ватт, масса, площадь, грамм
- Решите задачу
Штангист поднимает гирю массой 35 кг на высоту 1,4 м. Какую работу он при этом совершает?
Проверка остаточных знаний
8 класс
- Напишите не менее 3-х формул изученных в 7 классе
- Подпишите какие физические величины по ним рассчитываются
- Распределите слова по группам и дайте название каждой группе слов
Киловатт, время, час, паскаль, сила, энергия
- Решите задачу
Двигатель мощностью 1,6 МВт работал 10 минут. Какую работу он при этом совершил?
Какую работу он при этом совершил?
Проверка остаточных знаний
8 класс
- Напишите не менее 3-х формул изученных в 7 классе
- Подпишите какие физические величины по ним рассчитываются
- Распределите слова по группам и дайте название каждой группе слов
Мощность, путь, ньютон, метр, давление, джоуль
- Решите задачу
Определите давление воды на стенки котла водяного отопления, если высоты труб 20 м?
Проверка остаточных знаний
8 класс
- Напишите не менее 3-х формул изученных в 7 классе
- Подпишите какие физические величины по ним рассчитываются
- Распределите слова по группам и дайте название каждой группе слов
Килограмм, плотность, мегаджоуль, объём, работа, километр
- Решите задачу
Определите объём куска алюминия, на который в керосине действует выталкивающая сила, равная 160 Н.
Температура плавления металлов таблица по возрастанию
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты. Воздействие при этом примерно одинаковое.
Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты. Воздействие при этом примерно одинаковое.
Когда происходит нагревание, усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки, сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения — 5596 °C. Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов.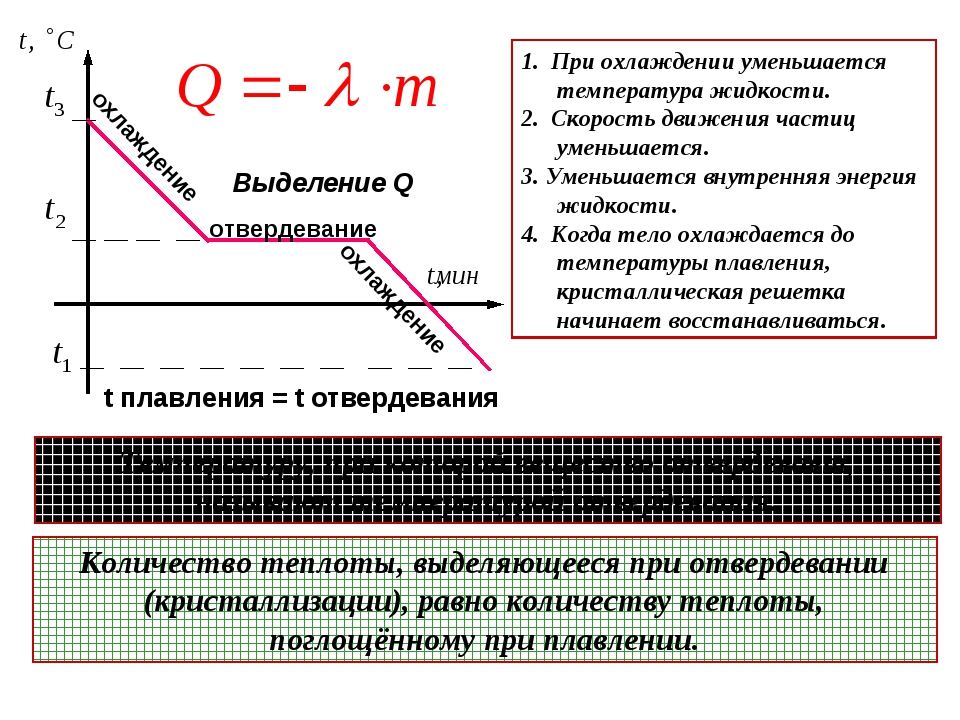 Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути – она плавится даже при -39 °C, самая высокая у вольфрама – 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой – плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты . Воздействие при этом примерно одинаковое.
Когда происходит нагревание , усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки , сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие – до 600 °C: свинец, цинк, олово;
- среднеплавкие – от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие – от 1600 °C: хром, вольфрам, молибден, титан.

В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина – градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы – непременная основа для ковки , литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота , ограды из чугуна, ножи из стали или браслеты из меди) , для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий – 660 °C;
- температура плавления меди – 1083 °C;
- температура плавления золота – 1063 °C;
- серебро – 960 °C;
- олово – 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец – 327 °C;
- температура плавления железо – 1539 °C;
- температура плавления стали (сплав железа и углерода) – от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) – от 1100 °C до 1300 °C;
- ртуть – -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл – ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления.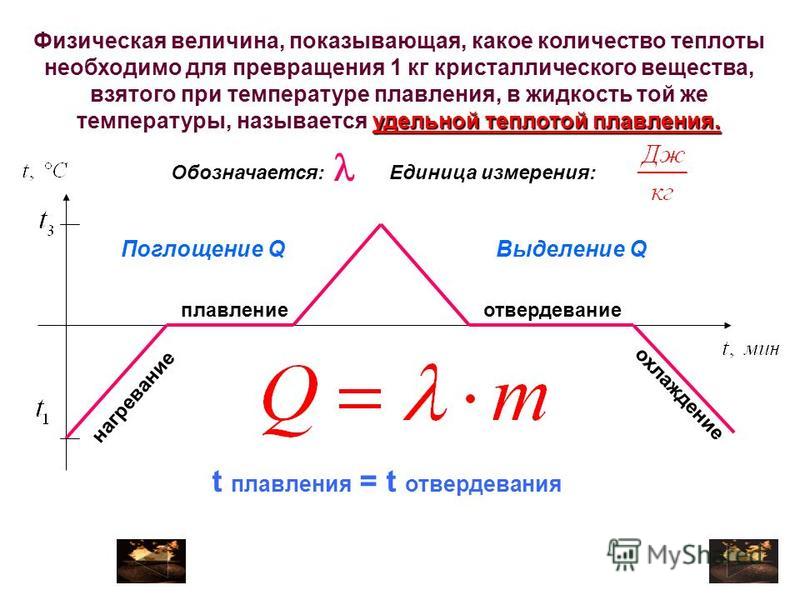 Например, у золота он 2660 °C, у алюминия – 2519 °C , у железа – 2900 °C, у меди – 2580 °C, у ртути – 356,73 °C.
Например, у золота он 2660 °C, у алюминия – 2519 °C , у железа – 2900 °C, у меди – 2580 °C, у ртути – 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов – у рения – 5596 °C . Наибольшая температура кипения – у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов . Самым лёгким металлом является литий, самым тяжёлым – осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа – очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах – это теплопроводность металлов . Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл – серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Температура плавления, наряду с плотностью, относится к физическим характеристикам металлов . Температура плавления металла – температура, при которой металл переходит из твердого состояния, в котором находится в нормальном состоянии (кроме ртути), в жидкое состояние при нагревании. При плавлении объем металла практически не изменяется, поэтому на температуру плавления нормальное атмосферное давление не влияет .
Температура плавления металлов находится в диапазоне от -39 градусов Цельсия до +3410 градусов . Для большинства металлов температура плавления высокая, однако, некоторые металлы можно расплавить в домашних условиях при нагревании на обычной горелке (олово, свинец).
Классификация металлов по температуре плавления
- Легкоплавкие металлы , температура плавления которых колеблется до 600 градусов Цельсия, например цинк, олово, висмут .

- Среднеплавкие металлы , которые плавятся при температуре от 600 до 1600 градусов Цельсия: такие как алюминий, медь, олово, железо .
- Тугоплавкие металлы , температура плавления которых достигает более 1600 градусов Цельсия – вольфрам, титан, хром и др.
- – единственный металл, находящийся при обычных условиях (нормальное атмосферное давление, средняя температура окружающей среды) в жидком состоянии. Температура плавления ртути составляет порядка -39 градусов по Цельсию.
Таблица температур плавления металлов и сплавов
| Металл | |
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Дюралюмин | |
| Железо | 1539 |
| Золото | 1063 |
| Иридий | 2447 |
| Калий | 63,6 |
| Кремний | 1415 |
| Латунь | |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Никель | 1455 |
| Олово | 231,9 |
| Платина | 1769,3 |
| Ртуть | –38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
При плавлении металла для изготовления металлических изделий-отливок от температуры плавления зависит выбор оборудования, материала для формовки металла и др. Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Не стоит путать понятия «температура плавления металла» и «температура кипения металла» – для многих металлов эти характеристики существенно отличаются: так, серебро плавится при температуре 961 градус по Цельсию, а закипает только при достижении нагрева до 2180 градусов.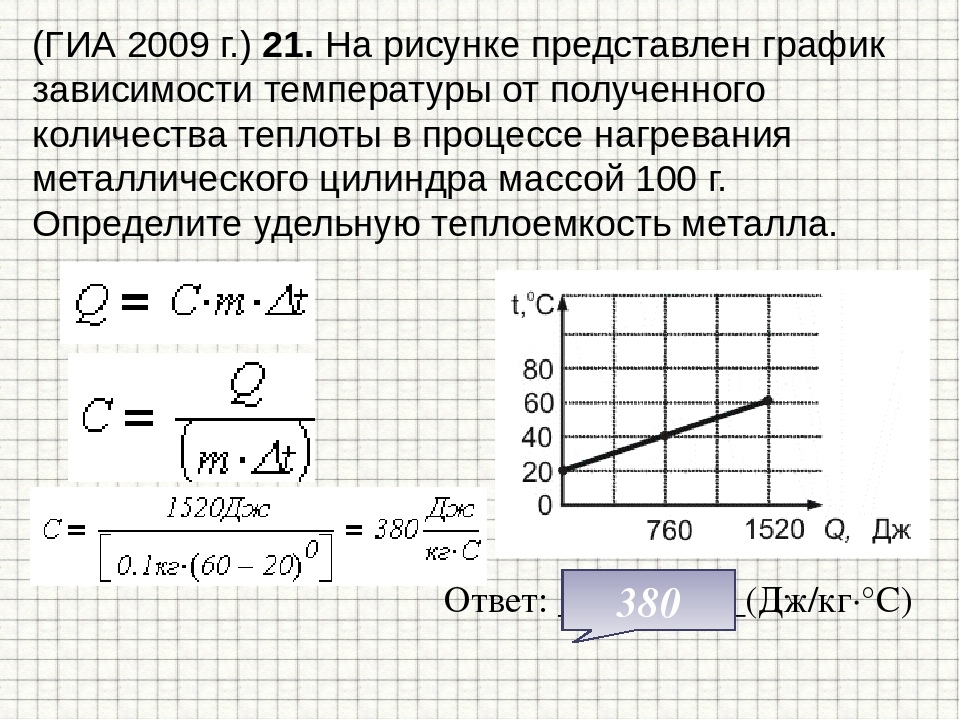
Температура плавления металла – это минимальная температура, при которой он переходит из твердого состояния в жидкое. При плавлении его объем практически не изменяется. Металлы классифицируют по температуре плавления в зависимости от степени нагревания.
Легкоплавкие металлы
Легкоплавкие металлы имеют температуру плавления ниже 600°C. Это цинк, олово, висмут. Такие металлы можно расплавить в домашних условиях , разогрев их на плите, или с помощью паяльника. Легкоплавкие металлы используются в электронике и технике для соединения металлических элементов и проводов для движения электрического тока. Температура плавления олова составляет 232 градуса, а цинка – 419.
Среднеплавкие металлы
Среднеплавкие металлы начинают переходить из твердого в жидкое состояние при температуре от 600°C до 1600°C. Они используются для изготовления плит, арматур, блоков и других металлических конструкций, пригодных для строительства. К этой группе металлов относятся железо, медь, алюминий, они также входят в состав многих сплавов. Медь добавляют в сплавы драгоценных металлов, таких как золото, серебро, платина. Золото 750 пробы на 25% состоит из лигатурных металлов, в том числе и меди, которая придает ему красноватый оттенок. Температура плавления этого материала равна 1084 °C. А алюминий начинает плавиться при относительно низкой температуре, составляющей 660 градусов Цельсия. Это легкий пластичный и недорогой металл, который не окисляется и не ржавеет, поэтому широко используется при изготовлении посуды. Температура плавления железа равна 1539 градусов. Это один из самых популярных и доступных металлов, его применение распространено в строительстве и автомобильной промышленности. Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Тугоплавкие металлы
Температура тугоплавких металлов выше 1600°C. Это вольфрам, титан, платина, хром и другие. Их используют в качестве источников света, машинных деталей, смазочных материалов, а также в ядерной промышленности. Из них изготавливают проволоки, высоковольтные провода и используют для расплавки других металлов с более низкой температурой плавления. Платина начинает переходить из твердого в жидкое состояние при температуре 1769 градусов, а вольфрам – при температуре 3420°C.
Их используют в качестве источников света, машинных деталей, смазочных материалов, а также в ядерной промышленности. Из них изготавливают проволоки, высоковольтные провода и используют для расплавки других металлов с более низкой температурой плавления. Платина начинает переходить из твердого в жидкое состояние при температуре 1769 градусов, а вольфрам – при температуре 3420°C.
Ртуть – единственный металл, находящийся в жидком состоянии при обычных условиях, а именно, нормальном атмосферном давлении и средней температуре окружающей среды. Температура плавления ртути составляет минус 39°C. Этот металл и его пары являются ядовитыми, поэтому он используется только в закрытых емкостях или в лабораториях. Распространенное применение ртути – градусник для измерения температуры тела.
Каждый металл и сплав имеет собственный уникальный набор физических и химических свойств, среди которых не последнее место занимает температура плавления. Сам процесс означает переход тела из одного агрегатного состояния в другое, в данном случае, из твердого кристаллического состояния в жидкое. Чтобы расплавить металл, необходимо подводить к нему тепло до достижения температуры плавления. При ней он все еще может оставаться в твердом состоянии, но при дальнейшем воздействии и повышении тепла металл начинает плавиться. Если температуру понизить, то есть отвести часть тепла, элемент затвердеет.
Самая высокая температура плавления среди металлов принадлежит вольфраму: она составляет 3422С о , самая низкая — у ртути: элемент плавится уже при — 39С о . Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Как происходит
Плавление всех металлов происходит примерно одинаково — при помощи внешнего или внутреннего нагревания. Первый осуществляется в термической печи, для второго используют резистивный нагрев при пропускании электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.
Оба варианта воздействуют на металл примерно одинаково.
При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул, возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
Разделение металлов
В зависимости от температуры плавления металлы делятся на:
- Легкоплавкие: им необходимо не более 600С о . Это цинк, свинец, виснут, олово.
- Среднеплавкие: температура плавления колеблется от 600С о до 1600С о . Это золото, медь, алюминий, магний, железо, никель и большая половина всех элементов.
- Тугоплавкие: требуется температура свыше 1600С о , чтобы сделать металл жидким. Сюда относятся хром, вольфрам, молибден, титан.
В зависимости от температуры плавления выбирают и плавильный аппарат. Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости. Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
Используя эти реакции, найдите стандартное изменение энтальпии для образования 1 моля PbO (ов) из металлического свинца и газообразного кислорода: \ begin {align *}
\ mathrm {PbO} (s) + \ mathrm {C} (графит) & \ rightarrow \ mathrm {Pb} (s) + \ mathrm {CO} (g) \; \; \; \; \; \; \ Дельта H ° = 106,8 \; \ mathrm {кДж} \\
2 \; \ mathrm {C} (графит) + \ mathrm {O_2} (g) & \ rightarrow2 \; \ mathrm {CO} (g) \; \; \; \; \; \; \; \; \ ; \; \; \; \; \; \ Delta H ° = -221,0 \; \ mathrm {кДж}
\ end {align *} Если 250 г свинца реагирует с кислородом с образованием оксида свинца (II), какое количество тепловой энергии (в кДж) поглощается или выделяется? :: Помощь и ответы на домашнее задание :: Slader
[математика] \ sinh [/ математика]
[math] \ sinh [/ math]
[math] \ ch [/ math]
[math] \ tanh [/ math]
[math] \ operatorname {sech} [/ math]
[math] \ operatorname {csch} [/ math]
[math] \ coth [/ math]
[математика] \ in [/ математика]
[математика] \ notin [/ математика]
[математика] \ подмножество [/ математика]
[математика] \ substeq [/ математика]
[математика] \ cap [/ математика]
[математика] \ чашка [/ математика]
[математика] \ существует [/ математика]
[математика] \ forall [/ математика]
[математика] \ грех [/ математика]
[математика] \ sin [/ математика]
[математика] \ cos [/ математика]
[math] \ tan [/ math]
[математика] \ сек [/ математика]
[математика] \ csc [/ математика]
[math] \ cot [/ math]
[математика] \ arcsin [/ математика]
[математика] \ arcsin [/ математика]
[математика] \ arccos [/ математика]
[математика] \ arctan [/ математика]
[математика] \ OperatorName {arcsec} [/ математика]
[math] \ operatorname {arccsc} [/ math]
[math] \ operatorname {arccot} [/ math]
[math] \ theta [/ math]
[математика] \ phi [/ математика]
[математика] \ varphi [/ математика]
[математика] \ int_ {a} ^ {b} f (x) \, dx [/ math]
[математика] \ bigg | _ {a} ^ {b} [/ math]
[математика] \ left [\ right] _ {a} ^ {b} [/ math]
Расчет теплоемкости Учебник по химии
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Удельная теплоемкость
Если вы осторожно нагреете воду с помощью источника тепла, например, горелки Бунзена, температура воды повысится.
Энергия, поставляемая горелкой Бунзена, заставляет молекулы воды двигаться быстрее, увеличивая их кинетическую энергию.
Мы можем измерить результат этой повышенной кинетической энергии как повышение температуры.
Количество энергии, поглощаемой молекулами воды для увеличения их кинетической энергии, называется «тепловой энергией». 3
Тепловая энергия частиц воды q пропорциональна изменению температуры ΔT.
ΔT = конечная температура — начальная температура
q ∝ ΔT
Это означает, что если вы используете ту же массу воды, но удвоите тепловую энергию (q), то изменение температуры (ΔT) также удвоится.
Аналогичным образом, если вы уменьшите вдвое тепловую энергию (q), то изменение температуры (ΔT) также уменьшится вдвое.
Вы также можете нагреть «холодную» воду, добавив в нее немного «горячей» воды.
Представьте, что у вас есть стакан с водой, содержащий 100 г воды с температурой 25,0 ° C.
Что произойдет с температурой воды, если вы добавите 10 г кипятка (100 ° C)?
Тепло перейдет от горячей воды к холодной. 4
Кинетическая энергия молекул «горячей» воды будет уменьшаться, а кинетическая энергия молекул «холодной» воды будет увеличиваться, пока все молекулы воды не будут иметь одинаковую среднюю кинетическую энергию. 5
Поскольку температура является мерой средней кинетической энергии всех молекул воды, мы находим, что температура воды станет постоянной.
В этом примере будет достигнута постоянная температура 6 31,8 ° C.
Изменение температуры ΔT равно
ΔT = конечная температура — начальная температура = 31,8 — 25,0 = 6,8 ° C
А теперь представьте, что вы повторяете эксперимент, но на этот раз с использованием 20 г кипящей воды.
Какая будет конечная температура воды?
И снова тепло перейдет от горячей воды к холодной, горячая вода охладится, а холодная вода нагреется до тех пор, пока во всем объеме воды не будет достигнута постоянная температура.
Но на этот раз температура будет выше, 37,5 ° C.
Изменение температуры ΔT равно
ΔT = конечная температура — начальная температура = 37,5 — 25,0 = 12,5 ° C
Добавление большей массы горячей воды к той же массе холодной воды приводит к еще большему повышению температуры.
Это говорит нам о том, что количество тепловой энергии, которая может быть передана от горячего вещества к холодному, зависит от массы используемого вещества.
Тепловая энергия (q) пропорциональна массе используемого вещества (m) и изменению температуры (ΔT):
q ∝ м × ΔT
Мы могли бы превратить это соотношение в математическое уравнение, используя коэффициент пропорциональности.
Пусть C — коэффициент пропорциональности, тогда:
q = C × м × ΔT
Давайте посмотрим, что произойдет с этой константой пропорциональности C, когда мы изменим вещество, используемое для нагрева воды.
Что произойдет с температурой 100 г воды при исходной температуре 25,0 ° C, если мы добавим 20 г другого вещества вместо воды, скажем, 20 г металлической меди при 100 ° C?
Тепло перейдет от горячей меди к более холодной воде, медь остынет, а вода будет нагреваться, пока не будет достигнута постоянная температура.
Конечная температура воды составляет всего 26,5 ° C, что ниже температуры при добавлении 20 г воды!
Изменение температуры ΔT равно
ΔT = конечная температура — начальная температура = 26.5 — 25,0 = 1,5 ° С
При равных массах горячей воды и горячей меди при одинаковой температуре горячая вода может передавать больше тепловой энергии холодной воде, чем горячая медь. 7
То есть значение коэффициента пропорциональности C для воды больше, чем для меди.
Термин, который используется для описания этой способности (или способности) передавать тепловую энергию, — «теплоемкость».
При сравнении масс веществ в граммах эта «теплоемкость» обозначается как удельная теплоемкость .
Итак, удельная теплоемкость воды больше удельной теплоемкости меди.
Удельная теплоемкость обозначена символом C г (считайте «г» граммами, то есть массой).
Теперь мы можем заменить коэффициент пропорциональности (C) в приведенном выше математическом уравнении на удельную теплоемкость (C г ):
q = C г × м × ΔT
Мы можем изменить это уравнение, разделив обе части уравнения на m × ΔT:
| q м × ΔT | = | C г × |
| q м × ΔT | = | C г |
Теперь, если я хочу сравнить удельную теплоемкость различных веществ, мне нужно поддерживать постоянную массу, скажем, 1 грамм, и я бы использовал достаточно тепловой энергии, чтобы вызвать изменение температуры на 1 ° C (или 1K),
Подставляя эти значения в уравнение:
| q 1 × 1 | = | C г |
| q | = | C г |
То есть удельная теплоемкость вещества — это энергия (q), необходимая для повышения температуры 1 грамма вещества на 1 ° C (или 1K)!
Различные вещества имеют разную удельную теплоемкость.Удельная теплоемкость некоторых веществ приведена в таблице ниже: 8
| Удельная теплоемкость некоторых веществ | |||
|---|---|---|---|
| Элементы | C г (Дж K -1 г -1 или Дж ° C -1 г -1 ) | Соединения | C г (J K -1 г -1 или J ° C -1 г -1 ) |
| алюминий | C г = 0.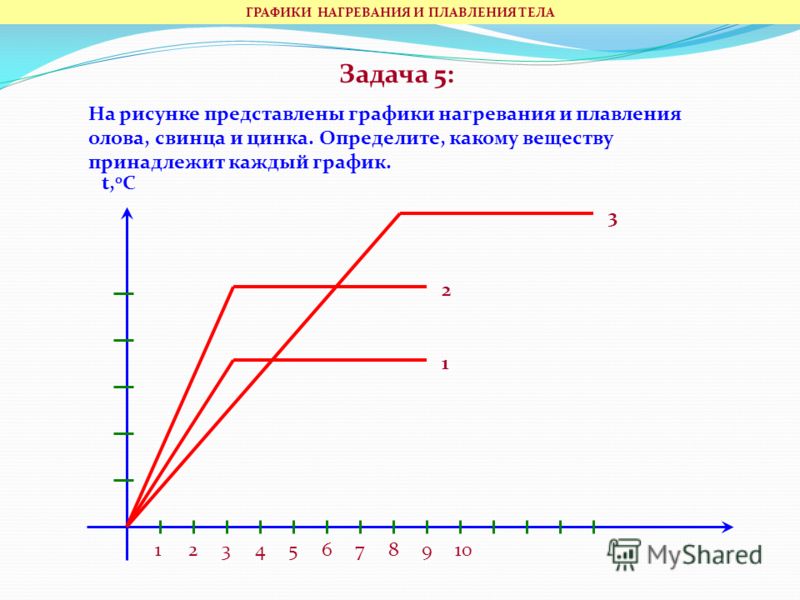 90 90 | вода (жидкость) | C г = 4,18 |
| углерод | C г = 0,72 | этанол (жидкость) | C г = 2,44 |
| медь | C г = 0,39 | серная кислота (жидкость) | C г = 1,42 |
| свинец | C г = 0,13 | хлорид натрия (твердый) | C г = 0.85 |
| ртуть (жидкость) | C г = 0,14 | гидроксид калия (твердый) | C г = 1,18 |
Из приведенной выше таблицы видно, что удельная теплоемкость меди составляет 0,39 Дж ° C -1 г -1 , в то время как удельная теплоемкость воды намного выше, 4,18 Дж ° C -1 г — 1 .
Требуется 0,39 Дж энергии, чтобы изменить температуру 1 грамма металлической меди на 1 ° C (или 1 K).
Требуется 4,18 Дж энергии, чтобы изменить температуру 1 грамма жидкой воды на 1 ° C (или 1 K).
Удельная теплоемкость, C г , как описано выше, полезно, потому что мы можем легко измерить массу многих веществ.
Однако, когда мы смотрим на таблицу значений, некоторые из этих значений кажутся нелогичными.
Почему требуется 0,13 Дж энергии для повышения температуры 1 г свинца на 1 ° C, но почти в 7 раз больше энергии для повышения температуры 1 г алюминия на 1 ° C?
А почему углерод должен иметь более высокую теплоемкость, чем металлическая медь или свинец?
Возможно, сравнение по массе — не лучший вариант…..
Молярная теплоемкость
Одинаковые массы разных веществ содержат разное количество «частиц» (атомов, ионов или молекул).
Химики используют «моль» как меру «количества» вещества, потому что моль чистого вещества всегда содержит одинаковое количество частиц (число Авогадро, N A = 6,02 × 10 23 ).
Масса 1 моля чистого вещества равна его относительной молекулярной массе, выраженной в граммах:
масса 1 моля = относительная молекулярная масса в граммах
Напомним, что удельная теплоемкость — это энергия, необходимая для повышения температуры 1 грамма вещества на 1 ° C (или 1 K).
пример: C г для металлической меди, Cu (s) , составляет 0,39 Дж ° C -1 г -1
Если мы хотим найти теплоемкость 1 моля вещества, нам нужно умножить удельную теплоемкость C г на относительную молекулярную массу (M r ) или молярную массу (M) вещества:
теплоемкость 1 моля = M r × C (г)
или
теплоемкость 1 моля = M × C (г)
Величина «M × C г » называется молярной теплоемкостью и обозначается символом C n (n — символ, используемый для молей).
Молярная теплоемкость вещества — это энергия, необходимая для повышения температуры 1 моль вещества на 1 ° C (или 1K).
Например, удельная теплоемкость металлической меди: C г = 0,39 Дж ° C -1 г -1
Относительная атомная масса меди из Периодической таблицы: M r = 63,55
Молярная теплоемкость металлической меди = C г × M r = 0.39 × 63,55 = 24,8 Дж ° C -1 моль -1
Вы можете выполнить этот расчет самостоятельно для каждого из веществ, перечисленных в таблице удельной теплоемкости выше.
Вы можете сравнить свои расчеты с расчетами, приведенными в таблице молярных теплоемкостей, приведенной ниже:
| Молярная теплоемкость некоторых веществ | |||
|---|---|---|---|
| Элементы | C n (Дж K -1 моль -1 или Дж ° C -1 моль -1 ) | Соединения | C n (J K -1 моль -1 или J ° C -1 моль -1 ) |
| ртуть | C n = 28.1 | серная кислота (жидкость) | C n = 139 |
| свинец | C n = 27,0 | вода | C n = 75 |
| медь | C n = 24,8 | гидроксид калия (твердый) | C n = 66 |
| алюминий | C n = 24,3 | хлорид натрия (твердый) | C n = 50 |
| угольный | C n = 8. 6 6 | этанол (этиловый спирт) | C n = 22 |
Эта таблица позволяет сравнивать теплоемкости одного и того же количества частиц, то есть 1 моль, разных веществ.
Мы находим, что молярная теплоемкость металлов очень похожа, в то время как молярная теплоемкость углерода намного ниже.
Требуется около 25 Дж энергии для повышения температуры 1 моля металла на 1 ° C (или 1 K), но требуется всего около 9 Дж энергии для повышения температуры 1 моля углерода на 1 ° C ( или 1 К).
Мы могли бы написать новое уравнение для расчета количества тепла, необходимого (q) для повышения температуры (ΔT) количества вещества в молях (n):
q = C n × n × ΔT
Сноски
1. Поскольку деления шкалы температур по шкале Цельсия и Кельвина одинаковы, и поскольку здесь нас не интересует ни начальная, ни конечная температура, а только разница между ними, можно видеть, что разница в 1 ° C такая же, как разница в 1 К.
Тщательные эксперименты показывают, что удельная теплоемкость вещества сама по себе является функцией температуры, поэтому в девятнадцатом веке был установлен стандарт, то есть теплоемкость — это тепло, необходимое для повышения температуры 1 г воды с 14,5 °. С до 15,5 ° С.
2. В 1960 году Генеральная конференция мер и весов согласовала единую версию метрической системы.
Единицы в этой системе известны как единицы СИ (Systèm International d’Unités).
Семь базовых единиц составляют основу системы СИ:
| Физическая величина | Название устройства | Обозначение | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| масса | килограмм | кг | ||||||||||||||
| длина | метр | м | с | с |
| Вещество | Удельная скрытая теплота плавления (кДж / кг) | Удельная скрытая теплота испарения (кДж / кг) |
|---|---|---|
| Вода | 334 | 2,260 |
| Свинец | 22.4 | 855 |
| Кислород | 13,9 | 213 |
Для превращения 1 кг льда в 1 кг воды при температуре плавления 0 ° требуется 334000 джоулей (Дж) энергии. С. Столько же энергии нужно извлечь из жидкости, чтобы заморозить ее.
Расчет изменений тепловой энергии
Количество тепловой энергии, сохраняемой или выделяемой при изменении температуры системы, можно рассчитать с помощью уравнения:
изменение тепловой энергии = масса × удельная скрытая теплота
\ [\ Q \\ = \\ ml \\]
Это когда:
- изменение тепловой энергии ( Q ) измеряется в джоулях (Дж)
- масса ( м ) измеряется в килограммах (кг)
- удельный скрытая теплота ( л ) измеряется в джоулях на килограмм (Дж / кг)
- Вопрос
Сколько энергии необходимо, чтобы заморозить 500 граммов (г) воды при 0 ° C?
- Показать ответ
\ [\ Q \\ = \\ ml \\]
\ [\ Q \\ = \\ 0.5 \ times 334,000 \\]
\ [\ Q \\ = \\ 167,000 \\ J \\]
Измерение скрытой теплоты
Скрытое тепло можно измерить по линейному графику кривой нагрева или охлаждения. Если используется нагреватель известной мощности, такой как погружной нагреватель на 60 Вт (Вт), который обеспечивает 60 Дж / с, температуру известной массы льда можно контролировать каждую секунду. Это сгенерирует график, который выглядит следующим образом.
График горизонтальный в двух местах. Это места, где энергия не используется для увеличения скорости частиц и, следовательно, не для повышения температуры, но используется для разрыва связей между частицами с целью изменения состояния.
Чем длиннее горизонтальная линия, тем больше энергии было использовано для изменения состояния. Количество поглощенной тепловой энергии, представленное этими горизонтальными линиями, равно скрытому теплу.
Пример
Если горизонтальная линия, показывающая кипение на кривой нагрева, длится 1 час 3 минуты, сколько энергии обогреватель мощностью 60 Вт обеспечивает воду?
63 минуты = 3780 с
60 Вт означает, что 60 Дж энергии подается каждую секунду
энергия = мощность × время
энергия = 60 × 3780
энергия = 226000 Дж
- Вопрос
Если эта энергия было применено к 100 г воды, какова удельная скрытая теплота испарения воды?
- Показать ответ
226 000 Дж для 100 г эквивалентно 2 260 000 Дж для 1 кг.Удельная скрытая теплота испарения воды составляет 2 260 000 Дж / кг.
6.1: Энергия, тепло и работа
Когда мы добавляем энергию к объекту в виде тепла, наиболее частыми результатами являются:
a) Температура объекта повышается.oC\))»> 0,129 Дж / г · ºC
Обратите внимание, что удельная теплоемкость воды не сильно меняется в диапазоне от 0 ° C до 25 ° C, но она сильно меняется, когда мы превращаем воду в лед или пар. Обратите также внимание на то, что мы видим широкий диапазон определенных температур, когда смотрим на различные химические вещества; удельная теплоемкость гелия примерно в 40 раз больше, чем у золота.oC \) вода закипает. Температура снова остается постоянной во время этого фазового перехода, в то время как вода поглощает 2256 кДж / кг тепла и превращается в пар. Когда вся жидкость превратилась в пар, температура снова повышается, поглощая тепло с постоянной скоростью. Если мы начнем с пара и охладим его, чтобы заставить его конденсироваться в жидкую воду и замерзнуть в лед, процесс полностью изменился бы, с постоянной температурой во время каждого фазового перехода.
Рисунок \ (\ PageIndex {4} \): Температура в зависимости от нагрева.oC \) отражают большое количество тепла, необходимое для плавления и испарения, соответственно.
Куда уходит тепло, добавляемое во время плавления или кипения, учитывая, что температура не меняется до завершения перехода? Энергия требуется, чтобы расплавить твердое тело, потому что силы притяжения между молекулами в твердом теле должны быть разрушены, чтобы в жидкости молекулы могли перемещаться со сравнимыми кинетическими энергиями; таким образом, нет повышения температуры.Энергия необходима для испарения жидкости по аналогичным причинам. И наоборот, когда молекулы сближаются во время замерзания и конденсации, работа совершается силами притяжения. Эта энергия должна передаваться из системы, обычно в виде тепла, чтобы молекулы могли оставаться вместе (рис. \ (\ PageIndex {4} \)). Таким образом, конденсация возникает в связи с холодными объектами — например, стеклом на рисунке \ (\ PageIndex {5} \).
Рисунок \ (\ PageIndex {5} \): На этом стакане холодного чая образуется конденсат, потому что температура окружающего воздуха понижена.oC \). Фруктовые сады намеренно распыляют водой, чтобы предотвратить сильные морозы. (кредит: Герман Хаммер)
Энергия на единицу массы, необходимая для перехода вещества из твердой фазы в жидкую, или высвобождаемая при переходе вещества из жидкого состояния в твердое, известна как теплота плавления, \ (\ Delta H_ {fus} \ ). Энергия на единицу массы, необходимая для перехода вещества из жидкой фазы в паровую, известна как теплота испарения \ (\ Delta H_ {vap} \).Сила сил зависит от природы составляющих частиц вещества. Теплота \ (q \), необходимая для фазового перехода в образце массой м , определяется как
\ [q = m \ Delta H_ {fus} \]
\ [q = m \ Delta H_ {vap} \]
, где эти «теплоты перехода» \ (\ Delta H_ {fus} \) и \ (\ Delta H_ {vap} \) являются константами, которые определяются экспериментально. Обратите внимание, что эти теплоты трансформации также иногда называют «скрытой теплотой». Эти константы являются «скрытыми» или скрытыми, потому что во время фазовых изменений энергия входит или покидает систему, не вызывая изменения температуры (!) В системе, поэтому, по сути, энергия скрыта.
Рисунок \ (\ PageIndex {7} \): (a) Энергия требуется для частичного преодоления сил притяжения (смоделированных как пружины) между частицами в твердом теле с образованием жидкости. Эта же энергия должна быть удалена из жидкости, чтобы произошло замерзание. (b) При переходе от жидкости к пару частицы разделяются на большие расстояния, что требует значительных затрат энергии для полного преодоления молекулярного притяжения. Такая же энергия должна быть удалена из пара для того, чтобы произошла конденсация.
Таблица \ (\ PageIndex {2} \) перечисляет типичные значения теплоты фазового превращения вместе с точками плавления и кипения. Обратите внимание, что в общем случае \ (L_v> L_f \). Таблица показывает, что количество энергии, участвующее в фазовых изменениях, может быть легко сравнимо или больше, чем количество энергии, участвующее в изменении температуры, как показано на рисунке \ (\ PageIndex {7} \) и сопутствующем обсуждении.oC\))»> 2595
Обратите внимание, что теплота превращения может быть выражена либо в джоулях на грамм, либо в джоулях на моль. Для воды теплота плавления составляет 3343,54 Дж / г. Так как моль воды составляет 18,0 1 6 граммов, теплота плавления также может быть выражена как 333.4 Дж = 11,7 кДж \ nonumber \]
Подобно переходам твердое тело-жидкость и жидкость-пар, прямые переходы твердое тело-пар или сублимация связаны с теплом. Передаваемая энергия задается уравнением \ (q = m \ Delta H_ {sub} \), где \ (\ Delta H_ {sub} \) — это теплота сублимации , аналогично \ (\ Delta H_ {fus } \) и \ (\ Delta H_ {vap} \). Теплота сублимации при данной температуре равна теплоте плавления плюс теплота испарения при этой температуре.
Теперь мы можем рассчитать любое количество эффектов, связанных с температурой и фазовым переходом.В каждом случае необходимо определить, какие температурные и фазовые изменения имеют место. Имейте в виду, что теплопередача может вызвать как изменение температуры, так и фазовые изменения. Вот пример, в котором мы меняем как температуру, так и физическое состояние.
Упражнение \ (\ PageIndex {3} \): теплопередача, включающая изменение температуры и фазы
Вопрос:
Сколько тепла требуется, чтобы превратить 50,0 г льда при -10,0ºC в жидкую воду при температуре 10 ° C.0ºC?
Решение:
Мы должны нагреть достаточно тепла, чтобы сделать три вещи: повысить температуру льда с -10,0 ° C до 0 ° C, растопить лед и затем повысить температуру полученной воды с 0 ° C до 10,0 ° C:
Нагревание льда: q 1 = (50,0 г) (2,05 Дж / г · ºC) [0ºC — (-10,0ºC)] = 1025 Дж = 1,025 кДж
Растапливание льда: q 2 = (50,0 г) (333.5 Дж / г) = 16675 Дж = 16,675 кДж
Подогрев жидкой воды: q 3 = (50,0 г) (4,18 Дж / г · ºC) (10,0 ºC — 0ºC) = 2090 Дж = 2,09 кДж
Общее необходимое количество тепла: q всего = q 1 + q 2 + q 3 = 1,025 кДж + 16,675 кДж + 2,09 кДж = 19,8 кДж
Из приведенного выше расчета мы видим, что всего 19.oC \). Однако эта поправка не существенно отличается от полученного нами результата. Вы можете объяснить почему?
Стратегия решения проблем: эффекты теплопередачи
- Изучите ситуацию, чтобы определить, есть ли изменение температуры или фазы. Есть ли передача тепла в систему или из нее? Когда неочевидно, происходит фазовое изменение или нет, вы можете сначала решить проблему, как если бы фазовых изменений не было, и изучить полученное изменение температуры.Если вам достаточно пройти через точку кипения или плавления, вам следует вернуться и решить проблему поэтапно — изменение температуры, изменение фазы, последующее изменение температуры и т. Д.
- Определите и перечислите все объекты, которые изменяют температуру или фазу.
- Определите, что именно необходимо определить в проблеме (определите неизвестные). Письменный список полезен.
- Составьте список того, что дано или что можно вывести из проблемы, как указано (определите известные).Если происходит изменение температуры, передаваемое тепло зависит от удельной теплоемкости вещества, а если есть фазовое изменение, передаваемое тепло зависит от теплоты преобразования вещества.
- Решите соответствующее уравнение для величины, которую нужно определить (неизвестное).
- Подставьте известные значения вместе с их единицами измерения в соответствующее уравнение и получите численные решения вместе с единицами измерения. Возможно, вам придется делать это поэтапно, если процесс имеет более одного состояния, например, изменение температуры, за которым следует фазовое изменение.Однако в задаче калориметрии каждый шаг соответствует члену в единственном уравнении \ (q_ {высвобождено} + q_ {поглощено} = 0 \). Обратите внимание, что упражнение 4 является примером такого уравнения.
- Проверьте ответ, чтобы узнать, разумен ли он. Имеет ли это смысл? Например, убедитесь, что любое изменение температуры также не вызывает фазового перехода, который вы не учли.
Упражнение \ (\ PageIndex {2} \)
Почему часто остается снег даже при дневных температурах выше нуля?
Снег состоит из кристаллов льда и, следовательно, является твердой фазой воды.oC \)
Практические проблемы, связанные с нагревом
1) Удельная теплоемкость этанола (C 2 H 5 OH) составляет 2,45 Дж / г · ºC, а его плотность составляет 0,789 г / мл. Используя эту информацию, ответьте на следующие вопросы:
a) Сколько тепла требуется для повышения температуры 50,0 мл этанола с –5,0 ° C до 25,0 ° C?
б) Если к 25,0 г этанола добавить 525 Дж тепла, и начальная температура этанола равна 10.0ºC, какая будет конечная температура?
c) Образец воды весом 50,0 г помещается рядом с образцом этанола, масса которого неизвестна. Затем два образца поглощают равное количество тепла. Температура воды повышается с 20,0ºC до 28,7ºC, а температура этанола повышается с 20,0ºC до 31,3ºC. Рассчитайте массу этанола.
2) Джерри помещает кусок алюминия весом 71,325 г в химический стакан и добавляет 123,4 г воды. Сколько тепла потребуется для повышения температуры воды и алюминия с 18?От 4ºC до 31,6ºC? Вам понадобится следующая информация:
Al: удельная теплоемкость = 0,897 Дж / г · ºC в этом диапазоне температур
H 2 O: удельная теплоемкость = 4,177 Дж / г · ºC в этом диапазоне температур
3) Химик нагревает 31,5 г кристаллов NaCl до 76,5 ° C, а затем выливает кристаллы в 61,2 г CCl 4 . Начальная температура CCl 4 составляет 12,8 ° C, а конечная температура — 36,5 ° C. Удельная теплоемкость CCl 4 (четыреххлористый углерод) равна 0.751 Дж / г · ºC. Предполагая, что в окружающую среду не теряется энергия, рассчитайте удельную теплоемкость NaCl.
4) Вы помещаете 12,0 г льда при 0,0 ° C в калориметр кофейной чашки, содержащий 50,0 г воды при 25,0 ° C. Предполагая, что весь лед растает, определите конечную температуру содержимого чашки. Для воды вам понадобится следующая информация:
точка плавления: 0,0 ºC Удельная теплоемкость: 4,18 Дж / г ºC теплота плавления: 333 Дж / г
5) Кусок железа по 300.0 ° C добавляют в изотермический контейнер, содержащий 100,0 г воды при 25,0 ° C. Какая минимальная масса железа требуется для превращения всей воды в пар при 100,0 ºC?
Вам понадобится следующая информация:
Вода — точка кипения: 100,0 ºC Удельная теплоемкость: 4,18 Дж / г ºC Теплота испарения: 2260 Дж / г
Железо — удельная теплоемкость: 0,448 Дж / гºC
————————————————- ——————————
Ответы на практические проблемы , связанные с жарой
1) а) 2.90 кДж б) 18,6 ° C в) 65,7 г
2) 7,65 x 10 3 Дж
3) 0,865 Дж / г ° C
4) 4,7 ° С
5) 2870 г
Энергетические и химические процессы
Вступительное эссе
Метаболизм , который мы изучим в главе 20 «Энергетический метаболизм», является собирательным термином для химических реакций, которые происходят в клетках и обеспечивают энергию для поддержания жизни клеток. Некоторая часть энергии метаболизма находится в форме тепла, и некоторые животные используют это тепло для регулирования температуры своего тела.Таких теплокровных животных получили название эндотерм . У эндотермов проблемы с обменом веществ могут привести к колебаниям температуры тела. Например, когда люди заболевают, температура нашего тела может подняться выше нормы; у нас поднимается температура. Когда пищи не хватает (особенно зимой), некоторые эндотермы переходят в состояние контролируемого пониженного метаболизма, называемое гибернацией . Во время спячки температура тела этих эндотермов фактически снижается. В жаркую погоду или при лихорадке эндотермы будут тяжело дышать или потеть, чтобы избавить свое тело от избыточного тепла.
Таблица 7.1 Средние температуры тела отдельных эндотерм
| Эндотерм | Температура тела (° F) | Температура тела (° C) |
|---|---|---|
| птица | до 110 | до 43,5 |
| кот | 101.5 | 38,6 |
| собака | 102 | 38,9 |
| лошадь | 100,0 | 37,8 |
| человек | 98,6 | 37,0 |
| свинья | 102.5 | 39,2 |
Ectotherms , иногда называемые хладнокровными животными, не используют энергию метаболизма для регулирования температуры тела. Вместо этого они зависят от внешних источников энергии, таких как солнечный свет. Например, рыба будет искать воду с разной температурой, чтобы регулировать температуру тела. Количество доступной энергии напрямую связано со скоростью метаболизма животного.Когда энергии не хватает, эктотерм также может впадать в спячку.
Связь между обменом веществ и температурой тела является напоминанием о том, что энергия и химические реакции тесно связаны. Базовое понимание этой взаимосвязи особенно важно, когда эти химические реакции происходят в нашем собственном теле.
Энергия — жизненно важный компонент окружающего нас мира. Почти каждый физический и химический процесс, включая все химические реакции, обсуждавшиеся в предыдущих главах, протекает с одновременным изменением энергии.В этой главе мы исследуем природу энергии и то, как связаны энергия и химия.
7.1 Энергия и ее единицы
Цель обучения
- Определите энергии и тепла .
Энергия — Способность выполнять работу. это умение делать работу. Вы можете понять, что это значит, думая о себе, когда вы чувствуете себя «энергичным». Вы чувствуете, что готовы к работе — вскочить и что-то сделать.Когда у вас много энергии, вы можете много работать. Напротив, если вы не чувствуете себя энергичным, у вас очень мало желания что-либо делать. Это описание применимо не только к вам, но и ко всем физическим и химическим процессам. Количество работы, которую можно выполнить, зависит от количества энергии, доступной для ее выполнения.
Энергия может передаваться от одного объекта к другому, если объекты имеют разную температуру. Передача энергии из-за разницы температур называется теплом. Передача энергии из одной части Вселенной в другую из-за разницы температур.. Например, если вы держите кубик льда в руке, кубик льда медленно тает, поскольку энергия в виде тепла передается от руки ко льду. Когда ваша рука теряет энергию, она начинает холодеть.
Из-за их взаимосвязи энергия, работа и тепло имеют одни и те же единицы. Единица измерения энергии, работы и тепла в системе СИ — джоуль, единица измерения энергии, работы и тепла в системе СИ. (J). Джоуль — это крошечное количество энергии. Например, для нагрева 1 мл H 2 O на 1 ° C требуется около 4 Дж.Многие процессы происходят с изменениями энергии в тысячи джоулей, поэтому килоджоуль (кДж) также является обычным явлением.
Еще одна единица энергии, широко используемая в профессиях здравоохранения и в повседневной жизни, — это калория. Единица энергии, широко используемая в профессиях, связанных со здоровьем, и в повседневной жизни. (кал). Первоначально калория определялась как количество энергии, необходимое для нагревания 1 г H 2 O на 1 ° C, но в настоящее время калория напрямую связана с джоулями:
1 кал = 4.184 Дж
Мы можем использовать это соотношение для преобразования количества энергии, работы или тепла из одной единицы в другую.
Калория используется в питании для выражения энергетической ценности продуктов. Однако, поскольку калория — это довольно небольшое количество, энергия питания обычно выражается в килокалориях (ккал), также называемых калориями (с заглавной буквы; Cal). Например, шоколадный батончик может обеспечить 120 калорий (питательных калорий) энергии, что равно 120 000 кал. Рисунок 7.1 «Пищевая энергия» показывает пример.Белки и углеводы обеспечивают 4 ккал / г, а жир — 9 ккал / г.
Рисунок 7.1 Энергетическая ценность
Энергетическая ценность продуктов указывается в килокалориях, также называемых калориями.
Примечание
Хотя правильной единицей СИ для измерения энергии является джоуль, в этой главе мы будем использовать калорию или килокалорию (или калорию), поскольку они широко используются профессионалами в области здравоохранения.
Пример 1
Энергетическая ценность одной порции хлеба — 70.0 Cal. Какое содержание энергии в калориях? В джоулях?
Решение
Это простая проблема с коэффициентом преобразования. Используя соотношение 1 Cal = 1000 cal, мы можем ответить на первый вопрос с помощью одноэтапного преобразования:
70,0 ккал × 1000 ккал1 ккал = 70000 ккал.
Затем переводим калории в джоули
70000 кал × 4,184 Дж1 кал = 2 Дж
, а затем
килоджоулей
2 Дж × 1 кДж 1000 Дж = 293 кДж
Энергетическая ценность хлеба состоит в основном из углеводов.
Упражнения по развитию навыков
Энергетическая ценность одной чашки меда составляет 1030 кал. Каково его энергетическое содержание в калориях и джоулях?
Для вашего здоровья: затраты на энергию
Большинство специалистов в области здравоохранения согласны с тем, что упражнения являются ценным компонентом здорового образа жизни. Упражнения не только укрепляют тело и развивают мышечный тонус, но и расходуют энергию.Получив энергию из продуктов, которые мы едим, нам нужно как-то ее расходовать, иначе наш организм будет накапливать ее нездоровым образом.
Как и содержание энергии в пище, энергетические затраты на упражнения также указываются в килокалориях, обычно в килокалориях на час упражнений. Эти расходы широко варьируются: от 440 ккал / ч при ходьбе со скоростью 4 мили в час до 1870 ккал / ч при езде на горном велосипеде со скоростью 20 миль в час. В таблице 7.2 «Энергозатраты человека весом 180 фунтов во время отдельных упражнений» перечислены затраты энергии на различные упражнения.
Таблица 7.2 Энергозатраты человека весом 180 фунтов во время отдельных упражнений
| Упражнение | Затраченная энергия (ккал / ч) |
|---|---|
| аэробика низкая | 325 |
| баскетбол | 940 |
| езда на велосипеде, 20 миль / ч | 830 |
| гольф с тележкой | 220 |
| гольф, клюшки | 425 |
| бег трусцой, 7.5 миль / ч | 950 |
| ракетбол | 740 |
| горные лыжи | 520 |
| футбол | 680 |
| подъем по лестнице | 1,200 |
| йога | 280 |
Поскольку некоторые виды упражнений требуют больше энергии, чем другие, любой, кто рассматривает конкретный режим упражнений, должен сначала проконсультироваться со своим врачом.
Упражнения по обзору концепции
Какая связь между энергией и теплом?
Какие единицы используются для выражения энергии и тепла?
ответов
Тепло — это обмен энергией от одной части Вселенной к другой.Тепло и энергия имеют одни и те же единицы.
Джоули и калории — это единицы энергии и тепла.
Основные выводы
- Энергия — это способность выполнять работу.
- Тепло — это передача энергии из-за разницы температур.
- Энергия и тепло выражаются в джоулях.
Упражнения
Какая связь между калорией и джоулями? Какая единица больше?
Какая связь между калорией и килокалорией? Какая единица больше?
Выразите 1,265 кал в килокалориях и джоулях.
Выразите 9 043,3 Дж в калориях и в килокалориях.
Одна килокалория равна сколько килоджоулей?
Сколько килокалорий равно одному килоджоулю?
Многие эксперты по питанию говорят, что среднестатистическому человеку требуется 2000 калорий в день из его или ее диеты.Сколько это джоулей?
Детское питание обычно содержит 20,0 кал на унцию. Сколько унций смеси ребенок должен выпивать в день, если РСНП составляет 850 ккал?
ответов
Энергия — это способность выполнять работу.
1 кал = 4.184 Дж; калорийность больше.
7.2 заезд
Цель обучения
- Свяжите теплопередачу с изменением температуры.
Тепло — знакомое проявление энергии. Когда мы прикасаемся к горячему объекту, энергия перетекает от горячего объекта к нашим пальцам, и мы воспринимаем эту поступающую энергию как «горячий» объект. И наоборот, когда мы держим кубик льда в ладонях, энергия перетекает из руки в кубик льда, и мы воспринимаем эту потерю энергии как «холод». В обоих случаях температура объекта отличается от температуры нашей руки, поэтому мы можем сделать вывод, что разница температур является основной причиной теплопередачи.
Предположим, мы рассматриваем передачу тепла с противоположной точки зрения, а именно, что происходит с системой, которая получает или теряет тепло? Как правило, температура системы меняется. (Мы рассмотрим несколько исключений позже.) Чем больше исходная разница температур, тем больше теплопередача и тем больше окончательное изменение температуры. Соотношение между количеством переданного тепла и изменением температуры можно записать как
тепло ∝ Δ T
, где ∝ означает «пропорционально», а Δ T — изменение температуры системы.Любое изменение в переменной всегда определяется как «конечное значение минус начальное значение» переменной, поэтому Δ T составляет T конечный — T начальный . Кроме того, чем больше масса объекта, тем больше тепла требуется для изменения его температуры. Мы можем включить переменную, представляющую массу ( м ) в пропорциональность, следующим образом:
тепло ∝ м Δ T
Чтобы преобразовать эту пропорциональность в равенство, мы включаем константу пропорциональности.Константа пропорциональности называется удельной теплоемкостью. Константа пропорциональности, которая связывает тепло с изменением температуры., Обозначается c :
.
тепло = мк Δ T
Каждое вещество имеет характерную удельную теплоемкость, которая выражается в единицах кал / г · ° C или кал / г · К, в зависимости от единиц, используемых для выражения Δ T . Удельная теплоемкость вещества — это количество энергии, которое должно быть передано 1 г этого вещества или от него, чтобы изменить его температуру на 1 °.В Таблице 7.3 «Удельная теплоемкость выбранных веществ» перечислены значения удельной теплоты для различных материалов.
Таблица 7.3 Удельная теплоемкость отдельных веществ
| Вещество | c (кал / г · ° C) |
|---|---|
| алюминий (Al) | 0,215 |
| оксид алюминия (Al 2 O 3 ) | 0.305 |
| бензол (C 6 H 6 ) | 0,251 |
| медь (Cu) | 0,092 |
| этанол (C 2 H 6 O) | 0,578 |
| гексан (C 6 H 14 ) | 0,394 |
| водород (H 2 ) | 3.419 |
| лед [H 2 O (s)] | 0,492 |
| железо (Fe) | 0,108 |
| оксид железа (III) (Fe 2 O 3 ) | 0,156 |
| ртуть (Hg) | 0,033 |
| кислород (O 2 ) | 0.219 |
| хлорид натрия (NaCl) | 0,207 |
| пар [H 2 O (г)] | 0,488 |
| вода [H 2 O (ℓ)] | 1,00 |
Примечание
Константу пропорциональности c иногда называют удельной теплоемкостью или (неправильно) теплоемкостью .
Направление теплового потока не показано в heat = mc Δ T . Если энергия поступает в объект, общая энергия объекта увеличивается, и значения тепла Δ T положительны. Если энергия исходит из объекта, общая энергия объекта уменьшается, а значения тепла и Δ T являются отрицательными.
Пример 2
Какое количество тепла передается при нагревании блока металлического железа весом 150,0 г от 25 ° С.От 0 ° C до 73,3 ° C? Какое направление теплового потока?
Решение
Мы можем использовать heat = mc Δ T , чтобы определить количество тепла, но сначала нам нужно определить Δ T . Поскольку конечная температура утюга составляет 73,3 ° C, а начальная температура составляет 25,0 ° C, Δ T имеет следующий вид:
Δ T = T окончательный — T начальный = 73,3 ° C — 25,0 ° C = 48,3 ° C
Масса равна 150.0 г, а в таблице 7.3 «Удельная теплоемкость выбранных веществ» указана удельная теплоемкость железа как 0,108 кал / г · ° C. Подставляем известные значения в heat = mc Δ T и решаем для количества тепла:
тепло = (150,0 г) (0,108 кал. г · ° C) (48,3 ° C) = 782 кал.
Обратите внимание, как единицы измерения грамм и ° C отменяются алгебраически, оставляя только единицу калорий, которая является единицей тепла. Поскольку температура железа увеличивается, энергия (в виде тепла) должна течь в металл.
Упражнения по развитию навыков
Какое количество тепла передается при охлаждении блока металлического алюминия массой 295,5 г с 128,0 ° C до 22,5 ° C? Какое направление теплового потока?
Пример 3
Образец красновато-коричневого металла массой 10,3 г выделил 71,7 кал тепла при снижении его температуры с 97,5 ° C до 22.0 ° С. Какова удельная теплоемкость металла? Можете ли вы идентифицировать металл по данным в таблице 7.3 «Удельная теплоемкость выбранных веществ»?
Решение
Вопрос дает нам тепло, конечную и начальную температуры и массу образца. Значение Δ T составляет:
Δ T = T окончательный — T начальный = 22,0 ° C — 97,5 ° C = -75,5 ° C
Если образец выдает 71.7 кал, он теряет энергию (в виде тепла), поэтому значение тепла записывается как отрицательное число, −71,7 кал. Подставляем известные значения в heat = mc Δ T и решаем для c :
-71,7 кал = (10,3 г) ( c ) (-75,5 ° C)
c = -71,7 кал (10,3 г) (-75,5 ° C)
c = 0,0923 кал / г · ° C
Это значение удельной теплоемкости очень близко к значению, приведенному для меди в таблице 7.3 «Удельная теплоемкость выбранных веществ».
Упражнения по развитию навыков
А 10.7 г кристаллов хлорида натрия (NaCl) имели начальную температуру 37,0 ° C. Какова конечная температура кристалла, если на него было подано 147 кал тепла?
Упражнение по обзору концепции
Опишите взаимосвязь между теплопередачей и изменением температуры объекта.
Ответ
Теплота равна произведению массы, изменения температуры и константы пропорциональности, называемой удельной теплоемкостью.
Key Takeaway
- Теплопередача связана с изменением температуры.
Упражнения
Кастрюля с водой ставится на горячую плиту печи. Какое направление теплового потока?
Несколько сырых макарон наливают в кастрюлю с кипящей водой.Какое направление теплового потока?
Сколько калорий требуется для нагрева 150 г H 2 O от 0 ° C до 100 ° C?
Сколько калорий требуется для нагрева 125 г Fe с 25 ° C до 150 ° C?
Если к 43 добавить 250 кал.8 г Al при 22,5 ° C, какова конечная температура алюминия?
Если 195 кал тепла добавить к 33,2 г Hg при 56,2 ° C, какова конечная температура ртути?
Образец меди поглощает 145 кал энергии, а его температура повышается с 37,8 ° C до 41,7 ° C. Какая масса у меди?
Большой монокристалл хлорида натрия поглощает 98.0 кал. Тепла. Если его температура повышается с 22,0 ° C до 29,7 ° C, какова масса кристалла NaCl?
Определите теплоемкость вещества, если 23,6 г вещества выделяет 199 кал. Тепла при изменении его температуры с 37,9 ° C до 20,9 ° C.
Какова теплоемкость золота, если для образца весом 250 г требуется 133 кал энергии, чтобы повысить его температуру с 23?От 0 ° C до 40,1 ° C?
ответов
Тепло поступает в кастрюлю с водой.
Меркурий испытает самое сильное изменение температуры.
7.3 Изменения фаз
Цель обучения
- Определите количество тепла, связанное с фазовым переходом.
В зависимости от окружающих условий нормальное вещество обычно существует в виде одной из трех фаз : твердой, жидкой или газообразной.
Фазовое изменение: физический процесс, в котором вещество переходит из одной фазы в другую. это физический процесс, в котором вещество переходит из одной фазы в другую. Обычно изменение происходит при добавлении или удалении тепла при определенной температуре, известной как точка плавления или точка кипения вещества. Точка плавления Температура, при которой вещество переходит из твердого состояния в жидкое (или из жидкости в твердое). это температура, при которой вещество переходит из твердого состояния в жидкое (или из жидкости в твердое).Точка кипения Температура, при которой вещество переходит из жидкости в газ (или из газа в жидкость). это температура, при которой вещество переходит из жидкости в газ (или из газа в жидкость). Характер фазового перехода зависит от направления теплопередачи. Тепло, переходящее в вещество , превращает его из твердого тела в жидкость или из жидкости в газ. Отвод тепла от вещество превращает газ в жидкость или жидкость в твердое тело.
Следует подчеркнуть два ключевых момента.Во-первых, при температуре плавления или кипения вещества могут существовать две фазы одновременно. Возьмем, к примеру, воду (H 2 O). По шкале Цельсия H 2 O имеет точку плавления 0 ° C и точку кипения 100 ° C. При 0 ° C твердая и жидкая фазы H 2 O могут сосуществовать. Однако при добавлении тепла часть твердого H 2 O расплавится и превратится в жидкость H 2 O. Если отвести тепло, произойдет обратное: часть жидкого H 2 O превратится в твердый H 2 О.Аналогичный процесс может происходить при 100 ° C: добавление тепла увеличивает количество газообразного H 2 O, а удаление тепла увеличивает количество жидкости H 2 O (Рисунок 7.2 «Точка кипения воды»).
Рисунок 7.2 Температура кипения воды
При температуре кипения H 2 O жидкая вода и газообразный пар имеют одинаковую температуру 100 ° C.
Примечание
Вода — хорошее вещество, которое можно использовать в качестве примера, потому что многие люди уже знакомы с ней.Другие вещества также имеют точки плавления и кипения.
Во-вторых, температура вещества не меняется при переходе вещества из одной фазы в другую. Другими словами, фазовые превращения — это изотермический процесс, который происходит при постоянной температуре. (изотермический означает «постоянная температура»). Снова рассмотрим H 2 O в качестве примера. Твердая вода (лед) может существовать при 0 ° C. Если к льду добавить тепло при 0 ° C, часть твердого вещества изменит фазу, превратившись в жидкость, которая также имеет температуру 0 ° C.Помните, что твердая и жидкая фазы H 2 O могут сосуществовать при 0 ° C. Только после того, как все твердое вещество превратилось в жидкость, добавление тепла изменяет температуру вещества.
Для каждого фазового перехода вещества существует характерное количество тепла, необходимое для выполнения фазового перехода на грамм (или на моль) материала. Теплота плавления Количество тепла на грамм или на моль, необходимое для фазового перехода, который происходит при температуре плавления. (Δ H fus ) — количество тепла на грамм (или на моль), необходимое для фазового изменения, которое происходит при температуре плавления.Теплота испарения Количество тепла на грамм или на моль, необходимое для фазового превращения, которое происходит при температуре кипения. (Δ H vap ) — количество тепла на грамм (или на моль), необходимое для фазового превращения, которое происходит при температуре кипения. Если вам известно общее количество граммов или молей материала, вы можете использовать Δ H fus или Δ H vap , чтобы определить общее тепло, передаваемое для плавления или затвердевания, используя следующие выражения:
heat = n × Δ H fus (где n — количество молей)
или же
тепло = м × Δ H фус (где м — масса в граммах)
Для кипения или конденсации используйте следующие выражения:
heat = n × Δ H vap (где n — количество молей)
или же
heat = м × Δ H vap (где м — масса в граммах)
Помните, что фазовый переход зависит от направления теплопередачи.При передаче тепла твердые вещества становятся жидкими, а жидкости становятся твердыми при температурах плавления и кипения соответственно. Если тепло передается, жидкости затвердевают, а газы конденсируются в жидкости.
Пример 4
Сколько тепла необходимо, чтобы растопить 55,8 г льда (твердый H 2 O) при 0 ° C? Теплота плавления H 2 O составляет 79,9 кал / г.
Решение
Мы можем использовать соотношение между теплотой и теплотой плавления, чтобы определить, сколько джоулей тепла необходимо, чтобы растопить этот лед:
тепло = м × Δ H фус
тепло = (55.8 г) (79,9 кал. Г) = 4460 ккал.
Упражнения по развитию навыков
Сколько тепла необходимо для испарения 685 г H 2 O при 100 ° C? Теплота испарения H 2 O составляет 540 кал / г.
В таблице 7.4 «Теплоты плавления и испарения некоторых веществ» перечислены теплоты плавления и испарения некоторых распространенных веществ. Обратите внимание на единицы измерения этих величин; Когда вы используете эти значения при решении проблем, убедитесь, что другие переменные в ваших расчетах выражены в единицах, соответствующих единицам для конкретных плавок или теплоты плавления и испарения.
Таблица 7.4 Теплоты плавления и испарения для выбранных веществ
| Вещество | Δ H фус (кал / г) | Δ H пар (кал / г) |
|---|---|---|
| алюминий (Al) | 94,0 | 2 602 |
| золото (Au) | 15.3 | 409 |
| железо (Fe) | 63,2 | 1 504 |
| вода (H 2 O) | 79,9 | 540 |
| хлорид натрия (NaCl) | 123,5 | 691 |
| этанол (C 2 H 5 OH) | 45.2 | 200,3 |
| бензол (C 6 H 6 ) | 30,4 | 94,1 |
Взгляд поближе: сублимация
Существует также фазовый переход, когда твердое вещество переходит непосредственно в газ:
твердое тело → газ
Это фазовое изменение называется сублимацией. Каждое вещество имеет характерную теплоту сублимации, связанную с этим процессом.Например, теплота сублимации (Δ H sub ) H 2 O составляет 620 кал / г.
Мы сталкиваемся с сублимацией по-разному. Возможно, вы уже знакомы с сухим льдом, который представляет собой просто твердый диоксид углерода (CO 2 ). При -78,5 ° C (-109 ° F) твердая двуокись углерода сублимируется, переходя непосредственно из твердой фазы в газовую:
CO2 (т) → −78,5 ° C CO2 (г)
Твердый диоксид углерода называется сухим льдом, потому что он не проходит через жидкую фазу.Вместо этого он работает непосредственно с газовой фазой. (Углекислый газ может существовать в виде жидкости, но только под высоким давлением.) Сухой лед имеет множество практических применений, включая долгосрочное хранение медицинских образцов.
Даже при температуре ниже 0 ° C твердый H 2 O будет медленно возгоняться. Например, тонкий слой снега или инея на земле может медленно исчезнуть, когда твердый H 2 O сублимируется, даже если внешняя температура может быть ниже точки замерзания воды.Точно так же кубики льда в морозильной камере со временем могут стать меньше. Хотя твердая вода заморожена, она медленно возгоняется, оседая на более холодных охлаждающих элементах морозильной камеры, что требует периодического размораживания. (В морозильных камерах без замораживания это повторное отложение сводится к минимуму.) Снижение температуры в морозильной камере уменьшит потребность в частом размораживании.
При аналогичных обстоятельствах вода также выделяется из замороженных продуктов (например, мяса или овощей), придавая им непривлекательный вид с пятнами, который называется ожогом при заморозке.На самом деле это не «ожог», и еда не обязательно испортилась, хотя выглядит неаппетитно. Ожог при замораживании можно свести к минимуму, снизив температуру в морозильной камере и плотно обернув продукты, чтобы у воды не было места для сублимации.
Упражнения по обзору концепции
Объясните, что происходит, когда тепло течет внутрь или из вещества при его температуре плавления или кипения.
Как количество тепла, необходимое для фазового перехода, соотносится с массой вещества?
ответов
На изменение фазы идет энергия, а не температура.
Количество тепла на грамм вещества постоянно.
Key Takeaway
- Есть изменение энергии, связанное с любым изменением фазы.
Упражнения
Сколько энергии нужно для плавления 43.8 г Au при температуре плавления 1064 ° C?
Сколько энергии выделяется, когда 563,8 г NaCl затвердевает при температуре замерзания 801 ° C?
Какую массу льда можно растопить с помощью 558 кал энергии?
Сколько этанола (C 2 H 5 OH) в граммах может замерзнуть при температуре замерзания, если удалить 1,225 кал тепла?
Какова теплота испарения вещества, если для испарения требуется 10,776 кал? 5.05 г? Выразите окончательный ответ в джоулях на грамм.
Если для испарения образца с теплотой испарения 137 кал / г требуется 1 650 кал / г, какова масса образца?
Какова теплота плавления воды в калориях на моль?
Какова теплота испарения бензола (C 6 H 6 ) в калориях на моль?
Какова теплота испарения золота в калориях на моль?
Какова теплота плавления железа в калориях на моль?
7.4 Энергии связи и химические реакции
Цели обучения
- Определите энергию связи .
- Определите, является ли химический процесс экзотермическим или эндотермическим.
Что произойдет, если вы возьмете баскетбольный мяч, поместите его на полпути на горку игровой площадки, а затем отпустите? Баскетбольный мяч катится по горке. Что будет, если вы сделаете это снова? Скатывается ли баскетбольный мяч по горке? Должно.
Если бы вам пришлось проводить этот эксперимент снова и снова, как вы думаете, баскетбольный мяч когда-нибудь катил бы на слайде? Возможно нет.Почему нет? Ну, для начала, по нашему опыту, баскетбол всегда опускался на более низкую позицию, когда появлялась возможность. Гравитационное притяжение Земли оказывает на баскетбольный мяч силу, и, если есть такая возможность, баскетбольный мяч сдвинется вниз. Мы говорим, что баскетбол собирается снизить гравитационную потенциальную энергию до . Баскетбольный мяч может двигаться вверх по горке, но только если кто-то приложит некоторое усилие (то есть поработает) над баскетбольным мячом. Общее утверждение, основанное на бесчисленных наблюдениях за столетиями изучения, состоит в том, что все объекты имеют тенденцию самопроизвольно перемещаться в положение с минимальной энергией, если на них не действует какая-либо другая сила или объект.
Аналогичное утверждение можно сделать и об атомах в соединениях. Атомы соединяются вместе, образуя соединения, потому что при этом они достигают более низких энергий, чем они обладают как отдельные атомы. Количество энергии, равное разнице между энергиями связанных атомов и энергиями отделенных атомов, обычно выделяется в виде тепла. То есть связанные атомы имеют более низкую энергию, чем отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию. При создании соединений атомы действуют как баскетбольный мяч на детской площадке; они движутся в направлении уменьшения энергии.
Мы можем повернуть процесс вспять, как в случае с баскетболом. Если мы вложим энергию в молекулу, мы можем вызвать разрыв ее связей, разделив молекулу на отдельные атомы. Связи между определенными конкретными элементами обычно имеют характерную энергию, называемую энергией связи. Сила взаимодействия между атомами, образующими ковалентные связи, которая необходима для разрыва связи.Такое же количество энергии было высвобождено, когда атомы в первую очередь образовали химическую связь. Термин энергия связи обычно используется для описания силы взаимодействий между атомами, которые образуют ковалентные связи. Для атомов в ионных соединениях, притягиваемых противоположными зарядами, термин энергия решетки означает силу взаимодействий между атомами, которые образуют ионные связи. используется. А пока мы займемся ковалентными связями в молекулах.
Хотя каждая молекула имеет свою характерную энергию связи, возможны некоторые обобщения.Например, хотя точное значение энергии связи C – H зависит от конкретной молекулы, все связи C – H имеют примерно одинаковую энергию связи, поскольку все они являются связями C – H. Для разрыва 1 моля связи C – H требуется примерно 100 ккал энергии, поэтому мы говорим об энергии связи C – H как примерно 100 ккал / моль. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а связь C = C имеет энергию связи около 145 ккал / моль. В таблице 7.5 «Приблизительные энергии связи» перечислены приблизительные энергии различных ковалентных связей.
Таблица 7.5 Приблизительная энергия связи
| Облигация | Энергия связи (ккал / моль) |
|---|---|
| C – H | 100 |
| C – O | 86 |
| С = О | 190 |
| C – N | 70 |
| C – C | 85 |
| С = С | 145 |
| ° C | 200 |
| N – H | 93 |
| H – H | 105 |
Когда происходит химическая реакция, атомы в реагентах меняют свои химические связи, образуя продукты.Новое расположение связей не имеет такой же полной энергии, как связи в реагентах. Следовательно, когда происходят химические реакции, всегда будет сопутствующее изменение энергии .
В некоторых реакциях энергия продуктов ниже энергии реагентов. Таким образом, в ходе реакции вещества теряют энергию в окружающую среду. Такие реакции являются экзотермическими — процессами с выделением энергии. и может быть представлен диаграммой уровней энергии , подобной той, что представлена на Фигуре 7.3 «Экзотермические реакции». В большинстве случаев энергия выделяется в виде тепла (хотя некоторые реакции выделяют энергию в виде света).
Рисунок 7.3 Экзотермические реакции
При экзотермической химической реакции выделяется энергия, поскольку реагенты превращаются в продукты.
В химических реакциях, где продукты имеют более высокую энергию, чем реагенты, реагенты должны поглощать энергию из окружающей среды, чтобы вступить в реакцию. Эти реакции являются эндотермическими — процессами с поглощением энергии.и может быть представлен диаграммой уровней энергии, подобной той, что показана на Рисунке 7.4 «Эндотермические реакции».
Рисунок 7.4 Эндотермические реакции
При эндотермической химической реакции энергия поглощается, поскольку реагенты превращаются в продукты.
Экзотермические и эндотермические реакции можно рассматривать как имеющие энергию либо продукт реакции, либо реагент. Экзотермические реакции выделяют энергию, поэтому энергия — это продукт. Эндотермические реакции требуют энергии, поэтому энергия — это реагент.
Пример 5
Каждая химическая реакция является экзотермической или эндотермической?
- 2H 2 (г) + O 2 (г) → 2H 2 O (ℓ) + 135 ккал
- N 2 (г) + O 2 (г) + 45 ккал → 2NO (г)
Решение
- Поскольку энергия является продуктом, энергия выделяется в результате реакции. Следовательно, эта реакция экзотермическая.
- Поскольку энергия является реагентом, энергия поглощается реакцией.Следовательно, эта реакция эндотермическая.
Упражнения по развитию навыков
H 2 (г) + F 2 (г) → 2HF (г) + 130 ккал
2C (т.) + H 2 (г) + 5,3 ккал → C 2 H 2 (г)
Каждая химическая реакция является экзотермической или эндотермической?
Упражнения по обзору концепции
Какая связь между энергией и химическими связями?
Почему энергия изменяется в ходе химической реакции?
ответов
Химические связи обладают определенной энергией, которая зависит от элементов в связи и количества связей между атомами.
Энергия изменяется, потому что связи перестраиваются, образуя новые связи с другой энергией.
Основные выводы
- Атомы удерживаются вместе за счет определенного количества энергии, называемой энергией связи.
- Химические процессы классифицируются как экзотермические или эндотермические в зависимости от того, выделяют они или поглощают энергию соответственно.
Упражнения
Является ли процесс разрыва связи экзотермическим или эндотермическим?
Является ли процесс связывания экзотермическим или эндотермическим?
Каждая химическая реакция является экзотермической или эндотермической?
- 2SnCl 2 (с) + 33 ккал → Sn (с) + SnCl 4 (с)
- CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (ℓ) + 213 ккал
Каждая химическая реакция является экзотермической или эндотермической?
- C 2 H 4 (г) + H 2 (г) → C 2 H 6 (г) + 137 кДж
- С (т, графит) +1.9 кДж → C (т, ромб)
7.5 Энергия биохимических реакций
Цель обучения
- Свяжите понятие изменения энергии с химическими реакциями, которые происходят в организме.
Химический состав человеческого тела или любого живого организма очень сложен. Даже в этом случае химические реакции, происходящие в человеческом теле, следуют тем же принципам энергии, что и другие химические реакции.
Откуда берется энергия, питающая наши тела? Детали сложны, но мы можем взглянуть на некоторые простые процессы, лежащие в основе клеточной активности.
Важной реакцией, обеспечивающей энергией наш организм, является окисление глюкозы (C 6 H 12 O 6 ):
C 6 H 12 O 6 (s) + 6O 2 (g) → 6CO 2 (g) + 6H 2 O (ℓ) + 670 ккал
Учитывая, что 1 моль C 6 H 12 O 6 (s) имеет объем около 115 мл, мы можем видеть, что глюкоза является компактным источником энергии.
Глюкоза и другие сахара являются примерами углеводов Один из основных диетических компонентов, таких как глюкоза и другие сахара, которые снабжают организм энергией, которые являются одним из трех основных диетических компонентов рациона человека. Все углеводы содержат примерно 4 ккал / г. В этом можно убедиться, разделив теплоту реакции окисления глюкозы на ее молярную массу. Белки Строительные блоки структурных тканей, таких как мышцы и кожа, строительные блоки структурных тканей, таких как мышцы и кожа, также обеспечивают около 4 ккал / г.Другими важными источниками энергии для организма являются жиры — соединение, состоящее в основном из углеводородных цепей, которое снабжает организм энергией, которые в основном представляют собой углеводородные цепи. Жиры дают еще больше энергии на грамм, около 9 ккал / г. Подробное обсуждение углеводов и жиров и их химического состава в организме можно найти в главе 16 «Углеводы» и главе 17 «Липиды».
Другой важной реакцией является превращение аденозинтрифосфата (АТФ) в аденозиндифосфат (АДФ), что показано на рисунке 7.5 «АТФ к АДФ». В физиологических условиях разрыв связи O – P и образование связи O – P и двух связей O – H выделяет около 7,5 ккал / моль АТФ. Это может показаться не таким уж большим количеством энергии, особенно по сравнению с количеством энергии, выделяемой при реакции глюкозы. Однако энергии достаточно для подпитки других биохимически важных химических реакций в наших клетках.
Рисунок 7.5 От ATP к ADP
Преобразование АТФ (вверху) в АДФ (внизу) обеспечивает энергию для клеток тела.
Примечание
Даже сложные биологические реакции должны подчиняться основным правилам химии.
Карьера: диетолог
Диетолог — эксперт по питанию, который доводит информацию о пищевых продуктах до широкой публики. Таким образом, диетологи способствуют общему благополучию населения и помогают людям излечиться от болезней, связанных с питанием.
Наша диета не только снабжает нас энергией.Мы также получаем витамины, минералы и даже воду из того, что мы едим. Слишком много, слишком мало или недостаточно правильной пищи может привести к множеству проблем. Диетологи обучены давать конкретные диетические рекомендации для решения конкретных проблем, связанных со здоровьем. Например, диетолог может вместе с человеком разработать общую диету, которая поможет ему сбросить вес или контролировать диабет. Больницы нанимают диетологов для составления меню для пациентов, и многие диетологи работают с общественными организациями, чтобы улучшить пищевые привычки больших групп людей.
Упражнение по обзору концепции
Какое содержание энергии в граммах белков, углеводов и жиров?
Ответ
белков и углеводов: 4 ккал / г; жиры: 9 ккал / г
Key Takeaway
- Энергия для питания человеческого тела возникает в результате химических реакций.
Упражнения
Порция цельного молока на 8 унций содержит 8,0 г жира, 8,0 г белка и 13 г углеводов. Примерно сколько килокалорий в нем содержится?
В порции картофельных чипсов 160 ккал. Если чипсы содержат 15 г углеводов и 2,0 г белка, сколько граммов жира содержится в порции картофельных чипсов?
Средняя температура тела человека составляет 37 ° C, а средняя температура окружающей среды — 22 ° C.Является ли общий метаболизм человека экзотермическим или эндотермическим?
Хладнокровные животные поглощают тепло из окружающей среды, чтобы получить часть энергии, необходимой им для выживания. Это экзотермический или эндотермический процесс?
Если реакция АТФ → АДФ дает 7,5 ккал / моль, то для обратного процесса АДФ → АТФ требуется 7.5 ккал / моль, чтобы продолжить. Сколько молей АДФ можно превратить в АТФ, используя энергию 1 порции картофельных чипсов (см. Упражнение 2)?
Если окисление глюкозы дает 670 ккал энергии на моль окисленной глюкозы, сколько порций картофельных чипсов (см. Упражнение 2) необходимо, чтобы обеспечить такое же количество энергии?
7.6 Материалы в конце главы
Краткое содержание главы
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения следующих жирным шрифтом терминов в следующем резюме и спросить себя, как они соотносятся с темами в главе.
Энергия — это способность делать работу. Передача энергии из одного места в другое составляет тепла, . Тепло и энергия измеряются в единицах джоулей, , калорий, или килокалорий (равных 1000 калориям).Количество тепла, получаемого или теряемого при изменении температуры объекта, может быть связано с его массой и константой, называемой удельной теплоемкостью вещества.
Передача энергии также может вызывать переход вещества из одной фазы в другую. Во время перехода, называемого фазовым переходом , тепло либо добавляется, либо теряется. Несмотря на то, что тепло входит или выходит из вещества во время фазового перехода, температура вещества не изменяется до тех пор, пока фазовый переход не завершится; то есть фазовые переходы изотермические .Аналогично удельной теплоемкости, константа, называемая теплотой плавления вещества , описывает, сколько тепла должно быть передано, чтобы вещество расплавилось или затвердело (то есть, чтобы переключиться между твердой и жидкой фазами), в то время как теплота испарения описывает количество тепла, передаваемого в процессе кипения или конденсации (то есть для переключения между жидкой и газовой фазами).
Каждое химическое изменение сопровождается изменением энергии. Это связано с тем, что взаимодействие между атомами, связанными друг с другом, имеет определенную энергию связи , энергию, необходимую для разрыва связи (называемую энергией решетки для ионных соединений), а энергии связи реагентов не будут такими же, как энергии связи продуктов.Реакции, которые выделяют энергию, называются экзотермическими , а реакции, которые поглощают энергию, называются эндотермическими . Диаграммы уровней энергии можно использовать для иллюстрации изменений энергии, сопровождающих химические реакции.
Даже сложные биохимические реакции должны следовать правилам простой химии, включая правила, связанные с изменением энергии. Реакции углеводов и белков обеспечивают наш организм примерно 4 ккал энергии на грамм, а жиров обеспечивают около 9 ккал на грамм.
Дополнительные упражнения
Двуокись серы (SO 2 ) — это загрязняющий газ, который является одной из причин кислотных дождей. Он окисляется в атмосфере до триоксида серы (SO 3 ), который затем соединяется с водой с образованием серной кислоты (H 2 SO 4 ).
- Напишите сбалансированную реакцию окисления SO 2 с образованием SO 3 .(Другой реагент — двухатомный кислород.)
- Когда 1 моль SO 2 реагирует с образованием SO 3 , выделяется 23,6 ккал энергии. Если бы 100 фунтов (1 фунт = 454 г) SO 2 были преобразованы в SO 3 , каково было бы общее изменение энергии?
Аммиак (NH 3 ) получают путем прямого объединения газов H 2 и N 2 в соответствии с этой реакцией:
N 2 (г) + 3H 2 (г) → 2NH 3 (г) + 22.0 ккал
- Эта реакция эндотермическая или экзотермическая?
- Каково общее изменение энергии, если 1500 г N 2 реагируют с образованием аммиака?
Образец металлического железа весом 5,69 г нагревали в кипящей воде до 99,8 ° C. Затем его поместили в химический стакан, содержащий 100,0 г H 2 O при 22,6 ° C. Если предположить, что вода получила все тепло, теряемое утюгом, какова конечная температура H 2 O и Fe?
А 5.69 г образца металлической меди нагревали в кипящей воде до 99,8 ° C. Затем его поместили в химический стакан, содержащий 100,0 г H 2 O при 22,6 ° C. Если предположить, что вода получила все тепло, теряемое медью, какова конечная температура H 2 O и Cu?
При конденсации 1 г пара выделяется 540 кал энергии. Сколько граммов льда можно растопить с помощью 540 калорий?
Когда замерзает 1 г воды, 79.Высвобождается 9 кал энергии. Сколько граммов воды можно вскипятить с 79,9 кал?
Изменение энергии составляет +65,3 кДж на каждый моль гидроксида кальция [Ca (OH) 2 ] в соответствии со следующей реакцией:
Ca (OH) 2 (т) → CaO (т) + H 2 O (г)
Сколько граммов Ca (OH) 2 могло бы прореагировать, если бы было доступно 575 кДж энергии?
Реакция термитов выделяет столько энергии, что элементарное железо, образующееся в виде продукта, обычно образуется в жидком состоянии:
2Al (s) + Fe 2 O 3 (s) → Al 2 O 3 (s) + 2Fe () + 204 ккал
Сколько тепла будет отдано, если будет произведено 250 г Fe?
Нормальному взрослому мужчине требуется 2500 ккал в день для поддержания метаболизма.
- Диетологи рекомендуют, чтобы не более 30% калорий в рационе человека приходилось на жиры. Какую максимальную массу жира должен потреблять взрослый мужчина при 9 ккал / г в день?
- При 4 ккал / г сколько граммов белка и углеводов должен ежедневно потреблять взрослый мужчина?
Нормальному взрослому мужчине требуется 2500 ккал в день для поддержания метаболизма.
- Какая масса жира при 9 ккал / г обеспечила бы такое количество килокалорий, если бы диета состояла только из жиров?
- Какая масса белка и / или углеводов необходима для получения такого количества килокалорий при 4 ккал / г каждый?
Объем мирового океана составляет приблизительно 1,34 × 10 24 см 3 .
- Сколько энергии потребуется, чтобы повысить температуру Мирового океана на 1 ° C? Предположим, что теплоемкость океанов такая же, как у чистой воды.
- Если Земля получает 6,0 × 10 22 Дж энергии в день от Солнца, сколько дней потребуется, чтобы нагреть океаны на 1 ° C, если вся энергия ушла на нагревание воды?
Требуется ли веществу с небольшой удельной теплоемкостью небольшое или большое количество энергии для изменения температуры? Объяснять.
Некоторые учебники биологии представляют преобразование аденозинтрифосфата (АТФ) в аденозиндифосфат (АДФ) и ионы фосфата следующим образом:
АТФ → АДФ + фосфат + энергия
Что не так с этой реакцией?
Если предположить, что изменения энергии аддитивны, сколько энергии требуется для изменения 15.
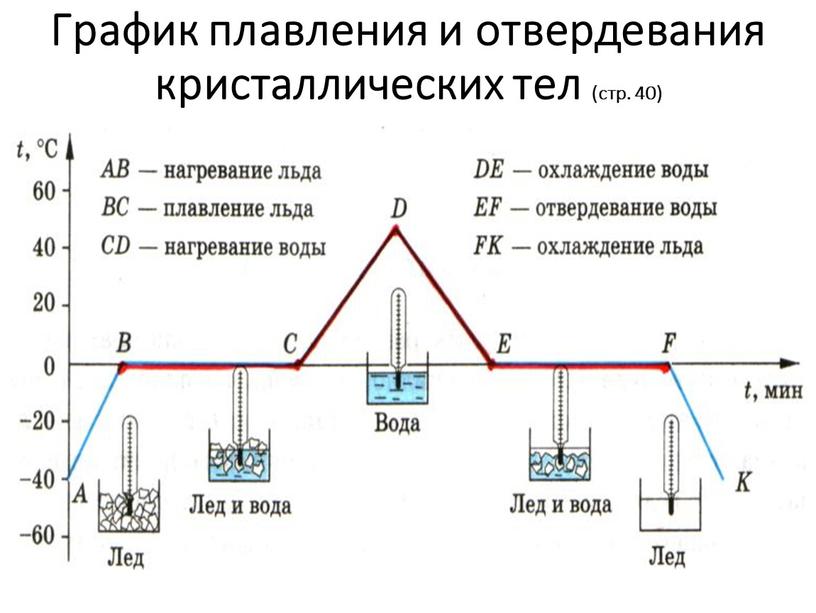


 Показатели данного стандарта соответствуют высшей категории качества.
Показатели данного стандарта соответствуют высшей категории качества.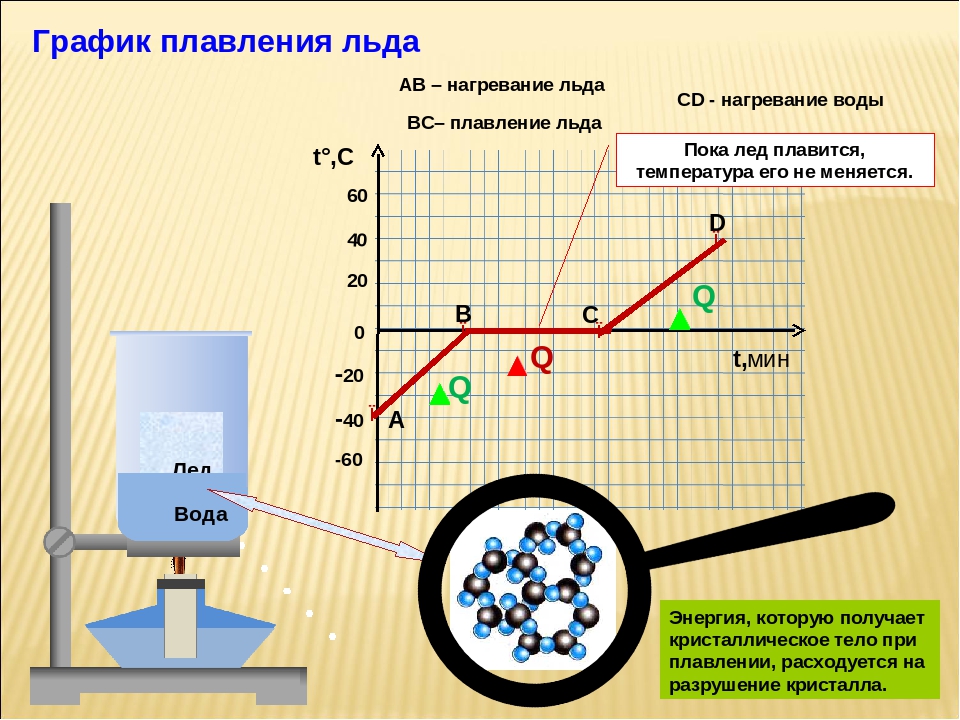 0-5.0
0-5.0 п.
п.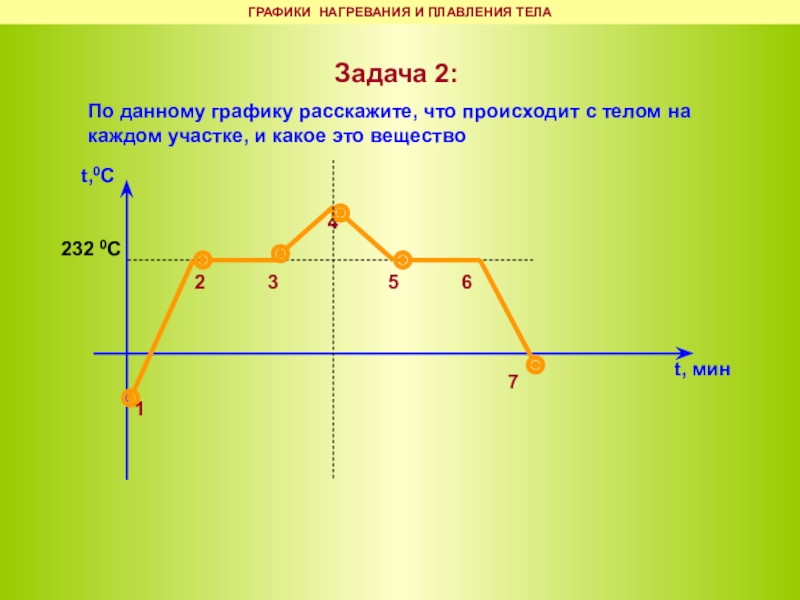 Для пайки может применяться как в чистом виде, так и в виде сплавов с другими металлами.
Для пайки может применяться как в чистом виде, так и в виде сплавов с другими металлами. Температура размягчения канифоли от 55 до 83°С. Применяется как флюс для пайки мягкими припоями.
Температура размягчения канифоли от 55 до 83°С. Применяется как флюс для пайки мягкими припоями.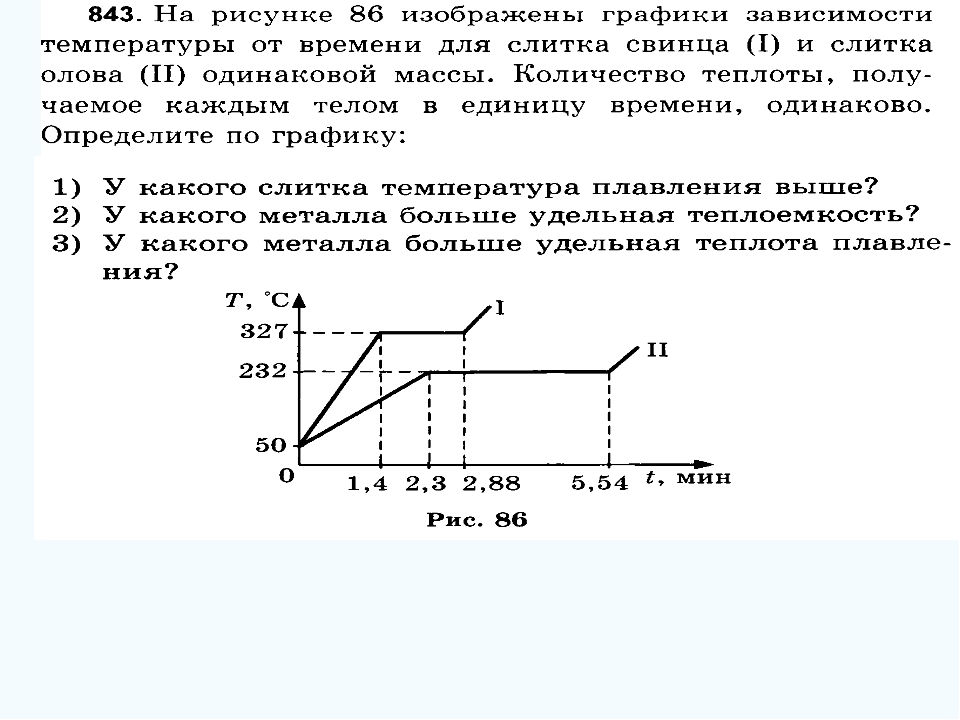 05-0.5
05-0.5 5-2.0
5-2.0 1
1 05
05 05
05 08
08 При пайке деталей, не допускающих перегрева, используются припои, имеющие низкую температуру плавления.
При пайке деталей, не допускающих перегрева, используются припои, имеющие низкую температуру плавления.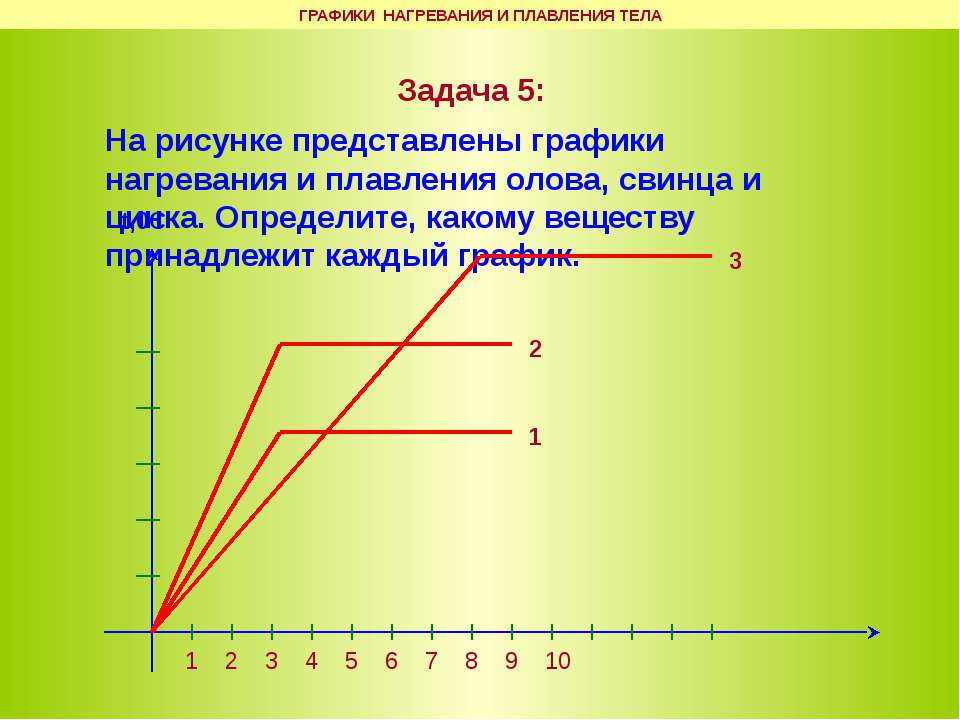
 По мере расплавления меди в тигель добавляют цинк, после расплавления цинка добавляется около 0,05% фосфорной меди. Расплавленный припой разливается в формочки. Температура плавления припоя должна быть меньше температуры плавления припаиваемого металла. Кроме указанных медно-цинковых припоев, находят применение и серебряные припои. Составы последних приведены в табл. 4.
По мере расплавления меди в тигель добавляют цинк, после расплавления цинка добавляется около 0,05% фосфорной меди. Расплавленный припой разливается в формочки. Температура плавления припоя должна быть меньше температуры плавления припаиваемого металла. Кроме указанных медно-цинковых припоев, находят применение и серебряные припои. Составы последних приведены в табл. 4. Припои ПСР-10 и ПСР-12 применяются для пайки латуни, содержащей не менее 58% меди, припои ПСР-25 и ПСР-45 — для пайки меди, бронзы и латуни, припой ПСР-70 с наиболее высоким содержанием серебра — для пайки волноводов, объемных контуров и т. п.
Припои ПСР-10 и ПСР-12 применяются для пайки латуни, содержащей не менее 58% меди, припои ПСР-25 и ПСР-45 — для пайки меди, бронзы и латуни, припой ПСР-70 с наиболее высоким содержанием серебра — для пайки волноводов, объемных контуров и т. п.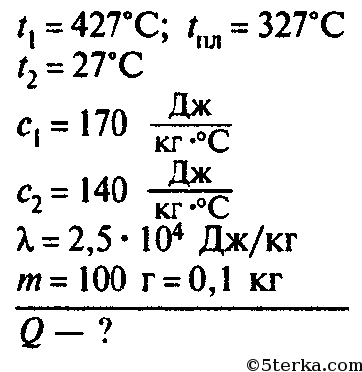
 п.
п.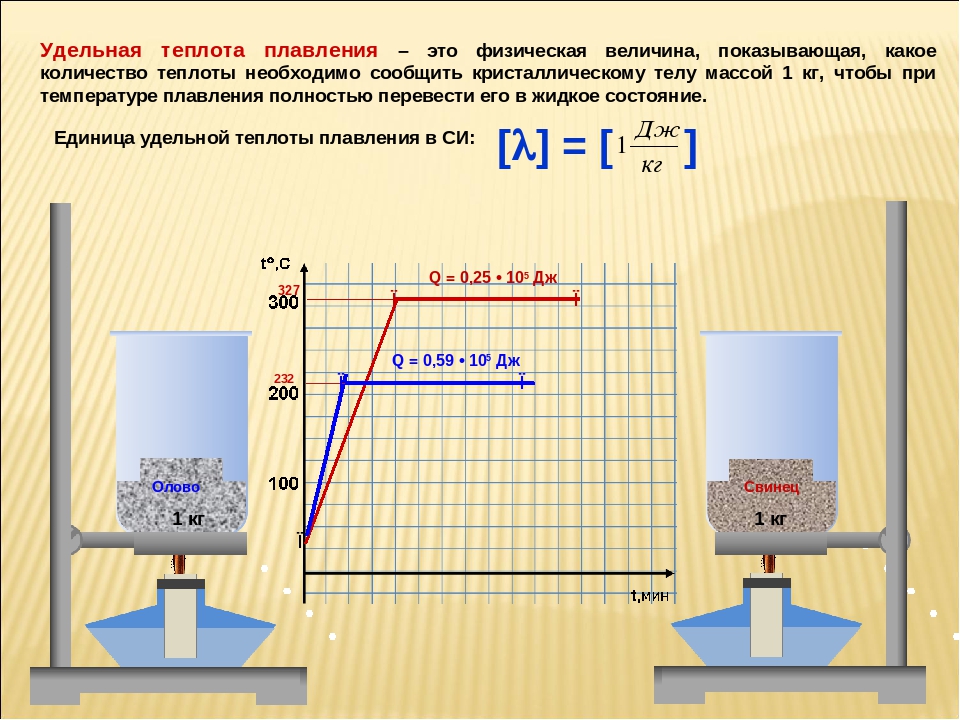 Пайку с хлористым цинком в помещении, где находится радиоаппаратура, производить нельзя. Применять хлористый цинк для пайки электро и радиоаппаратуры также нельзя. Хранить хлористый цинк необходимо в стеклянной посуде с плотно закрытой стеклянной пробкой.
Пайку с хлористым цинком в помещении, где находится радиоаппаратура, производить нельзя. Применять хлористый цинк для пайки электро и радиоаппаратуры также нельзя. Хранить хлористый цинк необходимо в стеклянной посуде с плотно закрытой стеклянной пробкой. Флюсы ЛТИ могут применяться также для пайки железа и его сплавов (включая нержавеющую сталь), меди и ее сплавов и металлов с высоким удельным сопротивлением (см. табл. 7).
Флюсы ЛТИ могут применяться также для пайки железа и его сплавов (включая нержавеющую сталь), меди и ее сплавов и металлов с высоким удельным сопротивлением (см. табл. 7). Она состоит из 70-80 г вазелина, 20-25 г канифоли и 50-70 млг флюса ЛТИ-120.
Она состоит из 70-80 г вазелина, 20-25 г канифоли и 50-70 млг флюса ЛТИ-120.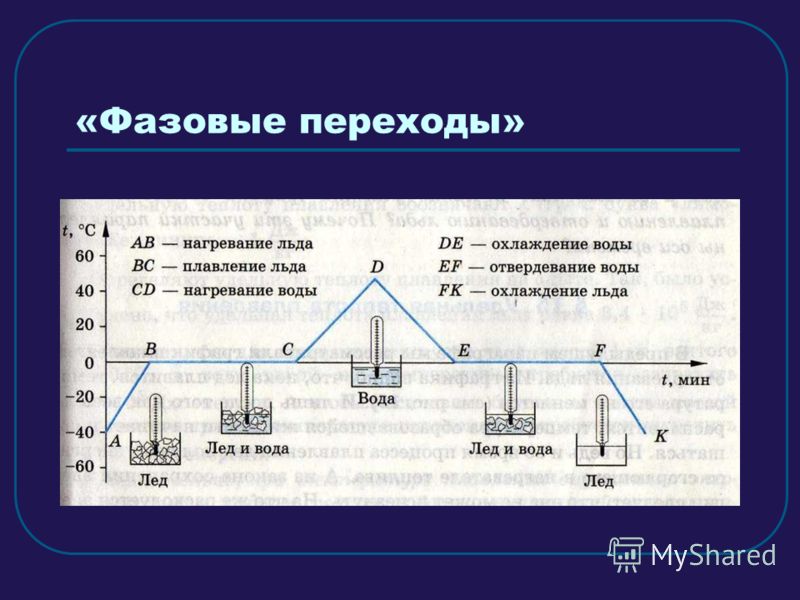 пл., C
пл., C ..90
..90 ..174
..174 .209
.209 ..204
..204 ..6
..6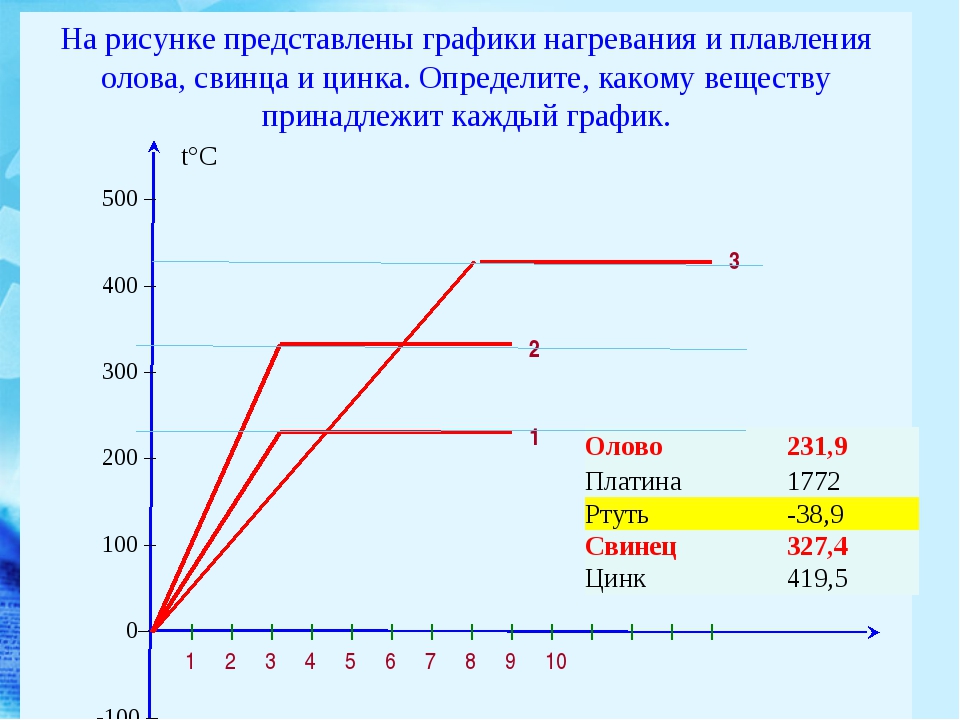 ..13
..13 ..1,7
..1,7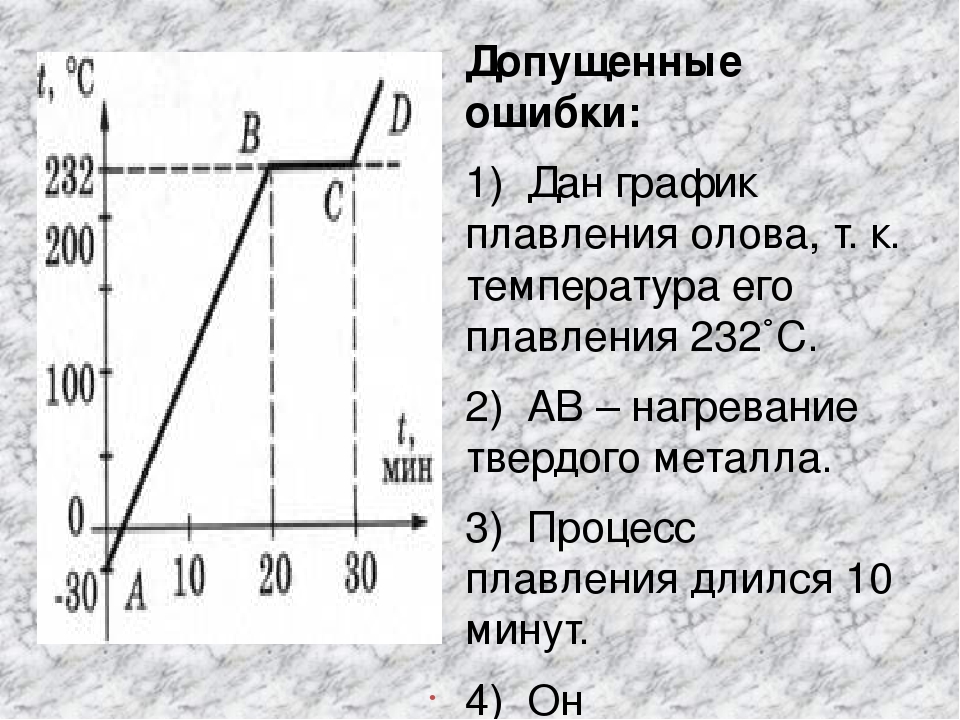




 Где
Где 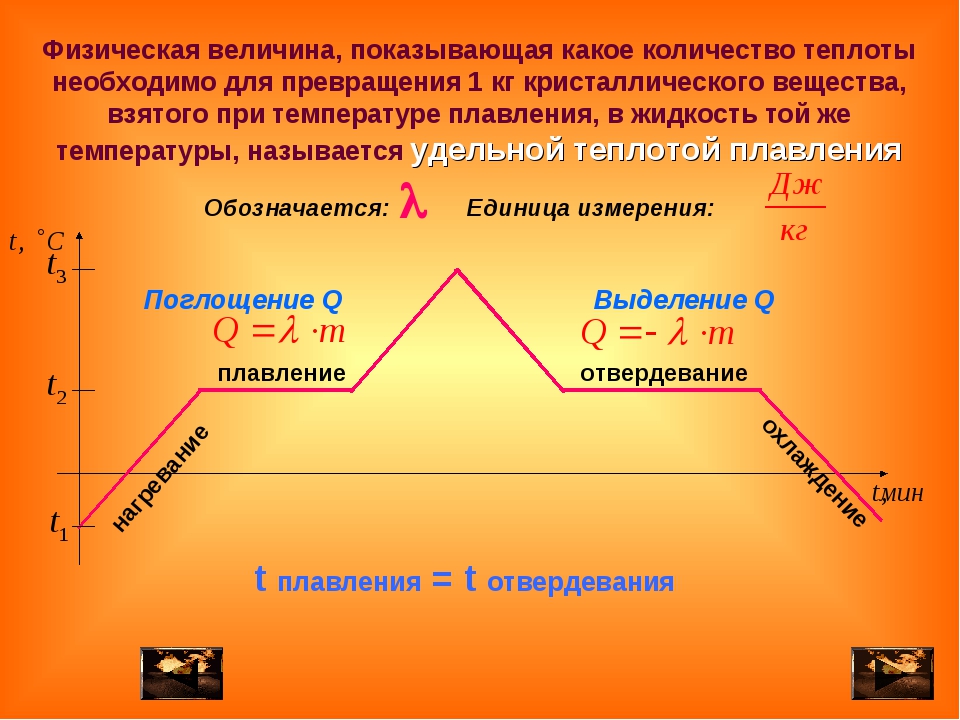 В этом примере задачи показано, как рассчитать количество энергии, необходимое для плавления образца водяного льда.
В этом примере задачи показано, как рассчитать количество энергии, необходимое для плавления образца водяного льда. (Исключением является гелий.) Если вы получили отрицательное число, проверьте свои математические расчеты.
(Исключением является гелий.) Если вы получили отрицательное число, проверьте свои математические расчеты.